中医药治疗非酒精性脂肪性肝病相关信号通路的研究进展
杨红娟,陈振东*,田旭东
1甘肃中医药大学,兰州730000;2甘肃省中医院,兰州730050
非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)是在没有酗酒和肝脏损伤的情况下,产生以大泡性为主的肝细胞脂肪变性疾病,其患病率不断升高且呈现起病低龄化的趋势[1]。依据病理发展的轻重,NAFLD可分为单纯性脂肪肝、脂肪性肝炎、脂肪性肝纤维化、脂肪性肝硬化四个阶段[2]。高能量饮食、肥胖、遗传易感性、基因多态性、细胞因子、肠道微生物生态失调是NAFLD发病的主要原因[3]。“二次打击”学说可部分揭示NAFLD的发生机制,胰岛素抵抗(insulin resistance,IR)导致肝组织中脂肪细胞的大量聚集是NAFLD发病中的首次打击,在此基础上发生的细胞毒性反应,包括氧化应激和炎症反应,成为NAFLD发病中的第二次打击,最终导致肝纤维化[4]。随着现代研究的不断深入,“多重打击”学说为NAFLD的发病机制提供了更加准确的解释,该学说认为细胞因子和内质网诱导的脂肪变性和炎症反应是NAFLD发病的基础,IR、脂质积累、胆汁酸、遗传多态性等是诱发NAFLD的主要因素[5,6]。以上两种学说均认为NAFLD形成和发展的关键在于脂质代谢异常和炎症反应,因此研究肝脏脂质代谢异常与炎症形成的根本机制,是NAFLD治疗的焦点问题。
截至目前,NAFLD尚无特定的治疗方法,现代医学主要尝试从改善IR、降低肝脏脂肪酸的水平、改善氧化应激和内质网应激等方面入手,药物类型主要有胰岛素增敏剂、抗氧化剂、细胞保护剂、肿瘤坏死因子-α(tumor necrosis factorα,TNF-α)抑制剂等[7]。但对于NAFLD,尤其是发展为肝纤维化的患者,这些药物的疗效还尚待进一步研究。中医从“肥人多痰湿”,“肥人多气虚”等观点出发,指出NAFLD的本质多为本虚标实,本虚为肝脾肾虚,标实为湿痰瘀滞。常见证型可分为湿浊内阻、湿热蕴结、肝郁脾虚、痰瘀互结,治法以疏肝健脾、化痰祛湿、清热利湿、活血化瘀为主[8]。NAFLD为慢性病,病程长且迁延不愈,中医从“治病求本”,“以人为本”,“辨证论治”出发,在NAFLD防治的发展中自成体系。大量实验证明,通过多靶点多通路治疗NAFLD是中医药治疗本病的原创优势,显现出很好的疗效和普遍适用性[9]。本文通过归纳总结中医药在脂质代谢和炎症反应方面治疗NAFLD常见信号通路,为临床治疗和实验研究提供理论依据。
1 脂质代谢异常与NAFLD
脂质包括脂肪、甘油三酯(trigly ceride,TG)、胆固醇等,它们的产生和运输障碍都可导致脂质的代谢异常。脂质的来源包括食物摄取、自身合成和外周脂肪的分解,去路主要有转化为TG、线粒体β氧化、与载脂蛋白结合为极低密度脂蛋白(very low density lipoprotein,VLDL)释放入血。肝细胞中脂质的过度聚集是导致NAFLD发生发展的先决条件之一,脂质在肝内的积聚会使肝组织更加脆弱,从而引起肝内的炎症反应和纤维化,最终导致不可逆性的肝损伤[6]。法尼醇X受体(farnesoid X receptor,FXR)信号通路、过氧化物酶体增殖物激活受体α(perixisome proliferator-activated receptor alpha,PPARα)信号通路、G蛋白信号通路、胆汁酸代谢在脂质代谢方面起着重要作用。
1.1 FXR信号通路
FXR属于配体激活转录因子核受体,FXR可分为FXRα和FXRβ,FXR主要以肝脏表达为主,FXR缺乏所引起的肝脏脂肪变性、胆汁酸失调、高血糖、高血脂等均可以被FXR基因激活所逆转[10]。它主要通过以下三个方面调控着脂质代谢的过程。
1.1.1 固醇调节元件结合蛋白1c
固醇调节元件结合蛋白1c(sterol regulatory element-binding protein-1c,SREBP-1c)作为FXR的下游靶点,其靶基因主要控制胆固醇、脂肪酸、TG合成。小异质二聚体(small heterodimer partner,SHP)是已知的FXR靶基因,SHP作为SREBP-1c的上游基因,FXR可以通过激活SHP来下调SREBP-1c,从而调控TG的生成[11]。FXR也可作用于SHP来抑制下游分子VLDL的分泌从而使得脂肪的合成减少。此外,FXR还可作用于成纤维细胞生长因子19(fibroblast growth factor 19,FGF19)来增加成纤维细胞生长因子21(fibroblast growth factor 21,FGF21)的含量,从而调节脂肪酸氧化。
1.1.2 肝激酶B1
肝激酶B1(liver kinase B1,LKB1)是腺苷酸活化蛋白激酶(adenosine 5′-monophosphate activated protein kinase,AMPK)上游的主要激酶,调节AMPK的磷酸化,LKB1作为FXR的下游靶点,FXR可以通过增加LKB1的含量来保护肝细胞不受损伤,AMPK主要通过抑制SREBP-1c的合成和其下游基因、糖类反应元件结合蛋白、PPARα的转录活性以及抑制糖原合成来调节脂肪酸代谢,从而导致成脂能力下降,抑制脂肪合成。
1.1.3 其他途径
FXR激动剂还可通过调节PPARα的表达,促进肝脏β-氧化和下游分子肉碱棕榈酰转移酶1(carnitine palmitoyl transterase-1,CPT-1)的合成从而减少脂质的生成[12]。
中医药通过干预脂质代谢通路的相关靶点发挥治疗NAFLD的作用。五味子酯甲(schisantherin A,Sch A)是五味子木脂素的主要成分之一,具有保肝,抗氧化的作用。Tian[13]通过实验研究发现,Sch A可以通过激活FXR从而调控SREBP及下游基因的表达来抑制高脂饮食诱导的NAFLD小鼠体内肝脏脂质的合成。Diao等[14]研究发现,山楂叶总黄酮通过调节AMPK通路和相关蛋白的表达,减少高脂大鼠体内的脂质积聚和合成来延缓NAFLD的发展。Shi[15]通过基因富集分析和通路分析证实了泽泻汤可以通过PPARα、AMPK等信号途径影响NAFLD小鼠体内脂肪的合成而发挥治疗作用。玳玳果黄酮[16]通过降低肝脏脂质代谢的关键调节因子AMPK、SREBP-1c的表达,增加PPARα的表达,从而抑制肝脏脂质的生成和增加。人参皂苷CK可以通过激活LKB1和AMPK的磷酸化来调节脂质合成和代谢,干扰NAFLD的进展[17]。以上研究表明,Sch A、山楂叶总黄酮、泽泻汤、玳玳果黄酮、人参皂苷CK都可以通过调节FXR信号通路相关靶点基因来调控脂质的合成与代谢,从而发挥治疗NAFLD的作用。
1.2 PPARα信号通路
PPARα是肝脏β-氧化的主要调节因子,它通过调节上下游基因和蛋白表达来减少脂质生成和变性。有研究表明,NAFLD小鼠体内PPARα基因表达下调,脂质代谢水平受到抑制[18]。实验证明PPARα选择性激动剂WY14643可以显著减少小鼠体内的脂肪变性,且WY14643的治疗在克服肥胖和IR引起的不良代谢和肝脏影响中有着重要作用[19]。线粒体的损伤和脂质的氧化可以增加氧化应激来促进NAFLD的发展,PPARα通过介导CPT-1来调控脂质的氧化,CPT-1介导了脂肪酸从线粒体内膜向线粒体基质中的转运,当肝脏缺乏PPARα的情况下,靶基因CPT-1表达下调,脂肪酸则以TG的形式积累于肝脏中[20]。脂蛋白脂肪酶(lipoprotein lipase,LPL)是TG水解的关键酶,PPARα作为LPL的上游基因,通过调节LPL上游相关因子的表达如载脂蛋白C3(apolipoprotein C3,ApoC3)、叉头框转录因子O1(forkhead box transcription factor O1,FoxO1)来催化脂蛋白中TG的水解,并且参与VLDL的代谢,从而减少脂质积聚[21]。此外,LPL的活性还受载脂蛋白A5(apolipoprotein A5,ApoA5)的影响,而ApoA5作为PPARα的下游基因,其表达也受到PPARα的调控[22]。PPARα还可通过介导肝X受体(liver X receptor,LXR),清道夫受体B类1型(scavenger receptor class B type 1,SR-B1)的表达来调节体内胆固醇的分泌,从而调节脂质代谢。
Ni[23]通过实验发现,自拟方QSHY(姜黄、虎杖、栀子、田基黄、茵陈)可以下调NAFLD模型小鼠体内LXR及下游脂质生成相关基因的表达,降低肝脏胆固醇的水平,减少肝脏TG的蓄积,延缓NAFLD的发展。Yang等[24]发现穴位埋线法(肝俞、胆俞、后海、后三里)可改善NAFLD大鼠血脂指标,可能与调节PPARα/CPT-1a信号通路有关。Ma[16]、Duan[25]等通过实验研究发现,玳玳果黄酮,桑叶总黄酮能够有效降低高脂血症大鼠体内脂肪积聚,且肝脏TG、总胆固醇、低密度脂蛋白胆固醇水平降低,PPARα、CPT-1等蛋白及m RNA表达上调。以上研究表明,自拟方QSHY、穴位埋线、玳玳果黄酮、桑叶总黄酮均通过PPARα信号通路改善脂肪变性,从而达到治疗NAFLD的作用。
1.3 G蛋白信号通路
G蛋白信号通路的异常表达,特别是胰高糖素样肽-1(glucagon-like peptide-1,GLP-1)、GPR119和GPR120干扰了NAFLD的正常信号传导途径,参与了NAFLD的侵袭、迁移和代谢等多种反应。GLP-1通过增加肝脏β-氧化和胰岛素的分泌,减少脂肪的生成和脂肪酸的摄取,从而降低肝脏脂肪积聚[26]。GPR119激动剂APD668可以控制高脂小鼠的体重增长,提高GLP-1的水平[27]。Chen等[28]研究表明,GPR120激动剂可抑制巨噬细胞浸润和活性氧的产生,改善高脂小鼠肝脏的脂肪变性和炎症反应,这一作用在GPR120激动剂未处理的小鼠中丧失。
Chen等[29]通过实验发现,葛根芩连汤通过促进小鼠体内GPR119,上调GLP-1表达的水平,从而调节血糖、抑制脂肪的沉积和氧化应激反应。Liu[30]发现中药成分复方GC方(栀子苷、绿原酸)能够降低NAFLD小鼠体内TG、谷丙转氨酶的含量,上调GLP-1在小鼠体内的表达,这一作用与G蛋白信号通路的激活密不可分。Zhang[31]及Zhang[32]实验研究显示,王不留行黄苷酮通过上调GPR120的表达,加速脂肪细胞的分化,调节脂质代谢,降低血糖水平。
1.4 胆汁酸代谢
胆汁酸是脂质和脂溶性物质吸收所必需的生物活性物质,它在脂质代谢、胆固醇清除甚至机体免疫功能中起着关键调控作用。胆汁酸可以通过各种途径调节各种脂质代谢酶,从而提高肠内对脂类的吸收。
胆固醇7α-羟化酶(cholesterol 7α-hydroxylase,CYP7A1)是胆汁酸合成的限速酶,肝脏胆汁酸激活FXR后正反馈于SHP,SHP对CYP7A1的作用与肝脏受体同源物1(liver receptor homolog 1,LRH-1)及LXR失活有关,CYP7A1作为LRH-1的下游分子,其表达水平也会随之下调[33]。在肠道中,FXR激活可上调成FGF19和成纤维细胞生长因子15(fibroblast growth factor 15,FGF15)的表达,二者通过门静脉至肝脏,与肝脏中成纤维细胞生长因子受体4(fibroblast growth factor receptor,FGFR4)成纤维细胞生长因子受体4和β-Klotho蛋白结合,抑制CYP7A1的表达来抑制胆汁酸的合成[34]。牛磺胆酸钠共转运蛋白(sodium taurocholate cotransporting polypeptide,NTCP)是肝细胞膜上胆汁酸的转运体,FXR通过激活SHP进而干扰视黄醇受体(retinoid X receptorα,RXRα)来抑制肝细胞核因子4α(hepatocyte nuclear factor 4 alpha,HNF4α)和肝细胞核因子1α(hepatocyte nuclear factor 1alpha,HNF1α)的表达,NTCP作为下游分子它的表达也会随之减少。
有实验研究证明[13],SchA通过抑制高脂饮食诱导NAFLD小鼠体内CYP7A1和胆固醇-27羟化酶(cholesterol-27hydroxylase,CYP271)的表达来调控胆汁酸的生成,而这一作用与Sch A直接调控核受体FXR有关。He等[35]通过实验研究发现,山楂叶总黄酮可以通过上调肝脏FXR和CYP7A1 mRNA和蛋白的表达来促进NAFLD大鼠肝脏脂质代谢。Xia等[36]临床研究发现,去脂软肝方可以通过激活FXR-FGF19信号通路降低脂肪性肝炎模型大鼠FXR和CYP7A1 mRNA的表达,降低肝脏胆汁酸。Liu等[37]的研究证实了柴胡人参药对亦能通过下调肝脏中CYP7A1的表达调节胆汁酸。中医药治疗NAFLD调控脂质代谢相关信号通路图总结如下(详见图1)。
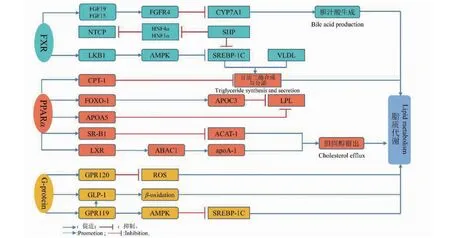
图1 中医药治疗NAFLD调控脂质代谢相关信号通路
2 炎症反应与NAFLD
炎症反应贯穿NAFLD的全过程,在NAFLD发展的各个阶段均发挥着重要作用。NAFLD的发病机制与IL-6、IL-8、TNF等炎症因子的产生有关,脂肪酸代谢紊乱、IR、糖脂代谢紊乱等都可导致炎症因子的释放进而激发炎症反应,如果肝脏炎症继续发展,可能会引起肝纤维化和肝硬化,最后造成不可逆转的肝损害[4]。通过检索文献发现,细胞核因子κB蛋白(nuclear factor-κB,NF-κB)、核因子E2相关因子2(nuclear factor E2-related factor 2,Nrf2)、辅助性T细胞17(T helper 17 cells,Th17)/调节性T细胞(regulatory T cells,Treg)、c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)信号通路与NAFLD的炎症反应关系密切。
2.1 NF-κB信号通路
NF-κB是由Rel结构域家族(p50、p52、p65、c-Rel、Rel B)中的5个蛋白组成的异源二聚体复合物,调节各种促炎因子的表达。通常情况下,NF-κB与κB抑制蛋白隔离,在细胞质中保持无活性的状态,氧化应激可以使NF-κB转移至细胞核中发挥作用。NAFLD一个显著特征是与炎症相关的细胞凋亡和纤维化,而这一过程与NF-κB的表达密切相关。TNF作为NF-κB众多靶基因之一,它通过与细胞膜上的肿瘤坏死因子受体1(tumor necrosis factor receptor 1,TNFR1)及相关蛋白形成复合体,激活核因子κB抑制因子激酶调控NF-κB的表达,发挥抗炎、抗凋亡的作用。此外,Toll样受体4(Toll-like receptor 4,TLR4)与膜内接头分子髓样分化因子88(myeloid differentiation factor 88,MyD88)结合调控NF-κB和炎症小体来促进炎症因子的分泌和表达,从而加快NAFLD的发展。
中医药治疗NAFLD 与NF-κB通路密切相关。Xian[38]、Hou等[39]研究发现,三七总皂苷和绞股蓝通过下调NAFLD小鼠体内NF-κB和炎症因子的表达,增加抗氧酶的含量来治疗NAFLD。Wu等[40]采用油酸诱导HepG2细胞,建立NAFLD模型,通过实验发现姜黄素干预细胞组肝脂肪变性明显缓解,这与NF-κB表达减弱有关。Zhao等[41]通过实验研究发现,决明子蒽醌苷可以减缓小鼠NAFLD的进展,采用蛋白质印迹法测定大鼠体内TLR4和NF-κB蛋白的表达量,结果发现用决明子蒽醌苷处理的大鼠体内TLR4和NF-κB的表达降低,且呈剂量依赖性。Xu等[42]通过实验研究发现,龙胆苦苷干预后,NAFLD模型大鼠体内TLR4、NF-κB等蛋白的表达降低,炎细胞浸润减少。
2.2 Nrf2信号通路
Nrf2由6个功能性Neh结构域(Neh1~Neh6)构成,调控着细胞的氧化应激和炎症反应。研究表明[43],Nrf2活化与 NAFLD患者体内的炎症水平相关,且慢性肝病小鼠纤维化的进展可以通过激活Nrf2得到改善。特异性敲除Nrf2的NAFLD小鼠肝脏炎症反应较未敲除组小鼠有明显改善[44]。Kelch样环氧氯丙烷相关蛋白1(Kelch-like ECH-associated protein-1,Keap1)是Nrf2的内源性抑制因子,氧化应激诱导Nrf2从Keap1上脱离,与细胞核中的抗氧化反应元件(antioxidant response element,ARE)结合,从而形成Keap1-Nrf2-ARE信号通路,该通路可活化下游基因的转录和靶蛋白的翻译,调节体内氧化还原平衡[45]。此外,血红素加氧酶(heme oxygenase,HO)-1作为Nrf2的下游基因,它可以通过中和促炎因子TNF和IL-1的表达来抗氧化损伤和抵抗炎症[46,47]。
Liu[48]、Luo等[49]通过实验研究发现,苦瓜皂苷和橙皮素能上调Nrf2、HO-1等蛋白的表达,下调氧化代谢产物活性氧(reactive oxygen species,ROS)、丙二醛(malondialdehyde,MDA)生成,从而维持NAFLD小鼠肝脏功能的完整性。Zhang等[50]通过动物实验证实了理中汤能够有效减轻NASH大鼠体内的炎症和氧化应激反应,与其调节Keap1-Nrf2-ARE信号通路相关蛋白的表达有关。Xu[51]、Ji等[52]通过实验研究发现,虎杖苷能明显降低高血脂大鼠体内氧化应激和炎症因子的表达,其作用机制与加强Nrf2相关信号通路的表达密切有关。Biao等[53]通过研究发现,当归芍药散组明显增加NAFLD大鼠Keap1、Nrf2、HO-1和蛋白表达,下调血清和肝脏中TG、TC、MDA等的含量,这一作用机制与调节Keap1/Nrf2信号通路有关。
2.3 Th17/Treg信号通路
初始CD4+T淋巴细胞产生Treg细胞以及Th17细胞两种表型,Treg细胞和Th17细胞通过介导白细胞介素17(in-terleukin 17,IL-17)、白细胞介素22(in-terleukin 22,IL-22)、白细胞介素21(in-terleukin 21,IL-21)、TNF-α等炎症因子的表达,在NAFLD脂质沉积、炎症反应及纤维化的发展中起着关键的调控作用。叉头框蛋白P3(forkhead box P3,FOXP3)是Treg细胞的重要转录因子,Foxp3通过与维甲酸相关孤儿受体γt(retinoic acid-related orphan receptorγt,RORγt)发生反应并抑制其表达,从而诱导T细胞向Treg细胞方向分化,同时RORγt也参与了Th17细胞分化。生长转化因子-β(transforming growth factor-β,TGF-β)是Th17和Treg细胞共有的转录因子,它可以调节Foxp3和RORγt的表达,而IL-17作为促炎因子之一,它可以通过TGF-β信号途径来抑制Treg细胞的分化,并通过诱导白细胞介素6(in-terleukin 6,IL-6)和其他炎症因子的产生促进Th17细胞分化,增强Treg/Th17失衡,加重肝脏炎症发展[54,55]。有研究显示,NAFLD患者体内Th17/Treg比例失调[56]。
Lv等[57]发现,刺五加总皂苷能下调IL-17、TNF-a、γ干扰素(interferon gamma,INF-γ)等炎症因子的表达来防治NAFLD,这可能与调节Treg/Th17及辅助型T细胞(T helper cell,Th)1/Th2有关。Cui等[58]以NAFLD大鼠为模型,发现枸杞子能通过减轻NAFLD大鼠RORγt基因表达,调整Th17/Treg平衡来治疗NAFLD。Yue等[59]通过实验证实了钩吻素子能有效减轻NAFLD大鼠肝细胞脂肪样变和延缓疾病的发展,这与其抑制Th17细胞分化,增加Treg细胞数目有关。Duan 等[60]的研究证实了大黄蛰虫丸能通过维持Th17/Treg平衡治疗NAFLD。
2.4 JNK信号通路
c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)信号通路在机体炎症反应及氧化应激方面起着重要作用,JNK激活后将细胞质中信号转导和转录激活因子(signal transducer and activator of transcription,STAT)二聚化到细胞核,调控机体的炎症反应。此外,JNK还可以通过TNF-α和半胱天冬酶-8(caspase-8)介导的途径促进细胞凋亡。炎症细胞因子通过刺激TNF相关的肿瘤坏死因子相关凋亡诱导配体(tumor necrosis factor-related apoptosis-inducing ligand,TRAIL)信号、Fas信号和TNF-α信号通路来发挥作用,TRAIL和Fas与其相对应的受体结合作用于下游基因caspase-8,caspase-8通过线粒体依赖途径激活半胱天冬酶-3(caspase-3),从而诱导细胞凋亡[61]。凋亡信号调节激酶1(apoptosis signal-regulating kinase 1,ASK1)和丝裂原活化蛋白激酶激酶4(mitogen-activated protein kinase kinase 4,MKK4)是JNK上游激活因子,可被ROS、TNF-α和内质网应激所激活,从而促进细胞凋亡。有研究表明水飞蓟宾通过激活JNK上游因子的表达来抑制JNK的磷酸化,调节NASH相关促氧化酶的活性和氧化应激,起到防治NAFLD的作用[4]。
Chen[62]研究发现,温中疏肝健脾方可以有效抑制NAFLD大鼠肝脏炎症反应,降低炎症因子TNF-α和IL-6的分泌,下调JNK1的蛋白表达。Tian等[63]通过实验发现,梓醇(地黄根提取物)可以显著降低高脂饮食诱导的NAFLD小鼠p-JNK和caspase-3蛋白的表达水平,降低肝脏炎症,抑制细胞凋亡。Shi[64]及Li[65]等研究显示,当归芍药散组高脂小鼠肝组织中炎症反应和JNK相关蛋白水平降低,由此推断当归芍药散可以通过介导JNK信号通路上下游基因和蛋白的表达来减轻肝脏变性从而治疗NAFLD。中医药治疗NAFLD调控炎症反应相关信号通路图总结如下(详见图2)。

图2 中医药治疗NAFLD调控炎症反应相关信号通路
3 小结与展望
综上所述,脂质代谢和炎症反应是中医药治疗NAFLD的两个重要靶点。中医药通过介导FXR、PPARα、G蛋白等信号通路、调节胆汁酸代谢来减少脂质的沉积,通过介导NF-κB、Nrf2、Th17/Treg、JNK等信号通路来降低炎性反应,减少氧化应激,最终防治NAFLD的进展(详见表1)。此外,中药以及复方大都具有清热、疏肝、化瘀、祛湿、补益的作用,这与NAFLD中医病因病机相契合。中医药从整体、多方位、多靶点的角度对NAFLD进行综合治疗,其疗效和安全性也得到了广泛的认可。
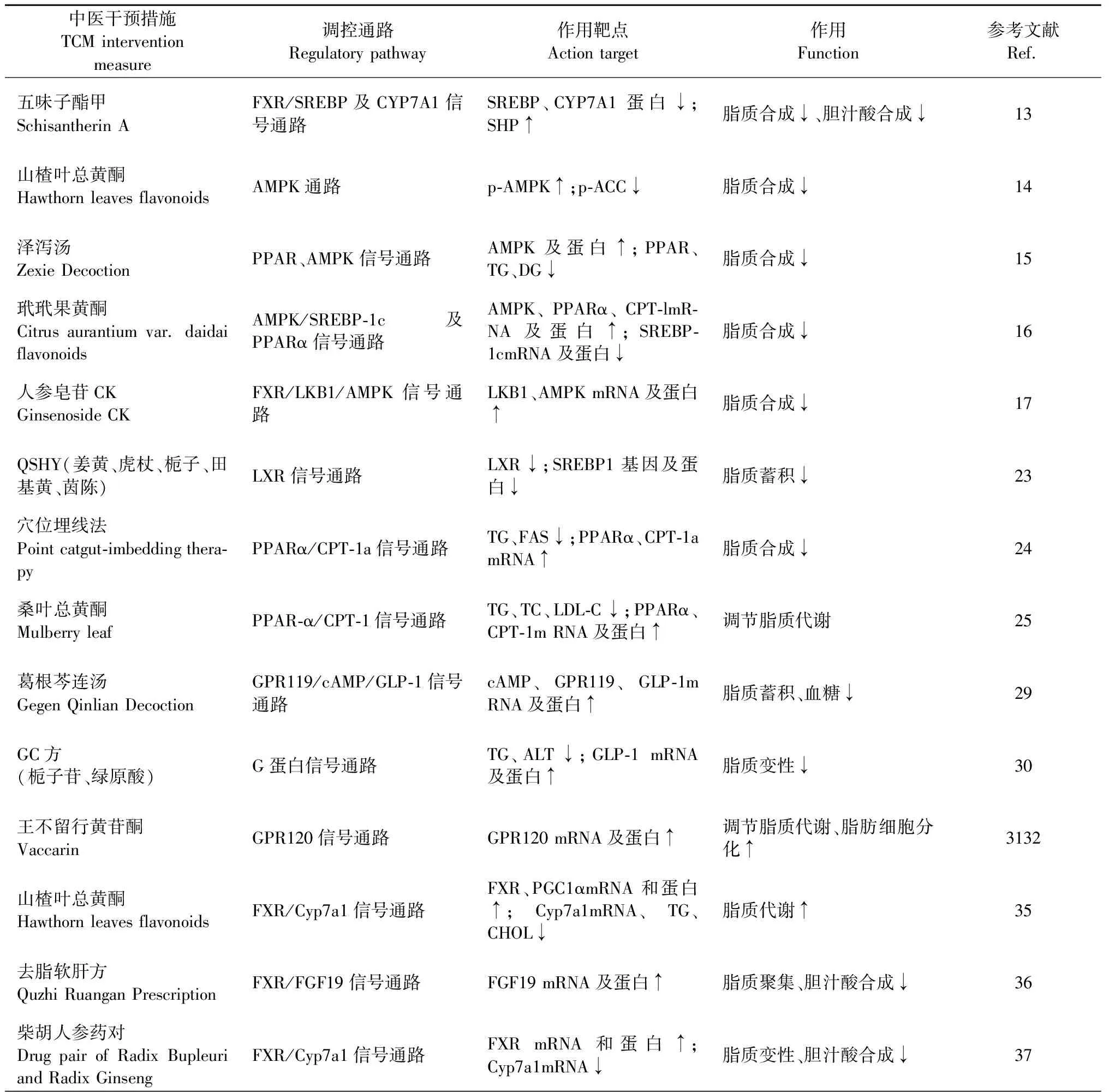
表1 中医药对NAFLD相关信号通路的调控作用
但笔者通过检索文献发现,中医药治疗NAFLD也有着许多不足之处。首先,在方剂治疗NAFLD研究时,往往反映了各组药物的综合效应,影响因子复杂,具体活性成分和作用机制不清,缺乏深入的机理研究。其次,中医药治疗NAFLD涉及的某些信号通路缺乏探索性研究和权威的理论支持,基础实验研究及后续临床应用研究相对不足。再次,中医药在NAFLD的治疗上涉及到的信号通路较多,且每条信号通路不是单独发挥作用的,信号通路的多重性以及信号通路之间是否存在拮抗和协同关系,是否存在其他影响因子和相关通路仍是我们需要探索的问题,因此需要更多学者对其靶点和机理进行深入研究,为以后临床用药提供技术与理论支持。

