阿根廷滑柔鱼雄性个体的能量积累特点及与环境因子关系
刘 伟 臧 娜 林东明,
(1.上海海洋大学海洋科学学院, 上海 201306; 2.大洋渔业资源可持续开发省部共建教育部重点实验室, 上海 201306;3.国家远洋渔业工程技术研究中心, 上海 201306; 4.农业农村部大洋渔业开发重点实验室, 上海 201306)
能量积累及其生殖投入分配是生物个体繁殖策略的重要组成部分, 有效地协调能量积累与投入分配是生物个体获得最优繁殖适合度的一种选择适应性过程[1]。头足类(除鹦鹉螺外)为“快节奏”生活表型的海生软体动物, 寿命短, 多为1—2年生, 生长快, 体质量生长速率可达45 g/d, 终生一次繁殖产卵, 产卵结束后便死去[2]。为了达成这种“快节奏”生活表型, 这些种类的摄食行为活跃, 每天的摄食率为其体质量的1.3%至15.0%, 食物的转化速率可达69%[3]。随着生物个体生长发育, 它们较快速地积累组织能量, 其中胴体肌肉是最大能量积累器官、消化腺组织次之[4]。然而, 头足类对海洋环境波动变化敏感, 在不同栖息海域表现出繁殖策略多样、生殖能量投入类型不同的多种生长发育模式[2,5]。同时, 这些种类的能量积累容易受到栖息海域环境波动变化的影响, 海表温、叶绿素a质量浓度等均可影响着组织的能量积累过程, 而且对生殖能量的投入分配也具有重要的影响效应[6,7], 进而影响个体的生长发育及随后的繁殖适合度[8]。
阿根廷滑柔鱼是典型的大洋性头足类, 分布在22°S—54°S的西南大西洋大陆架和大陆坡海域, 且以35°S—52°S巴塔哥尼亚大陆架海域的资源最为丰富[9]。阿根廷滑柔鱼因其资源量丰富, 不仅是大型鱼类、海洋哺乳类的重要饵料来源, 也是甲壳类、小型鱼类和头足类的主要捕食者[9], 起着链接中下层营养生物与高营养级捕食者之间的营养“生物泵”作用[10]。同时, 阿根廷滑柔鱼是世界头足类渔业的重要经济种, 2016—2020年的年均渔获产量占世界头足类总产量的10%左右, 在我国远洋鱿钓渔业总产量中也呈现递增趋势[11]。然而, 类似于其他头足类资源, 阿根廷滑柔鱼的种群资源量年间波动大[9]; 因其繁殖产卵结束后便死去, 种群资源量决定于补充群体大小, 而后者与亲体的能量积累及其生殖投入分配密切相关[8,9]。已有研究发现, 阿根廷滑柔鱼雌性个体肌肉组织能量积累在生理性发育期达到最大值, 随后能量积累占比呈下降趋势[12],而且组织能量积累与栖息海域的环境波动变化关系紧密[13,14]。然而, 阿根廷滑柔鱼雄性个体先于雌性个体性腺发育成熟, 并且生殖能量投入仅为雌性个体的1/2左右[9,15], 其组织能量积累是否存在特殊性仍未可知。因此, 本研究利用组织能量密度测定技术, 研究分析阿根廷滑柔鱼雄性个体的肌肉、消化腺和精巢等组织能量积累及与栖息海域环境因子的相关性, 旨在深入了解该种类的能量积累特性,为掌握其种群资源量的波动变化提供参考资料。
1 材料与方法
1.1 样本来源
阿根廷滑柔鱼样本来自我国远洋鱿钓作业渔船渔获物, 采集海域为56°15′—63°36′W、40°05′—45°48′S的西南大西洋公海海域, 采样时间为2020年5—6月、2021年2—4月(图1)。根据鱿钓作业渔船流动作业的特点, 每个站点随机取样, 样本经冷冻保存后运回实验室进行生物学测定分析。
1.2 生物学测定
阿根廷滑柔鱼样本室温解冻后进行生物学测定, 测定内容包括胴长(Mantel length, ML)、体质量(Body weight, BW)、精巢质量(Testis weight, TW)和性腺成熟度(Maturity stage, MAT)。胴长测定精确到1 mm, 体质量的测定精确到1 g, 精巢的质量测定精确到0.01 g。性腺成熟度根据林东明等[16]的划分标准, 将阿根廷滑柔鱼雄性个体的性腺成熟度划分为Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ、Ⅵ、Ⅶ和Ⅷ共8个时期。其中, Ⅰ—Ⅲ期为性腺发育未成熟期, Ⅳ—Ⅵ期为性腺发育成熟期, Ⅶ期为繁殖期, Ⅷ期为繁殖后期。
已有研究表明, 阿根廷滑柔鱼Ⅲ—Ⅵ期的生长发育能量积累需求大且显著[12]。为此, 本研究选取性腺发育成熟度Ⅲ期至Ⅵ期的雄性个体样本共130尾进行分析, 其中, 2020年59尾, 2021年71尾。
1.3 组织能量密度测定及能量积累计算
精巢、肌肉和消化腺等组织冷冻保存后, 置于冷冻干燥机中冷冻干燥至恒重, 称取各组织干重,精确至0.01 g。随后, 干燥组织置于研磨机中研磨粉碎, 称取0.2—0.5 g组织粉末置入全自动氧弹热量仪(Calorimeter Parr6400, Parr Instrument Company,Moline, IL, USA)中测定各组织的能量密度值, 单位为kJ/g。
根据测定的组织能量密度值, 计算精巢、肌肉和消化腺等组织能量积累和相对组织能量积累。其中, 组织能量积累计算公式[14]为:
式中,Ea为组织能量积累, kJ;Ed为精巢、肌肉、消化腺的组织能量密度, kJ/g;Wt为组织总湿重, g;Wd为冷冻干燥组织样品的干重, g;Ww为冷冻干燥组织样品的湿重, g;i表示精巢、肌肉和消化腺。
相对组织能量积累计算公式[17]为:
式中,Ra为某组织相对能量积累, %;TE为实验样本个体的总能量积累(Total energy), kJ;i表示精巢、肌肉和消化腺。
1.4 数据处理
数据分析处理在R统计平台中实现, 数据以平均值±标准差(mean±SD)表示。运用Kolmogorov-Smirnoff检验分析精巢、肌肉和消化腺的组织能量密度及能量积累等数据的正态性。若符合正态分布, 利用单因素方差分析(one-way ANOVA)检验分析组织能量密度及能量积累的组织间差异性, 利用t检验分析组织能量密度及能量积累的年间差异性;若不符合正态分布, 则利用Kruskal-Wallis 检验分析组织能量密度及能量积累的组织间差异性和年间差异性。同时, 利用Pearson 相关性分析探究不同年份、不同组织(肌肉、消化腺、精巢)的相对能量积累与胴长之间以及不同组织能量密度与胴长之间的关系。统计分析显著性水平为P<0.05。
利用广义线性混合效应模型 (Generalized linear mixed-effects models, GLMM), 拟合分析总能量积累和不同组织(肌肉、消化腺、精巢)相对能量积累与海表温(Sea surface temperature, SST)、海底温(Sea bottom temperature, bottomT)、海表盐度(Salinity, Sal)、海平面高度(Sea surface height, SSH)和叶绿素a质量浓度(Chlorophyllaconcentration, Chl.a)等的关系, 模型中以采样月份作为随机效应因子。SST、bottomT、Sal、SSH、和Chl.a等环境因子下载自哥白尼海洋数据库(Copernicus Marine Data Store, https://marine.copernicus.eu), 数据空间分辨率为0.083×0.083, 时间分辨率为天。考虑阿根廷滑柔鱼样本采样站点可能与环境因子空间位置的不一致, 为此选取距离采样站点最近4个位点上的环境因子数据, 求取平均值作为采样站点的环境因子数值。
2 结果
阿根廷滑柔鱼雄性个体的胴长为172—293 mm,平均胴长为(218.28±18.15) mm; 体质量为120—492 g, 平均体质量为(245.52±73.49) g。其中, 2020年样本的平均胴长为(220.43±15.58) mm和平均体质量为(257.52±72.84) g, 均大于2021年样本的平均胴长(216.02±17.62) mm和平均体质量(233.22±65.36) g。
2.1 组织能量密度
分析显示, 阿根廷滑柔鱼雄性个体的肌肉、消化腺和精巢等组织能量密度分别为18.34—22.10 kJ/g[平均值(20.15±0.64) kJ/g]和23.63—35.78 kJ/g [平均值(30.00±2.62) kJ/g], 18.32—20.36 kJ/g [平均值(19.66±0.33) kJ/g]。2020年和2021年之间, 消化腺的组织能量密度存在显著的年间差异(t=3.39,P<0.05), 而肌肉和精巢的组织能量密度则没有显著的年间差异(肌肉,t=0.81,P>0.05; 精巢,t= -0.29,P>0.05; 图2)。同时, 来自两个年度的阿根廷滑柔鱼雄性个体均以消化腺组织能量密度最大(2020年,F=948.43,P<0.05; 2021年,F=722.22,P<0.05), 平均值分别为(30.96±2.63)和(29.32±2.59) kJ/g; 肌肉与精巢之间的组织能量密度则没有显著差异(Tukey HSD, 2020年,P>0.05; 2021年,P>0.05)。
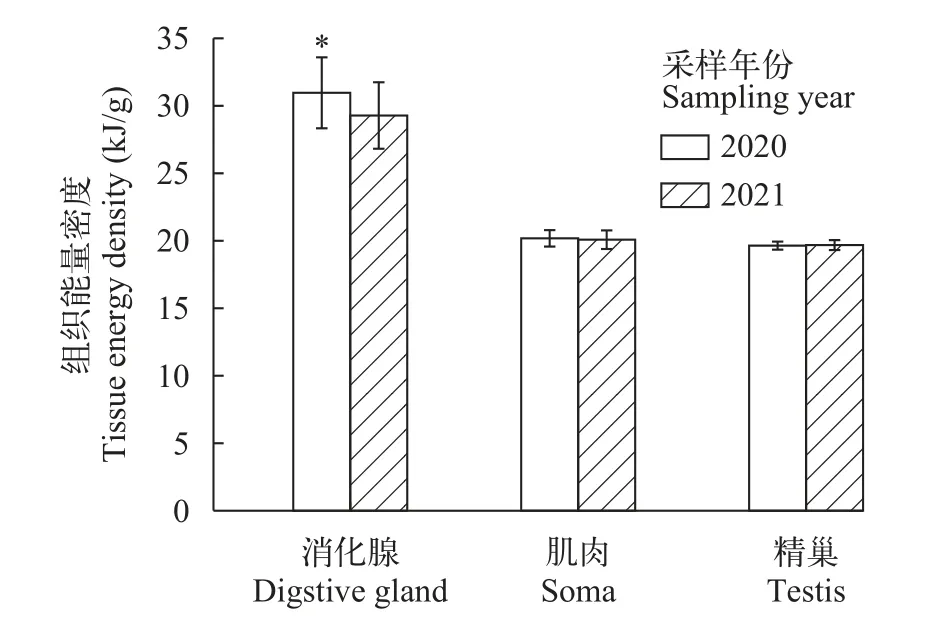
图2 阿根廷滑柔鱼雄性个体消化腺、肌肉和精巢的组织能量密度Fig.2 The tissue energy density digestive gland, soma and testis of male Illex argentinus
2.2 组织能量积累
阿根廷滑柔鱼雄性个体2020年和2021年的组织总能量积累分别为619.53—3056.15和411.17—1874.24 kJ, 平均值分别为(1485.15±559.61)和(1011.23±267.04) kJ。显著性检验结果显示, 2020年雄性个体的组织总能量积累显著大于2021年个体(χ2=26.12,P<0.05)。Pearson相关性分析显示, 两个年度雄性个体的组织总能量积累均与胴长呈显著的正相关关系(2020年,r=0.82,P<0.05; 2021年,r=0.61,P<0.05; 图3)。
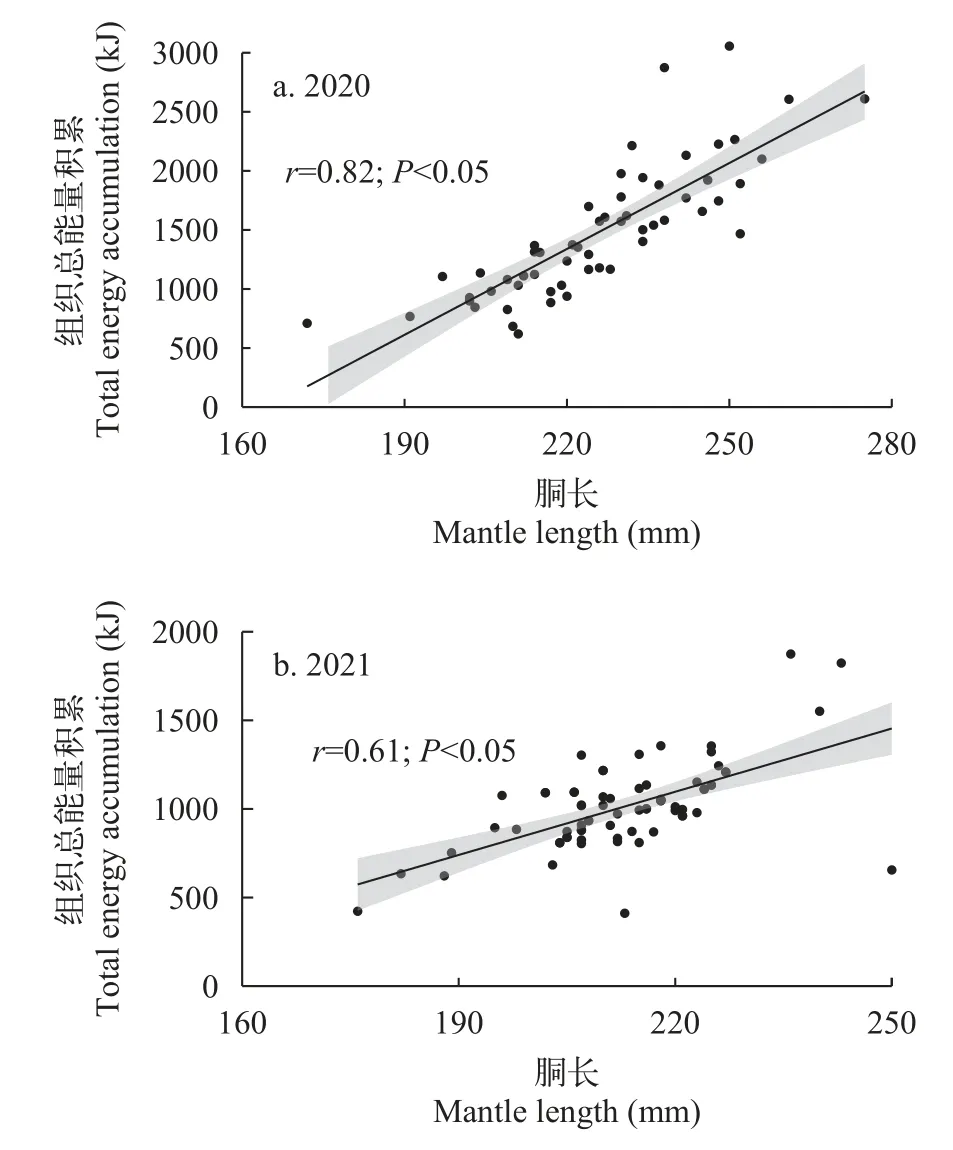
图3 阿根廷滑柔鱼雄性个体组织总能量积累与胴长的关系Fig.3 The relationship between total energy accumulation and mantle length for male Illex argentinus
相对能量积累分析显示, 2020年和2021年雄性个体组织能量积累均以肌肉组织的占比最大, 消化腺组织次之, 精巢组织的能量积累占比最小(2020年,F=890.58,P<0.05; 2021年,F=3428.97,P<0.05;图4a)。同时, 消化腺和肌肉的相对能量积累均存在显著的年间差异(消化腺,t=6.87,P<0.05; 肌肉,t=-6.77,P<0.05)。其中, 消化腺组织在2020年的相对能量积累大于2021年, 相对能量积累分别为(27.04±10.74)%和(15.99±7.38)%。肌肉组织在2020年的相对能量积累则低于2021年, 两年份的肌肉组织相对能量积累分别为(70.56±10.63)%和(81.42±7.47)%。然而, 精巢组织的相对能量积累均较低且没有显著的年间差异(t= -1.74,P=0.08), 2020年和2021年的相对能量积累平均值分别为(2.40±0.68)%和(2.59±0.71)%。
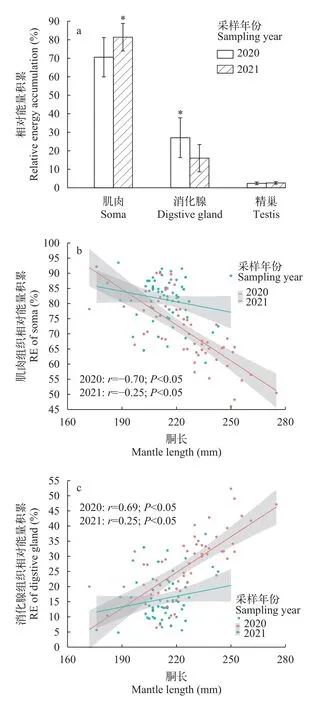
图4 阿根廷滑柔鱼雄性个体组织相对能量积累分布及与胴长的关系Fig.4 The distribution of relative energy accumulation and relation to mantle length for male Illex argentinus
Pearson相关性分析显示, 2020年和2021年雄性个体肌肉组织相对能量积累均与胴长呈显著的负相关关系(2020年,r= -0.70,P<0.05; 2021年,r= -0.25,P<0.05; 图4b), 消化腺组织相对能量积累则与胴长呈显著的正相关关系(2020年,r= -0.69,P<0.05;2021年,r= -0.26,P<0.05; 图4c)。两年份的精巢相对能量积累则均与胴长的相关性不显著(2020年,r= -0.04,P=0.77; 2021年,r= -0.03,P=0.82)。
2.3 能量积累与环境因子关系
GLMM模型结果显示, 阿根廷滑柔鱼雄性个体的总能量积累与海底温度呈显著效应关系(t= -2.60,P=0.01), 而与海表温、海表盐度、海平面高度及叶绿素a质量浓度等没有显著的相关性, 模型的合计方差解析率为50%(r2=0.50; 表1)。GLMM效应关系图显示, 海底温越高、总能量积累越小(图5a)。
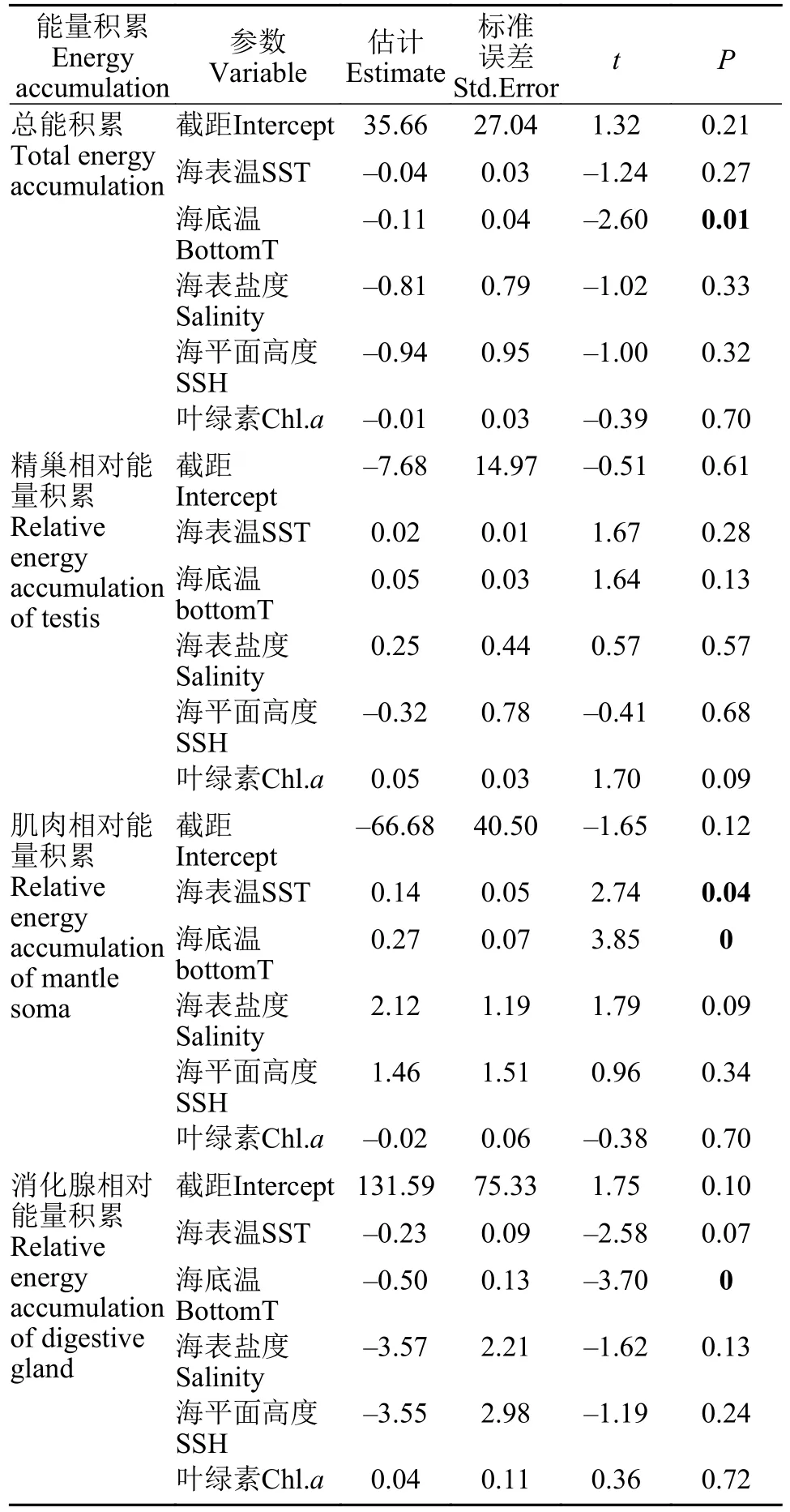
表1 阿根廷滑柔鱼雄性个体组织能量积累与环境因子的广义线性混合效应模型的固定效应结果Tab.1 Results of generalized linear mixed-effects models fixed effects of tissue energy accumulation performed on environmental factor for male Illex argentinus
同时, 阿根廷滑柔鱼雄性个体的肌肉相对能量积累与海表温和海底温度均呈显著效应关系(海表温,t=2.74,P=0.04; 海底温,t=3.85,P=0.00), 而与海表盐度、海平面高度及叶绿素a质量浓度等没有显著的相关性, 模型的合计方差解析率为57%(r2=0.57; 表1)。消化腺相对能量积累也与海底温成显著效应关系(t= -3.70,P=0.00), 与海表温、海表盐度、海平面高度及叶绿素a质量浓度等没有显著的相关性, 模型的合计方差解析率为50% (r2=0.50; 表1)。然而, 精巢相对能量积累则与栖息海域环境因子没有显著相关性(表1), 模型合计方差解析率仅为8%(r2=0.08)。GLMM效应关系图显示, 海表温、海底温度越高、肌肉相对能量积累越大(图5b—c)。而消化腺相对能量积累与海底温呈负相关关系, 温度越高、相对能量积累越小(图5d)。
3 讨论
3.1 组织间的能量密度
组织能量密度是生物个体每单位干质量的焦耳能, 综合体现了生物体组织中蛋白质、脂肪、碳水化合物等营养物质的组成变化[18], 以及生物个体在不同生长发育阶段对这些营养物质的积累需求[19]。头足类为海生软体动物, 蛋白质是主要的有机化合物, 次之为脂肪, 而碳水化物和糖原等含量极少[20]。其中, 肌肉组织以蛋白质为基础, 蛋白质含量是脂肪含量的10倍左右[21]。消化腺是脂肪积累的主要器官, 每克干质量的脂肪含量可达663 mg[22]。性腺组织的脂肪含量则随着配子发生增加显著, 但成熟配子具有相对稳定的营养物质组成[23,24]。在本研究中, 阿根廷滑柔鱼雄性个体的组织能量密度以消化腺组织的最高, 为肌肉组织的1.49倍、精巢组织的1.53倍, 而肌肉和精巢两者的组织能量密度相近。最近研究也发现, 阿根廷滑柔鱼雌性个体消化腺组织的每克干组织的脂肪含量在320—834 mg,而肌肉组织的脂肪含量最大为235 mg[25]。通常, 生物个体的蛋白质和脂肪的能量密度平均值分别为12.6和39.3 kJ/g[26]。可见, 阿根廷滑柔鱼消化腺具有较高的组织能量密度应该是其脂肪含量高所致,而肌肉和精巢两组织中的蛋白质、脂肪和碳水化合物等生化组成则较为相近。
同时, 本研究发现阿根廷滑柔鱼雄性个体的消化腺和肌肉两者的组织能量密度与雌性个体的相近, 前者为30 kJ/g左右、后者约为20 kJ/g[12,25]。然而, 雄性个体的精巢组织能量密度约为雌性卵巢组织能量密度的84%, 后者平均能量密度为24 kJ/g[12,25]。已有研究表明, 雄性个体性腺组织每克干质量的蛋白质、脂肪和碳水化合物的平均含量分别为15%、1.7%和1.4%, 而雌性个体性腺组织每克干质量的蛋白质、脂肪和碳水化合物的平均含量则分别为40%、7%和1.2%[19]。可见, 阿根廷滑柔鱼性腺组织能量密度的差异应该是其生化组成的雌雄性差异所致。
在本研究中, 阿根廷滑柔鱼消化腺组织能量密度也存在显著的年间差异。已有研究表明, 头足类的消化腺是代谢速率较快的器官单元, 可快速地转化食物脂肪, 反映最近14d之内的摄食情况[27]。在西南大西洋巴塔哥尼亚大陆架及大陆坡, 海域环境主要受到马尔维纳斯海流和巴西海流影响, 而且年间波动变化明显, 进而影响饵料生物资源的丰富度及种类多样性[28,29]。阿根廷滑柔鱼为机会主义型海生软体动物, 食性贪婪、饵料生物种类多样[9], 性腺发育开始之后具有较大的食谱宽度[8]。因此, 消化腺组织能量密度的年间差异性, 可能是所摄食的饵料生物种类存在不同所致。
3.2 组织间的能量积累
头足类的胴体、头腕和尾鳍等是最大的肌肉组织器官, 也是最大的能量积累单元, 消化腺因脂肪含量高而成为第二大能量积累单元[12,25]。本研究结果显示, 阿根廷滑柔鱼雄性个体的肌肉组织能量积累占比高达个体能量积累的81%, 消化腺和精巢两者的能量积累占比较低, 分别为个体能量积累的16%和3%。该结果与阿根廷滑柔鱼雌性个体的对应组织的能量积累占比相近[14,25], 表明组织间的能量积累占比没有雌雄差异性。同时, 阿根廷滑柔鱼肌肉组织为最大的能量积累单元与茎柔鱼(Dosidicus gigas)[7,30]、鸢乌贼(Sthenoteuthis oualanien-sis)[31]、科氏滑柔鱼(Illex coindetii)和埃布短柔鱼(Todaropsis eblanae)[32]、玛雅蛸(Octopus maya)[33]等种类的研究结果一致, 可见肌肉组织作为头足类能量积累的最大器官单元没有种类特殊性。
然而, 头足类肌肉、消化腺和性腺的组织能量积累随着性腺发育存在一定的组织差异性, 且与个体生长发育密切相关[25]。比如, 这些种类的性腺发育滞后于个体生长, 性腺发育前期以肌肉组织能量积累为主, 在性腺发育开始之后生殖能量积累增加迅速[12]。在本研究中, 阿根廷滑柔鱼雄性个体的组织总能量积累与胴长呈正相关关系, 说明其能量积累随着个体生长发育不断增加。这可能与阿根廷滑柔鱼终生一次繁殖的生活史策略相关, 以实现后代繁衍最大化[5]。然而, 肌肉和消化腺的相对能量积累与胴长的相关性存在差异, 前者与胴长呈负相关关系, 后者则与胴长呈正相关关系。通常, 阿根廷滑柔鱼肌肉组织能量随着个体生长显著增加, 但是能量占比在生理性发育期(Ⅲ期)达到最大值之后逐渐降低[4], 而体型则仍保持一定的生长[34]。相反,消化腺组织在生长发育过程中保持生长, 尤其在性腺发育开始之后组织内的脂肪含量增加显著[25]。因此, 肌肉和消化腺的相对能量积累随胴长生长而存在积累差异, 应该是生长发育过程中组织能量积累占比及能量物质组成的变化所致。
此外, 本研究发现阿根廷滑柔鱼精巢的相对能量积累与个体胴长的相关性不显著, 说明雄性个体的相对生殖能量投入水平稳定。朱凯等[31,35]也曾报道在性腺发育成熟至繁殖交配前, 南海鸢乌贼雄性个体的相对生殖能量积累保持不变。头足类(除鹦鹉螺外)的性腺组织一次发育[2], 因而保持相对稳定的生殖投入有助于实现繁殖价值最大化。同时,相对于雌性个体而言, 阿根廷滑柔鱼雄性个体的生殖投入较低[36], 也可能是其相对能量积累不因体型变化而改变的原因。然而, 具体原因则需要后续深入分析其生殖能量投入的来源途径加以确证。
3.3 组织能量积累的环境响应
头足类对栖息海域的环境波动变化敏感性高,生长发育容易受到栖息海域水温、盐度及海域生产力等的影响[2,37]。通常, 生物个体的代谢速率因外界温度变化而变化, 当外界温度较低时, 机体的酶活性和代谢速率会降低, 从而促进营养物质的积累和利用[14,38]。已有研究表明, 阿根廷滑柔鱼随着生长发育逐渐向水温较低且较深的水层移动, 最适生长的海底温度为4—10℃的海域[39]。在本研究中,阿根廷滑柔鱼雄性个体的总能量积累、肌肉相对能量积累和消化腺相对能量积累均与海底温度存在显著的相关关系, 且总能量积累随海底温度升高而减少, 结果与雌性个体的相一致[14]。韩飞等[7]也曾报道, 当栖息海域水温超过一定阈值时, 茎柔鱼的组织能量积累呈下降趋势。因此, 阿根廷滑柔鱼总能量积累与海底温度的负相关性, 可能是机体代谢随着生长发育对栖息海域水温的适应过程, 以增加个体的组织能量积累。
同时有研究表明, 适宜的海平面高度可以促进上下水层的混合, 形成营养盐和饵料等的富集带[40],进而提高捕食者的进食率, 促进组织能量的积累。Lin等[14]研究显示, 阿根廷滑柔鱼雌性个体的组织能量积累随海平面高度降低而呈先上升后下降的趋势, 在海平面高度-47.5 cm时能量积累达到最大值。然而, 本研究中阿根廷滑柔鱼雄性个体的能量积累与海平面高度不存在显著相关性, 且与叶绿素a质量浓度也没有显著关系。这说明阿根廷滑柔鱼能量积累对海平面高度及叶绿素a质量浓度的响应关系可能存在一定的雌雄性差异。通常, 阿根廷滑柔鱼雄性个体投入性腺组织生长发育的能量较低[36],且先行性腺发育的雄性个体会提前离开索饵场[9]。因而, 以叶绿素a质量浓度为表征的海域饵料食物丰度[41]对雄性个体生殖投入的作用影响较为不明显, 而且雄性个体性腺成熟后较活跃的繁殖行为[9]也可能是其生殖投入与海域初级生产力关系不显著的原因之一。
4 结论
综上所述, 本研究通过组织能量密度测定技术,初步阐明了阿根廷滑柔鱼雄性个体生长发育过程中的肌肉、消化腺、精巢等组织的能量密度变化及其组织能量积累过程。此外, 栖息海域温度对总能量积累、肌肉和消化腺组织相对能量积累具有显著的影响作用, 说明海域温度是影响阿根廷滑柔鱼组织能量积累的重要环境因子。在全球气候变化背景下, 该种类如何在能量积累及其投入分配上获得最优繁殖适合度, 将是后续研究面临的一个重要研究课题。本研究结果将为下一步开展阿根廷滑柔鱼繁殖适合度及其环境选择适应性研究提供理论基础。

