两个奥利亚罗非鱼品系对无乳链球菌的耐受性研究
李可心 祝璟琳, 李大宇 邹芝英 肖 炜 喻 杰 陈炳霖 杨 弘*
(1.南京农业大学无锡渔业学院, 无锡 214128; 2.中国水产科学研究院淡水渔业研究中心,农业农村部淡水渔业和种质资源利用重点实验室, 无锡 214081)
罗非鱼(Oreochromisspp.)是热带和亚热带地区的世界性养殖鱼类, 具有无肌间刺、生长快、繁殖能力强和适应性强等优点[1]。中国罗非鱼产量全球第一, 2020年达到165.54万吨。随着养殖密度的增加和养殖环境的恶化, 罗非鱼病害逐渐增多, 其中由无乳链球菌(Streptococcus agalactiae)引起的链球菌病已成为限制罗非鱼产业可持续发展的最重要因素之一[2]。无乳链球菌, 也称为B组链球菌(GBS), 引起鱼类败血症、脑膜脑炎、突眼症、厌食症和腹水等症状[3]。目前在尖吻鲈(Lates calcarifer)[4], 亚马逊鲶(Pseudoplatystomasp.)[5]、龙胆石斑(Epinephelus lanceolatus)[6,7]和金鲳(Trachinotus ovatus)[8]等病鱼体内也分离出无乳链球菌。据报道, 链球菌病暴发引起了世界各地的罗非鱼大规模死亡, 造成了重大经济损失[9,10]。
抗病育种是通过定向选择或改变某些基因型来培育对特定疾病产生较强抵抗力的动物新品种的方法。近几年我国罗非鱼养殖品种不断更新换代, 培育出了“壮罗1号”罗非鱼等新品种, 在同等养殖条件下, “壮罗1号” 罗非鱼抗无乳链球菌感染能力比吉富罗非鱼(Oreochromis niloticusGIFT strain)强, 养殖成活率比吉富罗非鱼高15.2%—21.4%[11]。罗非鱼养殖品系较多, 不同品系间抗病力差异较大,不同学者探讨了不同遗传背景的罗非鱼与其抵抗无乳链球菌能力的相关性。Huang等[12]研究发现奥尼罗非鱼 (O.niloticus♀×O.aureus♂)比“新吉富”罗非鱼(NEW GIFT tilapia,O.niloticus♀×O.niloticus♂)和吉奥罗非鱼(NEW GIFT tilapia ♀×O.aureus♂)对无乳链球菌的抵抗力更强, 抗病力与某些天然免疫参数有关, 如溶菌酶活性、NBT活性和特异性抗体水平。强俊等[13]研究发现吉富罗非鱼与奥利亚罗非鱼杂交后代对海豚链球菌(Streptococcus iniae)的抗病力明显高于吉富罗非鱼自繁组F1代, 相同攻毒条件下奥利亚罗非鱼自繁组F1代死亡率最低, 奥利亚罗非鱼较强的抗病性能可能有助于提高杂交子代的抗病力。有文献认为不同品系罗非鱼抗病力和耐受性差异是先天免疫和后天免疫协同作用的结果[12]。我们前期研究发现杂交育种能提高鱼体抗病力, 奥利亚罗非鱼抗链球菌病能力介于奥尼罗非鱼和尼罗罗非鱼之间[14]。与其他罗非鱼品系相比, 奥利亚罗非鱼在耐寒、耐盐等抗逆性方面也有显著优势[15,16], 已被广泛用作奥尼杂交罗非鱼的亲本。研究发现尼罗罗非鱼对无乳链球菌和海豚链球菌的抗性存在加性遗传变异, 表明通过人工选择提高对链球菌病暴发的存活率是可能的[17,18]。因此, 通过选育亲本来提高杂交子代的抗病性能是可行的, 本研究以奥利亚罗非鱼“夏奥1号”和埃及品系为研究材料, 检测它们感染无乳链球菌后存活率, 血清中生化指标和脾脏促炎性细胞因子表达变化差异, 初步筛选出抗病力和耐受性强的品系, 为培育抗链球菌病的奥尼罗非鱼提供抗性的亲本种质资源。
1 材料与方法
1.1 实验用鱼
本实验所用鱼均来自国家特色淡水鱼产业技术体系罗非鱼种质资源和品种改良岗位的保种基地, 其中奥利亚罗非鱼“夏奥1号”(简写为AX品系)为1983年从美国引进的奥利亚罗非鱼群体基础上十代连续群体选育获得的新品种(品种登记号GS-01-002-2006), 奥利亚罗非鱼埃及品系(简写为AE品系)为1999年从埃及农业部农业和农垦部水产研究中心实验室引进的奥利亚罗非鱼, 其卵子在鳜精子异源刺激后, 经雌核发育和群体选育培育而成的新品系。每种罗非鱼随机取150尾进行强化培育,每天投喂1次罗非鱼专用膨化饲料, 投喂量为鱼体重的3%—8%。在培育结束后将罗非鱼拉回实验室在循环水养殖系统32℃暂养14d, 此时AX奥利亚罗非鱼体重(145±40) g, AE奥利亚罗非鱼体重(130±35) g。病原菌用无乳链球菌GX1101在中国典型微生物保藏中心编号为 CCTCC NO: M 2020547, 保存在本实验室-80℃冰箱, 经复壮后使用。在整个实验期间保持水温(33±1)℃, 感染实验在加热棒控温的独立养殖桶中进行。
1.2 实验方法
实验设计感染实验①: 对强化培育结束后的两种奥利亚罗非鱼分别注射1.3×107cfu/mL无乳链球菌, 评估两种奥利亚罗非鱼对无乳链球菌的抗病力。菌浓度经预实验确定, 高于半致死浓度。每种罗非鱼设置3个平行组, 每个平行组10尾鱼, 每尾鱼腹腔注射无乳链球菌0.2 mL。人工感染后进行为期7d的观察, 统计7d内存活率, 绘制Kaplan-Meier生存曲线。感染无乳链球菌期间罗非鱼禁食。
感染实验②: 两种奥利亚罗非鱼各取120尾, 分4组暂养在160 L水族箱中7d, 后进行人工感染实验。其中3组罗非鱼每尾鱼腹腔注射0.2 mL的无乳链球菌, 为保证在感染后有足够存活数量的罗非鱼进行血液和组织样品的采集, 菌液注射浓度低于预实验确定的半致死浓度, 最终菌液浓度确定为2.2×106cfu/mL; 剩余1组腹腔注射等量的无菌生理盐水, 用于分析血清生化指标和脾脏促炎性细胞因子的表达变化, 评估两种奥利亚罗非鱼对无乳链球菌的耐受性。
样品采集感染实验②中生理盐水腹腔注射后, 在无乳链球菌腹腔注射后7h、24h、48h、72h、120h和168h每种奥利亚罗非鱼随机取6尾鱼进行血液和脾脏的采集。采用尾静脉取血法, 将抽取的血液收集到1.5 mL离心管, 室温静置2—4h后,以4000 r/min, 4℃的条件离心10min, 抽取上层血清于新的1.5 mL离心管中, -20℃保存待用。另外取罗非鱼新鲜抗凝血液100 μL用于测定呼吸暴发强度。无菌操作采集脾脏, 放入加有1 mL TRIzol的冻存管中, 液氮速冻后保存在-80℃冰箱, 直至分析。
罗非鱼血清生化指标测定通过日立7600全自动生化分析仪测定血液的血清生化指标, 谷丙转氨酶(ALT)、谷草转氨酶(AST)、总蛋白(TP)、球蛋白(GLO)、葡萄糖(GLU)、乳酸脱氢酶(LDH)、甘油三酯 (TG)和胆固醇(TC), 试剂盒从日本和光纯药工业株式会社采购; 碱性磷酸酶(AKP)试剂盒从四川迈克生物科技股份有限公司采购; 超氧化物歧化酶(SOD)试剂盒从宁波美康生物科技有限公司采购。溶菌酶(LZM)活力按照南京建成生物工程研究所的溶菌酶试剂盒说明书方法测定。血液呼吸暴发采用NBT(硝基四氮唑蓝)还原法[12]测定。
总RNA的提取和cDNA合成将保存在-80℃冰箱中的脾脏样品取出, 放入Sceintz-48型高通量组织研磨机(宁波新芝生物科技股份有限公司)中研磨匀浆。用TRIzol法提取总RNA。用Nanodrop超微量紫外分光光度计(Thermo公司)测定提取的总RNA的浓度及纯度, 并用1%琼脂糖凝胶电泳检测RNA的完整性。通过 PrimeScriptTMRT反转录试剂盒(TaKaRa公司)合成cDNA, -20℃保存备用。
实时荧光定量PCR分析促炎性细胞因子TNF-α、IL-1β、IL-6和内参基因β-actin的基因序列见表1, 在7900HT Fast Real Time PCR仪(ABI公司)上进行qRT-PCR测定基因的表达量。20 μL反应体系为: SYBR Green Realtime PCR Master Mix (Toyobo公司) 10 μL, cDNA模板 1 μL, 上下游引物(10 μmol/L)各0.8 μL, 无RNA水7.4 μL; PCR扩增程序: 95℃5min; 95℃ 15s, 60℃ 1min, 40个循环。用2-ΔΔCt法计算不同时间点TNF-α、IL-1β和IL-6的相对表达量。
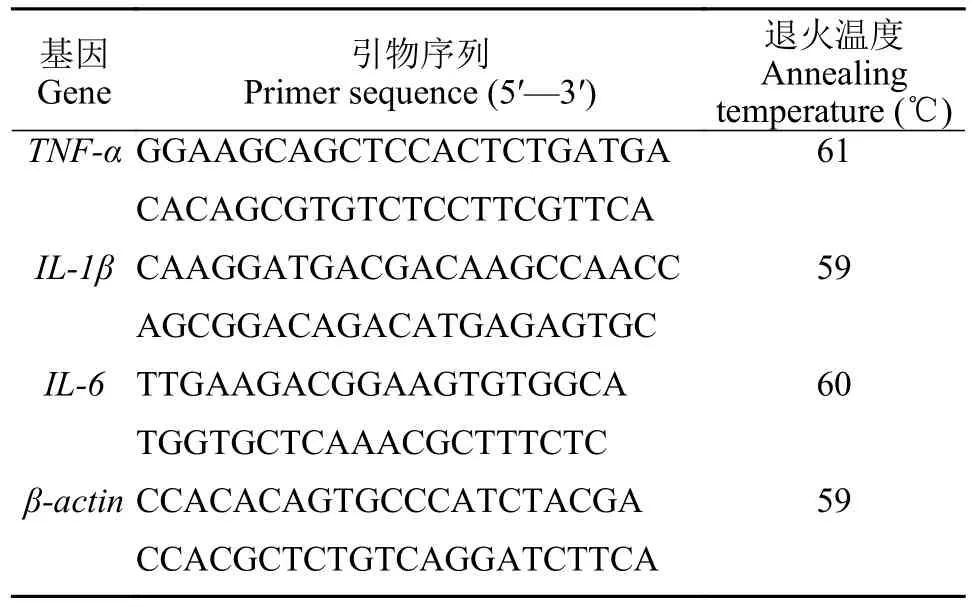
表1 本研究所用引物序列Tab.1 Primer sequence used in the study
1.3 统计分析
利用GraphPad Prism 9.0软件进行图表制作, 使用SPSS 25.0 和Microsoft Excel 2016 软件进行数据的统计分析。使用Log-rank检验两种奥利亚罗非鱼人工感染后生存曲线的差异, 并用P值显示两种奥利亚罗非鱼生存曲线的差异显著性。方差齐性通过Levene’s 检验后, 采用One-way ANOVA进行单因素方差分析, Duncan’s多重比较差异显著性, 显著性水平为0.05。血清生化指标以平均值±标准差(±SD)表示, 定量数据以平均值±标准误(±SE)表示。
2 结果
2.1 两种奥利亚罗非鱼感染无乳链球菌后生存曲线
由图1可知, 在人工感染无乳链球菌后, 奥利亚罗非鱼AE品系罗非鱼在感染后7d内的存活率为30%, AX品系在感染后7d内的存活率为10%。AE品系在感染后各时间点生存曲线一直高于AX品系,Log-rank检验后显示P=0.0477, 有显著性差异。
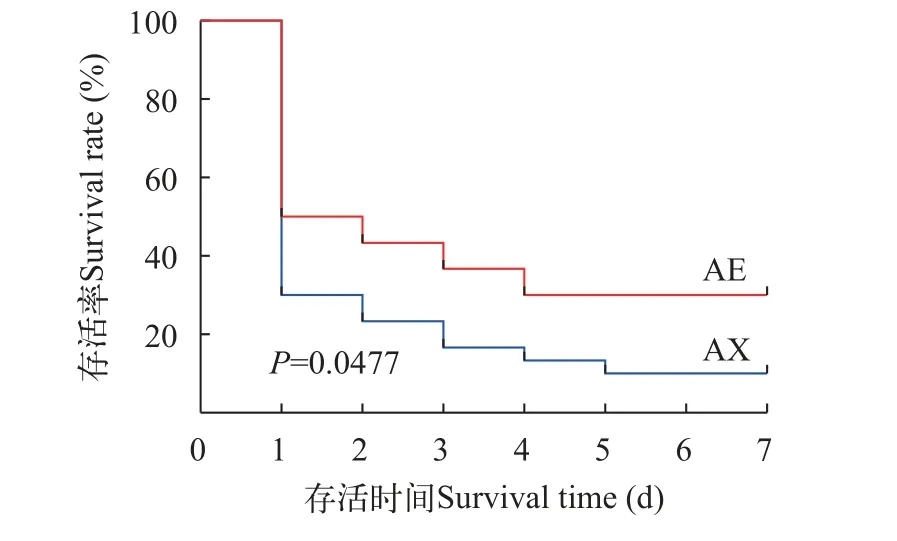
图1 两种奥利亚罗非鱼感染无乳链球菌后的生存曲线Fig.1 Kaplan-Meier survival curve for two blue tilapia species in the S.agalactiae challenge test
2.2 两种奥利亚罗非鱼感染无乳链球菌后血液生化指标变化
两种奥利亚罗非鱼在感染后ALT活性都呈现升高趋势, 在感染后168h达到最大值。AE奥利亚罗非鱼在感染后7h显著升高(P<0.05), AX奥利亚罗非鱼在感染后24h显著升高(P<0.05)。感染前两种奥利亚罗非鱼ALT活性没有显著性差异(P>0.05),在感染后7—168h, AE奥利亚罗非鱼的血清ALT活性显著高于AX奥利亚罗非鱼(P<0.05; 图2a)。两种奥利亚罗非鱼在感染后血清AST活性都显著性升高(P<0.05), 呈先上升后下降再上升的趋势, 且都在感染后48h达到最大值。在感染前、感染后7h和72h, AE奥利亚罗非鱼的血清AST活性显著高于AX奥利亚罗非鱼(P<0.05; 图2b)。

图2 两种奥利亚罗非鱼感染无乳链球菌后血清谷丙转氨酶(a)和谷草转氨酶(b)含量变化Fig.2 Changes of serum alanine aminotransferase (a) and aspartate aminotransferase (b) in two blue tilapia species infected with S.agalactiae
两种奥利亚罗非鱼感染后血清白蛋白与球蛋白比值(A/G)均呈现下降趋势, AE奥利亚罗非鱼在感染后7h血清A/G比值显著降低(P<0.05), 而AX奥利亚罗非鱼在感染后24h血清A/G比值显著下降(P<0.05)。AE奥利亚罗非鱼血清在感染前和感染后7h 的A/G比值和AX奥利亚罗非鱼没有显著性差异, 在感染后24h和48h显著低于AX奥利亚罗非鱼(P<0.05)。AE奥利亚罗非鱼的血清A/G比值始终低于AX奥利亚罗非鱼(图3a)。
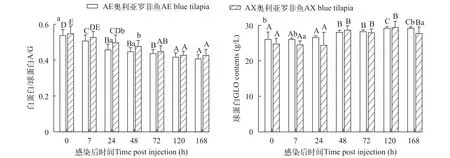
图3 两种奥利亚罗非鱼感染无乳链球菌后血清白蛋白/球蛋白(a)和球蛋白(b)含量变化Fig.3 Changes of serum albumin/globulin (a) and globulin (b) contents in two blue tilapia species infected with S.agalactiae
两种奥利亚罗非鱼在感染前血清GLO无显著性差异(P>0.0 5), 在感染后4 8 h 显著性升高(P<0.05)。在感染后7h和168h, AE奥利亚罗非鱼的血清GLO含量显著高于AX奥利亚罗非鱼(图3b)。
两种奥利亚罗非鱼感染无乳链球菌后血清AKP活性先升高后降低, 在感染后72h达峰。AE奥利亚罗非鱼的血清AKP活性在感染前和感染后7h显著高于AX奥利亚罗非鱼(P<0.05; 图4a)。
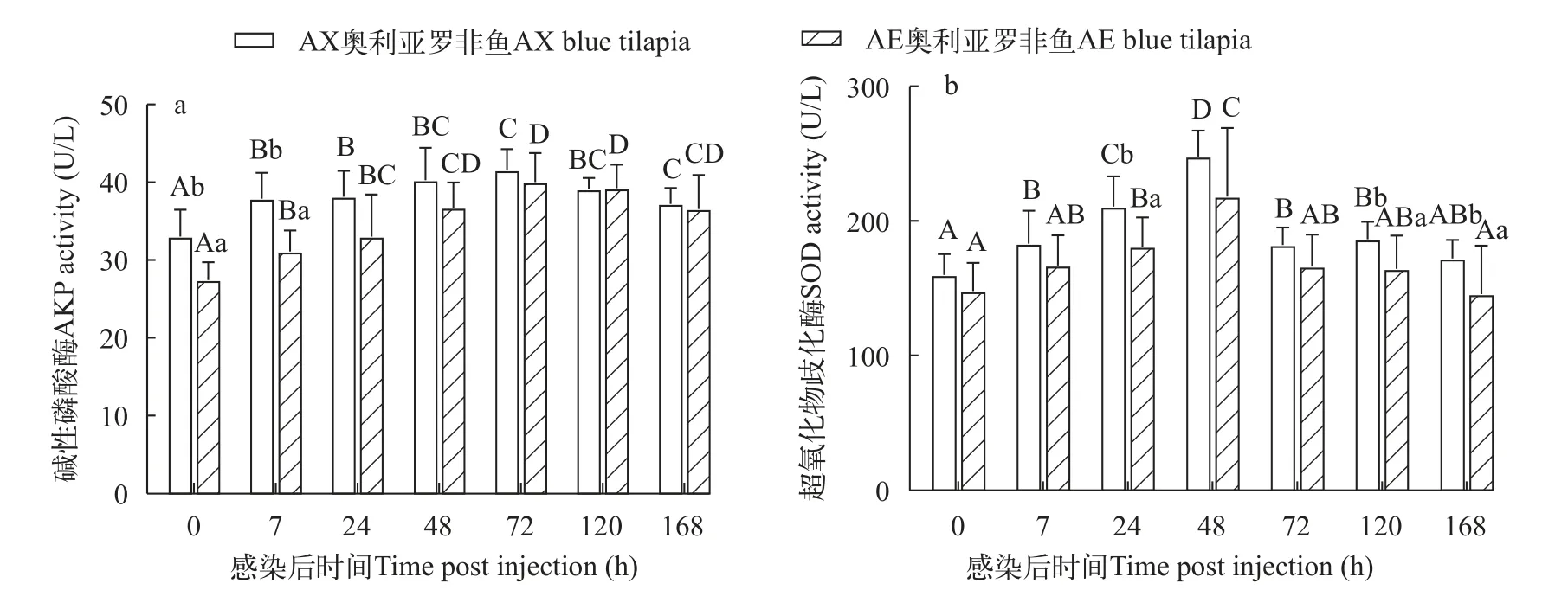
图4 两种奥利亚罗非鱼感染无乳链球菌后血清碱性磷酸酶(a)和超氧化物歧化酶(b)含量变化Fig.4 Changes of serum alkaline phosphatase (a) and superoxide dismutase (b) contents in two blue tilapia species infected with S.agalactiae
两种奥利亚罗非鱼感染无乳链球菌后血清SOD活性先升高后降低, 在感染后48h达峰, AX奥利亚罗非鱼在感染后72h就恢复到感染前水平,AE奥利亚罗非鱼在感染后168h恢复到感染前水平。两种奥利亚罗非鱼的血清SOD水平在感染前和感染后7h没有显著性差异(P>0.05), AE奥利亚罗非鱼的血清SOD水平在感染后24h、120h和168h显著高于AX奥利亚罗非鱼(P<0.05; 图4b)。
AE奥利亚罗非鱼在感染后7h血清GLU含量显著升高并达峰, 之后逐渐降低; AX奥利亚罗非鱼在感染后GLU含量呈下降趋势。感染前AE奥利亚罗非鱼的GLU含量显著低AX奥利亚罗非鱼(P<0.05),感染后两种罗非鱼的GLU含量没有显著性差异(P>0.05; 图5a)。
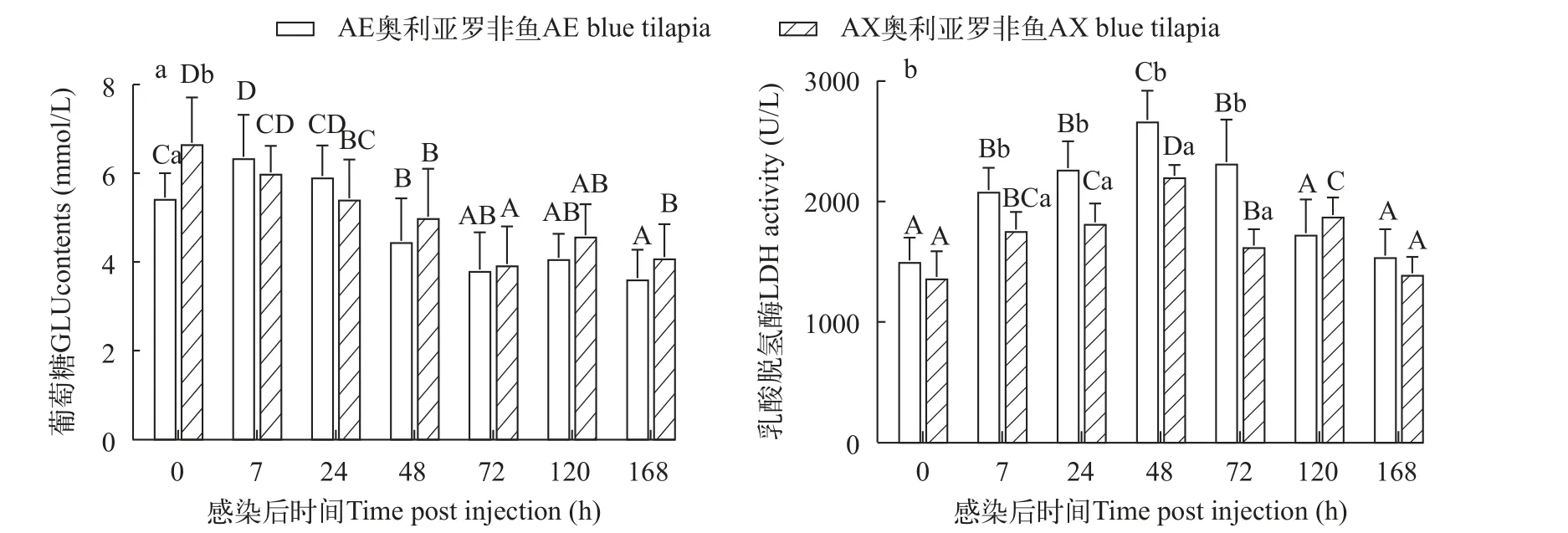
图5 两种奥利亚罗非鱼感染无乳链球菌后血清葡萄糖(a)和乳酸脱氢酶(b)含量变化Fig.5 Changes of serum glucose (a) and lactate dehydrogenase (b) contents in two blue tilapia species infected with S.agalactiae
两种奥利亚罗非鱼感染后血清LDH活性先升高后降低, 在感染后7h显著升高(P<0.05), 并都在感染后48h达峰; AE奥利亚罗非鱼在感染后120h恢复到感染前水平, AX奥利亚罗非鱼在感染后168h恢复到感染前水平。AE奥利亚罗非鱼在感染后7—72h LDH活性显著高于AX奥利亚罗非鱼(P<0.05),在感染前、感染后120h和168h两种奥利亚罗非鱼的LDH活性没有显著差异(P>0.05; 图5b)。
AE奥利亚罗非鱼感染后血清TC含量在感染后7h显著降低(P<0.05); AX奥利亚罗非鱼则先升高后降低再升高, 在感染后48h恢复到感染前水平。AE奥利亚罗非鱼在感染后24h TC含量显著低于AX奥利亚罗非鱼(P<0.05; 图6a)。
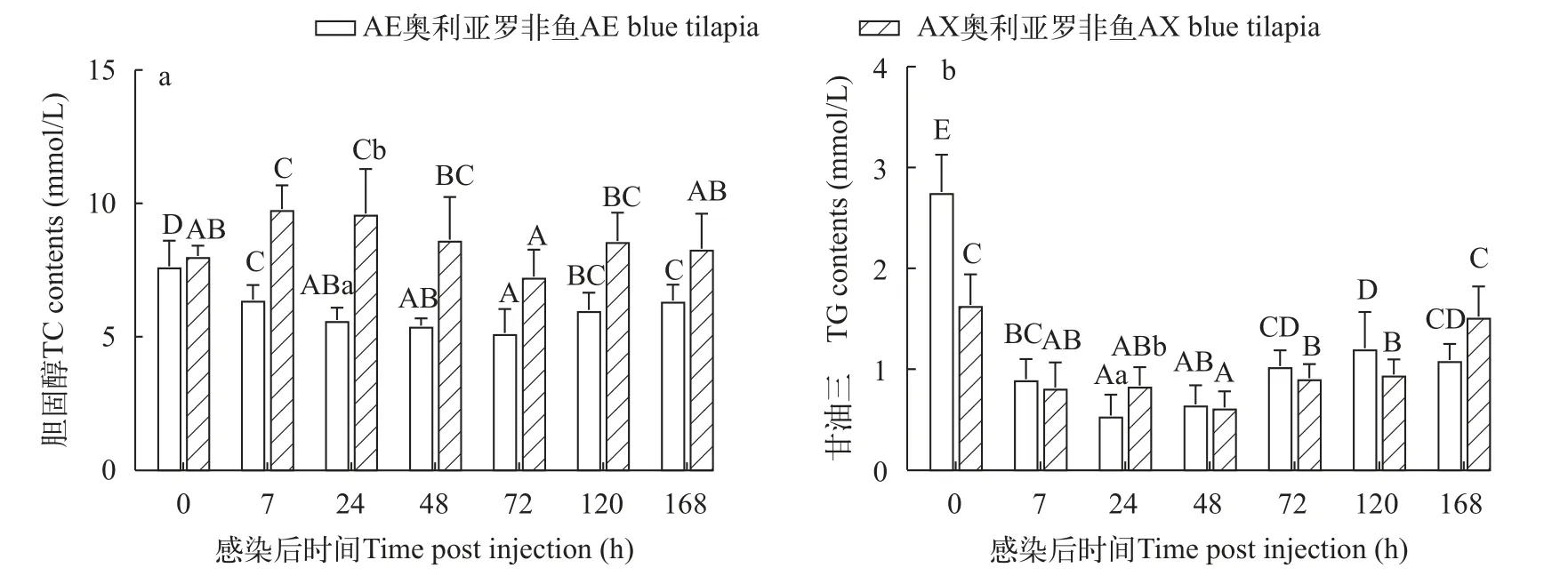
图6 两种奥利亚罗非鱼感染无乳链球菌后血清胆固醇(a)和甘油三酯(b)含量变化Fig.6 Changes of serum cholesterol (a) and triglyceride (b) contents in two blue tilapia species infected with S.agalactiae
两种奥利亚罗非鱼感染后血清TG含量先降低后升高, AE奥利亚罗非鱼在感染后24h最低, AX奥利亚罗非鱼在感染后48h最低, 感染后168h时AX奥利亚罗非鱼恢复到感染前水平。AE奥利亚罗非鱼在感染后24h的TG含量显著低于AX奥利亚罗非鱼(P<0.05; 图6b)。
两种奥利亚罗非鱼感染后血清LZM都升高后降低, AE奥利亚罗非鱼在感染后7h显著升高(P<0.05), 在感染后120h恢复至感染前水平; AX奥利亚罗非鱼在感染后LZM始终显著高于感染前水平(P<0.05)。AE奥利亚罗非鱼在感染前和感染后7h的LZM显著高于AX奥利亚罗非鱼(P<0.05), 而在感染后72—120h显著低于AX奥利亚罗非鱼(P<0.05; 图7a)。
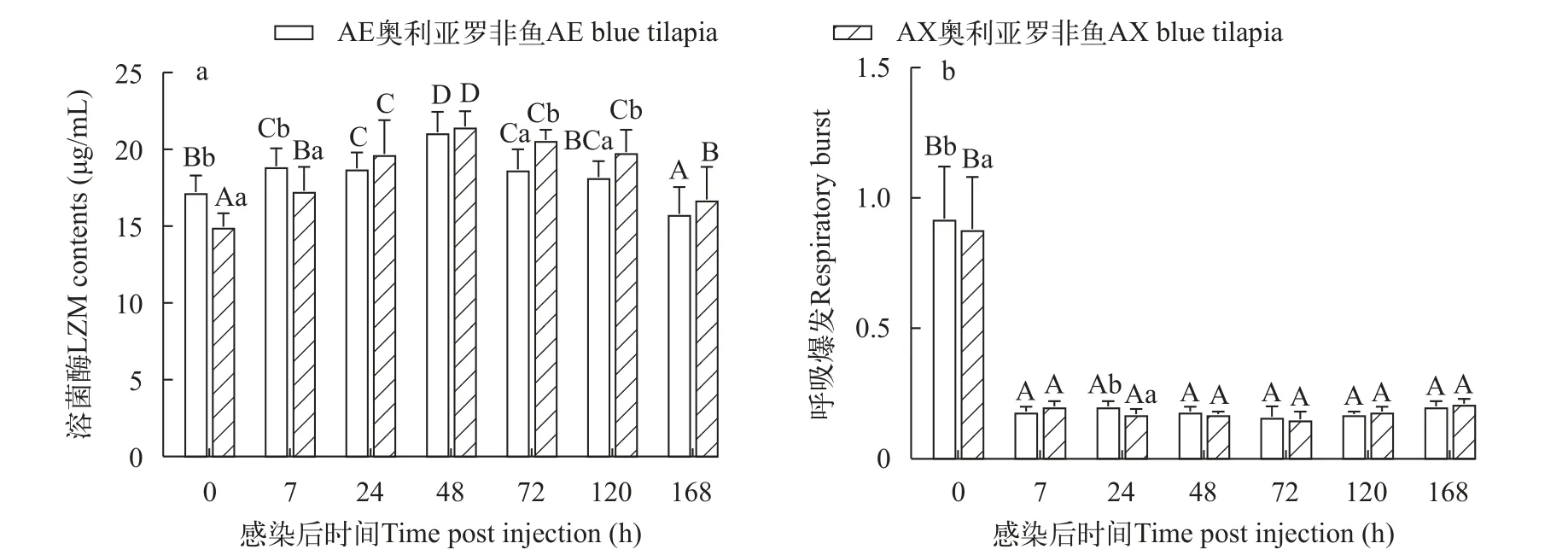
图7 两种奥利亚罗非鱼感染无乳链球菌后血清溶菌酶活性(a)和呼吸暴发(b)变化Fig.7 Changes of serum lysozyme activity (a) and respiratory burst (b) contents in two blue tilapia species infected with S.agalactiae
两种罗非鱼的呼吸暴发程度在感染后7h显著性下降(P<0.05)。感染后两种奥利亚罗非鱼呼吸暴发都显著降低(P<0.05); AE奥利亚罗非鱼在感染前和感染后24h呼吸暴发强度显著高于AX奥利亚罗非鱼(P<0.05), 在其他时间点则没有显著性差异(P>0.05; 图7b)。
2.3 两种奥利亚罗非鱼感染无乳链球菌后脾脏促炎性细胞因子表达变化
两种奥利亚罗非鱼感染无乳链球菌后脾脏TNF-α表达显著升高(P<0.05), 在感染后7h达峰, 之后显著性下降(P<0.05), 但在感染后168h都显著高于感染前水平; AE奥利亚罗非鱼的脾脏TNF-α表达在感染前和感染后120h都显著低于AX奥利亚罗非鱼(P<0.05), 在其他时间点没有显著性差异(P>0.05;图8a)。
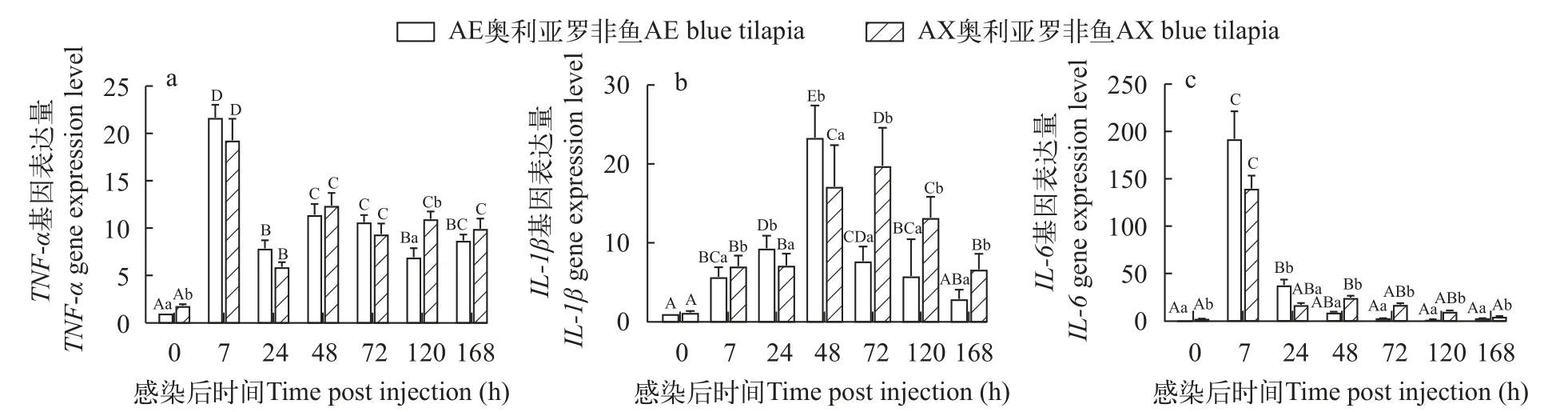
图8 两种奥利亚罗非鱼感染无乳链球菌后脾脏中TNF-α (a)、IL-1β (b)和IL-6 (c)相对表达量变化Fig.8 Changes of relative expression of TNF-α (a), IL-1β (b) and IL-6 (c) in two blue tilapia species infected with S.agalactiae
两种奥利亚罗非鱼在感染后脾脏IL-1β表达先升高后降低, AE奥利亚罗非鱼IL-1β表达在感染后48h达峰, 之后显著性下降(P<0.05), 在感染后168h恢复到感染前水平; AX奥利亚罗非鱼IL-1β表达在感染后72h达峰, 在感染后168h仍显著高于感染前水平(P<0.05)。AE奥利亚罗非鱼在感染后7h、72—168h这些时间点IL-1β表达都显著低于AX奥利亚罗非鱼(P<0.05; 图8b)。
两种奥利亚罗非鱼在感染后IL-6表达先升高后降低, 在感染后7h达到峰值, AE奥利亚罗非鱼在感染后48h恢复到感染前水平; AE奥利亚罗非鱼在感染前和感染后48—168h的IL-6表达显著低于AX奥利亚罗非鱼(P<0.05), 而在感染后24h显著高于AX奥利亚罗非鱼(P<0.05; 图8c)。
3 讨论
3.1 两种奥利亚罗非鱼人工感染无乳链球菌后存活率分析
链球菌病是罗非鱼产业影响最大的细菌性疾病, 病原菌主要是无乳链球菌, 发病时间集中在每年的6—10月, 病程短, 死亡率高。统计感染后的存活率能够初步说明鱼体的抗病能力的差异和免疫强弱[19]。目前对链球菌病的防治主要依赖抗生素,但抗生素的有效性只在病情暴发的早期应用时才能发挥作用[20]。除了抗生素外, 生态防治方法包括益生菌、鱼虾混养和鱼菜(药)共生等方式。此外,免疫防治是控制链球菌病的重要方法和未来趋势,已经研发出不同类型的疫苗, 但距离批文和产业化应用还有一定的距离。因此, 提高罗非鱼内在抗病能力, 筛选和培育抗病品种(系)是防控链球菌病的根本办法。水温32℃以上罗非鱼链球菌病容易暴发, 提高鱼体的抗病力能显著降低感染病原菌后的死亡率[18,21,22]。抗病力(Disease resistance)是宿主通过预防感染或抑制宿主内病原体复制来限制其宿主内病原体载量的能力[23], 简单来说就是宿主及其免疫系统如何对外来病原体负荷做出反应。水产养殖中将抗病力定义为疾病暴发期间或人工感染期间个体的存活率(和/或死亡率)[24]。本研究显示奥利亚罗非鱼AE品系在无乳链球菌胁迫下生存曲线一直高于AX品系, 表明AE奥利亚罗非鱼对无乳链球菌的抗病力强于AX奥利亚罗非鱼。
杂交是防止品种退化及创制优良品种的有效方法, 其中远缘杂交是指种间或种间以上亲缘关系较远的两个物种之间的杂交[25]。奥利亚罗非鱼属鲈形目、鲡鱼科, 鳜属鲈形目、鮨科。母本奥利亚罗非鱼和父本鳜的远缘杂交可获得能正常发育的杂交子代, 人工授精到鱼苗阶段的成活率为0.3%—0.5%[26,27]。杂交子代与奥利亚罗非鱼在形态学上没有显著差异[26], 与母本奥利亚罗非鱼有85.8%的遗传相似性, 但与父本鳜却只有4.9%的遗传相似性[27]。染色体核型分析表明, 子代与奥利亚罗非鱼的核型相似, 染色体数目均为2n=44, 而鳜为2n=48[28]。只有鳜染色体整套丢失而奥利亚罗非鱼染色体得到自然加倍的个体才可以得到存活[29]。一般认为, 由于种间生殖隔离的存在, 远缘杂交难以形成可育品系[25]。而本研究中的AE奥利亚罗非鱼为1999年从埃及农业部农业和农垦部水产研究中心实验室引进的奥利亚罗非鱼, 与鳜进行远缘杂交, 获得的杂交后代可育可自繁, 历经6个世代的群体选育形成新品系。形态学、遗传标记和染色体核型等方面表明, 它们可能为异精雌核发育的奥利亚罗非鱼,鳜精子在受精卵的发育过程中主要起刺激作用[26—29]。本研究中的AX奥利亚罗非鱼为1983年从美国奥本大学引进的奥利亚罗非鱼经群体选育形成的新品种, 而AE奥利亚罗非鱼可能因为融合了部分来自父本鳜的遗传物质, 从而提高了抗病力。类似的,新品种异育银鲫“中科 5号”利用银鲫独特的异精雌核生殖, 筛选获得整入团头鲂父本遗传信息, 从而比异育银鲫“中科3号”抗病能力更强[30]。
在无乳链球菌入侵罗非鱼后, 激活宿主免疫系统, 触发鱼体对感染的抵抗力。抗病力的重点是通过杀死入侵的病原菌来保护宿主, 而疾病耐受性(Disease tolerance)是针对感染进化的保守防御策略,其不对宿主病原体负荷产生直接的负面影响[31], 它依赖于组织损伤控制, 降低宿主对病原体或针对病原体的免疫反应造成的组织损伤[32], 简而言之就是宿主如何修复病原体或激活的免疫系统造成的损害。维持血液等各种生理系统平衡的机制有助于宿主对感染的耐受, 当组织损伤的程度或宿主生理学的改变超过了耐受机制的能力时, 就会出现感染的病理结果; 相反, 较强的耐受性有助于减少发病率和死亡率[32]。
3.2 两种奥利亚罗非鱼感染无乳链球菌后血液生化指标变化分析
血液学检查是评估鱼类生理状态和健康的常用方法之一[33], 当罗非鱼受无乳链球菌感染后, 组织或器官受到损害, 可以在血清酶学指标上反映出来。谷丙转氨酶、谷草转氨酶是评价肝脏是否受损的重要指标[34]。肝脏急性损伤或坏死性病变导致血清 ALT 和 AST 水平显著升高, 具有重要的鱼病诊断意义[35—37]。在本研究中, 两种奥利亚罗非鱼的血清ALT和AST活性在感染后都出现了显著性升高, 且在感染后7—168h, AE品系的血清ALT活性显著高于AX品系; 感染后7h和72h, AE品系的AST活性显著高于AX品系, 说明奥利亚罗非鱼感染无乳链球菌后肝脏都受到了损伤, 且AE品系的肝脏受损可能更严重。
血清总蛋白包括白蛋白和球蛋白, 具有维持血管渗透压和酸碱度, 参与代谢产物的运输和机体免疫等生理功能[38]。白蛋白/球蛋白(A/G)比值一定程度上可以反映机体的免疫情况和肝脏的功能状况[39]。在本研究中两种奥利亚罗非鱼感染后A/G均显著下降, 大黄鱼(Pseudosciaena crocea)感染哈维氏弧菌(Vibrio harveyi)后A/G比值也呈下降趋势[40]。球蛋白与机体免疫力息息相关, 当机体受到细菌、病毒等抗原侵袭时, 血清球蛋白水平会增加, 通常被认为与鱼类更强的先天免疫反应有关[41]。本研究中两种奥利亚罗非鱼球蛋白在感染后48h都显著上升,说明两种奥利亚罗非鱼都及时产生了免疫球蛋白来对抗无乳链球菌的感染; 而AE品系的血清球蛋白在感染后7h和168h显著高于AX品系, 表明AE品系在感染初期和后期对无乳链球菌有更大的耐受性。
碱性磷酸酶是一种参与代谢调控的非特异性磷酸水解酶, 与物质的跨膜转运、蛋白质合成、机体的非特异性免疫等密切相关[42]。Du等[34]研究表明尼罗罗非鱼在无乳链球菌感染后血清中AKP活性先升高后降低再升高。本研究中两种罗非鱼血清中AKP活性在感染后先升高, 但随着感染时间的延长, AKP活性降低。有报道表明这可能与随着病程发展鱼体贫血有关[43]。超氧化物歧化酶(SOD)是鱼类体内一种关键的抗氧化酶, 具有消除活性氧的毒性、参与由病毒或细菌引起的免疫反应、平衡氧化与抗氧化等方面的作用[44]。之前研究表明奥利亚、吉富和奥尼罗非鱼感染无乳链球菌48h时SOD都显著升高[19]。类似的, 本研究中两种奥利亚罗非鱼在感染无乳链球菌后48h都升高至峰值; 但AE品系的血清SOD水平在感染后期显著高于AX品系, 说明AE品系在感染后期的抗氧化能力更强。
血糖浓度是鱼类重要的应激指标[45]。作为增强寄主抗性的一种策略, 宿主生物代谢受到调节,以剥夺病原菌生存所需的底物[46]。葡萄糖是许多病原菌的主要碳源, 研究表明, 调节宿主葡萄糖代谢的应激反应可以控制组织损伤, 并建立对细菌感染的疾病耐受性[47]。花鲈(Lateolabrax maculatus)感染哈维氏弧菌后12h 血糖急剧下降, 在感染后24—72h随时间显著升高[37]。Zeng等[48]研究表明葡萄糖增强罗非鱼对迟缓爱德华氏菌(Edwardsiella tarda)感染的抵抗力。本研究中AE品系感染后血清GLU先上升后下降; AX品系感染后GLU显著下降。血糖水平降低, 最有可能旨在限制病原菌对葡萄糖的利用[46,49]; 而AE品系可能糖原动员能力更强, 升高的血糖增强了鱼体对无乳链球菌的耐受性。血清LDH活性增高是病鱼肌肉受损的表征[50]。感染无乳链球菌后埃及尼罗、吉富和奥尼罗非鱼血清中LDH活性先升高后降低, 在感染后48h达峰[19]。本研究中两种奥利亚罗非鱼在感染后血清LDH活性变化趋势与之相同, 与之不同的是本次实验观察时间更长, 在感染后168h都已恢复到感染前水平。LDH活性的变化趋势提示, 在感染无乳链球菌鱼体初期即有肌肉损伤, 但随着时间的推移逐渐恢复正常。
胆固醇是细胞膜的主要结构成分, 此外, 鱼类血浆胆固醇与抗病性高度相关, 是鱼类健康的重要指标, 因为它与细菌感染后的死亡率显著相关[51]。同时, 胆固醇是皮质醇等一些类固醇激素的前体,而甘油三酯是体细胞的主要能量来源, 也作为肝功能指标[14,52]。生物絮体和海水中褐牙鲆(Paralichthys olivaceus)感染迟缓爱德华氏菌后TC显著降低,表明是由于迟缓爱德华氏菌感染导致抗病性降低[45]。3种正交子一代奥尼罗非鱼感染在感染无乳链球菌后3d TC和TG都显著下降[53]。这与本研究结果类似, 说明两种奥利亚罗非鱼感染无乳链球菌后抗病力下降, 引起鱼体营养不良、脂代谢和肝功能障碍。
溶菌酶是一种非特异性免疫抗菌酶, 具有抵抗鱼类病原菌的活性。史氏鲟(Aclpenser Schrenckii)感染嗜水气单胞菌(Aeromonas hydrophila)后血清、肝脏和黏液中LZM活力出现不同程度升高[54]。有研究表明LZM可作为罗非鱼抗病品系的选育指标, 与抗链球菌病能力正相关[19]。同样, 具有较高溶菌酶活性的虹鳟(Oncorhynchus mykiss)对杀鲑气单胞菌(Aeromonas salmonicida)[55]、鲤(Cyprinus Carpio)对嗜水气单胞菌感染表现出更强的抵抗力[56]。本研究发现两种品系在感染后7h的血清LZM活力都有显著升高。AE品系的LZM在感染前和感染后7h显著高于AX品系, 提示AE品系可能抗病力更强。呼吸暴发是一种重要的防御机制, 通过在生物体内产生有毒的超氧阴离子(O2-)来帮助对抗病原菌[57]。海鲈(Dicentrarchus labrax)感染鳗弧菌(Vibrio anguillarum)后导致呼吸暴发强烈抑制[58]。有研究表明, 抗无乳链球菌或嗜水气单胞菌的鱼类比易感鱼类表现出更高的呼吸暴发活性[12,59]。本研究中两种品系呼吸暴发感染后都受到抑制, AE品系的呼吸暴发强度在感染前和感染后24h显著高于AX品系, 表明AE品系比AX品系更不容易感染无乳链球菌。
3.3 两种奥利亚罗非鱼脾脏促炎性细胞因子表达差异分析
疾病耐受性和对感染的抵抗力与疾病的发展有关, 脾脏是罗非鱼抵抗无乳链球菌感染的主要靶器官, 对于细菌抗原呈递和启动适应性免疫应答非常重要[60]。宿主免疫反应, 如促炎细胞因子, 出现在受体和信号级联之前, 在宿主防御中起着关键作用, 最先分泌的促炎细胞因子主要有TNF-α、IL-1β和IL-6[61]。He等[62]发现尼罗罗非鱼在接种无乳链球菌后,TNF-α和IL-1β的表达显著增加。本研究中两种品系罗非鱼的脾脏TNF-α、IL-1β和IL-6在感染后7h都显著升高, 说明当病原菌入侵后两种罗非鱼都快速产生了免疫应答。IL-6是一种多效性细胞因子, 参与尼罗罗非鱼对细菌感染的应答并促进抗体的产生[63]。Costa等[64]提出IL-6能够被其他免疫因子诱导表达, 并诱导抗菌肽生成, 防止机体自我损伤。炎症是通过促炎性细胞因子和抗炎因子之间的平衡来调节的[65], 炎症过度可能造成机体损伤[66]。AE品系在感染后24hIL-6显著高于AX品系,但感染后48—168h却低于AX品系;TNF-α在感染后120h显著低于AX品系;IL-1β在感染后72—168h显著低于AX品系, 促炎因子表达低提示炎症程度更轻, 表明AE品系在感染前期快速诱导炎症杀死病原, 但在感染后期炎症更轻, 从而保持对无乳链球菌更大的耐受性。
4 结论
长期以来, 普遍的观点认为, 遏制、杀死或驱逐入侵病原菌的免疫驱动抵抗机制是对抗传染病的主要防御策略。然而, 疾病耐受性是一种同样重要的宿主防御感染策略, 它不会对病原菌产生直接的负面影响, 同时在功能上与免疫驱动的抵抗机制相互作用, 以限制传染病的严重程度[47,67]。本研究比较了奥利亚罗非鱼AE品系和AX品系对无乳链球菌的抗病力差异, 血清生化指标和脾脏中促炎性细胞因子表达变化。结果发现人工感染后7d内AE奥利亚罗非鱼生存率显著高于AX奥利亚罗非鱼。感染后两种奥利亚罗非鱼血清中的ALT、AST、GLO、AKP、SOD和LZM显著升高; A/G、TG显著下降, 呼吸暴发抑制; 且AE品系的血清球蛋白和SOD水平在感染后期显著高于AX品系。定量PCR结果显示两种奥利亚罗非鱼脾脏TNF-α、IL-1β和IL-6表达在感染后7h都显著升高, 但AE品系在感染后期3种促炎性细胞因子的表达都显著低于AX品系。研究表明AE品系对无乳链球菌的抗病力强于AX品系, 在感染后期的抗氧化能力更强, 炎症程度更轻, 从而保持对无乳链球菌更大的耐受性。本研究初步筛选出抗病力和耐受性强的奥利亚罗非鱼品系, 为培育抗链球菌病的奥尼罗非鱼提供抗性的亲本种质资源。

