基于CRISPR/Cas13a系统建立大口黑鲈弹状病毒检测方法
张敏琳 黄枫淇 左小玲 梁建韬 梁凯珊 单金红 李宗烊 喻 婕罗丽媛 禤梓杰 赵会宏, 王 庆,
(1.华南农业大学海洋学院, 广州 510642; 2.华南农业大学粤港海洋生物资源保护与开发联合实验室, 广州 510642)
大口黑鲈(Micropterus salmoides)是我国重要的淡水经济鱼类之一, 因其肉质鲜美、无肌间刺,加之其适应性强、养殖周期短等优点, 深受消费者和养殖者的喜欢, 近年来大口黑鲈的养殖出现了快速增长[1]。目前, 我国大口黑鲈年养殖产量已达70万吨, 养殖场主要集中分布在广东、江苏、浙江、江西、四川和福建6省份, 占全国生产总量的90%以上[2]。然而, 在大口黑鲈的养殖过程中, 其病害日趋严重, 细菌病和病毒病成为危害其养殖的主要疾病[3], 其中大口黑鲈弹状病毒(Micropterus salmoides rhabdovirus, MSRV)危害巨大。该病毒能引起幼鱼嗜睡、漫游、腹部肿胀和体形扭曲, 以及诱导坏死性溃疡和多器官出血, 一旦感染死亡率超过90%[4]。MSRV是一种包膜状、短棒状或子弹状的单股负链RNA病毒, 能够严重危害大口黑鲈养殖业的发展, 该病毒具有传播速度快、死亡率高、防控难度大的特点[5]。MSRV包含11300—11600个核苷酸, 包括3′非翻译区和5种结构蛋白[核蛋白(N)、磷蛋白(P)、基质蛋白(M)、糖蛋白(G)和RNA聚合酶]。其中MSRV的3′前导区与其他鱼类弹状病毒相比在遗传水平上具有低同源性[6]。弹状病毒共有9个属, 除了一些未被分类的病毒之外, 感染鱼类的弹状病毒主要为水泡性口炎病毒属、诺拉弹状病毒属和佩弹状病毒属这3个属[7]。其中, MSRV属弹状病毒科(Rhabdoviridae), 水泡性口炎病毒属(Vesiculovirus)[8,9]。每年因MSRV导致的大口黑鲈鱼苗损失超过30%, 给大口黑鲈养殖产业发展带来巨大损失。但是目前关于该病毒的治疗和检测方法还不成熟, 尤其是现有检测技术较难做到在无复杂检测设备的情况下开展现场检测。
目前关于检测MSRV的方法主要分为组织病理学检测、免疫学检测和分子生物学检测等。组织病理学检测主要是采取鱼的患病组织器官制作石蜡病理切片, 后在显微镜下观察组织病理变化[10];免疫学检测主要是采用ELISA检测大口黑鲈血清中的G蛋白抗体水平, 用以分析MSRV诱导的抗原特异性免疫反应[11]; 分子生物学上经常使用的是聚合酶链式反应(PCR)[12]、荧光实时定量PCR[13]等。上述检测方法还存在一些不足之处, 如检测方法不够高效方便、检测设备需要专业的温控功能、检测所需时间较长、实验人员需要一定的实验技能等。除此之外, 目前关于MSRV还没有有效的治疗方法, 故很有必要在感染之前及时发现病毒并做好有效的防范措施, 能够在一定程度上减少养殖过程中的损失。因此, 开发一种灵敏度高、特异性强并且适合现场诊断的MSRV检测方法迫在眉睫。
CRISPR系统最初是在细菌和古细菌中得到确认[14], CRISPR-Cas系统是结合和切割外来核酸的原核适应性免疫系统[15]。CRISPR-Cas系统主要分为两类: 使用多蛋白复合物破坏外来核酸的一类系统, 包括Ⅰ型、Ⅲ型和Ⅳ型, 以及使用单一蛋白质的二类系统, 包括Ⅱ、Ⅴ和Ⅵ型[16]。Ⅰ型和Ⅲ型系统拥有如下特征: Cas核酸内切酶处理前crRNA, 每个crRNA被组装成多Cas蛋白复合物, 从而可以识别和切割与crRNA互补的核酸片段。而Ⅱ型系统处理前crRNA的机制不同, 其中与前crRNA中重复序列互补的反式激活crRNA(tracrRNA)在Cas9蛋白存在的情况下会触发双链RNA特异性核糖核酸酶RNaseⅢ的处理[17]。近年来, CRISPR-Cas13a引发了很多的研究。CRISPR-Cas13a(以前称为C2c2)是一种新表征的单效应子Ⅱ类, Ⅵ型, RNA引导的RNA编辑系统[18]。Cas13a的序列分析显示存在两个更高的真核和原核核苷酸结合内核糖核酸酶结构域, 且不存在DNase催化位点[19]。CRISPR-Cas13a具有RNA引导的RNA靶向内切酶和非特异性RNA内切酶活性两种活性, 故逐渐被开发为核酸检测的工具[18]。当Cas13a与crRNA结合后, 会形成具有核酸酶活性的核糖核蛋白复合体, 当识别到具有互补序列的单链靶标RNA时, 会激活Cas13a切割单链靶标RNA[20]。其切割活动可通过连接的荧光体-淬灭体的ssRNA来检测, 被激活的Cas13a会切割ss-RNA导致其裂解后发荧光[18,21]。基于这一特性,CRISPR/Cas13a的检测已成功应用于检测赤点石斑鱼神经坏死病毒[22]、猪繁殖与呼吸综合征病毒[23]和甲型H7N9禽流感病毒[24], Cas13a与对应的crRNA结合形成复合物并且与靶向RNA结合时, Cas13a的切割活性被激活以降解非靶向RNA。
MIRA (Multienzyme Isothermal Rapid Amplification, MIRA)技术是一种基于重组酶恒温核酸快速扩增技术, 通过MIRA反应可实现对目标核酸序列的扩增, 无须复杂的热循环仪, 而是可以通过简单的水浴或加热块在20—37℃的恒定温度下完成。整个反应过程需要3种酶: 重组酶, 负责将特异性引物与模板DNA配对; 单链DNA结合蛋白(SSB),在不加热的情况下形成单链DNA; 链置换DNA聚合酶, 负责扩增和延伸。反应一旦开始, DNA扩增会迅速进行, 并在20min时间内达到可检测的水平[25]。与RPA (T4 UvsX)或RAA (大肠杆菌UvsX)中使用的重组酶不同[26], MIRA使用螺旋酶(gp41)和重组酶(SC-recA)的组合来形成单链DNA并启动反应。多酶系统加速了反应速度, 促进了对潜在抑制剂的耐受性。在MIRA中, 核酸模板的扩增过程可以在37—42℃下10—30min内完成。这项技术已被用于检测猪瘟病毒[25]。与其他等温扩增类似, 反转录-MIRA (RT-MIRA)产物也可以通过侧流条检测或实时定量PCR进行可视化检测。
本研究开发了一种结合MIRA技术和CRISPR/Cas13a系统的MSRV核酸检测方法, 该方法特异性强, 灵敏度高并且操作简便, 为MSRV的现场检测提供帮助, 也为尽早发现MSRV采取防控措施提供帮助。
1 材料与方法
1.1 样本来源
从鲈鱼养殖场采集患有大口黑鲈弹状病毒全长约2 cm的鱼苗样品, 均存放于-80℃冰箱保存。
1.2 实验仪器与试剂
主要试剂: 纯化的LwaCas13a (East Mad东抗生物公司); Tris饱和酚(pH7.8); RNAiso plus和RTPCR试剂盒(TaKaRa公司); 反转录试剂(TOYOBO东洋纺公司); T7高产RNA转录试剂盒、ChamQ SYBR qPCR Master Mix(Without ROX)试剂盒(Vazyme诺唯赞生物技术有限公司); CRISPR/Cas13a检测系统的缓冲液使用Macklin麦克林试剂公司定制(40 mmol/L Tris-HCl pH 7.3, 60 mmol/L NaCl,6 mmol/L MgCl2); MIRA-RNA恒温快速扩增试剂盒(基础型)(潍坊安普未来生物科技有限公司)。
主要仪器: Tannon2500 凝胶成像系统、实时荧光定量 PCR仪(美国Bio-Rad 公司); 高速离心机(美国Beckman 公司); 电泳仪(北京白晶生物技术有限公司); 紫外透射器(美国MaestroGen公司)。
1.3 crRNA的制备以及MIRA引物设计
在GenBank中下载MSRV序列, 针对其衣壳蛋白(CP)基因序列(NCBI: MK397811.2)设计长度为20 nt的靶点, 并根据靶点所在位置设计出两个crRNA(分别为crRNA1和crRNA2), 如表1所示, 并通过NCBI-BLAST来确认其特异性。设计使用两对不同MIRA引物分别对含有靶序列的基因片段进行扩增, 并命名分别为MIRA-F1/R1和MIRA-F2/R2,如表2所示。
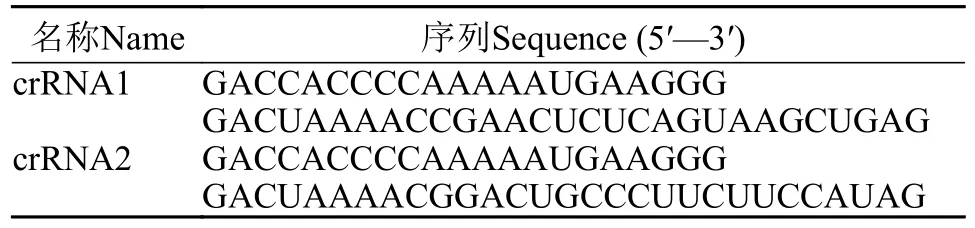
表1 针对MSRV设计的crRNA序列Tab.1 crRNA sequences designed for MSRV
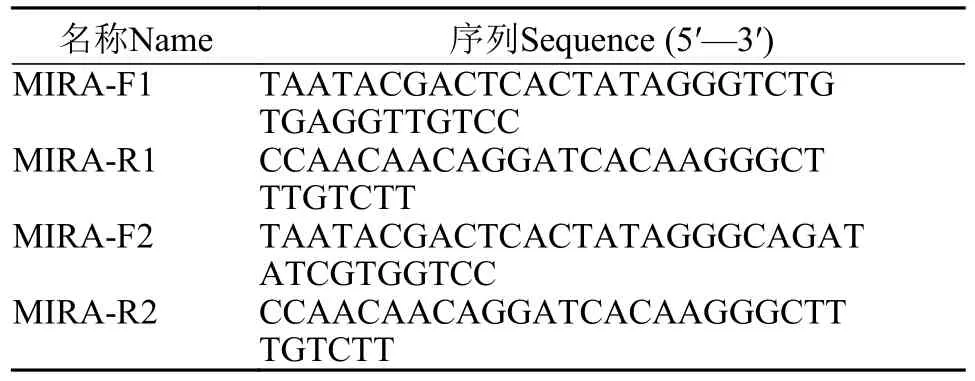
表2 MIRA扩增引物序列Tab.2 Primer sequences for MIRA amplification
1.4 MIRA扩增以及体外转录
使用MIRA恒温快速扩增试剂盒,在42℃恒温条件下, 用MIRA引物将提取出来的样品RNA进行扩增, 并将扩增产物进行切胶回收, 得到的DNA使用体外转录试剂盒体外转录为RNA, 从而获得病毒RNA序列。
1.5 标准品的制备
基于实验室现有的cDNA库, 用MSRV引物对cDNA进行qPCR验证是否为MSRV。经测序确定后的模板cDNA经PCR扩增后进行体外转录, 测定浓度并稀释得到RNA标准品。
1.6 ssRNA报告探针合成
ssRNA报告探针序列为: 5′-UUUUUU-3′, 5′端和3′端分别标记了荧光基团和淬灭基团。我们使用RNA酶来测试ssRNA报告探针作为检测信号的可行性, 同时, 利用Cas13a蛋白的特性, ssRNA报告探针可被激活的Cas13a蛋白裂解, 从而发出荧光, 可通过简单的紫外灯或荧光定量仪检测。
1.7 Cas13a检测体系
CRISPR/Cas13a检测反应体系如表3所示, 将反应物充分混匀离心后置于荧光定量仪上, 选择观察 FAM 荧光强度, 在37℃恒温条件下反应1h, 并且每隔1min收集一次荧光值, 反应结束后用紫外灯照射观察荧光值。

表3 CRISPR /Cas13a检测体系Tab.3 CRISPR /Cas13a detection system
1.8 检测体系优化
为了确定用CRISPR/Cas13a检测MSRV的最佳反应体系, 我们对检测体系的四个部分进行了优化: crRNA种类、反应温度、ssRNA报告探针含量以及Cas13a与crRNA的反应浓度比, 同时我们在实验中使用ddH2O作为空白对照。
首先保持所有的参数不变, 变量为crRNA的种类(即crRNA1和crRNA2), 最后根据单位时间内反应效率及最终收集的荧光值来选择最佳的crRNA;探究最佳反应温度, 除了反应温度, 其他参数保持不变, 分别在31℃、34℃、37℃和40℃进行实验;接下来, 除了ssRNA报告探针含量, 其他参数保持不变, 设置探针浓度分为100、200、300、400、500、600和700 nmol/L; 最后, 保持其他参数不变, 改变Cas13a与crRNA的反应浓度比。根据单位时间内反应效率及最终收集的荧光值来选择最佳的反应温度、ssRNA报告探针浓度及Cas13a与crRNA的反应浓度比。
1.9 灵敏度试验
使用优化后的CRISPR/Cas13a检测系统检测不同浓度的RNA标准品, 以104fM到10-1fM的浓度对RNA标准品进行10倍连续稀释, 以无目标RNA样品为阴性对照, 从而探寻CRISPR/Cas13a检测系统最低检测浓度。
1.10 特异性试验
使用优化后的CRISPR/Cas13a检测系统检测不同的水产RNA病毒, 包括RGNNV、BFNNV、TPNNV,用无病毒感染鱼的RNA作为阴性对照, 用ddH2O作为空白对照, 测试含有特异性crRNA的CRISPR/Cas13a检测系统是否能检测出其他的水产RNA病毒。
1.11 重复性试验以及样品检验
采集有明显患病迹象的病鱼样品, 并对样品进行预处理和扩增RNA。采用本研究优化后的CRIS-PR/Cas13a检测系统, 与实验室常规使用的MSRV检测方法(qPCR)做对比, 以MSRV基因作为阳性对照组, 无MSRV病毒感染鱼的RNA样品作为阴性对照组, ddH2O作为空白对照组。
2 结果
2.1 MIRA引物对筛选
使用两对不同MIRA引物对含有靶序列的基因片段进行扩增, 扩增产物经琼脂糖凝胶电泳, 如图1a所示。电泳图位于100 bp的位置, 3个泳道均出现明亮的条带, 表明有非特异性扩增产物。泳道2和3中250 bp处为扩增的目的条带。用Image J软件分别将电泳图泳道2中长度为224 bp和泳道3中长度为255 bp的目的条带进行定量分析, 并用“灰度值”表示定量分析的结果。从分析结果得出, 灰度值越低表示引物利用率高, 即引物特异性结合扩增效率高,如图1b所示。结果表明: 采用MIRA-F2/R2引物对时, 特异性结合扩增效率高。
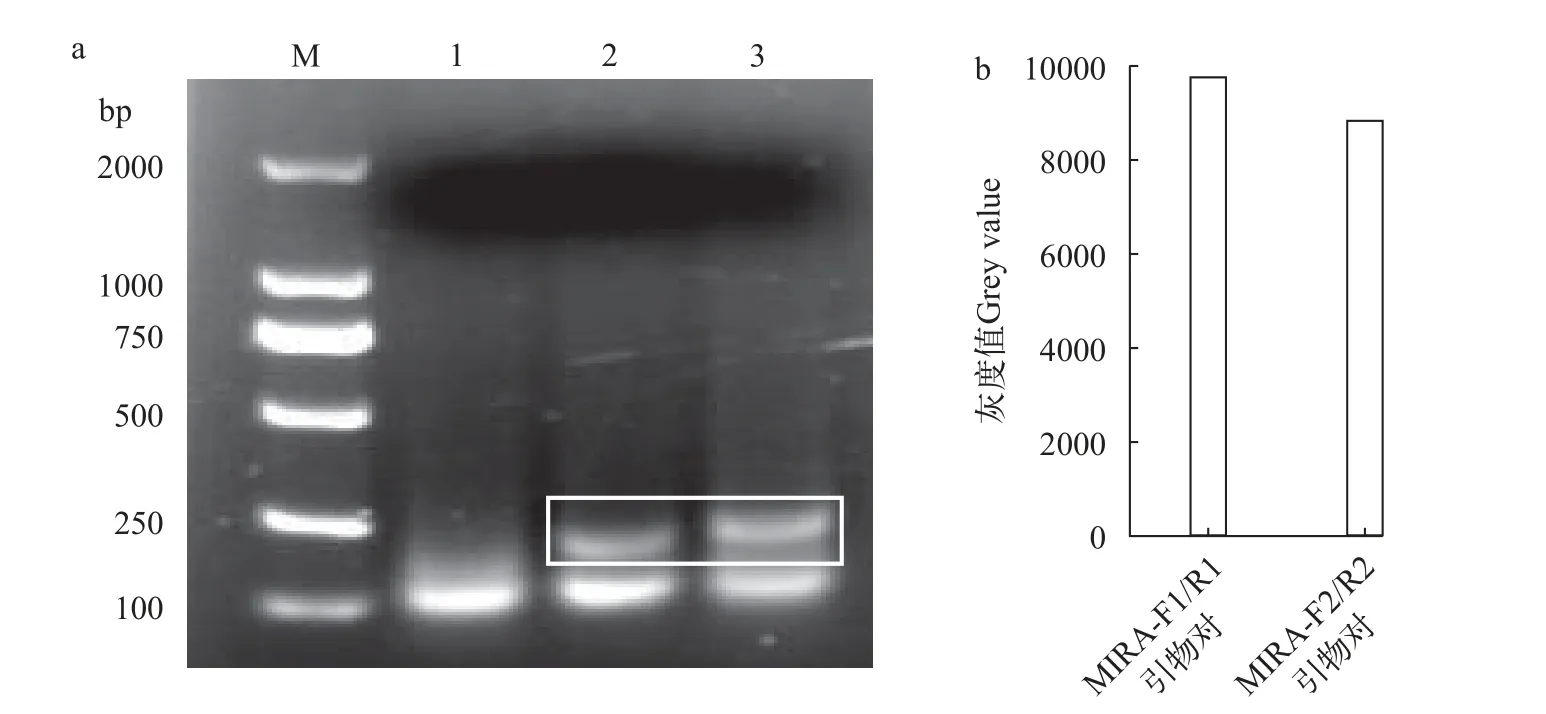
图1 MIRA引物对筛选电泳胶图以及灰度值分析Fig.1 MIRA primer pair screening electrophoretic gel plots as well as gray value analysis
2.2 CRISPR/Cas13a检测体系
CRISPR/Cas13a检测体系反应结束后用紫外灯进行照射, 观察荧光值(图2)。
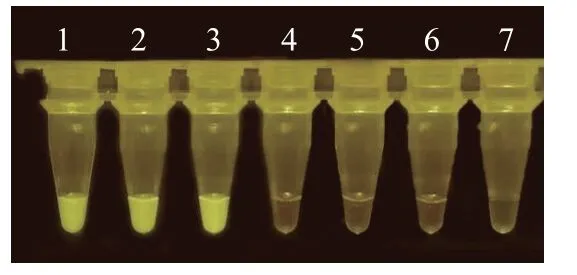
图2 CRISPR/Cas13a检测体系-荧光亮度图Fig.2 CRISPR/Cas13a detection system-fluorescence brightness map
2.3 CRISPR/Cas13a-MSRV最佳反应体系
我们分别用RNA标准品和扩增的样品RNA进行实验, 如图3a所示, 靶向目标RNA的定位速度,crRNA2要优于crRNA1; crRNA1比crRNA2有更强的最终荧光信号; crRNA1+crRNA2等比例混合使用能综合两者的优点, 反应效率更好。
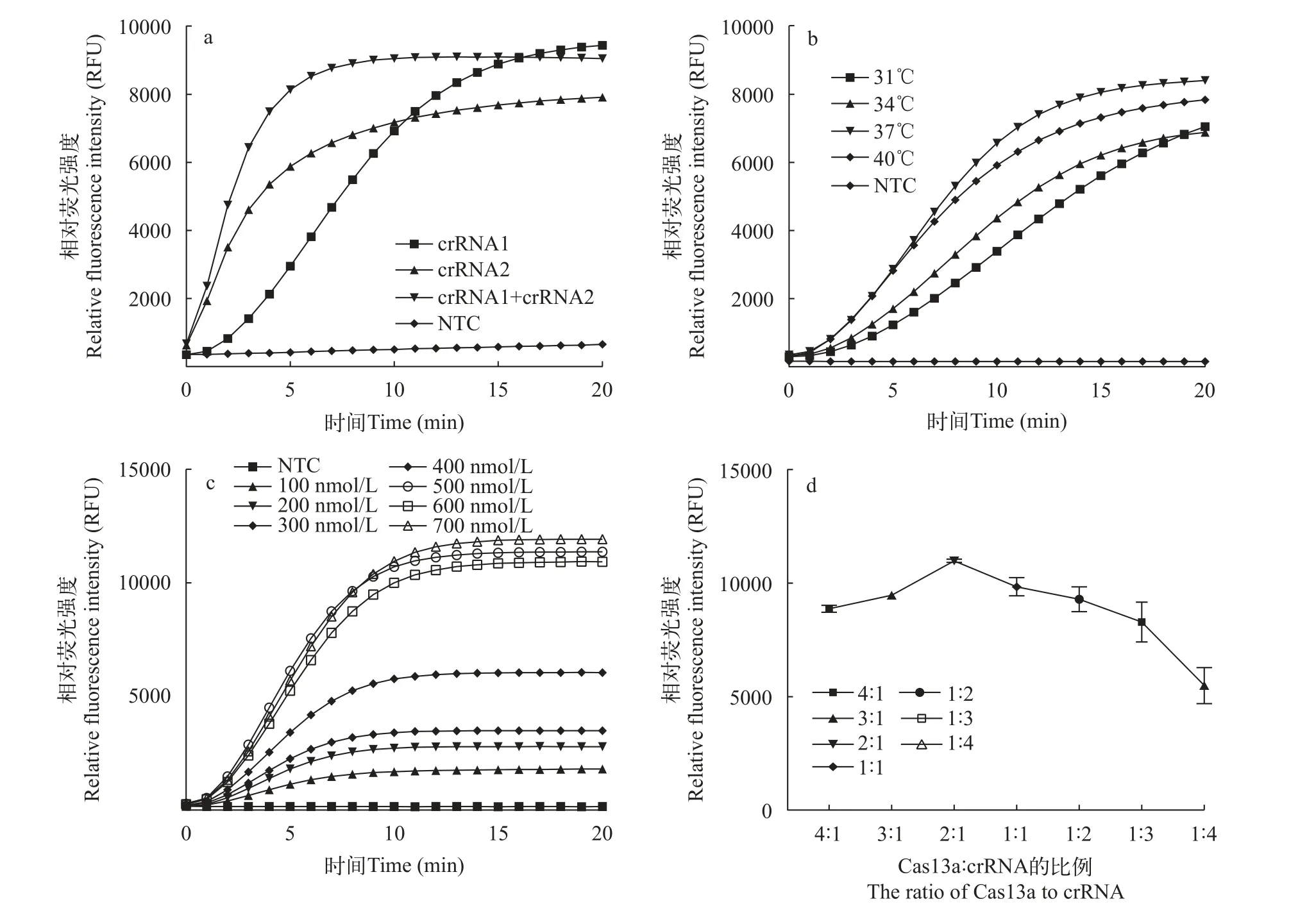
图3 优化CRISPR/Cas13a-MSRV检测反应条件检测效果各数据图Fig.3 Optimization of CRISPR/Cas13a-MSRV assay reaction conditions to detect the effect of each data graph
探究反应温度对检测系统的影响, 设置了31℃、34℃、37℃和41℃不同反应温度, 如图3b所示, CRISPR/Cas13a-MSRV检测体系最佳反应温度是37℃。
探究ssRNA报告探针浓度对检测系统的影响,如图3c所示, 在测试范围内, 荧光强度与ssRNA报告探针浓度呈正相关, ssRNA报告探针浓度在 500—700 nmol/L检测效果差异不大, 考虑到现实经济问题, 最佳的ssRNA报告探针浓度为500 nmol/L。
为探究不同Cas13a与crRNA的反应浓度比对检测系统的影响, 如图3d所示, 当以每份100 nmol/L比例的基础上,Cas13a∶crRNA的比例为4∶1和3∶1时,Cas13a达到饱和状态; 当Cas13a数量一定时, 荧光信号的强度并没有与crRNA数量的增加呈正相关。因此, Cas13a与crRNA比例为2∶1时, CRISPR/Cas13a-MSRV检测系统能够获得最大的检测活性。
2.4 灵敏度评估
为探究CRISPR/Cas13a-MSRV检测系统对MSRV的最低检测浓度, 故将RNA标准品进行10倍梯度连续稀释, 并用CRISPR/Cas13a-MSRV检测系统进行检测。如图4所示, CRISPR/Cas13a-MSRV检测系统至少能检测到102fM MSRV的ssRNA。当目标RNA浓度低于102fM时, 机器检测到的荧光信号与空白对照无明显差异。因此, CRISPR/Cas13a-MSRV检测系统至少能检测到102fM MSRV的ss-RNA。
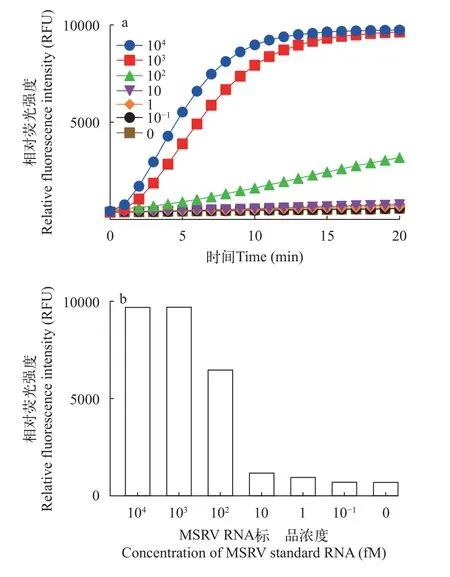
图4 评估CRISPR/Cas13a-MSRV检测系统对MSRV的灵敏度Fig.4 Assessing the sensitivity of the CRISPR/Cas13a-MSRV detection system for MSRV
2.5 特异性评估
为评估CRISPR/Cas13a-MSRV检测系统的特异性, 使用优化后的CRISPR/Cas13a检测系统检测不同的水产RNA病毒, 包括RGNNV、BFNNV和TPNNV。如图5所示, 只有MSRV的检测体系能检测出荧光信号, 其他病毒的检测体系检测出的荧光信号与阴性对照无差别, 为阴性结果。这表明CRISPR/Cas13a-MSRV检测系统可特异性靶向MSRV,该检测方法特异性很好。

图5 评估CRISPR/Cas13a-MSRV检测系统对MSRV的特异性Fig.5 Assessing the specificity of the CRISPR/Cas13a-MSRV detection system for MSRV
2.6 样品检测
对从鲈鱼养殖场采集有明显患病迹象的病鱼样品, 验证病鱼所感染病原体是否为MSRV, 使用MSRV衣壳蛋白序列特异性引物进行PCR扩增, 并将图6a中电泳图中相对应条带送测, 比对确认为MSRV。
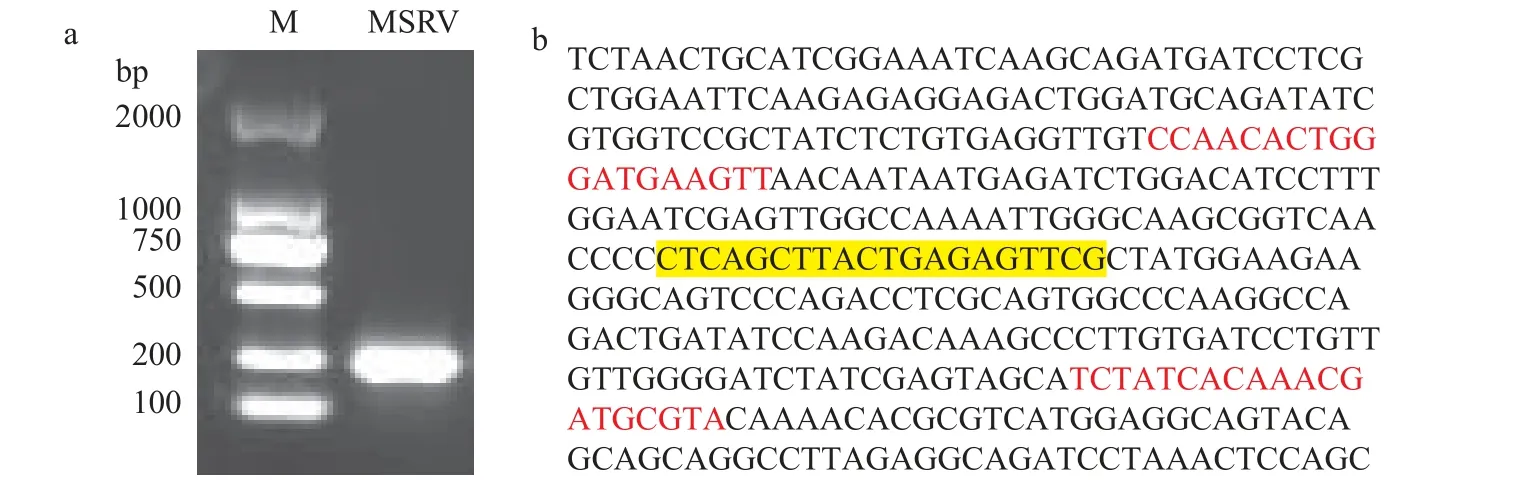
图6 MSRV序列信息确认Fig.6 Confirmation of MSRV serial information
对感染了MSRV的病鱼样品进行预处理和预扩增病毒RNA, 然后与阴性对照组进行检测。同时提取样品的cDNA做常规检测qPCR进行比较。如图7所示, 用CRISPR/Cas13a-MSRV检测系统检测出阳性样品(3、6、7、8、9、12、13、14和15号)与常规检测qPCR的结果一样, 其中qPCR的CQ值处于18—25; 而阴性样品(1、2、4、5、9、10和11号)阈值循环数则都大于38, 表明样品无携带MSVR病毒。综上所述, CRISPR/Cas13a-MSRV检测系统与常规检测RT-qPCR的检测数据相符合, 表明CRISPR/Cas13a-MSRV检测系统的可行性且在一定程度上可以代替原先常规繁杂的检测方法。
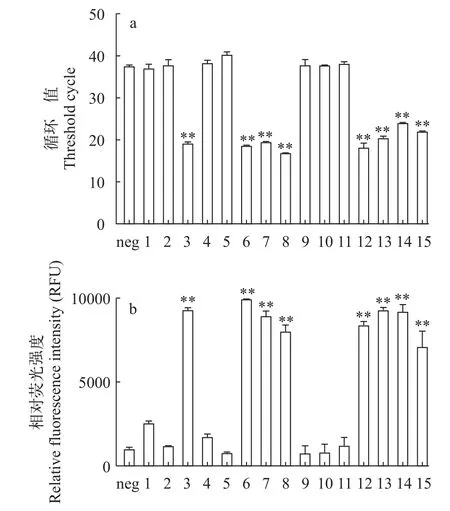
图7 样品qPCR检测数据以及CRISPR检测数据纵向比较图Fig.7 Longitudinal comparison of sample qPCR assay data and CRISPR assay data
3 讨论
大口黑鲈是我国淡水鱼养殖的重要品种之一,但是在养殖过程中, 病害频发, 其中MSRV是影响其苗种成活的主要病原, 幼苗感染该病毒后死亡率可达90%[10]。故尽早发现MSRV并采取有效针对性措施进行预防和控制是至关重要的。准确的病毒核酸检测方法能为病毒的检测提供准确且高效的技术支持。在现阶段的研究中, 关于MSRV的快速检测方法的研究很少, 传统检测方法需要复杂设备和较长的检测时间[27]。因此, 建立一种准确、高效的病毒核酸检测方法对于后续疾病的控制作用很大。
本研究利用CRISPR/Cas13a系统结合等温扩增MIRA技术检测MSRV, 根据MSRV的衣壳蛋白序列设计了检测靶标位点和设计合成了MIRA引物,并用它们进行等温扩增目标序列, 并对CRISPR/Cas13a-MSRV系统进行了优化, 探索建立了最优的检测体系为在20 μL的检测体系中含有200 nmol/L Cas13a、100 nmol/L crRNA1、100 nmol/L crRNA2、500 nmol/L ssRNA报告探针, 在反应温度为37℃的情况下能够获得最佳的CRISPR/Cas13a-MIRA-MSRV检测效果。此外, 检测了该方法的灵敏性和特异性, 发现CRISPR/Cas13a-MSRV检测系统能检测到102fM的MSRV, 只有MSRV的检测体系能检测出荧光信号, 其他病毒的检测体系检测出的荧光信号与阴性对照无差别, 说明该检测系统灵敏度高、特异性强。结合等温扩增MIRA技术的CRISPR/Cas13a-MSRV核酸检测方法能在一管内进行反应,当检测到MSRV时, ssRNA报告探针也相应被裂解,能够通过肉眼直接观察。从理论方面来看, 检测体系中除了crRNA的需要根据样品而改变, 其他组分不改变, 这在一定程度上能与多种核酸扩增技术相兼容。在本研究中我们还将检测结果与常规核酸检测方法qPCR的数据进行了对比, 以检验CRISPR/Cas13a技术应用于MSRV检测的可行性和优势。检测结果只有阳性样本组才能触发CRISPR/Cas13a系统荧光信号的显著产生, 而其他非目标序列病毒或阴性对照组则没有荧光信号, 说明该检测系统具有良好的特异性。同时, 该检测系统与qPCR在灵敏度和重复性方面也表现出一致性和稳定性, 阳性样本检出符合率高。
基于CRISPR/Cas13a系统的病毒核酸检测方法, 能够在短时间内建立, 其灵敏度和特异性高, 且反应迅速, 可在1h内提供检测结果。反应所需条件简单, 不需要依赖复杂的热循环仪, 可在室温条件下进行。反应可在1个试管里进行, 所耗费试剂的量小, 反应所需的cas13a蛋白及crRNA购买之后可以使用很多次, 故平均每次检测所需成本很低。在本研究中已经建立了CRISPR/Cas13a-MSRV检测方法, 检测过程不需要复杂的变温条件, 相比使用普通的PCR扩增, 这大大减少了检测所需时间。另外, 我们的检测方法可以在20min内检测到102fM的MSRV, 这与其他的检测方法相比, 该方法明显要更迅速得出检测结果。普通的PCR方法至少需要1h, qPCR通常需要30min到2h的时间。此外, 传统的分子生物学检测方法, 如RT-PCR, qPCR的检测依赖于复杂的热循环仪或其他昂贵的仪器或试剂; 免疫学检测方法, 如免疫组化容易出现试剂污染、灰尘污染、染色异常、实验耗时长等问题, 因此难以应用于非实验室环境中的现场诊断。而用CRISPR/Cas13a系统进行检测, 其反应过程不需要依赖热循环仪, 且结果能够通过紫外灯照射而得知。从上述实验的检测结果发现CRISPR/Cas13a系统可以特异性的检测MSRV, 并且最低检测浓度达到102fM。综上所述, 将CRISPR/Cas13a系统用于MSRV检测具有现场检测成本低、可行性高、特异性强, 灵敏度高的特点。
在疾病的发展初期, 及时发现病原体和控制疾病的走向是非常重要的, 特别是病毒性疾病。在此基础上, 应用CRISPR/Cas系统进行病毒的检测, 表现出该系统的应用范围广的特点。CRISPR/Cas系统是原核生物的免疫系统, 用来抵抗外源遗传物质的入侵, 比如噬菌体病毒和外源质粒。CRISPR/Cas系统可以识别出外源DNA或RNA, 并将其切断, 这表明CRISPR/Cas系统拥有精确的靶向功能, 因此应用该系统进行病毒检测具有较高的特异性[28]。CRISPR/Cas系统主要针对大多数DNA起作用, 而CRISPR/Cas13a系统针对的是RNA[29]。以往的RNA病毒检测中会存在灵敏度不高的问题, 容易出现错检、漏检的现象。在现在的研究中, Liu等[30]将CRISPR/Cas13a系统用于严重急性呼吸综合征冠状病毒-2(SARS-CoV-2)的检测, 实现最低检测浓度达到0.25拷贝/μL。Huang等[31]也将CRISPR/Cas13a系统用于猫杯状病毒(FCV)的检测, 实现最低检测浓度达到13.13拷贝/μL, 达到了快速高效的检测效果。基于该特点, CRISPR/Cas13a系统有望成为在临床上快速、方便且准确诊断RNA病毒的工具。
同时, 该检测方法在运用CRISPR/Cas13a系统的基础上结合了等温扩增MIRA技术, 等温扩增MIRA技术与重组酶聚合酶扩增(RPA)类似, 是1种新型的核酸快速等温扩增技术。能在5—30℃条件下25—42min完成反应, 可有效避免其他扩增技术的缺点, 更加灵敏、特异、经济、方便[32]。因此,在反应条件和时间方面, 等温扩增MIRA技术比起普通的PCR, 要更加适合于现场的快速检测。
综上所述, 本研究建立的CRISPR/Cas13a-MSRV检测方法不需要昂贵的实验仪器, 可使现场检测变得快速、准确且方便。因此, 在实际养殖过程中如果采用该种检测方法对MSRV进行及时的发现, 并采取针对性的有效措施, 这在很大程度上能够减少养殖过程中病害带来的损失, 并且该检测方法快捷、灵敏度高、特异性高, 具有较大的应用和推广前景。

