GCRV感染存活草鱼的血清蛋白表达特性
阳 鸿 邓亚东 丁春华 许宝红 吕 钊 肖调义
(湖南农业大学水产学院, 长沙 410128)
草鱼(Ctenopharyngodon idella)是我国“四大家鱼”之一, 年产量居淡水养殖品种之首。然而, 草鱼常因感染草鱼呼肠孤病毒(Grass carp reovirus, GCRV)而患草鱼出血病, 死亡率可达90%[1], 给我国草鱼养殖业造成巨大经济损失。尽管近年来在草鱼出血病致病机理解析、疫苗研制、中草药开发等方面取得了重要进展[2,3], 但目前仍没有稳定防控草鱼出血病的策略。研究发现不同地域草鱼群体的免疫机能存在差异[4], 不同个体应对GCRV的抗性存在差异[5], 基于自然界存在的GCRV抗性草鱼群体开展分子辅助选育获得高抗性草鱼品系是解决草鱼出血病难题的有效途径之一。
鱼类抗病性状由多基因决定, 因此挖掘关键抗性基因及遗传标记对高抗性品系分子辅助选育具有重要意义[6]。关于草鱼GCRV抗性基因及分子标记的研究已有报道, 以往研究结果揭露草鱼补体、模式识别受体、干扰素及干扰刺激因子等免疫基因[5,7—10]在抗GCRV感染中发挥重要作用, 其中Toll样受体8基因、黑色素瘤分化相关基因5、视黄酸诱导基因Ⅰ、抗黏液病毒基因等存在与GCRV抗性关联的遗传标记[11—14]。但由于这些研究比较分散, 仅局限在单个基因, 目前仍难以确认草鱼关键的GCRV抗性基因。随着测序技术的进步及草鱼全基因组序列的破译[15], 利用组学系统地挖掘草鱼抗性基因成为重要的研究方向。Xu等[16]通过比较GCRV感染前后的草鱼脾脏转录组发现, 差异表达基因主要注释为补体凝血级联及细胞因子与细胞因子互作等先天性免疫通路相关的基因。Li等[17]通过比较分析易感染GCRV的一龄草鱼和不易感染GCRV的三龄草鱼脾脏转录组, 筛选到差异表达基因9450个, 主要富集在补体凝血级联、TLR信号转导等免疫相关的通路。此外, 本团队前期对GCRV感染前后草鱼头肾进行了miRNA测序分析, 共筛选到118个差异miRNAs, 这些 miRNAs的靶基因达数千个, 主要富集在肌动蛋白细胞骨架的调节以及趋化因子与趋化因子受体等信号通路[18]。转录组测序分析系统评价了草鱼GCRV抗性的分子基础, 而缺点是筛选到的抗性基因过多, 判别关键抗性基因具有难度。
蛋白质是生命活动的主要执行者, 蛋白质组比转录组可以更直接、真实地反映生物表型变化。目前蛋白质组学技术已经在人类和动植物疾病标志物筛选及农业生物抗病品系培育等研究中得到广泛应用, 利用疾病抗性/易感群体开展蛋白质组分析筛选到了人类抑郁症[19]、家蚕核型多角体病[20]和小麦赤霉病[21]等疾病的抗性/易感关键基因, 而对鱼类相关研究的报道还较少。动物血清是疾病检测中最常用的样本, 血清蛋白参与机体免疫、凝血/抗凝血、物质运输等多种重要的生理过程, 血清蛋白在结构和数量上的改变可反映机体的生理或病理状况[22,23]。通过血清蛋白质组学研究分析疾病抗性/易感动物群体的血清蛋白表达差异有利于挖掘关键的抗性基因[20,21]。团队前期利用大规模群体感染的方式获得了候选GCRV抗性草鱼材料, 本研究将应用4D label-free定量蛋白质组学分析技术, 系统比较候选抗性草鱼材料与对照草鱼血清蛋白表达的差异, 解析抗性相关的关键分子组成,旨在丰富草鱼GCRV抗性分子基础的理论研究, 为高抗性草鱼选育及分子设计育种工作提供可参考的信息。
1 材料与方法
1.1 实验材料
实验用草鱼来自湖南农业大学耘园鱼类繁育基地, 候选抗性草鱼材料为团队前期利用GCRV感染筛选的存活群体, 将未经感染的健康草鱼作为对照组。随机选取规格为14—17 cm的候选抗性组草鱼与对照组草鱼各30尾, 每组设置3个重复, 每个重复10尾草鱼。采样前在循环水养殖系统28℃暂养7d, 随后进行尾静脉采血, 4℃静置过夜后吸取上清,分别混合抗性组与对照组草鱼各重复10尾草鱼的血清并保存于-80℃冰箱备用。
1.2 蛋白样品检测及酶解
利用BCA试剂盒(Thermo Fisher, 美国)对草鱼血清进行蛋白浓度测定, 同时使用SDS-PAGE凝胶电泳检测血清样品中蛋白的完整性。随后取各样品等量蛋白进行还原, 即加入终浓度为5 mmol/L的二硫苏糖醇, 置于56℃孵育30min。之后加入终浓度为11 mmol/L的碘乙酰胺, 室温避光孵育15min进行烷基化。将烷基化好的样品转移至超滤管, 室温12000×g离心20min, 接着用8 mol/L尿素溶液置换3次, 用置换溶液置换尿素3次, 然后以1∶50的比例(蛋白质与蛋白酶比例)加入胰蛋白酶, 酶解过夜。室温12000×g离心10min回收酶解肽段, 接着用超纯水清洗回收肽段1次, 合并两次收集的肽段溶液, 待质谱分析。
1.3 液相色谱-质谱联用分析
肽段溶液用液相色谱流动相A相溶解后, 采用EASY-nLC1200超高效液相系统进行分离。流动相A为含0.1%甲酸和2%乙腈的水溶液; 流动相B为含0.1%甲酸和90%乙腈的水溶液。液相梯度设置为:0—96min, 4%—20% B; 96—112min, 20%—32% B;112—116min, 32%—80% B; 116—120min, 80% B,流速维持在500 nL/min。肽段经由超高效液相系统分离后被注入NSI离子源中进行电离, 然后在Orbitrap Exploris™480仪器进行质谱分析。离子源电压设置为2.3 kV, FAIMS补偿电压设置为-70和-45 V之间交替, 肽段母离子及其二级碎片都使用高分辨的Orbitrap进行检测和分析。一级质谱扫描范围设置为400—1200 m/z, 扫描分辨率设置为60000; 二级质谱扫描范围固定起点为110 m/z, 二级扫描分辨率设置为30000, Turbo TMT设置为Off。数据采集模式使用数据依赖型扫描程序, 即在一级扫描后选择信号强度最高的前15肽段母离子依次进入HCD碰撞池, 使用27%的碎裂能量进行碎裂, 同样依次进行二级质谱分析。为了提高质谱的有效利用率, 自动增益控制设置为75%, 信号阈值设置为1E4 ions/s, 最大注入时间设置为100ms, 串联质谱扫描的动态排除时间设置为30s以避免母离子的重复扫描。
1.4 质谱数据比对鉴定及定量
使用软件Proteome Discoverer (v2.4.1.15)对质谱数据在已有数据库进行比对和检索。检索参数设置: 数据库设置为斑马鱼蛋白质组数据, 于Uniprot蛋白数据库下载获得, 添加反库计算随机匹配造成的假阳性率(FDR); 酶切方式设置为Trypsin(Full); 漏切位点数设为2; 肽段最小长度设置为6个氨基酸残基; 肽段最大修饰数设为3; 一级母离子质量误差容忍度设为10 ppm, 二级碎片离子的质量误差容忍度为0.02 Da。将Carbamidomethyl (C)设置为固定修饰, 将Oxidation (M)、Acetyl (N-terminus)、Met-loss (M)、Met-loss+acetyl (M)和Deamidated(N, Q)设置为可变修饰。将蛋白、肽段和PSM鉴定的FDR都设置为1%。依据Proteome Discoverer软件计算的LFQ intensity值, 经标准化得出蛋白在不同样本中的相对定量值。
1.5 数据质控分析
质谱下机的数据, 在完成数据库比对后, 对其进行一系列质控评价, 包括肽段长度分布、肽段数分布、蛋白覆盖度分布和蛋白分子量分布。在进行蛋白定量之后, 采用皮尔森相关性(Pearson’s Correlation Coefficient, PCC)统计分析方法评估样品间的重复性。
1.6 差异表达蛋白筛选及功能注释与富集
依据蛋白质丰度水平, 当两组样品蛋白平均表达量差异倍数Fold change≥1.2或<0.83且经t检验P<0.05时, 视为差异表达蛋白。为揭示差异表达蛋白的功能属性, 利用Wolfpsort在线工具(https://wolfpsort.hgc.jp)获得差异表达蛋白的亚细胞结构定位信息。利用DAVID在线工具(https://david.ncifcrf.gov/home.jsp)获得差异表达蛋白的功能注释信息, 并进行GO、KEGG及蛋白结构域的富集分析,使用Fisher精确检验确定富集途径的统计学意义。GO、KEGG及蛋白结构域富集途径的P值经过Bonferroni、Holm、Sidak和错误发现率校正后≤0.05则被认为显著富集。
1.7 血清C3和IgM蛋白免疫印迹(Western Blot)分析
将候选抗性和对照草鱼血清用PBS稀释10倍后进行SDS-PAGE电泳, 电泳完毕后进行转膜。接着, 使用快速封闭液(碧云天生物科技, 中国)与PVDF膜于室温孵育15min。封闭完成后, 于4℃摇床过夜孵育一抗(1∶1000稀释), 所用草鱼C3 (Accession: AAQ74974)抗体为团队前期制备的兔源多克隆抗体, 草鱼IgM抗体为鼠单克隆抗体, 由青岛农业大学聂品研究员赠送[24]。翌日, 用PBS洗膜3次, 每次10min; 随后加入HRP标记的二抗(1∶2000稀释),室温孵育1h。使用PBS洗膜3次后, 暗室中滴加ECL化学发光底物混合液, 使用Bio-Rad凝胶成像仪对PVDF膜上的条带拍照。采用Image J软件对蛋白条带进行灰度分析, 结合SPSS 22软件对数据进行t检验, 分析差异的显著性。
2 结果
2.1 SDS-PAGE分析候选抗性草鱼与对照草鱼血清蛋白样品
为检测草鱼血清样品中蛋白的完整性, 并初步观察候选抗性草鱼与对照草鱼血清蛋白组成及表达差异, 将血清蛋白浓度调整一致后进行SDSPAGE凝胶电泳分析。结果显示, 6个血清样品蛋白条带清晰, 无拖尾现象, 说明蛋白完整度高, 可满足后续质谱鉴定需求。组内重复各泳道平行性较好,组间各泳道蛋白条带分布、灰度存在差异, 表明候选抗性草鱼与对照草鱼血清蛋白的组成及表达水平存在差异(图1)。
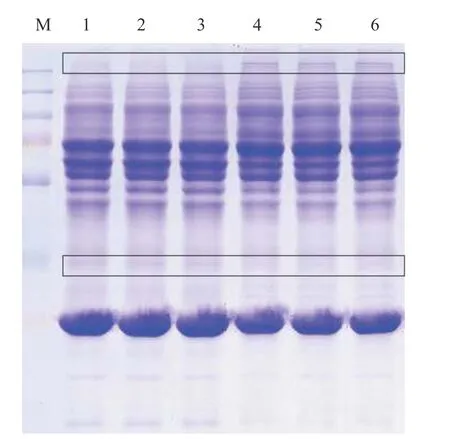
图1 候选抗性草鱼与对照草鱼血清蛋白的SDS-PAGE分析Fig.1 SDS-PAGE analysis of serum proteins from the candidate resistant grass carps and the control grass carps
2.2 候选抗性草鱼与对照草鱼的血清蛋白质组测定
利用质谱技术从两组草鱼血清蛋白中共获得524548张二级谱图; 继而通过比对斑马鱼蛋白数据库共匹配到30829张有效谱图, 基于谱图共鉴定到2239条肽段, 其中蛋白特异性肽段2022条, 共鉴定到858个蛋白(图2A)。其中792个蛋白在候选抗性组中被定量, 815个蛋白在对照组中被定量, 784个蛋白在两个组中均被定量(图2A)。依据LFQ intensity值对蛋白进行定量后, 采用皮尔森相关性(Pearson’s Correlation Coefficient, PCC)分析方法评估样品间的重复性, 发现候选抗性组样品与对照组样品的关系界线明确, 证明组间结果存在差异; 组内样品间的皮尔森相关系数均大于99.8%, 说明组内重复的结果一致性高(图2B)。
在肽段长度分布上, 大部分肽段分布在7—20个氨基酸, 符合基于酶解和质谱碎裂方式的一般规律, 质谱鉴定到的肽段长度的分布符合质控要求(图2C)。在蛋白分子量分布上, 所鉴定蛋白处于不同分子量阶段, 且分布均匀(图2D)。在肽段的数量分布上, 大部分蛋白对应两个以上肽段, 代表定量结果的精确性和可信性较高(图2E)。在蛋白覆盖度上, 大部分蛋白的覆盖度在30%以下, 说明实验对血清高丰度蛋白的去除效果较好(图2F)。质谱下机数据的综合质控评价结果良好, 可用于下一步分析。
2.3 候选抗性草鱼与对照草鱼的血清蛋白质组比较分析
差异表达蛋白筛选本研究以火山图形式显示了候选抗性草鱼与对照草鱼血清蛋白差异表达情况, 候选抗性草鱼与对照草鱼血清中共筛选到329个差异表达蛋白(差异倍数大于1.2倍); 其中163个蛋白在候选抗性草鱼血清中显著高表达,166个蛋白显著低表达(图3)。
差异表达蛋白的功能分类为分析329个差异表达蛋白的生物学功能, 对差异表达蛋白进行了COG功能分类以及亚细胞结构定位预测。COG功能分类结果显示, 差异表达蛋白中有169个蛋白的功能可归类为细胞过程和信号转导, 32个蛋白的功能归类为信息储存与处理, 66个蛋白的功能归类为代谢, 17个蛋白的功能未知。这些蛋白的功能具体主要涉及翻译后修饰、蛋白质转换、分子伴侣、信号转导机制、细胞骨架等(图4A)。亚细胞定位预测分析发现, 此次实验鉴定到的差异表达蛋白大部分为细胞质蛋白及细胞外蛋白,占比66.57%; 其中细胞质蛋白有118个, 细胞外蛋白有99个(图4B)。
差异表达蛋白的功能富集为进一步明晰差异表达蛋白的生物学功能, 利用Fisher氏精确双端检测方法对差异蛋白进行GO、KEGG及Domain富集分析。图5A列出了P<0.05的所有GO条目, 差异表达蛋白主要富集到生物过程(BP)中的体液免疫反应调节(Regulation of humoral immune response)和补体激活调节(Regulation of complement activation)等条目, 细胞组分(CC)中的细胞外空间(Extracellular space)和细胞外区域(Extracellular region)等条目及分子功能(MF)中的丝氨酸蛋白酶活性(Serine hydrolase activity)和丝氨酸型肽酶活性(Serine-type peptidase activity)等条目。
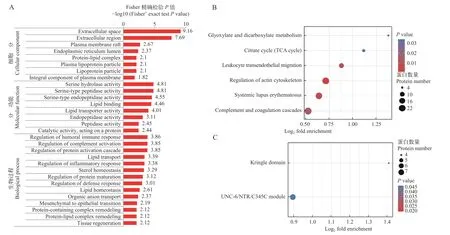
图5 差异表达蛋白的GO、KEGG及Domain富集分析Fig.5 GO, KEGG and Domain enrichment analysis of differentially expressed proteins
KEGG富集分析显示, 差异表达蛋白主要富集在补体凝血级联(Complement and coagulation cascades)、细胞黏附分子(Cell adhesion molecules)、胆固醇代谢(Cholesterol metabolism)和铁死亡(Ferroptosis)等免疫与代谢相关信号通路(图5B)。
Domain富集分析表明, 差异表达蛋白显著富集的结构域有三环状结构域(Kringle domain)和补体分子C3、C4、C5共有的羧基端结构域(UNC-6/NTR/C345C module; 图5C)。三环状结构域(Kringle domain)在调节蛋白水解活性中起重要作用, 具有三环状结构域的蛋白主要有凝血酶原、纤维蛋白溶解酶原、载脂蛋白和凝血因子等。UNC-6/NTR/C345C module与金属锌蛋白家族的锌金属蛋白酶的抑制有关, 存在于C3、C4、C5等补体分子中。
2.4 候选抗性草鱼与对照草鱼差异表达的免疫相关蛋白分析
鱼类主要依靠免疫系统抵御病原, 部分免疫基因与鱼类抗病力密切关联, 因此本研究对显著差异表达的免疫相关蛋白进行了重点分析。结果显示,在候选抗性/对照草鱼组间差异表达的329个蛋白中, 总共有118个蛋白与先天性或适应性免疫过程相关; 其中59个蛋白在候选抗性草鱼血清中显著高表达, 59个蛋白显著低表达。
先天性免疫分子先天性免疫分子主要包括补体、细胞因子、抗菌肽及酶类物质等。本研究发现, 候选抗性草鱼血清中甘露聚糖结合凝集素相关丝氨酸蛋白酶2 (MASP2)、补体组分4 (C4)、补体组分4b (C4b)、补体组分7b (C7b)、补体组分8b (C8b)、补体组分9 (C9)、补体I因子(CFI)、补体组分3a (C3a.1、C3a.2、C3a.3、C3a.6)等补体分子的蛋白表达水平显著高于对照草鱼。此外, 候选抗性草鱼血清中细胞因子受体如白介素6受体(IL6ST)、白介素11受体(EBI3)、介导粒细胞微生物识别及吞噬的癌胚抗原相关细胞黏附分子(CD66), 以及具有抗氧化功能的超氧化物歧化酶(SOD2)和α1微球蛋白(AMBP)等免疫分子的蛋白表达水平也显著高于对照草鱼(图6)。
适应性免疫分子适应性免疫发挥作用的核心组分主要包括主要组织相容性复合体(MHC)、T细胞受体、B细胞受体和免疫球蛋白等。本研究结果显示, 候选抗性草鱼血清中Ⅰ类主要组织相容性复合体分子(MHC1UBA)及免疫球蛋白轻链分子(IGL4V8)等蛋白表达水平显著高于对照草鱼, 而T细胞受体(TRAV)及免疫球蛋白重链分子(IGHV1-1、IGHV2-1、IGHV6-1、IGHV3-2、IGHV11-2)等蛋白表达水平显著低于对照草鱼(图6)。
2.5 候选抗性与对照草鱼血清补体C3与IgM蛋白表达量分析
利用Western Blot检测分析先天性免疫代表分子补体C3及适应性免疫代表分子IgM在候选抗性草鱼与对照草鱼血清中表达水平的差异, 发现Western Blot检测结果与定量蛋白质组学结果一致,分别证实了候选抗性草鱼血清中C3蛋白的表达量显著高于对照草鱼, 为对照草鱼的2.46倍; 候选抗性草鱼血清中IgM蛋白的表达量也显著高于对照草鱼, 为对照草鱼的1.71倍(图7)。
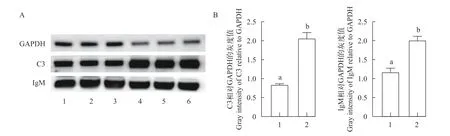
图7 Western blot分析候选抗性及对照草鱼血清C3及IgM表达差异Fig.7 Western Blot analysis of serum C3 and IgM from the resistant grass carps and the control grass carps
3 讨论
近年来我国在鱼类抗病选育工作中取得了一系列进展, Li等[25]采用哈维氏弧菌(Vibrio harveyi)连续感染的方法, 经多代筛选获得了抗病力强的半滑舌鳎(Cynoglossus semilaevis)国审新品种“鳎优1号”。Zhu等[26]采用类似方法对罗非鱼(Oreochromis mossambicus)开展抗无乳链球菌(Streptococcus agalactiae)病选育, 培育了抗病力强、养殖成活率高的“壮罗1号”罗非鱼。这些研究表明, 通过人工感染筛选具有抗性性状的个体或群体, 经过多次选优去劣, 可获得抗性性状的新品种; 其原理是利用抗性筛选不断富集优良基因的频率、淘汰不利的基因频率, 优良基因的富集会导致这些基因转录形成的RNA及编码的蛋白发生结构或数量上的变化,最终反映为相关蛋白表达水平的变化。Zhu等[26]发现罗非鱼无乳链球菌病抗性家系肝脏超氧化物歧化酶、碱性磷酸酶和溶菌酶表达量显著高于易感家系。王红权等[27]发现GCRV感染后存活草鱼血清溶菌酶、超氧化物歧化酶、免疫球蛋白及干扰素表达水平显著高于对照草鱼。因而, 深入分析抗性鱼类的蛋白表达谱有助于揭示鱼类抗病的分子或遗传基础。
血清中部分关键蛋白的含量(水平)可以作为标志表征着多种疾病的发生发展状态及易感程度。但血清蛋白组成特殊, 由少数几种高丰度蛋白占据血清总蛋白的99%以上, 这严重影响常规质谱方法分析血清低丰度蛋白的效果。4D蛋白质组学质谱技术在3D质谱技术的基础上增加了第四维度即离子淌度(Mobility), 提高了血清样本蛋白质组的检测深度[28]。与3D非标质谱及iTRAQ等同位素标记质谱分别鉴定到326种鲤(Cyprinus carpio)和513种红大马哈鱼(Oncorhynchus nerka)血清蛋白相比[29,30],本研究应用4D label-free定量蛋白质组学技术从草鱼血清中鉴定到858个蛋白, 其中784个蛋白被顺利定量, 提高了血清蛋白的鉴定深度, 以便下一步更准确地挖掘草鱼抗性分子基础。
本研究鉴定到候选抗性草鱼与对照草鱼血清中显著差异表达的蛋白329个, 这些差异表达蛋白主要与体液免疫反应与补体激活调节相关, 可能参与补体凝血级联、细胞黏附、铁死亡等免疫过程或信号转导通路。候选抗性草鱼血清中先天性免疫分子MASP2、C4和C4b等及适应性免疫分子MHC1UBA、IGL4V8等分子蛋白表达水平显著高于对照草鱼, 而免疫球蛋白重链分子IGHV1-1、IGHV2-1及T细胞受体TRAV等分子蛋白表达水平则显著低于对照草鱼。这些结果表明候选抗性草鱼与对照草鱼血清的免疫蛋白水平具有显著差异, 体现了免疫分子表达与草鱼抗病力存在密切关联。此外, 与前期报道利用转录组筛选鉴定草鱼潜在抗性基因相比, 本研究通过蛋白质组比较分析候选抗性草鱼与对照草鱼血清的蛋白表达差异, 同样筛选到了众多差异表达的免疫相关分子[9,16], 再次证实这些免疫分子在草鱼抗GCRV感染中发挥重要作用。与转录组鉴定到草鱼成千上万潜在抗性基因不同的是, 本研究利用蛋白组筛选到的目标分子更聚焦, 集中在部分关键的先天性免疫和适应性免疫蛋白如组织蛋白酶D (CTSD)、主要组织相容性复合体(MHC1UBA)及癌胚抗原相关细胞黏附分子3(CD66)等蛋白, 它们在候选抗性草鱼血清的蛋白表达水平分别是对照草鱼的8.5、4.8及4.6倍, 这些结果对进一步明确草鱼抗性关键分子的基础研究具有重要意义。
先天性免疫是鱼类抵御病原入侵的第一道防线, 本研究结果揭示先天性免疫重要组分——补体系统的激活状态可反映草鱼的抗性水平。与高等脊椎动物相比, 鱼类的适应性免疫系统演化不够完善, 先天性免疫补体系统在鱼类抵抗病毒、细菌、寄生虫等病原入侵的过程中可能发挥更为重要的作用[7,31—33]。Xu等[16]基于转录组数据发现, 草鱼在感染GCRV后脾脏补体凝血级联通路相关基因富集最为显著。Xiong等[7]分析GCRV感染后草鱼补体C3基因的甲基化与表达水平变化, 发现GCRV期间补体C3基因甲基化水平降低, 表达量显著升高,证明草鱼补体系统在机体抵抗GCRV感染的过程中具有极其关键的作用。Li等[17]通过比较易感GCRV的1龄草鱼和不易感染的3龄草鱼脾脏转录组观察到3龄草鱼的补体表达水平整体显著高于1龄草鱼。这些研究结果均表明草鱼补体的表达水平可能与抗病能力相关联。补体C3是补体系统的核心成分, 其介导补体经典途径、替代途径、凝集素途径的激活, 是补体系统发挥效应功能的关键分子, 也是所有补体成分中含量最高的蛋白。C3激活后裂解为C3a和C3b, 参与炎症反应及免疫调理作用。研究发现, 在虹鳟(Oncorhynchus mykiss)、斑马鱼(Danio rerio)和泥鳅(Misgurnus anguillicaudatus)等多种硬骨鱼类中均存在多个补体C3基因[34—36],不同C3亚型的蛋白在特异性结合羟基或氨基的硫酯催化位点等结构位点上有所差异[36], 它们的溶血活性及与各种天然靶标的结合特异性亦不同[37], 提示不同C3亚型具有不同的识别功能。最近的研究发现, 草鱼拥有9个C3基因, 其中C3.1(AAQ74974)表达最为广泛[38]。本研究借助质谱技术在候选抗性草鱼血清中发现4种C3a蛋白亚型表达水平显著高于对照草鱼, 同时采用Western Blot检测进一步证实, 补体C3.1蛋白在候选抗性草鱼血清中的表达水平显著高于对照草鱼, 即候选抗性草鱼具有更高的补体激活水平。
适应性免疫是鱼类抵御病原入侵的第二道防线, 包括B淋巴细胞介导的体液免疫和T淋巴细胞介导的细胞免疫, 本研究结果还揭示体液免疫反应水平可反映草鱼的抗性水平。鱼类作为最早出现的脊椎动物, 已具备介导适应性免疫应答的分子体系。例如, 鱼类拥有结构与功能与高等哺乳动物保守的T细胞受体, 其由α、β两条链经二硫键组成异源二聚体, 每条链有两个功能区, 即可变区和恒定区[39,40]。主要组织相容性复合体(MHC)主要分为3类, 其中MHC Ⅰ类几乎分布于所有细胞表面, 能结合并呈递抗原给细胞毒性T淋巴细胞。研究发现大菱鲆MHC Ⅰ类分子基因的多态性与迟缓爱德华氏菌抗性/易感性显著相关[41]。鱼类免疫球蛋白、B细胞受体的组成不同于高等哺乳动物, 主要包括IgM、IgD和IgT。它们由轻链和重链组成, 轻链、重链均包含一个可变区(V区); V区氨基酸序列的组成、排列随免疫球蛋白结合抗原的不同而变化, 所以V区具有高度的多态性。本研究质谱分析发现了候选抗性草鱼血清中免疫球蛋白部分轻链可变区片段(IGL4V8)的高表达和部分重链可变区片段(IGHV1-1、IGHV2-1、IGHV6-1、IGHV3-2、IGHV11-2)的低表达。因为无法确证这些轻链、重链片段的组合关系, 该结果不能说明候选抗性草鱼和对照草鱼血清中IgM、IgD和IgT任意一种免疫球蛋白的表达趋势或差异, 但是可见两类草鱼的免疫球蛋白可变区存在不同, 可能是由两类草鱼经历的病原史不一样所导致, 相似结果在大鼠中亦有报道[42]。IgM是硬骨鱼类中最早发现的免疫球蛋白, 也是硬骨鱼类血清中表达量最高的免疫球蛋白, 具有激活补体、凝集作用和调理细胞毒作用等功能。早前已有研究报道, 草鱼在GCRV感染后血液中淋巴细胞数量发生变化[43], 脾脏IgM、MHC分子的mRNA表达发生上调[44], 提示了草鱼适应性免疫在抵抗GCRV入侵的过程中发挥重要作用。本研究质谱分析结果显示, 候选抗性草鱼血清中MHC Ⅰ类分子MHC1UBA的蛋白表达水平显著高于对照草鱼,可能赋予其更高效的抗原识别与呈递能力。值得注意的是, 本研究质谱和Western Blot检测分析还表明, 候选抗性草鱼血清中IgM蛋白水平显著高于对照草鱼, 而T细胞受体TRAV蛋白水平显著低于对照草鱼, 该结果表征着候选抗性草鱼在适应性免疫层面可能拥有较高的体液免疫反应水平和较低的细胞免疫反应水平, 这将有利于机体的免疫平衡。因此, 结合前述候选抗性草鱼高表达C3等补体蛋白的结果, 我们推测以C3和IgM为代表的体液免疫分子表达水平与草鱼抗病能力密切关联。
综上所述, 本研究应用4D Label-free定量蛋白质组学分析发现, 候选抗性草鱼与对照草鱼血清中免疫相关蛋白的表达差异显著, 主要表现为候选抗性草鱼显著高表达部分体液免疫和抗原提呈分子,而低表达T细胞免疫相关分子; 其中以C3和IgM为代表的体液免疫分子在候选抗性草鱼血清中显著高表达, 可能与草鱼抗病能力关联。本研究将为高抗性草鱼的选育提供可参考的分子资源。

