肝肠胞虫对凡纳滨对虾肠道和肝胰腺菌群的影响
李舢舢 赵晨曦 吴 波 郑侠飞 戴文芳 林志华 柳敏海
(浙江万里学院宁海海洋生物种业研究院, 浙江省水产种质资源高效利用技术研究重点实验室, 宁波 315000)
水产养殖为不断增长的全球人口提供食物来源方面发挥着关键作用。据联合国粮食及农业组织(Food and Agriculture Organization of the United Nations, FAO)发布的《2022年世界渔业和水产养殖状况》报告[1], 水产品对粮食安全和营养贡献之大前所未有。全国水产品总产量6690.29万吨, 养殖产量5394.41万吨, 甲壳类动物位居养殖产量第二,其中约70%的甲壳类动物来自虾和蟹[2]。凡纳滨对虾(Litopenaeus vannamei)是南美洲太平洋沿岸、秘鲁北部及亚洲等地区主要养殖物种之一, 其养殖过程中也面临一些挑战[3], 如频繁暴发的疾病: 白斑综合征(White Spot disease, WSD)[4]、肝胰腺微孢子虫病(Hepatopancreatic microsporidiosis,HPM)[5]、急性肝胰腺坏死病(Acute hepatopancreatic necrosis disease, AHPND)[6]、Taura综合征(Taura syndrome,TS)[7]和黄头病(Yellow head disease, YHD)[8], 其中HPM已给凡纳滨对虾养殖造成了巨大的损失[9]。
虾肝肠胞虫(Enterocytozoon hepatopenaei,EHP)是引起对虾HPM的主要病原[10], 已成为对虾养殖业最致命的威胁之一, 肝胰腺是易受EHP感染的组织,在肠道和胃中也检测到EHP感染[11,12]。在EHP感染早期, 对虾通常不会死亡, 摄食正常且无明显疾病症状; 感染后期, 对虾生长缓慢或停滞生长, 产量严重下降、经济损失严重。最近的研究表明由EHP感染引起的肝胰腺微孢子虫病已在不同地区报告, 包括越南、印度、文莱、中国、印度尼西亚、马来西亚、委内瑞拉和澳大利亚等国家[13,14—18]。自2013年以来, 我国各地养殖的凡纳滨对虾先后出现EHP感染, 且感染率居高不下[19]。肝胰腺作为虾的主要消化腺, 分泌消化酶, EHP感染肝胰腺导致虾生长不良和免疫力受损。Ha等[20]报道越南养殖的斑节对虾感染EHP后生长缓慢, 且伴有白便症状;Flegel等[21]发现了与 Ha 等[20]报道相同现象, 认为泰国和越南养殖的斑节对虾及凡纳滨对虾的白便症状与EHP有一定的关系, EHP已成为制约凡纳滨对虾养殖业健康发展的最主要病害之一[22]。
目前, 有关EHP感染是否影响凡纳滨对虾肠道及肝胰腺中细菌群落的研究鲜有报道。因此, 本研究比较了凡纳滨对虾健康样本和感染EHP的发病样本中其肠道和肝胰腺微生物的结构、多样性和组成差异, 进一步探究了其肠道及肝胰腺菌群介导的功能。本研究旨在确定健康对虾、发病对虾之间的细菌组成差异, 筛选肠道和肝胰腺中的优势菌属用于区分健康对虾和发病对虾。
1 材料与方法
1.1 实验材料
养殖池塘投放同一批次凡纳滨对虾苗种, 养殖48d后, 表现出明显的体长和体重差异, 2022年5月31日从养殖池中随机采集生长差异的对虾, 大虾(D)平均体重(8.11±0.36) g, 平均体长(86.42±1.18) mm;小虾(X)平均体重(1.73±0.12) g, 平均体长(50.04±1.21) mm; D和X的平均体重和体长均存在极显著差异(P<0.01)。在无菌操作下采集对虾肠道和肝胰腺, 分别设3组平行且保存无菌冻存管中, 并置于-80℃冰箱备用。D和X进行PCR检测验证(图1),X与肝肠胞虫病虾序列的相似度高达99.51%, 因此标记D为健康对虾, X为发病对虾。
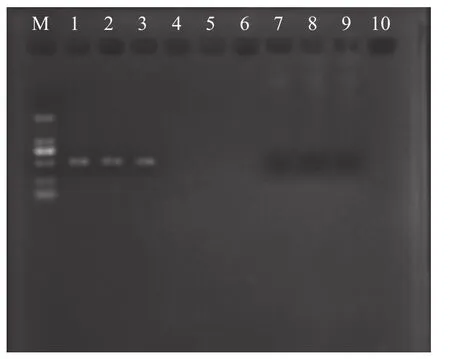
图1 PCR扩增结果图Fig.1 PCR amplification results graph
1.2 细菌DNA提取及高通量测序
从-80℃冰箱中取出样品, 冰上融化后, 采用SDS法提取样本总基因组DNA。在1%的琼脂糖凝胶上检测DNA的浓度和纯度。根据浓度, 用无菌水稀释样品DNA至l μg/μL。利用正向引物(5′-GTGCC AGCMGCCGCGGTAA-3′)和反向引物(5′-CGCC AG CGCGGGTAA-3′)对16S rRNA基因V3—V4可变区进行扩增。以10 ng DNA样本为模板进行PCR扩增, 反应系统: 98℃预变性1min, 98℃变性10s, 50℃退火30s, 72℃延长30s, 进行30次循环, 最后72℃延长5min, 并在4℃保存。使用QIAquick PCR纯化试剂盒(Qiagen, GmbH, Hilden, 德国), 对每个样品的PCR产物进行合并及纯化。将健康对虾肠道(D.C)、健康对虾肝胰腺(D.G)、发病对虾肠道(X.C)、发病对虾肝胰腺(X.G)及水体菌群(S)这5组样品送测, 最后在Illumina NovaSeq平台上进行测序。
1.3 高通量测序原始数据处理
将配对末端读数与FLASH (V1.2.7, http://ccb.jhu.edu/software/FLASH/)连接, 然后使用Quantitative Insights Into Microbial Ecology (QIIME v1.9.0,http://qiime.org/)通道进行处理。通过 QIIME中的质量分数、序列长度、模糊序列及引物错位阈值等信息来筛选出嵌合体, 再利用 UCHIME (V11, http://www.drive5.com/usearch/manual/uchime_algo.html)技术将嵌合体序列剔除, 从而得到有效的序列。采用USEARCH的UPARSE (V7.0.1001, http://www.drive5.com)算法进行样品运算分类单元(OTU)聚类分析, 相似度大于97%的序列聚为一类, 筛选每个OTU的代表性序列。对于每个具有代表性的序列,使用基于Mothur算法的SILVA123 (http:// www.arbsilva.de/)数据库对分类信息进行注释。采用MUSCLE软件(v5.1, https://www.drive5.com/muscle/)对多个基因序列进行了比对, 研究不同OTUs的系统发育关系, 并比较不同样本(组)中优势种间的差异。对α多样性(Chao1指数、Ace指数、Simpson指数和Shannon指数)进行分析; 在生物学分类的门和属水平上对样本的微生物的群落组成及相对丰度进行统计; 利用Tax4Fun对SILVA数据库中16S序列的注解进行 KEGG功能预测。
1.4 数据统计
利用SPSS 18.0开展单因素方差分析, 比较各组间水体、肝胰腺、肠道之间的微生物群落多样性的显著差异, 用基于binary_jaccard距离的主坐标分析PCoA和群落相似度分析ANOSIM比较各组间水体、肝胰腺、肠道之间的微生物群落组成结构的显著差异。
2 结果
2.1 样品测序数据质量评估及复杂度分析
D.C、D.G、X.C、X.G和S五组样品得到的原始序列1214292条, 通过过滤和双端拼接最终获得了1014269个tags数, 其中有效数据占83.53%。在相似性超过97%的水平上共发现了6449个OTU数。
统计和比较所有样品中的 OTU数, 绘制花瓣图(图2)。从图2中可见, 5组样品中共有的OTU数为80, 其中D中的特有OTU数目与S中特有的OTU数目较为接近, 且S中特有的OTU数目最多, 说明水体菌群的丰富度和多样性最高、D菌群次之。
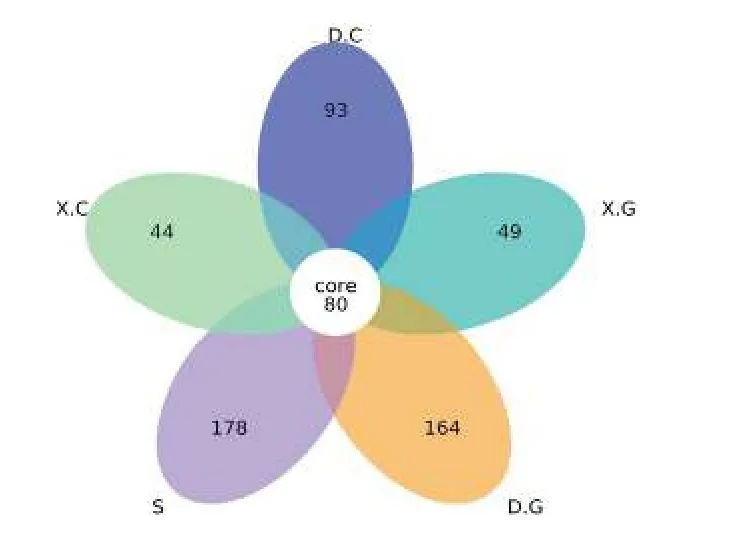
图2 各样本间OTU的差异性Fig.2 Variability of OTU among samples
稀释性曲线间接地反映出样品中的物种丰富度, 5个样本的物种数据构建稀释性曲线见图3。随着测序序列的增加, 5组样品所能聚类的物种数量逐渐趋于饱和, 表明随着测序量增加, 新的菌系已经不再显著增加, 菌群分析结果具有较高的可靠性和充分性。
2.2 菌群多样性分析
Alpha多样性分析结果对各样品在97%一致性阈值下的Alpha Diversity分析指数进行统计分析(表1)。D和X中肠道细菌和肝胰腺细菌的群落的丰富度及多样性各不相同, S、D.C、X.C、D.G、X.G样品中Shannon指数、Simpson指数、Chao 1指数、ACE指数依次减少。从Shannon 指数及Simpson指数来看, D.C与X.C、D.G与X.G及S与X.C Shannon 指数及Simpson指数之间无显著差异(P>0.05),而D.C中细菌群落与X.G细菌菌落存在差异(P<0.05), S细菌群落与D.G中细菌菌群存在差异(P<0.05)。从Chao1和ACE可知, D.C与X.C、S与X.C及S与X.G细菌群落之间丰度差异显著(P<0.05), 而D.G与X.G、D.G与X.C及S与D.C细菌群落之间丰度无明显差异(P>0.05)。

表1 各样品α-多样性指数差异表Tab.1 Differences in alpha-diversity indices among samples (mean±SD, n=3)
Bate多样性分析结果非定向β多样性是对某些环境或实验因素响应的群落结构变化的度量。使用OTU水平的细菌群落的PCoA来可视化D和X中肠道和肝胰腺细菌群落的差异(图4),D.C和X.C微生物群落、D.G和X.G微生物群落的组成是均匀的且高度相似性, 而S的细菌群落较虾肠道及虾肝胰腺的细菌群落相似性较低。
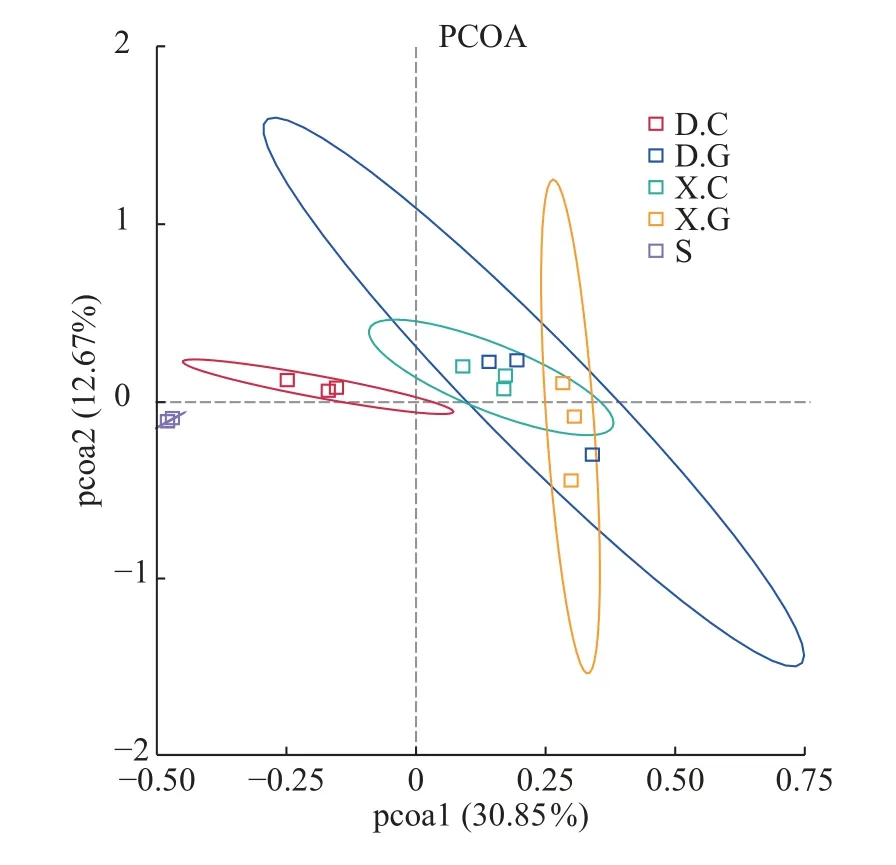
图4 不同样本之间细菌群落的β多样性Fig.4 Beta diversity of bacterial communities among different samples
ANOSIM检验结果进一步证实了水体、肝胰腺和肠道之间的微生物群落差异。由表2可知,D.G中细菌群落与S中细菌群落存在极显著差异(P<0.001), D.G中细菌群落与D.C细菌群落、X.C细菌群落与D.G细菌群落、X.G群落与S中的细菌群落均显著差异(P<0.05)。
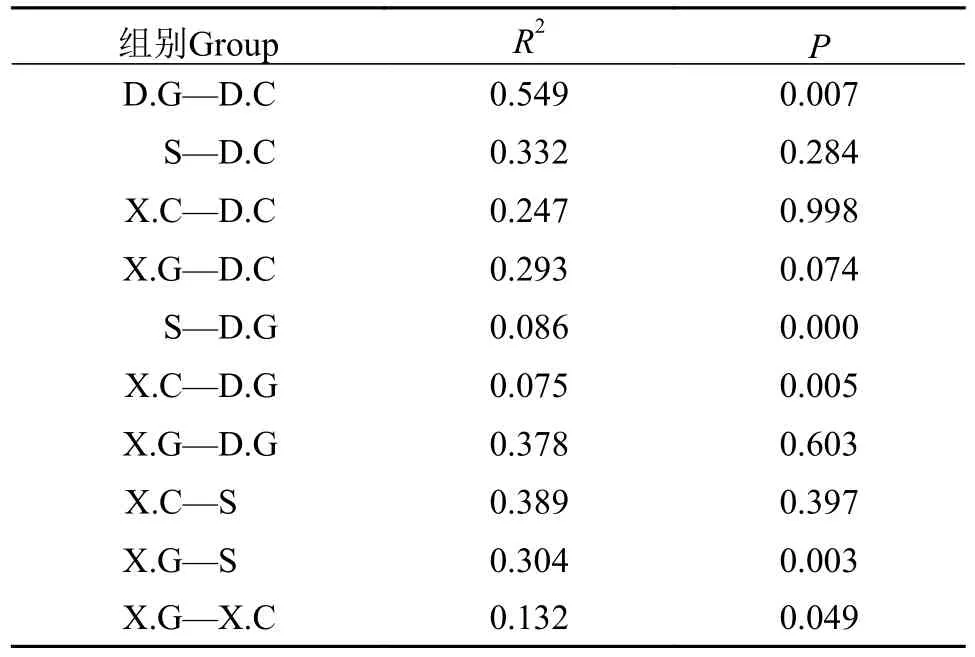
表2 不同样本组之间方差的置换多变性分析Tab.2 Displacement multivariance analysis of variance between different sample groups
2.3 细菌群落的组成
基于门分类水平上的物种注释及分析基于门(Phylum)分类水平构建相对丰度累加图(图5)。D.C主要是拟杆菌门(Bacteroidetes)、变形菌门(Pro-teobacteria)及厚壁菌门(Firmicutes), 以上三门微生物占菌群总量的94.42%; 变形菌门是D.G、X.C、X.G及S优势菌群, 占比分别为86.19%、38.18%、87.74%、40.68%。在D.G及X.G中未检测到其他共有的优势菌门, 而在X.C及S中还检测到拟杆菌门为共有优势菌门。D.C与X.C共有拟杆菌门、变形菌门及厚壁菌门3个优势菌门。D.C与S有拟杆菌门、变形菌门2个优势菌门。五组样品的细菌种群在门水平上的组成和分布说明在同一养殖池塘中D.C、X.C、S、D.G、X.G中细菌菌群组成有密切的关联。

图5 各组样本中的优势细菌门的平均相对丰度分布情况Fig.5 Mean relative abundance distribution of the dominant bacterial phylum in each group of samples
基于属分类水平上样本菌群组成分析在属(Genus)水平上, D和X的肠道及肝胰腺内优势细菌的组成及丰度存在明显不同(图6)。D.C优势菌属为埃希杆菌-志贺菌属(Escherichia-Shigella)、海绵菌属(Spongiimonas), 而X.C优势菌属为希瓦式菌属(Shewanella)、巨球型菌属(Megasphaera)、克雷伯氏菌属(Klebsiella)。D.G优势菌属是假单胞菌属(Pseudomonas)、汉氏盐单胞菌属(Halomonas), 而X.G优势菌属为贪铜菌属(Cupriavidus)。由于S中的菌群的多样性较高, 因此具有优势丰度的菌群数量居多。
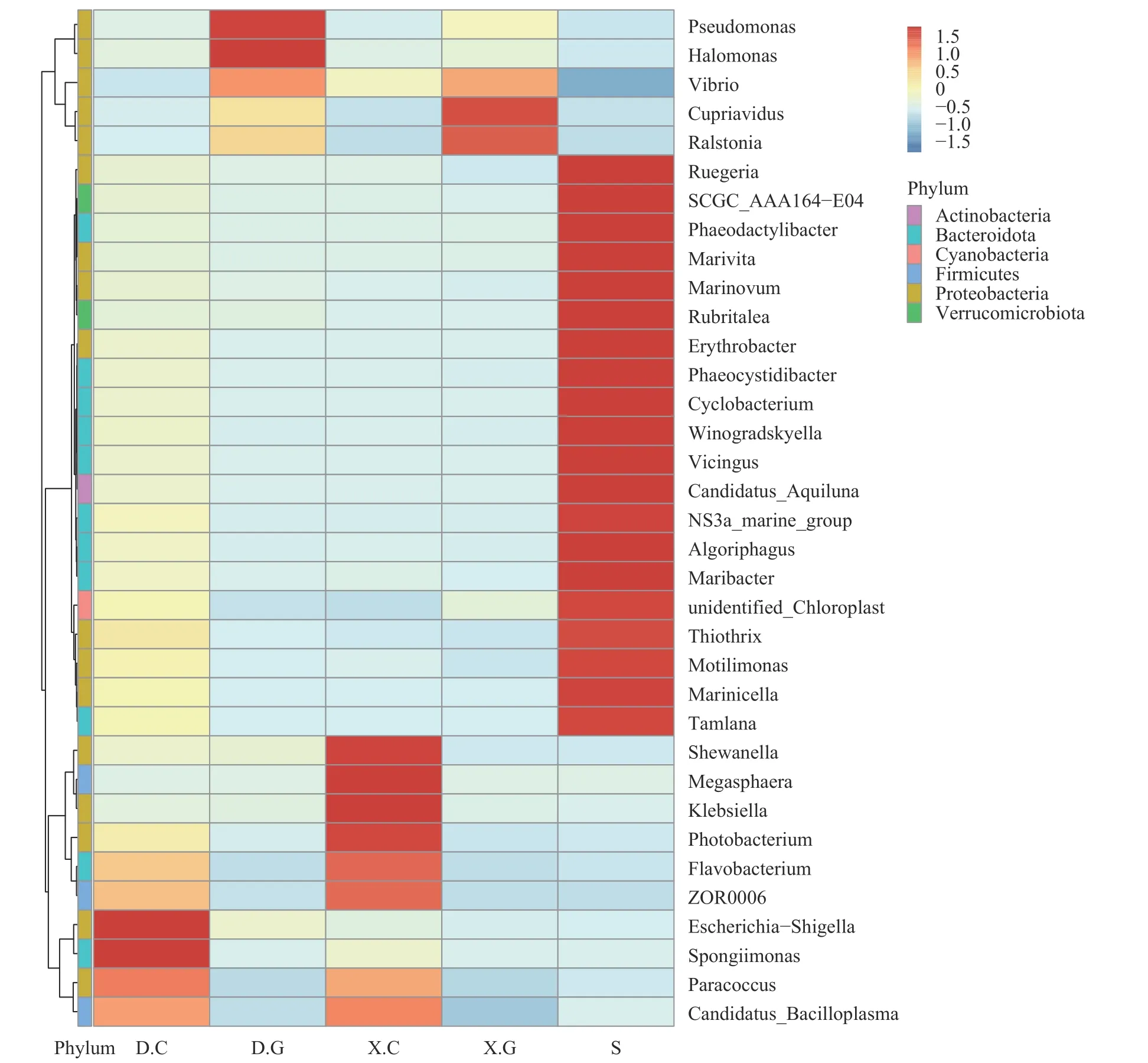
图6 菌群在属水平丰度聚类热图Fig.6 Abundance clustering heat map of the bacteriophage at the genus level
2.4 菌群与预测功能特征的相关性
利用Tax4Fun2预测菌群中的潜在功能并绘制功能丰度聚类图(图7)。结果显示: D.C与X.C、D.G与X.G存在明显差异, 其中D.C菌群的主要功能为氨基酸代谢、X.C菌群的主要功能为转运RNA;D.G菌群的主要功能为二分组系统, 而X.G菌群的主要功能为肽酶。

图7 Tax4Fun2功能丰度聚类图Fig.7 Tax4Fun2 functional abundance clustering map
3 讨论
3.1 肠道及肝胰腺菌群生物多样性分析
凡纳滨对虾作为产量最高的经济虾之一, 受到了养殖户的广泛关注和选择[23]。与其他虾相比, 微生物菌群与健康、疾病、生长速度有关[24], 与其他种类虾相比, 凡纳滨对虾的生长速度和繁殖速度非常迅速, 其所需的高蛋白饲料可以实现大规模的养殖。肠道菌群为宿主提供有益的功能, 如营养素的吸收、消化酶的产生、通过激活对病原体的保护机制产生宿主代谢必需元素和免疫反应, 以及与致病菌产生竞争关系[25]。虽然已有研究揭示对虾肠道内的细菌组成[26], 最近研究发现[27], 正常水生生物和患病水生生物具有不同功能的消化系统, 它们产生的微生物群落也具有多样性。肝胰腺是甲壳类动物消化、吸收和储存营养物质的重要器官, 在调节宿主先天免疫方面也发挥着关键作用。自2009年泰国研究者Peng和Pu[12]首次发现一种未知的微孢子虫, 经过后续的研究命名为EHP。EHP主要在凡纳滨对虾的肠道表皮表层、肝脏、胰脏及附着在肝胰腺小管上皮的细胞上, 被感染的对虾其病变位置出现肿大现象, 并且有大量的嗜碱性包涵体存在于肝胰脏小管上皮细胞的细胞质内。研究表明凡纳滨对虾生长缓慢跟EHP的感染有直接关系[28]。本研究表明: 健康虾的肠道和肝胰腺菌群的丰度及多样性比发病虾的肠道和肝胰腺的丰度及多样性更高, 表明受EHP侵染对凡纳滨虾肠道及肝胰腺菌群多样性造成了一定的影响, 这一结果与吴金凤等[29]、段健诚等[30]研究的结果相似。
3.2 肠道及肝胰腺菌群结构分析
肠道是水生动物共生微生物定殖和增殖的适宜环境[31]。肠道也是消化吸收营养物质的主要器官, 是机体最大的“免疫器官”。肠道菌群是构建抵御病原体的第一道屏障, 促进肠道健康并确保肠道持续正常的生理功能。在门水平, 变形菌门、拟杆菌门、放线菌门和厚壁菌门在不同发育阶段的虾肠道中均占优势。Tzeng等[32]比较了不同栖息环境日本沼虾(Macrobrachium nipponense)肠道细菌组成, 发现主要为变形菌门, 其次是厚壁菌门和放线菌门。Rungrassamee等[33]研究发现不同发育阶段的斑节对虾肠道优势菌都是变形菌门。郁维娜等[34]发现健康和患病的凡纳滨对虾肠道主要菌群均为变形菌门 (51.2%) 和放线菌门 (27.2%) 。Mente等[35]研究处于蜕壳不同阶段罗氏沼虾(Macrobrachiumrosenbergii)的肠道优势菌主要为变形菌门, 其次为厚壁菌门。段健诚等[30]研究肝肠胞虫病虾及健康虾肠道菌群, 优势菌群也为变形菌门和厚壁菌门。本实验研究得到健康对虾与发病对虾中肠道及肝胰腺中的优势菌组成类似, 其中健康虾与发病对虾肠道中的优势细菌均属于变形菌门、厚壁菌门和拟杆菌门, 而其肝胰腺中的优势菌门均为变形菌门。这一结果与其他虾肠道优势菌亦类似, 表明健康对虾与发病对虾中肠道与肝胰腺细菌群落具有高度的相似性。
而在属水平上, 健康对虾和发病对虾的肠道及肝胰腺内优势细菌的组成及丰度存在明显不同, 健康对虾肠道中的丰度最大的优势菌属为埃希杆菌-志贺菌属、海绵菌属; 而发病对虾肠道中的则为希瓦式菌属、巨球型菌属和克雷伯氏菌属。健康对虾肝胰腺中最具优势丰度的是假单胞菌属、汉氏盐单胞菌, 而发病对虾肝胰腺中的则为贪铜菌属。蒋葛等[36]研究凡纳滨对虾急性肝胰腺坏死综合症病虾与健康虾肠道优势菌群, 发现不同生长阶段病虾肠道中的优势菌属均为弧菌属(vibrio), 而健康虾幼虾肠道优势菌属为假单胞菌属, 养殖中期的优势菌属为发光杆菌属(Photobacterium), 养殖后期的优势菌属为弧菌属; 而Jesús AntonioLópez-Carvallo等[37]研究发现虾感染EHP后期, 肝胰腺丰度最高的菌属为假单孢菌属。同时研究表明[38], 肝肠胞虫病会引起对虾饮食及个体大小不同, 这些差异可能会影响虾肠道微生物的变化。李彦芹等[39]曾进行了一项初步研究, 比较了摄食不同饵料对日本沼虾肠道菌群的影响, 研究结果表明: 摄食人工饲料及小黄鱼的日本沼虾的肠道的优势菌群均为邻单胞菌属(Plesiomonas)和假单胞菌属, 且研究还发现摄食饲料后的肠道细菌数量与摄食饲料前相比呈先增后减的趋势; 另外, 杨慧赞等[40]研究发现大虾和小虾在菌属水平存在显著差异, 大虾的主要优势菌属为乳杆菌属(Lactobacillus)和片球菌属(Pediococcus)、苍白杆菌属(Ochrobactrum)、军团杆菌属(Legionella), 而小虾的主要优势菌属为红小梨形菌属(Rhodopirellula)、布拉格菌属(Pragia)和不动杆菌属(Acinetobacter)。
3.3 肠道及肝胰腺菌群功能预测分析
虾肠道内富含许多微生物, 其中包括一些能够代谢蛋白质的细菌和酵母菌, 将蛋白质分解成小分子的氨基酸, 提供给对虾进行吸收利用。本研究中Tax4Fun2预测结果显示, 健康对虾肠道菌群的基因功能与新陈代谢功能有关, 主要为氨基酸代谢。研究表明健康虾肠道菌群代谢氨基酸可能通过合成蛋白质、酶和激素等功能来维持健康状态并提供能量[41], 同时Li等[42]也做了相关研究, 证实了这一观点。而发病对虾的肠道菌群和肝胰腺菌群的基因功能主要与遗传信息处理功能有关, 王金星等[43]研究发现相关基因和遗传信息可以影响肝胰腺肠道菌群的组成和数量, 从而影响虾类的免疫系统和代谢。健康对虾肠道及肝胰腺菌群的基因功能和发病对虾肠道及肝胰腺菌群之间的基因功能不同,导致它们对病原体的不同反应, 这为研究虾类疾病的病理机制提供启示, 并帮助开发更有效的防治策略。
综上所述, 健康对虾与发病对虾间的肠道和肝胰腺中的优势菌门具有高度相似性, 但优势菌属组成及丰度存在明显不同。健康对虾肠道和肝胰腺的菌群的主要功能与发病对虾肠道和肝胰腺的主要功能存在明显差异。本研究有助于了解肝肠胞虫对凡纳滨对虾肠道及肝胰腺细菌群落的影响, 并为凡纳滨对虾的疾病管理和健康养殖提供依据。

