大黄活性成分药代动力学研究进展
王 磊, 张静泽, 高文远
(1.天津大学药物科学与技术学院,天津300072;2.天津中新药业集团股份有限公司乐仁堂制药厂,天津300380)
大黄史载于《神农本草经》,为我国应用最为广泛的重要中药材之一。2010版药典收载大黄Radix et Rhizoma Rhei为蓼科植物掌叶大黄Rheum palmatum L.、唐古特大黄R.tanguticum Maxim.ex Balf.或药用大黄 R.officinale Baill.的干燥根和根茎。大黄性味苦、寒,归脾、胃、大肠、肝、心包经,具有泻热通肠、凉血解毒、逐瘀通经的功效[1]。主要活性成分包括大黄酸、大黄素、大黄酚、芦荟大黄素、大黄素甲醚等游离蒽醌及其苷类。现代药理学研究表明大黄中活性成分具有泻下[2]、抗炎[3]、抗菌抗病毒[4]、降压降脂[5]、抗肿瘤[6]等作用。对于大黄的相关研究较早也非常广泛,其中涉及了活性成分分离分析、药理学、毒理学以及药代动力学等多方面,虽药效学研究较为深入,但对大黄中主要成分药代动力学的研究相对较为滞后,且尚无对大黄中主要活性成分体内外代谢研究的系统报道。本文对大黄中蒽醌类单体成分、大黄单味药材给药后主要成分药代动力学特点、大黄复方给药后药材配伍对入血成分的影响以及体外代谢等研究进展进行综述,为深入研究大黄发挥药效的作用物质基础以及指导临床用药提供可参考的科学依据。
1 大黄蒽醌单体给药后体内代谢过程的研究
大黄中的主要成分为蒽醌类化合物,其中游离型蒽醌主要为芦荟大黄素(aloe-emodin)、大黄酸(rhein)、大黄素(emodin)、大黄酚(chrysophanol)、大黄素甲醚(physcion)等;结合型蒽醌为蒽醌衍生物与葡萄糖结合成的苷,番泻苷(Sennoside)A-F等[7]。对于大黄中蒽醌类成分药代动力学研究的较早,文献中报道了蒽醌类单体经不同途径给药后在体内的代谢过程。到目前为止研究发现,对于大黄中成分的体内代谢过程以Ⅰ相代谢为主,口服大黄煎剂后从大鼠的尿、胆汁、血样中检测到了113种成分[8]。大黄中的主要成分芦荟大黄素、大黄酸、大黄素、大黄酚单体给药后体内吸收速度较快,与血浆蛋白结合率较高,除以化合物原型入血吸收,芦荟大黄素、大黄酸、大黄酚在体内均会代谢生成大黄酸。
1.1 芦荟大黄素 实验研究发现小鼠腹腔注射给予芦荟大黄素 20 mg/kg,体内血药浓度最大值为 654.6 ng/mL[9];大鼠口服灌胃4.5 mg/mL后发现,血药浓度在1.5~3 h范围内达到最高,且其浓度最高值在不同性别大鼠体内存在差异,在雄鼠体内为248 ng/mL,而在雌鼠体内可达441 ng/mL[10]。给药后血液中原型成分仅占10%,其进入体内后迅速代谢为3种产物,其中以大黄酸为主要成分,另外为一种缀合物及一种未知成分;组织分布研究发现芦荟大黄素在肝、肾、小肠中的浓度明显高于血液,同时发现在大鼠卵巢中浓度明显高于睾丸。
1.2 大黄酸 大黄酸在体内以原型为主,在尿液和胆汁中检测到2种代谢成分,由于该成分能被葡萄糖苷酸酶和硫酸酯酶水解,因此判断为大黄酸的缀合物[11]。大黄酸给药后入血吸收非常迅速,口服给药后5 min取血测定,即可检测到大黄酸,且在体内残留时间较长。雄性大鼠灌服或静脉注射大黄酸单体成分后,48 h内均可检测到血液中的大黄酸含量;静脉注射给药2 d后在组织中仍可检测到大黄酸;口服给药7 d后仍可检测到。单次肠道内给药大黄酸25 mg/kg,收集5 d内尿样及粪样,大黄酸在尿液中回收率为37%,粪便中为53%。在组织中的血药浓度明显低于血液,以脑组织和睾丸最低,在肾脏中浓度最高[12-13]。
1.3 大黄素 给家兔静脉注射大黄素后,发现其体内代谢过程属于二室开放模型,AUC 518 ng/mL min,消除半衰期为227 min;口服给药后,大黄素在血液中浓度较低,利用平衡透析法测定大黄素与血浆蛋白结合率,其结合率较高达到99.6%[14]。
1.4 大黄酚 给家兔耳缘静脉注射大黄酚10 mg/kg后,其体内代谢过程更符合二室模型,分布较为迅速,T1/2α为9.6 min,T1/2β为 139.27 min,T1/2β远大于 T1/2α,说明家兔耳缘静脉注射大黄酚在体内以消除过程为主[15]。
1.5 大黄中结合型蒽醌 结合型蒽醌以番泻苷为主,是大黄蒽醌类衍生物以及蒽酮与葡萄糖结合形成的苷类。然而经口服给药后在血液中并未检测到这类结合型蒽醌类衍生物,检测到的为水解糖基后的苷元[16]。大鼠口服番泻苷2.3 h后,于肠内检测到等摩尔的芦荟大黄素蒽酮以及大黄酸蒽酮。在给予抗生素干扰后,由于肠道内菌群发生了改变,番泻苷转化的总蒽酮的量明显减少[17]。大黄中的二蒽酮双氧葡萄糖苷口服后被肠道菌群代谢生成其苷元,被吸收后再进而形成葡萄糖醛酸和硫酸酯缀合物。因此证明蒽酮碳苷和双蒽酮氧苷进行治疗时其发挥作用的成分为水解后苷元的部分,其代谢过程如图1所示。
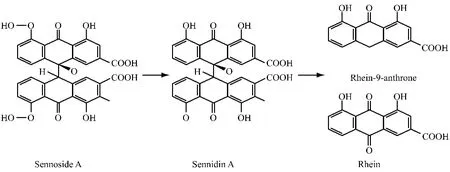
图1 番泻苷的体内代谢过程
2 大黄药材提取物给药后体内代谢过程的研究
中药中的有效成分种类多且成分复杂,各成分在进入体内后可能会由于药物之间的相互作用而影响某些成分的代谢过程,单体给药后体内代谢过程有时与中药材提取物给药后体内代谢过程的差别较大。文献报道,虽然提取物中大黄酸的含量较低,但口服给药后血浆样品中所检测到的主要成分为大黄酸。
12个健康志愿者口服大黄水提取物100 mg/kg后,采用TCL、HPLC和LC-MS方法对未知成分入血成分进行鉴定。结果发现,虽然大黄提取物中芦荟大黄素、大黄素、大黄酚的含量均高于大黄酸,但并未在体内检测到芦荟大黄素、大黄素、大黄酚的存在,而大黄酸为唯一入血吸收的蒽醌类成分[18-19];Yan等报道大鼠口服大黄水提物6 g/kg,在血样中检测到了芦荟大黄素、大黄酸、大黄素、大黄酚及大黄素甲醚等五种蒽醌类成分,此五种大黄蒽醌类成分入血吸收较快,均在30 min之内达到血药浓度的最高值[20]。
3 大黄复方给药后体内代谢过程的研究
中药复方体现了中医学的整体观念和辨证论治的思想,药物通过合理的配伍可以增强或改变原有的功用,调其偏性,制其毒性。中药复方中各味药材配伍比例的差异可能会导致某一种成分药代动力学特征发生变化[21-23],从而导致药理活性的改变。中药复方主要成分代谢过程的研究为揭示复杂体系在体内发挥作用的物质提供新的思路和方法。大黄在中药复方中的使用频率较高,且随配伍不同大黄所体现出的功效侧重各不相同,如泻下通腑作用的大小承气汤、凉血止血的泻心汤、活血化瘀的桃核承气汤以及清泄湿热的大黄栀子汤等。与单体和单味药材提取物给药相比,含大黄药材的复方提取物给药后蒽醌类成分的药代动力学参数发生改变:比较了家兔灌服桃核承气汤(5.0 g生药/kg)和单味大黄(1.4 g生药/kg)后大黄酸的药代动力学特征,发现灌服桃核承气汤后大黄酸在体内达到最高血药浓度Cmax为同等剂量下大黄单味药材提取物给药时的2倍,且复方给药后大黄酸的吸收更为迅速[24];大小承气汤是治疗便秘、清泻肠热的经典方剂,大黄在其中的配伍剂量不同。在大黄给药剂量相同的条件下,比较了给大鼠灌服大小承气汤后大黄酸的体内代谢过程,实验结果发现大承气汤给药后大黄酸的血药浓度以及AUC均明显高于小承气汤[25-26];与口服大黄煎剂相比,大鼠灌服通脉活血灵胶囊内容物大黄酚的体内代谢过程也存在一定差异,口服通脉活血灵胶囊后大黄酚的吸收更快,生物利用度更高[27];在研究复方制剂WPY颗粒的药代动力学过程中发现,大黄的蒽醌类成分芦荟大黄素、大黄酸、大黄素、大黄酚的体内代谢过程与大黄单味药材给药组相比并无显著差异。对单味药材配伍前后入血成分及尿中排泄成分的研究发现,配伍后入血成分及尿中排泄成分并非为各单味药材主要成分简单的加和,大黄与黄芩配伍后血中和尿中的原型成分及代谢产物的种类和数量增多且移行量都有明显增加[28],而大黄与甘草配伍后由于甘草中皂苷类成分对P450酶有激活作用致使大黄中的入血成分大黄酸的血药浓度显著降低[29]。由此说明大黄复方制剂中药材之间配伍关系的不同对于活性成分的药代动力学影响较大,这也为揭示中药复方的发挥作用的真正活性物质奠定了基础。
4 大黄蒽醌类成分体外代谢过程的研究
4.1 Caco-2体外代谢 药物透过Caco-2单细胞层的体外过程与药物口服在肠道中的吸收有较好的相关性,研究Caco-2单细胞层的体外过程,能够从细胞水平了解药物在肠中的吸收和转运。研究芦荟大黄素、大黄酸、大黄素、大黄酚的跨上皮细胞膜转运的情况发现此类蒽醌类化合物属于中等渗透性药物,渗透性强弱顺序:大黄酚<大黄素<大黄酸<芦荟大黄素。其表观渗透系数比高渗透性标准参照物普萘洛尔低10倍;比低渗透性参照物阿替洛尔高10倍[30]。大黄蒽醌类成分母核结构相同,取代基团不同在透过细胞膜吸收的过程中存在竞争性抑制作用,利用Caco-2小肠细胞体外模型实验考查了芦荟大黄素、大黄酸、大黄酚、大黄素甲醚对大黄素吸收过程的影响,发现大黄素的吸收受到其他蒽醌类化合物的影响,随着剂量的增加对大黄素吸收过程的抑制越为明显。药物本身结构的不同,表观渗透系数各不相同,大黄蒽醌对其影响也存在差异[31]。
大黄蒽醌类成分与肠上皮组织作用导致上皮细胞的损伤,同时肠运动性能的改变,加速大肠小肠的转运。在肠内水分吸收和分泌的交替会导致肠转运的进一步加速。这些改变都是由于泻下剂与肠上皮细胞相互作用所导致的。蒽醌类成分会导致ATP的降低,较低的ATP浓度和Na+-K+-ATP酶的抑制作用会使肠上皮细胞膜内外离子梯度降低,它将阻止Na+和水的吸收,从而影响共服药物的渗透性[32]。
4.2 肝微粒体酶体外代谢 产生药物之间相互作用的影响途径为肝微粒体酶的活性。肝脏中含有一系列细胞色素P450酶(CYP)、CYP 1A 2(13%)、CYP 2 C(20%)、CYP 2 D 6(2%)、CYP 2 E 1(7%)、CYP 3 A(29%)等,它们在药物代谢过程中起着重要的作用。一种药物对其酶活性的诱导或抑制会直接影响同服的其它药物在体内的代谢过程。大黄的水提物和甲醇提取物均对P450酶产生抑制作用,通过肝微粒体酶体外实验测定相应探针药物的代谢后浓度了解到大黄中的活性成分大黄酸对 CYP 1 A 2、CYP 2 C、CYP 2 D 6、CYP 2 E 1、CYP 3 A的活性均有抑制作用,因此提示该成分会影响同服的其它药物的代谢过程[33-34]。
5 结语
中药中所含成分种类繁多而且结构复杂,对于中药成分药代动力学研究起步较晚。上世纪80年代日本学者田代真一提出了血清药物化学的概念,其主要是发现并观测血清中外源性生物活性物质以及这些物质的作用和代谢规律,“经时”采集给药后含药血清,分析、分离制备中药血中移行成分,并分析其活性与药效的相关性。王喜军等[35]把血清药物化学方法与中药复方作用物质基础研究相结合,将中药血清药物化学的概念付诸于中药现代化的实践,为中药活性成分体内代谢过程的研究提供了新的思路和方法,也为进一步明确中药实际产生作用的有效成分奠定了基础。随着液质联用(LC-MS)和液相核磁联用(LC-NMR)等一些先进分析技术和方法在药代动力学中的应用,对中药成分代谢过程研究逐步深入。然而中药复方是一个复杂体系,其药效发挥为多组分多靶点作用的结果,因此单一成分的药代动力学并不能完全代表中药整体在体内发挥作用的过程。本文对大黄中活性成分药代动力学的研究经历了从单体成分分析到药材提取物再到复方配伍研究的过程,逐渐形成了以中药及中药复方作为一个整体研究其体内药动学过程的理论模式。随着研究的不断深入,将血清药物化学与血清药理学的研究结合起来并建立药代动力学-药效动力学模型,才有可能最终揭开中药以及复方制剂这一复杂体系发挥作用的真正物质基础。
[1]国家药典委员会.中华人民共和国药典:2010年版一部[S].北京:中国医药科技出版社,2010:20.
[2]肖培根.新编中药志[M].第一卷.北京:化学工业出版社,2002:66.
[3]Xiao P,He L,Wang L.Ethnopharmacologic study of Chinese rhubarb[J].J Ethnopharmacol,1984,10:276-293.
[4]马永涛,玄延花,曹东铉.大黄醇提液抗柯萨奇B病毒的初步研究[J].中国中医药科技,2001,8(5):308-309.
[5]郭丹杰,徐成斌,陈源泉.大黄对血管平滑肌细胞增殖影响的实验研究[J].中华内科杂志.1996,35(3):157-159.
[6]姜晓峰,甄永苏.大黄逆转肿瘤细胞多药抗药性作用[J].药学学报,1999,34(3):164-164.
[7]Ye M,Han J,Chen H B,et al.Analysis of phenolic compounds in rhubarbs using liquid chromatography coupled with electrospray ionization mass spectrometry[J].J Am Soc Mass Spectrom,2007,18:82-91.
[8]Song R,Xu L,Xu F,et al.In vivo metabolism study of rhubarb decoction in rat using high-performance liquid chromatography with UV photodiode-array and mass-spectrometric detection:a strategy for systematic analysis of metabolites from traditional Chinese medicines in biological samples[J].J Chromatogr A,2010,1217(45):7144-7152.
[9]Zaffaroni M,Mucignat C,Pecere T,et al.High performance liquid chromatographic assay for the determination of aloe emodin in mouse plasma[J].J Chromatogr B,2003,796:113-119.
[10]Lang L.Pharmacokinetic-metabolic studies with 14C-aloe emodin after oral administration to male and female rats[J].Pharmacology,1993,47(1):110-119.
[11]Lang W.Pharmacokinetics of 14C-labelled rhein in rats[J].Pharmacology,1988,36:158-171.
[12]Dewitte P,Lemli J.Excretion and distribution of(C-14)rhein and(C-14)rhein anthrone in rat[J].J Pharm Pharmacol,1988,40(9):652-655.
[13]江振洲,黄 鑫,王 涛,等.大黄酸在Beagle犬体内的毒代动力学研究[J].毒理学杂志,2007,21(4):302.
[14]Liang J W,Hsiu S L,Wu P P,et al.Emodin pharmacokinetics in rabbits[J].Planta med,1995,61(5):406-408.
[15]谭晓虹,张丹参,张 力,等.大黄酚在兔体内药物代谢动力学的研究[J].中成药,2006,28(7):1039-1040.
[16]Dewitte P.Metabolism and pharmacokinetics of anthranoids[J].Pharmacology,1993,47:86-97.
[17]Yamamuchi K,Shinano K,Nakajima K,et al.Metabolic-activation of sennoside C in mice[J].J Pharm Pharmacol,1992,44(12):973-976.
[18]Lee J H,Kim J M,Kim C.Pharmacokinetic analysis of rhein in Rheum undulatum L.[J].J Ethnopharmacol,2005,84:5-9.
[19]朱 伟,阮新民,陈可冀.性别差异对大黄酸在人体内药动学过程的影响[J].中国临床药理学与治疗学,2006,11(2):223-226.
[20]蒋心惠,张 丹,陈淑杰.大黄蒽醌衍生物的高效液相色谱法测定及在家兔体内的药代动力学研究[J].色谱,2003,21(3):251-254.
[21]Yasuharu M,Yukiho T,Kazuhisa I,et al.The influence of the sennosides on absorption of glycyrrhetic acid in rats[J].Biol Pharm Bull,2005,28(10):1897-1902.
[22]Yan D M,Ma Y M,Shi R,et al.Pharmacokinetics of anthraquinones in Xiexin decoction and in different combinations of its constituent herbs[J].Phytother Res,2009,23,317-323.
[23]辛 颖,耿慧春,张 嵩,等.三黄泻心汤及大黄中大黄酸在大鼠体内的药代动力学[J].中国实验方剂学杂志,2009,15(3):56-59.
[24]谢 华,马越鸣,王天明,等.桃核承气汤及单味大黄中大黄酸在家兔体内的药代动力学[J].中药药理与临床,2005,21(2):1-3.
[25]Tang W F,Huang X,Yu Q,et al.Determination and pharmacokinetic comparison of rhein in rats after oral dosed with Da-Cheng-Qi decoction and Xiao-Cheng-Qi decoction[J].Biomed Chromatogr,2007,21:1186-1190.
[26]Yua Q,Xiang J,Tang W F,et al.Simultaneous determination of the 10 major components of Da-Cheng-Qi decoction in dog plasma by liquid chromatography tandem mass spectrometry[J].J Chromatogr B,2009,877:2025-2031.
[27]李兰芳,张勤增,解丽君,等.通脉活血灵胶囊中大黄酚在大鼠血浆中的浓度及药代动力学研究[J].河北医学,2006,12(12):1207-1209.
[28]吴 斌,刘 爽,孙兆林,等.大鼠口服大黄、黄芩及其配伍后血液和尿液成分分析[J].世界科学技术-中医药现代化,2010,12(4):652-656.
[29]韩 刚,王彦雪,康 欣,等.18β-甘草酸对大黄酸在大鼠体内药物动力学的影响[J].中药新药与临床药理,2010,21(3):273-275.
[30]Wang Y,Yang X W.Intestinal transport of free anthraquinones in Caco-2 cell model[J].Chin J Nat Med,2008,6:141-145.
[31]Liu C H,Jiang Z Z,Huang X,et al.Cellular absorption of emodin influenced by anthraquinones in human intestinal Caco-2 cells[J].Chin J Nat Med,2008,6(4):298-301.
[32]Leena L,Elina T,Heikki V,et al.Anthranoid laxatives influence the absorption of poorly permeable drugs in human intestinal cell culture model(Caco-2)[J].Eur J Pharm and Biopharm,2007,66:135-145.
[33]Tang J C,Yang H,Song X Y,et al.Inhibition of cytochrome P450 enzymes by rhein in rat liver microsomes[J].Phytother Res,2009,23:159-164.
[34]Atsushi H,Yoko K,Hiromitsu N,et al.Effects of Kampo extracts on drug metabolism in rat liver microsomes:Rhei Rhizoma extract and Glycyrrhizae Radix extract inhibit drug oxidation[J].Jpn J Pharmacol,2002,164-170.
[35]王喜军.中药血清药物化学的研究动态及发展趋势[J].中国中药杂志,2006,31(10):789-835.