PES1在卵巢癌中的表达及其对内皮生长因子的影响
江絮萍,叶 泓
(武警福建总队医院妇产科,福州350003)
Pescadillo基因是在研究逆转录病毒诱发的斑马鱼胚胎发育缺陷中发现的。该基因在酵母、小鼠和人类均有表达,且功能高度保守,分别被命名为 YPH1/Nop7p、Pes1和 PES1[1-3]。Pescadillo主要表达在乳腺、卵巢等细胞分裂旺盛的组织中,能诱导染色质发生大规模伸展,而且能直接诱导下游靶基因表达,表明该分子具有转录因子功能[4-6]。研究表明,PES1在多种肿瘤如乳腺癌、胶质瘤、前列腺癌、胃癌以及头颈部鳞状上皮细胞癌中高表达[4,7-10]。血管内皮生长因子(VEGF)在卵巢癌的发生、发展中起极其重要的作用。因此,本研究初步探讨PES1在卵巢癌中的表达及其与VEGF表达的关系,报道如下。
1 材料与方法
1.1 材料 FLAG-PES1和pSliencer 2.1-U6neo载体由本科室构建并保存。293T细胞由本科室保存,采用含10%胎牛血清的RPMI 1640培养基于37℃5%CO2孵箱内常规培养。卵巢癌CAOV-3和ES-2细胞培养基同条件培养。FLAG抗体和鼠抗GAPDH购自Sigma公司,抗缺氧诱导因子-1α(HIF-1α)抗体购自北京中山公司,PES1抗体购自中衫金桥公司。限制性内切酶、DNA连接酶、DNA纯化试剂和Lipofectamine 2000等分别购自美国NEB公司、德国Qiagen公司及美国In-vitrogen公司。VEGF酶联免疫吸附试验(ELISA)试剂盒购自北京邦定公司。含VEGF启动子的荧光素酶报告基因由解放军309医院熊志红研究员惠赠。卵巢癌及癌旁组织取自本科室患者的组织标本。
1.2 方法
1.2.1 组织蛋白的提取 分别取出小块的癌组织或癌旁组织,先用生理盐水洗涤,放入研磨器中加入200μL RIPA(含10g/L NP40,5g/L脱氧胆酸钠,10g/L十二烷基硫酸钠)充分研磨后4℃12 000r/min离心10min取上清液。
1.2.2 蛋白印迹分析 样品蛋白电泳(SDS-PAGE),封闭、洗膜,加到硝酸纤维素膜上压片显影。
1.2.3 细胞转染和转录激活活性的测定 参照文献[11]:将总量为2.0μg的重组质粒DNA与80μL的培养基混合,再将2.5μL脂质体2000与80μL的培养基混合,然后将上述2种溶液混合,室温放置20min,加入到含有800μL培养液和10%胎牛血清的12孔板中。各组同时转染0.2μg含VEGF启动子的荧光素酶报告基因和0.1μg表达半乳糖苷酶的质粒。每组检测3个复孔,作用24h后分别测定各组的转录激活活性,取平均值,计算各组与空白对照组的转录激活活性的比值为相对值。
1.2.4 酶联免疫吸附试验(ELISA)检测VEGF的分泌量每组细胞接种2×105个,细胞贴壁后,用磷酸盐缓冲液(PBS)冲洗2次,加入不含血清的培养液培育24h,收集相应细胞的培养液,按照人VEGF ELISA试剂盒说明书进行检测,每组重复3次。
1.2.5 荧光定量聚合酶链反应(RT-PCR)检测VEGF的相对mRNA表达 总RNA用Trizol试剂提取后,按一步法RTPCR试剂盒说明进行。VEGF的上游引物为5′-TCT ACC TCC ACC ATG CCA AGT-3′,下游引物为5′-GAT GAT TCT GCC CTC CTC CTT-3′;β-actin上游引物为5′-TCA AGA TCA-TTG CTC CTC CTG-3′,下游引物为5′-CTG CTT GCT GAT CCA CAT CTG-3′。循环条件为:50 ℃ 10min,95 ℃5min为1个循环,再95℃10s,60℃30s,72℃30s,共40循环。扩增结果与β-actin进行比较作为VEGF的相对mRNA表达水平,每组实验重复3次。
1.2.6 HIF-1αSiRNA SiRNA表达载体的构建参照文献[12]。siRNA正义链为5′-AGT TAG TTC AAA CTG AGT TAA TCC C-3′;反义链为 5′-GGG ATT AAC TCA-GTT TGA ACT AAC T-3′。构建好的SiRNA表达载体用Lipofectamine 2000转染细胞。
1.3 统计学处理 采用SPSS13.0进行统计学分析,计量资料用±s表示,组间比较行t检验,以P<0.05为差异有统计学意义。
2 结 果
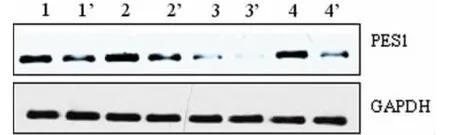
图1 PES1在卵巢癌组织中的表达
2.1 PES1在卵巢癌组织中的表达 为阐明PES1与卵巢癌的相关性,提取了4例不同卵巢癌患者的肿瘤组织及其对应的癌旁组织蛋白,蛋白印迹检测结果显示,肿瘤组织中PES1的表达水平明显高于相应的癌旁组织(图1)。
2.2 过表达PES1对卵巢癌细胞中HIF-α表达和VEGF分泌的影响 由于VEGF表达在卵巢癌的发生、发展过程中起极其重要的作用,而PES1具有转录因子功能,因此,观察PES1是否能调节VEGF的表达。将FLAG-PES1瞬时转染上皮性卵巢癌CAOV-3和ES-2细胞24h后,取细胞培养液用ELISA检测其中VEGF的分泌量发现,转染PES1的CAOV-3和ES-2细胞培养液的 VEGF分泌量分别由(178.0±11.8)pg/mL和(309.5±18.5)pg/mL 上升到 (375.0±18.3)pg/mL 和(633.2±25.7)pg/mL,这2种细胞的VEGF分泌量明显升高,差异有统计学意义(P<0.01)。RT-PCR结果表明,转染PES1的CAOV-3和ES-2细胞的VEGF相对mRNA水平分别上升了约1.8倍和2倍,差异有统计学意义(P<0.01)。结果表明,PES1可以增强CAOV-3和ES-2细胞中VEGF的表达。由于VEGF是HIF-1α的直接靶基因,因此,进一步观察过表达PES1是否升高HIF-1α表达。蛋白印迹结果表明PES1表达能升高这两种细胞中HIF-1α的表达(图2)。
2.3 PES1对含VEGF启动子的荧光素酶报告基因的转录激活活性的影响 由于PES1具有转录调节功能,因此,需要观察PES1是否能直接调节VEGF的转录。将不同剂量的FLAG-PES1与含VEGF启动子的荧光素酶报告基因共转染293T细胞后,检测报告基因的转录激活活性,发现加入不同剂量的PES1与没有加入PES1的转录激活活性相比,差异无统计学意义(P>0.05),说明PES1对调节VEGF的转录没有直接影响。
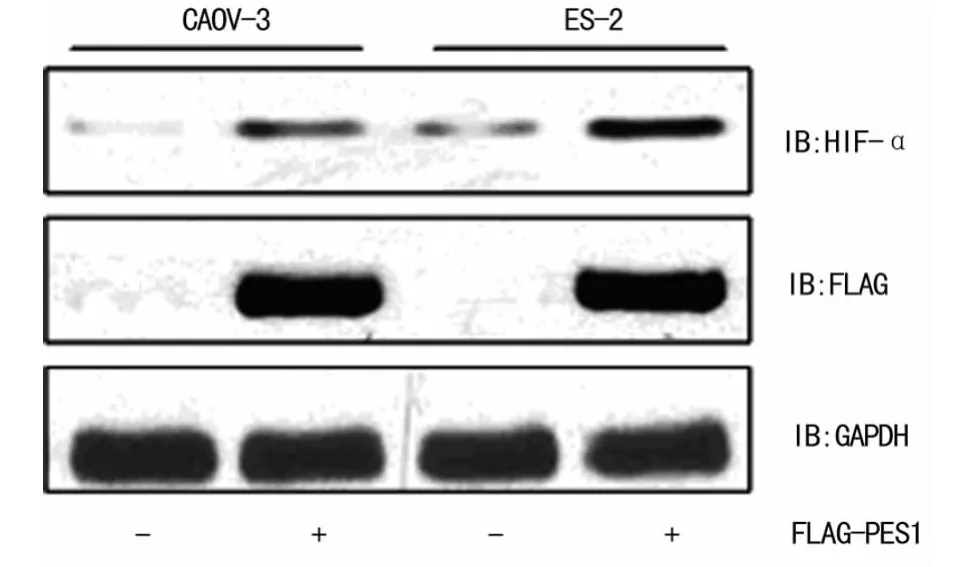
图2 PES1对CAOV-3和ES-2细胞中VEGF表达的影响
2.4 PES1升高VEGF的表达依赖于HIF-1α 将构建好的HIF-1αSiRNA或空载体转染CAOV-3细胞后,发现转染HIF-1αSiRNA的CAOV-3细胞中HIF-1α的表达明显降低,说明所构建的HIF-1αSiRNA能有效地抑制HIF-1α表达。将HIF-1αSiRNA与FLAG-PES1共转染CAOV-3和ES-2细胞后,蛋白印迹结果表明,HIF-1αSiRNA明显抑制PES1引起的HIF-1α表达升高,而且VEGF的蛋白分泌量和mRNA水平也被明显抑制,说明PES1升高VEGF的表达依赖于HIF-1α(图3、4)。
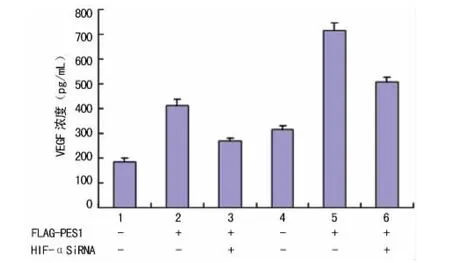
图3 HIF-1αSiRNA对PES1引起的VEGF分泌的影响

图4 HIF-1αSiRNA对PES1引起的VEGF相对mRNA水平的影响
3 讨 论
卵巢癌是妇科常见的恶性肿瘤之一,病死率居妇科恶性肿瘤首位。由于卵巢位于盆腔深部,难以早期筛查,缺乏早期诊断方法,多数患者确诊时已处于晚期,预后差,长期以来人们一直为找到敏感的肿瘤标志物而努力。目前,卵巢癌发生的分子机制并不十分清楚,因此,进一步揭示卵巢癌发生、发展的分子机制,对指导卵巢癌的诊断和治疗具有重要的指导意义。
Pescadillo在细胞增殖和细胞周期进程中起着极其重要的作用。在哺乳动物中,PES1与上游结合因子(upstream binding factor,UBF1)一起在核糖体生物合成中起重要的作用,PES1是核糖体生物合成所必需的,PES1突变或缺陷会导致细胞周期阻滞[13-14]。PES1在许多肿瘤细胞中过量表达。研究表明,外源性Pescadillo表达能够转化人、鼠的成纤维细胞,使其在软琼脂中发生、非依赖性生长[15]。雌激素能诱导乳腺癌细胞中PES1的表达,而且PES1在乳腺癌细胞中高表达;PES1会引起细胞周期蛋白D1表达降低,而周期素依赖性蛋白激酶抑制剂p27升高,从而抑制乳腺癌细胞增殖和致瘤性[4,16]。这些表明PES1与细胞的转化、恶变密切相关,可能参与肿瘤的发生、发展。本研究的结果表明,PES1在卵巢癌组织比在癌旁组织中表达明显升高,提示PES1可能在卵巢癌的发生、发展过程中起重要的作用。
活跃的血管生成是实体肿瘤生长和转移过程中普遍存在的病理现象,VEGF是重要的血管生成因子。在肿瘤的发生过程中,其增生速度超过血管生成的速度而造成局部缺氧。HIF-1α是缺氧状态下在细胞内的一种转录因子,其靶基因涉及肿瘤细胞能量代谢、血管生成、肿瘤转移和离子代谢等,在肿瘤发生、发展中的作用逐渐被重视。VEGF是HIF-1α直接调节的下游靶基因。VEGF和HIF-1α在卵巢癌组织表达明显升高,并在其发生、发展、转移等过程中起极其重要的作用。由于90%以上的卵巢癌起源于卵巢上皮细胞,因此,本研究用上皮性卵巢癌细胞CAOV-3和ES-2进行实验。结果表明,过表达PES1可以明显升高CAOV-3和ES-2细胞的VEGF分泌及其mRNA水平,可以升高VEGF的表达,同时PES1增强HIF-1α的表达。但报告基因的转录活性检测说明,PES1不能直接调节VEGF的转录。将HIF-1αSiRNA与PES1共转染细胞后,发现HIF-1αSiRNA能明显抑制PES1诱导的VEGF分泌升高以及其mRNA水平的升高。说明PES1能通过HIF-1α通路升高VEGF的表达。但是HIF-1αSiRNA没有完全抑制PES1诱导的VEGF表达升高,说明PES1可能还通过其他途径影响VEGF的表达。有研究表明,雌激素受体(ER)可以调节VEGF的表达,PES1可以与ER相互作用并调节其下游基因的表达[17-18]。因此,PES1可 能 通过 HIF-1α途 径 影 响VEGF的表达,当然这需要进一步的实验研究证明。
[1]Allende mL,Amsterdam A,Becker T,et al.Insertional mutagenesis in zebrafish identifies two novel genes,pescadillo and dead eye,essential for embryonic development[J].Genes Dev,1996,10(24):3141-3155.
[2]Haque J,Boger S,Li J,et al.The murine Pes1gene encodes a nuclear protein containing a BRCT domain[J].Genomics,2000,70(2):201-210.
[3]Kinoshita Y,Jarell AD,Flaman JM,et al.Pescadillo,a novel cell cycle regula-tory protein abnormally expressed in malignant cells[J].J Biol Chem,2001,276(9):6656-6665.
[4]张浩,李杰萍,王晓辉,等.Pescadillo抗体的制备及其表达研究[J].中国科学 C辑:生命科学,2007,37(2):135-142.
[5]张浩,方言,黄翠芬,等.人Pescadillo能够诱导大规模染色质伸展[J].中国科学 C辑:生命科学,2005,35(1):44-49.
[6]Sikorski EM,Uo T,Morrison RS,et al.Pescadillo interacts with the cadmium response element of the human heme oxygenase-1promoter in renal epithelial cells[J].J Biol Chem,2006,281(34):24423-24430.
[7]Byungsik K,Seunghyun B,Seungkoo L,et al.Expression profiling and subtype-specific expression of stomach cancer[J].Cancer Res,2003,63(23):8248-8255.
[8]Li YW,Xin H,Maha H,et al.Gene expression profiling revealed novel molecular targets of docetaxel and estramustine combination treatment in prostate cancer cells[J].Mol Cancer Ther,2005,4(3):389-398.
[9]Weber A,Hengge UR,Stricker I,et al.Protein microarrays for the detection of biomarkers in head and neck squamous cell carcinomas[J].Hum Pathol,2007,38(2):228-238.
[10]Li J,Yu L,Zhang H,et al.Down-regulation of pescadillo inhibits proliferation and tumorigenicity of breast cancer cells[J].Cancer Sci,2009,100(12):2255-2260.
[11]李杰萍,熊志红,杨智洪,等.雌激素受体 转录激活系统的构建[J].中华妇产科杂志,2008,43(8):611-614.
[12]李杰萍,张浩,杨树兴,等.利用不同方法检测RNAi抑制人Pescadillo基因的表达[J].细胞与分子免疫学,2007,23(5):1064-1065.
[13]Lerch-Gaggl A,Haque J,Li JX,et al.Pescadillo is essential for nucleolar asse-mbly,ribosome biogenesis,and mammalian cell proliferation[J].J Biol Chem,2002,277(47):45347-45355.
[14]Prisco M,Maiorana A,Guerzoni C,et al.Role of pescadillo and upstream binding factor in the proliferation and differentiation of murine myeloid cells[J].Mol Cell Biol,2004,24(12):5421-5433.
[15]Maiorana1A,Tu X,Cheng GJ,et al.Role of pescadillo in the transformation and immortalization of mammalian cells[J].Oncogene,2004,23(53):7116-7124.
[16]Li J,Yu L,Zhang H,et al.Down-regulation of pescadillo inhibits proliferation and tumorigenicity of breast cancer cells[J].Cancer Sci,2009,100(12):2255-2260.
[17]Mueller MD,Vigne JL,Minchenko A,et al.Regulation of vascular endothelial growth factor(VEGF)gene transcription by estrogen receptors alpha and beta[J].Proc Natl Acad Sci U S A,2000,97(20):10972-10977.
[18]Cheng L,Li J,Han Y,et al.PES1promotes breast cancer by differentially regulating ERαand ERβ[J].J Clin Invest,2012,122(8):2857-2870.

