大围山森林土壤中高产纤维素酶菌株的筛选及鉴定
李 悦,李世俊,薛桥丽,胡永金*
(1.云南农业大学 食品科学技术学院,云南 昆明 650201;2.云南农业大学 图书馆,云南 昆明650201)
随着人口膨胀和全球经济的迅猛发展,人类对于能源的需求也呈现逐年增长的趋势,能源短缺问题日益严重,并且全世界每年产生大量的农业废弃纤维素资源没有得到充分利用,造成极大浪费和环境污染[1-3],这为开发和利用纤维素提供了无穷的可再生资源。其次近年来对纤维素降解方面的研究最经济、环保的方法就是生物降解[4],所以寻找和开发高产纤维素酶菌种,是开发利用纤维素资源的前提和关键[5-6]。因此,从环境中筛选酶活高的野生菌株有着重要的意义[7-8]。
实验以大围山原始森林土壤为材料,通过初筛(刚果红纤维素水解试验和滤纸条分解试验)和复筛(利用3,5-二硝基水杨酸法测定内切纤维素酶活,滤纸酶活和β-葡萄糖苷酶活),筛选出了一株具有较强纤维素酶分解能力的菌株,期望能有效回收利用纤维素废弃物,提高其附加价值,以适应纤维素酶和纤维素乙醇工业化生产的需求。
1 材料与方法
1.1 材料与试剂
1.1.1 实验材料
土壤样品:云南省红河州屏边苗族自治县大围山原始森林腐烂落叶下面土壤。
1.1.2 主要试剂
羧甲基纤维素钠(sodium carboxyl methyl cellulose,CMC-Na,分析纯)、3,5-二硝基水杨酸(分析纯):国药集团化学试剂有限公司;水杨苷(≥99%):上海源叶生物科技有限公司;刚果红(分析纯):天津博迪化工股份有限公司;酒石酸钾钠(分析纯):天津市永大化学试剂有限公司;琼脂粉:广东环凯微生物科技有限公司;定量滤纸(中速):杭州富阳特种纸业有限公司。
1.1.3 培养基
种子培养基采用马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:土豆200 g,去皮,切成小块,煮沸30 min,纱布过滤,定容至1 L,再加2%葡萄糖,1.5%琼脂,自然pH,121 ℃灭菌30 min。
CMC-Na培养基:CMC-Na 1.5%,NH4NO30.1%,酵母膏0.1%,MgSO4·7H2O 0.05%,KH2PO40.1%,琼脂2%,pH自然,121 ℃灭菌30 min。
刚果红纤维素琼脂培养基:CMC-Na 1.5%,NH4NO30.1%,KH2PO40.1%,MgSO4·7H2O 0.05%,琼脂2%,pH自然,121 ℃灭菌30 min。培养4 d之后用刚果红染色进行鉴定。
滤纸液体培养基[9]:滤纸2%,酵母膏0.4%,NH4NO30.4%,MgSO4·7H2O 0.02%,KH2PO40.4%,pH自然,121 ℃灭菌30 min。
液体产酶培养基[9]:CMC-Na l%,蛋白胨0.3%,酵母膏0.02%,(NH4)2SO40.2%,KH2PO40.4%,CaC12·2H2O 0.03%,MgSO4·7H2O 0.03%,pH自然,121 ℃灭菌30 min。
1.2 仪器与设备
HX121-0054立式压力蒸汽灭菌锅:上海华线医用核子仪器有限公司;SHA-BA恒温振荡器:常州澳华仪器有限公司;101-2A电热鼓风干燥箱:北京中兴伟业仪器有限公司;SW-CJ-2D超净工作台:苏州净化设备有限公司;7200型可见分光光度计:尤尼柯(上海)仪器有限公司;DT5-2型低速台式离心机:北京时代北利离心机有限公司。
1.3 实验方法
1.3.1 样品的处理
将从菌源地采样得来的样品分别溶于无菌水中,稀释成一系列不同的稀释度,取10-3、10-4、10-53种稀释度,涂布于CMC-Na培养基,每个稀释度涂布3个平板,培养。反复划线分离至单个菌落。
1.3.2 初筛[10-11]
(1)将分离得到的单菌落接种于刚果红纤维素琼脂平板上,28 ℃恒温箱中培养4 d后用1 mg/mL的刚果红溶液染色30 min,再用蒸馏水清洗,最后用1 mo1/L的NaCl溶液脱色30 min。以透明圈的直径和菌落直径的比值大小作为筛选的标准,挑选出该比值较大的菌再进行划线分离,镜检确定菌体为单菌落后,接种于保藏培养基上保存。
(2)将滤纸条培养基的液体部分装入250 mL三角瓶中,每个100 mL,再加入2张灭过菌的滤纸条(滤纸经烘干后称质量),将保存的菌种制成菌悬液,分别接种于滤纸条培养基,于28 ℃恒温培养,于第7天采用失重法测定滤纸溃解情况,重复3次,测定反应体系中滤纸失重率,挑选出失重率较高的菌再去进行复筛。失重率计算公式如下:

式中:x为失重率,%;m为接种前滤纸条干质量,g;m1为接种培养后滤纸条干质量,g。
1.3.3 复筛[9,12-13]
通过初筛得到的菌株分别接种到CMC-Na液体种子培养基中于28 ℃、120 r/min培养3 d获得均匀的种子,然后按一定比例分别接种到液体产酶培养基中于28 ℃、120 r/min培养6d后离心获得粗酶,以3,5-二硝基水杨酸(dinitrosalicylic acid,DNS)法测定羧甲基纤维素酶活(carboxyl methyl cellulose activity,CMCA),滤纸酶活(filter paper activity,FPA)和β-葡萄糖苷酶(β-glucosidase)酶活。
粗酶液制备:将发酵液5 000 r/min离心10 min,取上清液作为粗酶液。酶活单位采用国际定义方法:以1 mL酶液在1 min内分解底物生成1 μg葡萄糖的酶量定义为1个酶活单位(U)。
(1)葡萄糖标准溶液的配制:分别加入0、0.2mL、0.4 mL、0.6 mL、0.8 mL、1.0 mL、1.2 mL葡萄糖标准液(1 mg/mL),加入3 mL配制好的DNS试剂混合均匀,在沸水浴中加热10 min,取出后立即用冷水冷却到室温,每管稀释到15 mL,摇匀。在波长540 nm处测定OD值并记录结果,以葡萄糖含量为横坐标,以对应的OD值为纵坐标,作标准曲线。
(2)羧甲基纤维素酶活力(CMCA)测定:分别向4支管中(1支空白管,3支样品管),加入用pH值为5.0醋酸-醋酸钠缓冲溶液配制的CMC-Na溶液2.00 mL,然后加入一定稀释比例的酶液0.50 mL(空白管不加),混匀。将4支试管置于(50±0.1)℃水浴中反应30 min,迅速向各管加入DNS试剂3.0 mL,再于空白管中加入稀释好的酶液0.5 mL。将4支管同时放入沸水浴中,加热10 min取出。冷却至室温,定容至15 mL,摇匀,以空白管(对照液)调零,在波长540 nm条件下测OD值。
(3)滤纸酶活力(FPA)的测定:分别向4支管中(1支空白管,3支样品管),加入(50±0.5)mg滤纸和pH值为5.0的醋酸-醋酸钠缓冲溶液1.5 mL,然后加入一定稀释比例的酶液0.50 mL(空白管不加),使管内溶液浸没滤纸,盖塞。将4支试管同时置于(50±0.1)℃水浴中反应60 min。立即向各管加入DNS试剂3.0 mL。再于空白管中加入稀释好的酶液0.50 mL。后续操作同上。
(4)β-葡萄糖苷酶酶活的测定:取0.5 mL适当倍数稀释的酶液,加入0.5 mL 1.0%的水杨苷溶液,55 ℃保温20 min后,加入3 mL DNS试剂,充分混合在沸水中煮沸5 min,冷却后,定容至15 mL,摇匀。在波长540 nm处测OD值,另取一支试管加入灭活的酶液作为对照。
1.3.4 菌株鉴定
(1)形态学特征初步鉴定[14-15]
将菌株接种到PDA平板上培养7 d后观察菌落的特征,在平板上挑菌体少许,涂于载玻片上,置于显微镜下观察。
(2)分子生物学鉴定
将目的菌送于华大基因科技公司测序,进行18S rRNA基因序列比对分析。
2 结果与分析
2.1 葡萄糖标准曲线
以葡萄糖质量浓度为横坐标,吸光值为纵坐标,绘制标准曲线,结果见图1,回归系数R2=0.999 7,线性关系良好。

图1 葡萄糖标准曲线Fig.1 Standard curve of glucose
2.2 初筛
将样品处理所得196株单菌落点种于刚果红纤维素琼脂平板上进行初筛,以培养4 d后透明圈直径和菌落直径比值≥2.0作为筛选的标准,满足条件的菌株有20株,实验结果见表1,平板上生长的菌株经刚果红染色后结果如图2所示,同时将这20株菌株接种到滤纸条培养基中,测定滤纸失重率,结果见表2。
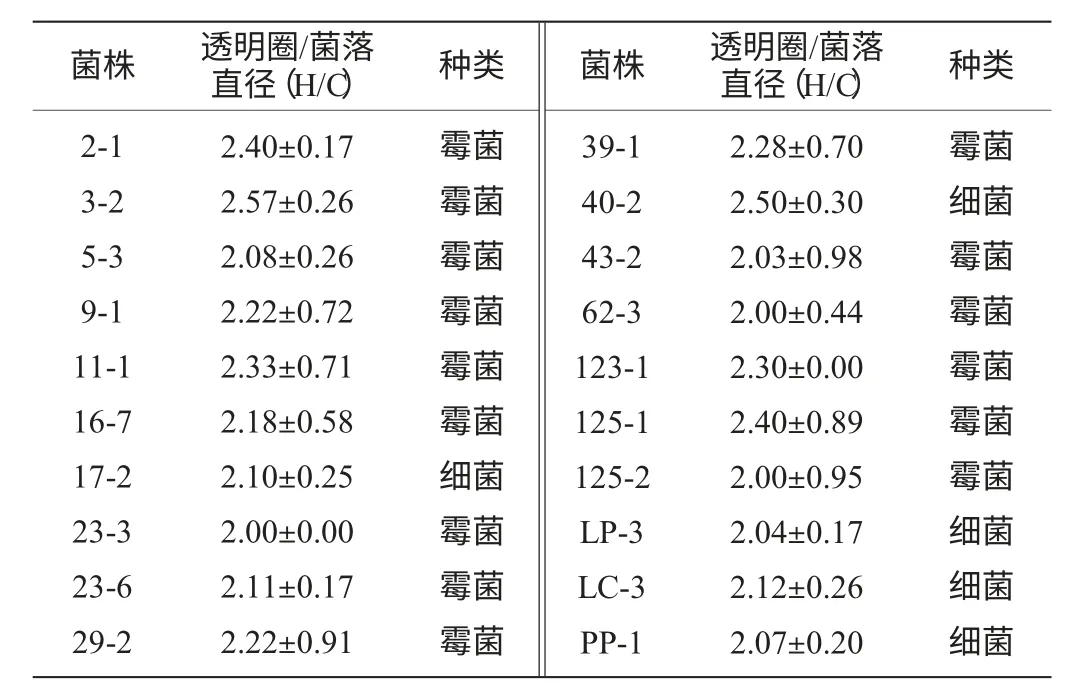
表1 刚果红平板水解圈筛选结果Table 1 Screening results of hydrolyzed circle by Congo red plate
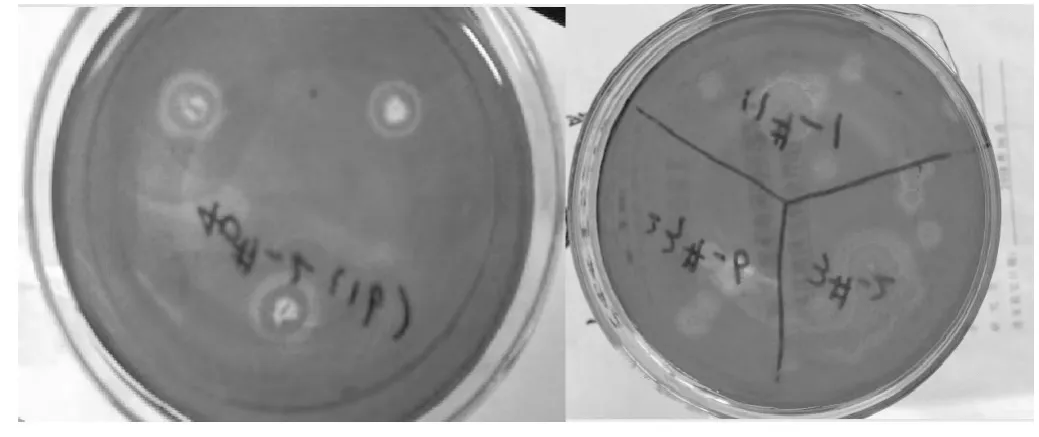
图2 霉菌在刚果红平板上染色后结果Fig.2 Result of moulds after dying in Congo red plate
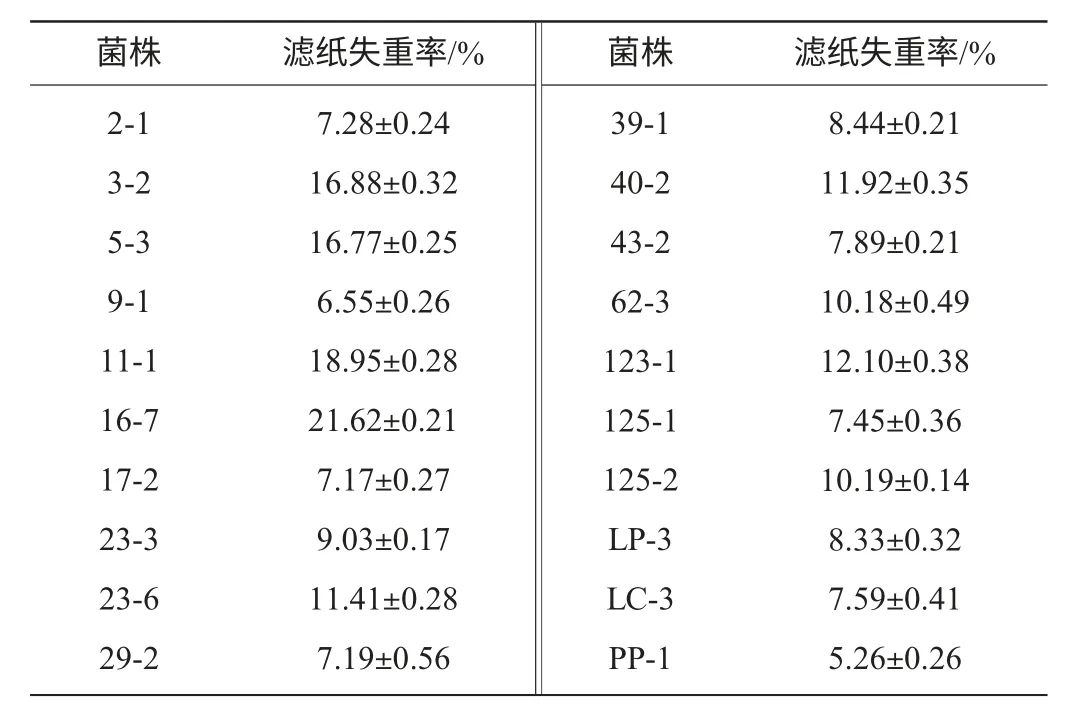
表2 滤纸失重率结果Table 2 Results of filter paper weight loss ratio
根据表2结果,以滤纸失重率>15%为标准,筛选出的菌株作为下步复筛的目的菌株,分别是3-2、5-3、11-1、16-7。
2.3 复筛
将初筛出来的4株菌制成菌悬液,按2%的接种量接种到CMC-Na液体发酵培养基中,在28 ℃,120 r/min的条件下,培养6 d后测定不同的酶组分活力,结果见表3。
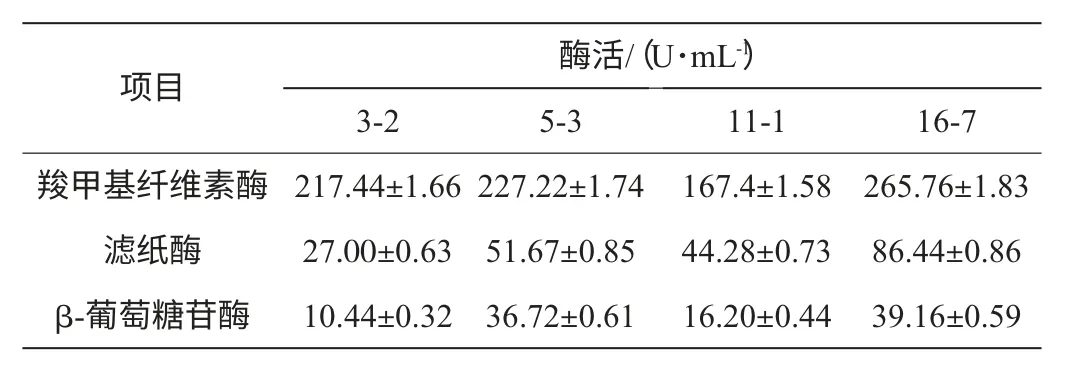
表3 不同菌种产酶能力的比较Table 3 Enzyme production capacity comparison of different strains
由表3可知,经酶活测定,菌株16-7的各个酶活最大。相对另外的3株菌而言,无论是透明圈直径与菌落直径比值,滤纸失重率,还是各个酶活值相较之都有优势,因此选择16-7号菌作为目的菌进行后续实验。
2.4 菌株鉴定
2.4.1 形态鉴定
(1)菌落形态观察:菌株16-7在PDA平板上培养7 d后,菌落颜色为灰绿色,菌丝质地呈地毯状(半绒毛状),背面呈灰色,无渗出液,周边以白色絮状扩散,呈同心圆状,菌落形态见图3。
(2)显微镜观察:营养菌丝具有横隔,子实体为扫帚状,表面产生许多小梗,小梗上着生成串的球状或圆形分生孢子,单个孢子较光滑,见图4。
依据菌落形态和显微镜观察,结合真菌鉴定手册:初步鉴定为半知菌亚门,丝孢纲,丝孢目,丛梗孢科,青霉属(Penicillium)。
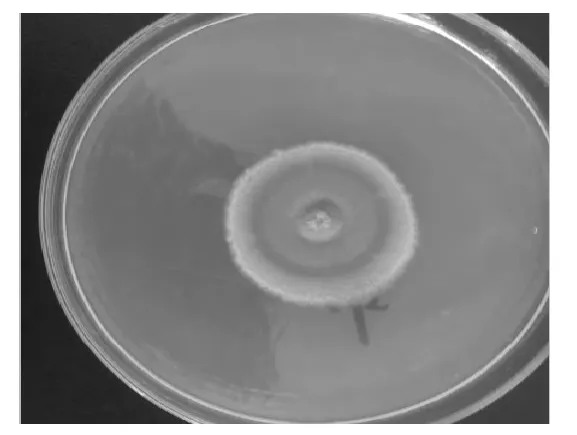
图3 16-7菌落形态Fig.3 Colonial morphology of strain 16-7
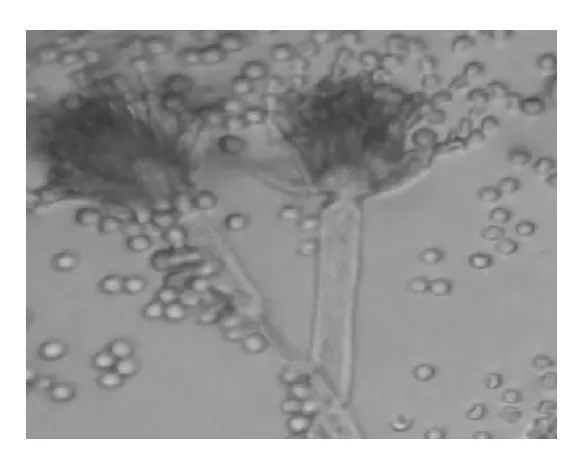
图4 16-7显微镜下菌株形态特征Fig.4 Morphological characteristics of strain 16-7 under microscope
2.4.2 分子生物学鉴定[16]
将测得的有效序列提交GenBank数据库,进行Blasten检索。分析结果表明,菌株16-7的18S rRNA基因序列与小刺青霉(Penicillium spinulosum)的18S rRNA基因序列同源性高达99%,初步确定该真菌为小刺青霉。16-7的18S rDNA序列长度为452 bp,全序列如下:
GCCGGGGGGCTTCTGCCCCCGGGTCCGCG CGCACC GGAGACACCATTGAACTCTGTCTGAAGATTGCAGT CTGAGCATAAACTAAATAAGTTAAAACTTTCAACA ACGGATCTCTTGGTTCCGGCATCGATGAAGAACGC AGCGAAATGCGATAACTAATGTGAATTGCAGAATT CAGTGAATCATCGAGTCTTTGAACGCACATTGCGC CCCCTGGTATTCCGGGGGGCATGCCTGTCCGAGCG TCATTGCTGCCCTCAAGCACGGCTTGTGTGTTGGGC TCCGTCCCCCCGGGGACGGGTCCGAAAGGCAGCGG GCGGCACCGAGTCCGGTCCTCGAGCGTATGGGGCT TTGTCACCCGCTCTGTAGGCCCGGCCGGCGCCAGCC GACAACCAATCATCCTTTTCAGGTTGACCTCGGATC AGGTAGGGATACCGCTGAACTTAAGCATA
3 结论
实验结果表明,利用刚果红纤维素水解及滤纸条分解初筛,液体产酶复筛的方法筛选高产纤维素酶菌株是可行的,将多种方法综合应用可得到更为准确可靠的实验结果。刚果红纤维素平板透明圈筛选法明显优于传统的筛选法,该法除了可用于识别产纤维素酶的菌株外,还可根据透明圈大小、透明圈出现早晚,粗略估计每株菌产酶能力,大幅度减少了筛选工作量。同时考虑滤纸是天然结晶类纤维素,且滤纸酶活力是纤维素酶组分的重要组成,因此可以通过观察滤纸培养基中滤纸分解程度进行二次初筛。最后对CMC酶活,滤纸酶活和β-葡萄糖苷酶活进行测定,综合反映了3类酶组分的协同作用,更加真实准确地反映了纤维素酶的活力。本研究对目的菌进行形态学观察和分子生物学鉴定(18S rRNA基因序列分析)相结合的方法,能够快速、准确地对微生物种属进行鉴定。
[1]薛桥丽,王 炜,胡永金,等.堆肥中高温纤维素酶菌株的筛选及其酶性质研究[J].中国酿造,2012,31(1):30-33.
[2]邓天福,杜开书,李广领.纤维素酶及其在酿造业中的应用[J].中国酿造,2011,30(12):17-19.
[3]武林芝.纤维素酶以及应用行业的研究进展[J].安徽农业科学,2013,41(26):10570-10574.
[4]傅 力,涂正东,叶 凯.里氏木霉高产纤维素酶菌株的选育及产酶培养基的优化[J].食品与机械,2009,25(3):10-13.
[5]武香玉,徐海燕,辛国芹,等.纤维素酶及其研究进展[J].饲料博览,2013(10):27-29.
[6]胡格华,苏香萍,潘 虹,等.纤维素酶产生菌的筛选及产酶条件的研究[J].三峡大学学报:自然科学版,2013,35(4):100-102.
[7]徐 昶,龙敏南,邬小兵,等.高产纤维素酶菌株的筛选及产酶条件研究[J].厦门大学学报,2005,44(1):107-111.
[8]王美珠,曹月坤,陈文艺,等.纤维素酶产生菌的诱变与筛选[J].安徽农业科学,2012,40(34):16510-16512.
[9]刘海波,王义强,陈介南.一株高产纤维素酶菌的筛选与鉴定[J].生物学杂志,2008,25(3):16-20.
[10]叶姜瑜.快速识别纤维素分解菌的新方法[J].生物学通报,1997,32(12):34.
[11]TEATHER R M,WOOD P J.Use of congo red polysaccaride interaction in enumeration and characterization of cellulytic bacteria from the bovine rumen[J].Appl Environ Microbial,1982,43(4):148-158.
[12]张瑞萍.纤维素酶的滤纸酶活和CMC 酶活的测定[J].印染助剂,2002,19(5):51-53.
[13]MANDELS M,ANEREOTTI R E.Enzymatic hydrolysis of waste cellulose[J].Biotech Bioeng Symp,1976,16(11):17-21.
[14]刘 慧.现代食品微生物学实验技术[M].北京:中国轻工业出版社,2006.
[15]魏景超.真菌鉴定手册[M].上海:上海科技出版社,1979.
[16]王 卫,王新惠,李再新.甜酒曲中霉菌18S rRNA 序列分析及分子鉴定[J].酿酒科技,2008(11):33-35.

