黄芪甲苷对慢性心衰大鼠心肌纤维化及能量代谢的影响*
唐 斌, 张金国, 谭洪勇, 尉希清
(1山东大学医学院,山东 济南 250012; 2济宁医学院附属医院心内二科,山东 济宁 272092)
黄芪甲苷对慢性心衰大鼠心肌纤维化及能量代谢的影响*
唐 斌1,2, 张金国2△, 谭洪勇2, 尉希清2
(1山东大学医学院,山东 济南 250012;2济宁医学院附属医院心内二科,山东 济宁 272092)
目的: 研究黄芪甲苷对慢性心衰大鼠心肌纤维化的影响,初步探讨其具体机制。方法: 采用腹主动脉缩窄法(AAC)建立大鼠慢性心衰模型,建模成功后随机分为模型组、缬沙坦组及黄芪甲苷组,另建立假手术组。缬沙坦组和黄芪甲苷组分别给予2 mg·kg-1·d-1的缬沙坦及30 mg·kg-1·d-1的黄芪甲苷灌胃,假手术组及模型组给予生理盐水灌胃。8周后收集心脏结构及血流动力学参数,留取心肌染色后观察心肌细胞形态学变化,Western blot和RT-qPCR检测长链脂酰辅酶A脱氢酶(LCAD)、6-磷酸果糖激酶1(PFK1)的蛋白及mRNA表达情况。结果: 与假手术组相比,模型组大鼠的左室质量指数(LVMI)、胶原容积分数(CVF)、左室后壁厚度(LVPWD)、PFK1蛋白及mRNA表达均升高(P<0.05),LCAD蛋白及mRNA表达均下降(P<0.05)。与模型组相比,缬沙坦组及黄芪甲苷组LVMI、CVF、LVPWD、PFK1蛋白及mRNA表达均下降(P<0.05),LCAD蛋白及mRNA表达升高(P<0.05)。结论: 黄芪甲苷可以抑制慢性心衰大鼠心肌纤维化,其机制可能是通过上调LCAD、下调PFK1、纠正能量代谢异常实现的。
能量代谢; 黄芪甲苷; 慢性心力衰竭; 心肌纤维化
慢性心力衰竭(chronic heart failure,CHF)是多种心血管疾病的终末阶段,CHF患者可出现肺循环和体循环淤血的临床表现,如咳嗽、咳痰、呼吸困难、下肢水肿、消化功能下降等,其治疗方式目前以对症处理、改善心功能为主,尚无有效根治措施[1-2]。目前全球大约有4千万CHF患者,截止到2011年仅美国就有570万CHF患者且每年新增病例达到87万[3]。心肌纤维化是CHF发生发展的重要病理变化之一,其主要表现为心肌细胞坏死凋亡、胶原纤维增生、室壁厚度增加、心脏变大[4-5]。抑制心肌纤维化可以明显延缓心衰的发生发展,对改善心衰患者的预后具有重要意义。黄芪甲苷(astragaloside IV,AS-IV)是中药黄芪的提取物,其具有多种药理作用,如改善心功能、调节内皮细胞功能、神经保护、免疫调节等[6-8]。相关研究表明黄芪甲苷可以抑制CHF大鼠心肌纤维化、改善心功能,但其具体机制尚未明确[9]。本文以腹主动脉缩窄法(abdominal aorta constriction,AAC)诱导的CHF大鼠为研究对象,探讨黄芪甲苷对CHF大鼠纤维化心肌的保护作用,并从心肌能量代谢的角度初步探讨其可能机制。
材 料 和 方 法
1 实验动物及试剂
8周龄雄性SD大鼠80只,体重(230±10) g,购自山西医科大学动物中心(许可证号为SCXJ晋20150001);黄芪甲苷购自南京春秋生物工程有限公司;兔抗鼠长链脂酰辅酶A脱氢酶(long-chain acyl-CoA dehydrogenase,LCAD)及6-磷酸果糖激酶1(6-phosphofructokinase-1,PFK1)多克隆抗体分别购自武汉博士德生物工程有限公司及Thermo;兔抗鼠肌动蛋白β-actin抗体及羊抗兔 Ⅱ 抗购自武汉博士德生物工程有限公司;RNA提取及逆转录试剂盒购自天根生化科技有限公司;UltraSYBR Mixture购自康为世纪;Masson 染色试剂盒购自上海歌凡生物科技有限公司。
2 方法
2.1 模型的建立及分组 采用AAC的方式建立CHF模型大鼠60只,6周后通过超声心动图结合大鼠症状判断模型是否建立成功。将建模成功的大鼠通过随机数字表分为CHF模型组、缬沙坦(valsartan, Val)组及AS-IV组。另外建立假手术(sham)组。
2.2 药物干预 模型建立成功后,缬沙坦及黄芪甲苷组大鼠分别给予2 mg·kg-1·d-1和30 mg·kg-1·d-1的缬沙坦及黄芪甲苷灌胃,假手术组及模型组给予相同体积的生理盐水灌胃。连续干预8周后进行下一步实验。
2.3 收集心脏结构及血流动力学参数 干预结束后,各组大鼠进行心脏超声及左心室插管,收集各组大鼠左室舒张末期内径(left ventricular end-diastolic diameter,LVEDD)、左室收缩末期内径(left ventricular end-systolic diameter,LVESD)、左室后壁厚度(left ventricular posterior wall depth,LVPWD)、左心室舒张末期压力(left ventricular end-diastolic pressure,LVEDP)、左心室收缩压(left ventricular end-systolic pressure,LVSP)等参数。
2.4 留取标本进行分子生物学实验 左室插管结束后,留取心肌测定游离脂肪酸(free fatty acid,FFA)及葡萄糖水平。大剂量水合氯醛处死大鼠后留取心脏,分析天平称量左心室及全心重量,计算右室质量指数(right ventricular mass index,RVMI)及左室质量指数(left ventricular mass index,LVMI),部分左心室组织于4%甲醛中固定,部分左心室组织于液氮中速冻后置于-80 ℃冰箱中保存。
2.5 心肌形态学检查 左室心肌经过固定、脱水、包埋、切片的标准程序制成病理切片,然后进行HE及Masson染色,观察心肌细胞肥大程度及胶原纤维增生情况,通过IPP 6.0图像分析系统对Masson染色的切片进行胶原容积分数(collagen volume fraction,CVF)测定[10]。
2.6 实时荧光定量聚合酶链式反应(RT-qPCR)检测LCAD及PFK1的mRNA表达水平 分别提取各组大鼠心肌总RNA,然后将RNA逆转录成cDNA作为RT-qPCR的模板。由上海生工设计并合成LCAD和PFK1的引物序列(表1),以β-actin作为内参照,通过2-ΔΔCt法[11]比较各组大鼠心肌中mRNA的相对含量。

表1 RT-qPCR中各引物序列
2.7 Western blot检测LCAD和PFK1的表达 提取心肌组织中的总蛋白,进行定量及变性后通过Wes-tern blot检测各组大鼠心肌中LCAD及PFK1的表达水平,以β-actin作为内参照,定量计算并比较各组大鼠Western blot条带灰度值。
3 统计学处理
采用SPSS 13.0软件进行统计学分析。本研究所有数据均为计量资料,以均数±标准差(mean±SD)表示,首先通过单因素方差分析(one-way ANOVA)判断各组间差异有无统计学意义,然后采用SNK-q检验进行多重比较,以P<0.05为差异有统计学意义。
结 果
1 各组大鼠基线情况
所有大鼠在实验前均进行心脏超声检查,统计学分析发现各组大鼠基线情况基本一致,未见统计学差异,见表2。
2 实验中大鼠死亡情况
实验期间模型组大鼠死亡2只,余组未见死亡,死亡原因考虑与手术感染、心力衰竭及呼吸衰竭等有关。模型大鼠从AAC术后3周开始逐渐出现呼吸急促、对外界刺激反应淡漠、精神萎靡、食欲不振等症状,黄芪甲苷或缬沙坦干预后大鼠上述症状有所改善,假手术组大鼠未出现上述症状。

表2 各组大鼠基线情况
3 模型评价
大鼠在AAC术后6周行心脏超声检查,结果发现AAC大鼠LVEDD[(5.75±0.22)mm]较假手术组[(5.11±0.32)mm]升高(P<0.05),LVESD[(2.97±0.31)mm]较假手术组[(2.50±0.33)mm]升高(P<0.05),LVPWD[(1.49±0.21)mm]较假手术组[(1.06±0.30)mm]升高(P<0.05),差异均有统计学意义;同时AAC大鼠表现出疲乏、呼吸困难、精神萎靡、食欲降低等症状,基本符合Bishop提出的实验动物心衰标准[12]。
4 干预结束后大鼠心脏结构及血流动力学参数
与假手术组相比,模型组大鼠LVEDP、LVSP、LVEDD、LVESD和LVPWD明显升高,左心室内压最大上升速率(+dp/dtmax)和左心室内压最大下降速率(-dp/dtmax)明显降低,差异具有统计学意义(P<0.01);与模型组相比,缬沙坦组及黄芪甲苷组大鼠LVEDP、LVSP、LVEDD、LVESD和LVPWD出现降低,差异具有统计学意义(P<0.05),+dp/dtmax和-dp/dtmax明显升高,差异具有统计学意义(P<0.01),见图1及表3、4。
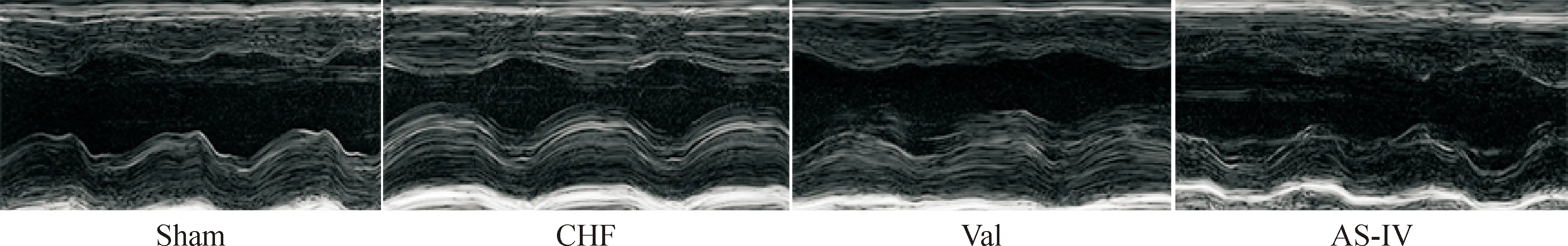
Figure 1.The cardiac structure change after intervention.

表3 各组大鼠干预结束后左室结构及血流动力学变化
**P<0.01vssham group;△△P<0.01vsCHF group.
5 大鼠心脏重构的情况
与假手术组相比,模型组大鼠LVMI及RVMI较之升高(P<0.01),提示模型建立成功;与模型组LVMI及RVMI相比,缬沙坦组仅LVMI降低,而黄芪甲苷组则LVMI及RVMI均明显降低,提示黄芪甲苷可以明显改善CHF大鼠心室重构,见图2。
6 各组大鼠心肌形态学检查

表4 各组大鼠干预结束后左心室结构的变化
**P<0.01vssham group;△P<0.05,△△P<0.01vsCHF group.

Figure 2.The results of LVMI (left ventricular weight/body weight) and RVMI (right ventricular weight/body weight) after intervention. Mean±SD. n=18~20. **P<0.01 vs sham group; △P <0.05, △△ P<0.01 vs CHF group.
HE染色切片示与假手术组相比,模型组大鼠心肌HE染色示心肌细胞肥大,排列紊乱,细胞间质增多,同时有炎细胞浸润;与模型组相比,缬沙坦及黄芪甲苷组大鼠心肌细胞未见明显肥大,排列较为规则,细胞间质未见显著变化;Masson染色切片经过CVF计算后发现,模型组大鼠心肌CVF[(7.89±0.39)%]较假手术组大鼠CVF[(1.83±0.59)%]明显升高(P<0.01),缬沙坦及黄芪甲苷组大鼠心肌CVF[分别为(5.46±0.51)%和(4.25±0.35)%]较模型组CVF明显下降,差异有统计学意义(P<0.01),且黄芪甲苷比缬沙坦有更好的抑制胶原纤维增生的效果,见图3。
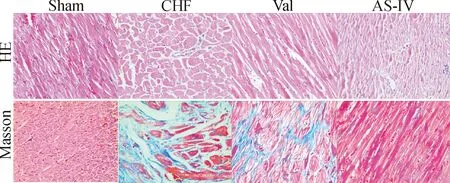
Figure 3.The morphological change (HE staining) and collagen proliferation (Masson’s trichrome staining) of myocardial tissue after intervention (×200). Red indicates cardiac muscle fibers and blue indicates collagen.
7 各组大鼠心肌中LCAD及PFK1 mRNA表达情况
与假手术组相比,模型组LCAD mRNA表达降低,而PFK1 mRNA表达明显升高(P<0.01);与模型组相比,缬沙坦组及黄芪甲苷组LCAD mRNA表达明显升高,而PFK1 mRNA表达明显降低(P<0.05),见图4。

Figure 4.The mRNA expression levels of LCAD and PFK1. Mean±SD. n=3. △P<0.05, △△P<0.01 vs CHF group.
8 各组大鼠心肌组织中LCAD和PFK1蛋白表达情况
经计算Western blot条带灰度值后发现,与假手术组相比,模型组LCAD的表达明显降低而PFK1的表达则明显升高,差异有统计学意义(P<0.01);与模型组相比,缬沙坦组LCAD表达升高(P<0.05),黄芪甲苷组LCAD表达明显升高(P<0.01),缬沙坦组PFK1表达下降(P<0.05),黄芪甲苷组PFK1表达明显下降(P<0.01),差异有统计学意义,见图5。这与mRNA的结果相吻合。
9 干预结束后各组大鼠心肌FFA及葡萄糖水平
各组大鼠干预结束后留取心肌,匀浆后测定FFA及葡萄糖水平,结果表明与假手术组相比,模型组大鼠FFA水平升高而葡萄糖水平降低(P<0.01),与模型组大鼠相比,黄芪甲苷组及缬沙坦组大鼠FFA水平下降而葡萄糖水平升高(P<0.05)。这一结果提示CHF大鼠对FFA的利用率下降而对葡萄糖的利用率上升,黄芪甲苷则可以改善这种异常状态,见图6。
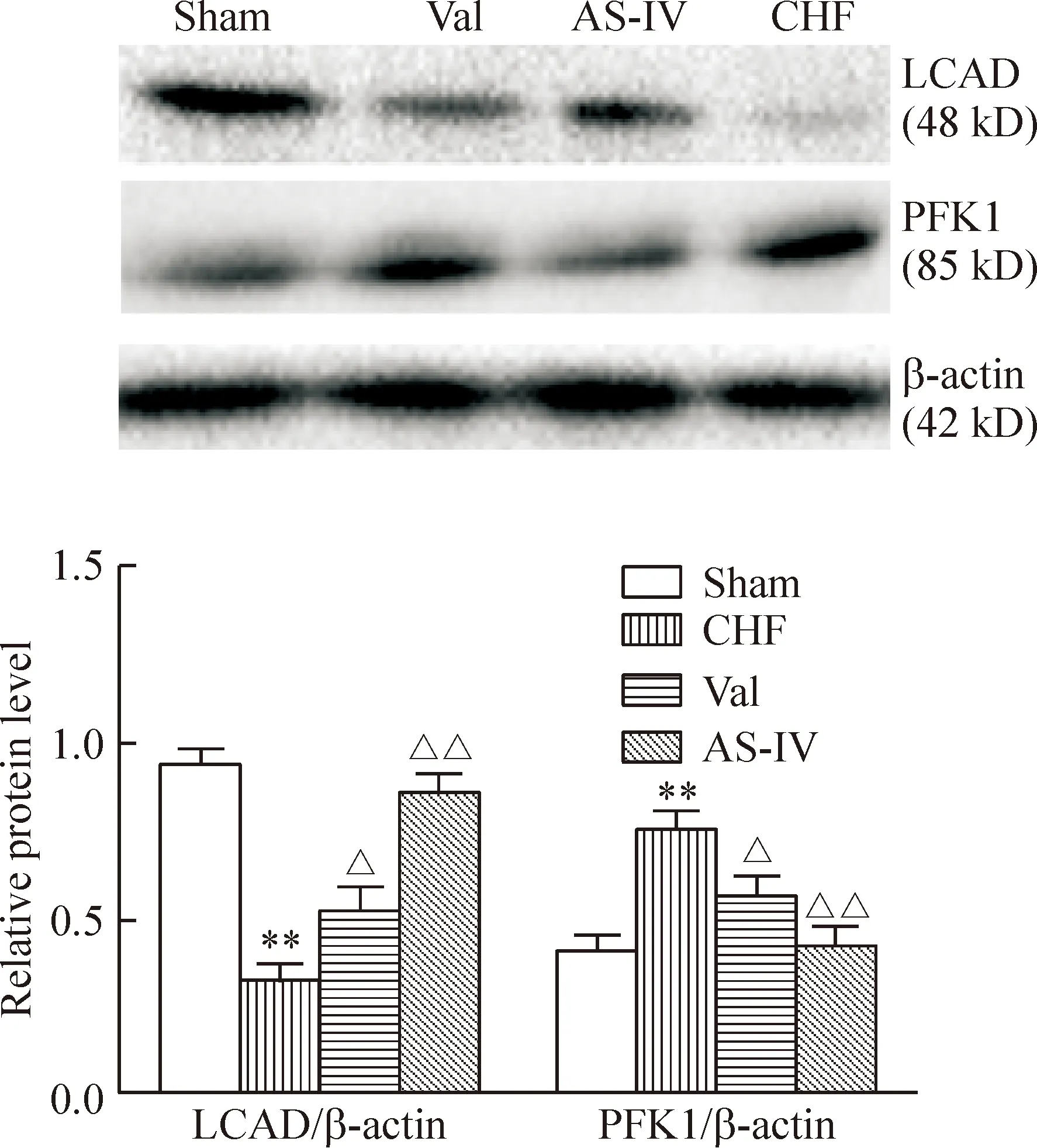
Figure 5.The protein expression levels of LCAD and PFK1.Mean±SD. n=3. **P<0.01 vs sham group; △P<0.05, △△P<0.01 vs CHF group.

Figure 6.The FFA and glucose levels after intervention. Mean±SD. n=3. **P<0.01 vs sham group; △P<0.05, △△P<0.01 vs CHF group.
讨 论
CHF是严重危害人类健康的疾病,患者生活质量及寿命受到严重影响,其发病率呈明显上升趋势[13-15]。有研究表明,CHF患者心肌细胞能量代谢出现异常,由主要依靠脂肪酸氧化供能转变为主要依靠糖酵解供能[16]。本研究通过对大鼠心肌FFA及葡萄糖的测定证实了这一观点。正常的心肌细胞主要以脂肪酸代谢作为能量来源,而在CHF的心肌能量来源主要为糖酵解[17]。LCAD在脂肪酸的β-氧化过程中发挥重要作用,其功能主要是把酯酰辅酶A转变为反Δ2烯酰辅酶A,这也是脂肪酸β-氧化的第一步反应。PFK1是糖酵解最重要的关键酶,它可以催化6-磷酸果糖转变为1,6-二磷酸果糖,这也是糖酵解最重要的限速步骤之一[18]。本研究通过AAC增加大鼠后负荷,以压力超负荷诱导的CHF大鼠模型为研究对象,以黄芪甲苷为干预措施,从心脏结构、血流动力学及心肌形态学变化等方面多角度研究黄芪甲苷对CHF大鼠心脏的影响,并从心肌细胞能量代谢方面初步探讨其可能机制。
缬沙坦具有抑制心室重构的作用,可以改善慢性心衰患者的长期预后,在临床上使用较为广泛,因此本研究以缬沙坦为标准对照,证实了黄芪甲苷可以抑制CHF大鼠的心肌纤维化,改善心功能,其效果并不劣于缬沙坦,这可能与药物剂量有关。本研究通过Western blot及RT-qPCR检测了各组大鼠心肌中LCAD及PFK1的蛋白及mRNA相对含量,其结果表明药物干预后,与脂肪酸代谢相关的酶LCAD蛋白及mRNA含量均升高,与糖酵解相关的酶PFK1蛋白及mRNA含量均降低,且黄芪甲苷这一效应较缬沙坦更为明显,其原因可能与黄芪甲苷抑制心肌纤维化、改善心室重构及心衰的效果较缬沙坦明显有关。这一结果提示黄芪甲苷可以提高CHF大鼠心肌细胞对脂肪酸的代谢能力,降低对糖酵解的过分依赖,从而纠正CHF大鼠心肌细胞的能量代谢异常。为了证实这一观点,本研究对各组大鼠FFA及葡萄糖进行了测定,结果提示黄芪甲苷可以改善CHF大鼠心肌对FFA的利用率,抑制其对葡萄糖的利用。Kato等[19]以盐敏感性大鼠建立的CHF模型为研究对象,发现CHF时心肌对脂肪酸的利用减少,对葡萄糖的利用增加。Ping等[20]以异丙肾上腺素诱导的心衰大鼠模型为研究对象,同样发现在心衰的大鼠心肌中,对脂肪酸的利用减少而对葡萄糖的利用增加。这与本实验结果相符。
由此可见,能量代谢异常在CHF的发生发展过程中起到重要作用,恢复能量代谢异常可以明显减轻CHF的进展,因此纠正能量代谢异常可以作为治疗CHF的研究方向之一[21]。有研究表明,可以激活心肌细胞脂肪酸代谢关键酶的PPARα可以缓解CHF的进展[22],相关PPARα的激活剂如非诺贝特等也可以抑制CHF的进展[23]。
综上所述,黄芪甲苷可以从多方面抑制CHF的发生发展,其具体机制可能与纠正心肌细胞能量代谢异常有关,这一机制的发现为CHF的治疗提供了新的思路,可以作为一个新的方向加以深入研究。
[1] Krittanawong C, Namath A, Lanfear DE, et al. Practical pharmacogenomic approaches to heart failure therapeutics[J]. Curr Treat Options Cardiovasc Med, 2016, 18(10):60.
[2] Xanthakis V, Enserro DM, Larson MG, et al. Prevalence, neurohormonal correlates, and prognosis of heart failure stages in the community[J]. JACC Heart Fail, 2016, 4(10):808-815.
[3] Ziaeian B, Fonarow GC. Epidemiology and aetiology of heart failure[J]. Nat Rev Cardiol, 2016, 13(6):368-378.
[4] Cohn JN, Ferrari R, Sharpe N. Cardiac remodeling—concepts and clinical implications: a consensus paper from an international forum on cardiac remodeling. Behalf of an International Forum on Cardiac Remodeling[J]. J Am Coll Cardiol, 2000,35(3):569-582.
[5] Reddy S, Bernstein D. Molecular mechanisms of right ventricular failure[J]. Circulation, 2015,132(18):1734-1742.
[6] Ren S, Zhang H, Mu Y, et al. Pharmacological effects of Astragaloside IV: a literature review[J]. J Tradit Chin Med, 2013, 33(3):413-416.
[7] Zhao P, Wang Y, Zeng S, et al. Protective effect of astragaloside IV on lipopolysaccharide-induced cardiac dysfunction via downregulation of inflammatory signaling in mice[J]. Immunopharmacol Immunotoxicol, 2015,37(5):428-433.
[8] 谢 靖, 高惠春, 郑 玺. 黄芪甲苷对急性脑出血大鼠神经功能的影响[J]. 中国病理生理杂志, 2016, 32(10):1905-1908.
[9] 蒋洪强, 张金国, 谭洪勇, 等. 黄芪甲苷抑制慢性心力衰竭大鼠心肌纤维化和转化生长因子β1的表达[J]. 新医学, 2016, 47(1):27-33.
[10]Arteaga E, de Araújo AQ, Bernstein M, et al. Prognostic value of the collagen volume fraction in hypertrophic cardiomyopathy[J]. Arq Bras Cardiol, 2009, 92(3): 210-214, 216-220.
[11]Chang S, Chen W, Yang J. Another formula for calcula-ting the gene change rate in real-time RT-PCR[J]. Mol Biol Rep, 2009, 36(8):2165-2168.
[12]Braunwald E, Mock MB, Wastson JT. Congestive heart failure: current research and clinical applications [M]. 1st ed. Philadelphia: Grune & Stratton, 1982:123-126.
[13]Maggioni AP. Epidemiology of heart failure in europe[J]. Heart Fail Clin, 2015,11(4):625-635.
[14]Roger VL. Epidemiology of heart failure[J]. Circ Res, 2013, 113(6):646-659.
[15]Sato N. Epidemiology of heart failure in Asia[J]. Heart Fail Clin, 2015, 11(4):573-539.
[16]Sankaralingam S, Lopaschuk GD. Cardiac energy metabo-lic alterations in pressure overload-induced left and right heart failure (2013 Grover Conference Series)[J]. Pulm Circ, 2015, 5(1):15-28.
[17]de las Fuentes L, Soto PF, Cupps BP, et al. Hypertensive left ventricular hypertrophy is associated with abnormal myocardial fatty acid metabolism and myocardial efficiency[J]. J Nucl Cardiol, 2006, 13(3):369-377.
[18]查锡良, 周春燕, 周爱儒, 等. 生物化学[M]. 第7版. 北京:人民卫生出版社, 2011: 88-92, 126-128.
[19]Kato T, Niizuma S, Inuzuka Y, et al. Analysis of metabolic remodeling in compensated left ventricular hypertrophy and heart failure[J]. Circ Heart Fail, 2010, 3(3):420-430.
[20]Li P, Luo S, Pan C, et al. Modulation of fatty acid metabolism is involved in the alleviation of isoproterenol-induced rat heart failure by fenofibrate[J]. Mol Med Rep, 2015, 12(6):7899-7906.
[21]Fukushima A, Milner K, Gupta A, et al. Myocardial energy substrate metabolism in heart failure: from pathways to therapeutic targets[J]. Curr Pharm Des, 2015,21(25):3654-3664.
[22]Meng RS, Pei Zh, Yin R, et al. Adenosine monophosphate-activated protein kinase inhibits cardiac hypertrophy through reactivating peroxisome proliferator-activated receptor-alpha signaling pathway[J]. Eur J Pharmacol,2009,620(1-3):63-70.
[23]何 燕, 邬江涛, 钟国强, 等. 非诺贝特对压力超负荷中期大鼠心肌能量代谢和心室重构的影响[J].中国循环杂志, 2013, 28(2):140-143.
(责任编辑: 陈妙玲, 罗 森)
Effects of astragaloside IV on myocardial fibrosis and energy metabolism in chronic heart failure rats
TANG Bin1, 2, ZHANG Jin-guo2, TAN Hong-yong2, WEI Xi-qing2
(1SchoolofMedicine,ShandongUniversity,Jinan250012,China;2SecondDepartmentofCardiology,AffiliatedHospitalofJiningMedicalCollege,Jining272092,China.E-mail:cck112000@aliyun.com)
AIM: To observe the effects of astragaloside IV (AS-IV) on myocardial fibrosis in chronic heart failure (CHF) rats and to explore the underlying mechanism preliminarily. METHODS: Chronic heart failure model rats established by abdominal aorta constriction (AAC) were divided into CHF group, valsartan group and AS-IV group. Sham operation group was also established. The rats in valsartan group and AS-IV group received valsartan and AS-IV at 2 and 30 mg·kg-1·d-1, respectively. The rats in sham operation group and CHF group received normal saline. After 8 weeks of treatment, the cardiac structure and the hemodynamic parameters were measured. The morphologic changes of myocardial tissue were observed after staining. The expression of long-chain acyl-CoA dehydrogenase (LCAD) and 6-phosphofructokinase-1 (PFK1) at mRNA and protein levels was determined by RT-qPCR and Western blot. RESULTS: Compared with sham operation group, left ventricular mass index (LVMI), collagen volume fraction (CVF), left ventricular posterior wall depth (LVPWD), and the mRNA and protein of PFK1 in CHF group were increased (P<0.05), while the mRNA and protein levels of LCAD were decreased (P<0.05). Compared with CHF group, the LVMI, CVF, LVPWD, and the mRNA and protein levels of PFK1 in valsartan group and AS-IV group were decreased (P<0.05), while the mRNA and protein levels of LCAD were increased (P<0.05). CONCLUSION: AS-IV inhibits myocardial fibrosis in the CHF rats, the mechanism of which might be associated with up-regulating the expression of LCAD, down-regulating the expression of PFK1 and normalizing the myocardial energy metabolism.
Energy metabolism; Astragaloside IV; Chronic heart failure; Myocardial fibrosis
1000- 4718(2017)03- 0411- 06
2016- 10- 09
2016- 11- 21
山东省高校优秀科研创新团队计划资助项目(鲁教科字[2012]8号); 济宁医学院重点科研计划(No. JY2013KJ015)
△通讯作者 Tel: 13964926108; E-mail: cck112000@aliyun.com
R541; R363
A
10.3969/j.issn.1000- 4718.2017.03.005

