肥胖2型糖尿病患者与大鼠胃旁路术后血清总胆汁酸水平的变化*
何伟丽, 翟贺宁, 许戈阳, 杨景哥, 杨 华, 王存川△
(暨南大学 1附属第一医院普通外科, 2附属第一医院内镜中心, 3医学院生理学系, 广东 广州 510632)
肥胖2型糖尿病患者与大鼠胃旁路术后血清总胆汁酸水平的变化*
何伟丽1, 翟贺宁2△, 许戈阳3, 杨景哥1, 杨 华1, 王存川1△
(暨南大学1附属第一医院普通外科,2附属第一医院内镜中心,3医学院生理学系, 广东 广州 510632)
目的: 观察胃旁路术对肥胖2型糖尿病患者及肥胖2型糖尿病模型大鼠血清总胆汁酸水平的影响,并探讨其分子机制。方法: 收集并分析2011年6月~2016年6月暨南大学附属第一医院肥胖2型糖尿病患者共87例术后血糖恢复情况及血清总胆汁酸水平变化数据。动物实验选用SD大鼠,高脂喂养联合腹腔注射低剂量链脲佐菌素的方法制作肥胖2型糖尿病模型,分为正常对照(普通饲料喂养非手术)组、胃旁路手术组及假手术组,检测手术前后大鼠血糖及血清总胆汁酸水平,HE染色观察大鼠胰腺组织病理变化,ELISA方法检测大鼠肝组织胆固醇7α-羟化酶(CYP7A1)含量,real-time PCR和Western blot分别检测各组大鼠肝组织CYP7A1和小分子异源二聚体伴侣(SHP) mRNA和蛋白水平。结果: 肥胖2型糖尿病患者及模型大鼠胃旁路术后空腹血糖降低,血清总胆汁酸水平升高,肝组织合成胆汁酸经典途径的限速酶CYP7A1含量降低,CYP7A1 mRNA和蛋白表达量均减少,肝组织胆汁酸合成的负性调节因子SHP mRNA和蛋白表达量均增加,与假手术组比较差异显著(P<0.05)。结论: 胃旁路手术后肥胖2型糖尿病患者及模型动物血清总胆汁酸水平升高,且该变化并非因经典途径合成胆汁酸增多。
胃旁路术; 肥胖; 2型糖尿病; 胆汁酸
随着人们饮食结构的变化、生活方式的改变,近年来肥胖2型糖尿病患者逐年增多[1],据统计我国超重或肥胖人口约占总人口的1/4,且超重与肥胖人群2型糖尿病患病率分别为12.8%和18.5%,并且我国2型糖尿病患者中约50%腹型肥胖[2-3]。肥胖2型糖尿病患者药物治疗疗效欠佳[4]。而近年来开展的胃旁路手术不但缓解了肥胖问题,患者高血糖状态也得到长期有效控制,甚至达到治愈标准[5]。临床研究发现胃旁路手术后血清总胆汁酸水平升高[6]。胆汁酸可通过激活法尼酯X受体(farnesoid X receptor, FXR)和G蛋白偶联胆汁酸受体1(G protein-coupled bile acid receptor 1, GPBAR1; 又称TGR5)两大类受体参与糖代谢调节[7]。研究发现低胆汁酸水平更容易导致肥胖和脂代谢紊乱[8]。胆汁酸作为胆汁的主要成分,是以胆固醇为原料在肝细胞内转化而成,胆汁酸从头合成是机体肝组织清除胆固醇的主要方式,肝细胞合成胆汁酸途径有两种:经典途径和替代途径,经典途径占体内胆汁酸合成80%以上,该途径合成的限速酶是胆固醇7α-羟化酶(cholesterol 7α-hydroxylase, CYP7A1),替代途径由甾醇27-羟化酶(sterol 27-hydroxylase, CYP27A1)催化,约占总胆汁酸合成的18%。正常情况下人体每天合成胆汁酸约0.2~0.6 g,粪便排出约占体内胆汁酸的5%,并通过肠-肝循环维持动态平衡[9]。并且当血清中胆汁酸升高后,可以通过上调SHP负反馈调节CYP7A1,从而维持血清中胆汁酸平衡[10]。尽管临床研究发现胃旁路术后血清总胆汁酸水平显著升高,但是其具体分子机制未明。本研究收集并分析2011年6月~2016年6月暨南大学附属第一医院肥胖2型糖尿病患者共87例术后血糖恢复情况及血清总胆汁酸水平变化数据,还通过动物实验研究肥胖2型糖尿病模型大鼠血清总胆汁酸水平的变化,以探讨胃旁路手术后血清总胆汁酸变化的分子调控机制。
材 料 和 方 法
1 临床研究对象
收集2011年6月~2016年6月期间暨南大学附属第一医院收治的胃旁路手术治疗肥胖2型糖尿病患者术前及术后半年以上随访时血清总胆汁酸及血糖等相关数据。
2 实验动物和主要试剂
SPF级21日龄SD大鼠,购自中山大学实验动物中心,许可证号为SCXK(粤)2011-0029,饲养于暨南大学实验管理中心SPF级动物房,动物饲养许可证号为SCXK(粤)2012-0017。普通饲料参照Research Diets公布的AIN-93M,高脂饲料在此基础上添加动物脂肪(猪油)和蔗糖作为高脂饲料,蛋白质、碳水化合物和脂肪能量比值为13.9∶45.9∶40.2,饲料由广州市花都区华东信华实验动物养殖场加工,许可证号为SCXK(粤)2009-0023,经广州市华大辐照中心钴60辐照(辐照剂量25.0 kGy)后送入暨南大学实验管理中心SPF级动物房喂养大鼠。
CYP7A1抗体及试剂盒购自Millipore;SHP抗体购自Santa Cruz;CYP7A1 ELISA试剂盒购自Cloud-Clone;HRP标记的马抗山羊IgG购自Vector Laboratories;兔抗小鼠Ⅱ抗购自DAKO;发光液购自Engreen Biosystem;real-time PCR试剂盒购自Roche;BCA蛋白检测试剂盒购自Thermo。
3 主要方法
3.1 样本采集及临床指标测定 所有研究对象记录术前身高、体重,禁食8 h空腹抽取静脉血,EDTA-K2抗凝管及促凝管测定空腹血糖和糖化血红蛋白,全自动生化分析仪检测血清总胆汁酸水平。
3.2 动物模型制备 参照相关文献[11-12]及预实验方法制作肥胖2型糖尿病大鼠模型,将大鼠随机分为正常对照(normal control,NC)组和高脂饲料组,分别予普通饲料和高脂饲料,饲养8周后,在高脂饲料组称重筛选出体重超过正常对照组平均体重20%的大鼠,腹腔注射链脲佐菌素40 mg/kg,制作肥胖2型糖尿病模型,按照以禁食8 h空腹血糖大于11.2 mmol/L,且随机血糖大于16.7 mmol/L为成模标准[13],将成模大鼠随机分为胃旁路手术(Roux-en-Y gastric bypass,RYGB)组和假手术(sham)组,按照相应干预方法进行干预,分别予术前及术后第10周,大鼠麻醉后眶上静脉采血,离心分离血清进行生化检测,取一部分大鼠肝组织及胰腺组织于4%甲醛溶液中固定,进行常规HE染色,另一部分于-80 ℃冻存进行蛋白及mRNA水平检测。
3.3 各组动物干预方法
3.3.1 NC组 作为正常对照,给予普通饲料,不限制饲料和饮水(检测相关指标时除外)。
3.3.2 RYGB组 根据大鼠胃解剖的特殊性及参考相关文献[14],采取以下方法:在屈氏韧带远端15 cm处离断空肠,近端空肠与远端空肠下15 cm处行端侧吻合;切除胃大弯大部分胃组织使体积剩余约10%,形成管状胃,保留幽门,幽门口处离断,近端与上提的远端空肠吻合,远端缝合形成盲端。
3.3.3 Sham组 分别在胃大弯侧切开2 cm切口并缝合,于幽门口及屈氏韧带下15 cm处离断并吻合,延长麻醉及手术时间,使之与同期进行胃旁路手术的大鼠的手术时间一致。
3.4 动物血糖及糖耐量测定 通过Roche卓越型血糖仪检测大鼠尾静脉采血血糖,术后第10周检测大鼠糖耐量,检测方法为大鼠禁食不禁水过夜,用50%葡萄糖以1 g/kg灌胃,尾静脉采血分别检测灌胃前及灌胃后15、30、60、120、180 min时的血糖。
3.5 动物血清及组织处理 术前及术后大鼠眶上静脉采血,血液凝固后于4 ℃、3 500 r/min离心15 min,分离血清用全自动生化分析仪检测血清总胆汁酸含量。大鼠处死后,迅速取出部分肝组织并置于液氮中,随后在-80 ℃保存备用,取出的部分胰腺组织放入4%甲醛溶液固定,并进一步石蜡固定做病理HE染色观察。
3.6 ELSIA法检测肝组织CYP7A1含量 严格按照CYP7A1试剂盒操作说明进行肝组织CYP7A1检测及建立标准曲线。简述步骤如下:精确称取各组大鼠等量肝组织,进行肝组织匀浆并离心取上清稀释后检测,采用酶标仪450 nm波长测量各孔吸光度(A)值,绘制标准曲线最佳方程式,根据样品浓度及稀释倍数算得各样品实际浓度。
3.7 Real-time PCR检测肝组织中mRNA的水平 使用TRIzol试剂盒分离纯化术后第10周大鼠肝组织的总RNA,分光光度法测定并计算提取的总RNA含量及浓度。参照One Step real-time PCR试剂盒推荐的标准操作步骤,在Chromo 4实时荧光定量PCR仪上进行PCR,内参照使用β-actin,扩增条件为95℃ 10 min;95℃ 10 s,60℃ 30 s,共设置40个循环。根据GenBank数据库中的目的基因cDNA序列,使用Primer Premier 6.0软件设计特异性引物,由上海捷瑞生物工程有限公司合成,β-actin的上游引物序列为5’-CTGAACCCTAAGGCCAACCG-3’,下游引物序列为5’-GACCAGAGGCATACAGGGACAA-3’;SHP的上游引物序列为5’-GAGCCAGGAAGAAACAGGAACAAG-3’,下游引物序列为5’-CGGGGCTTAGAAGTGTGTAGAGAA-3’;CYP7A1的上游引物序列为5’-CGAAGGCATTTGGACACAGAAG-3’,下游引物序列为5’-ACCCAGGCATTGCTCTTTGATT-3’。以β-actin作为内参照,记录各孔Ct值,取3孔平均值作为最终结果,并采用2-ΔΔCt法进行分析。
3.8 Western blot检测肝组织CYP7A1及SHP蛋白表达情况 取100 mg大鼠肝组织,提取各组蛋白,BCA法蛋白定量。定量后调整各蛋白浓度,加上样缓冲液调整浓度为5 g/L后混匀、煮沸变性,约5~10 min。使用12%分离胶分离蛋白,再转移到PVDF膜上,室温下用5%脱脂奶粉封闭1~2 h,相应Ⅰ抗4 ℃孵育过夜,Ⅱ抗室温孵育1 h,洗膜3次后加入ECL发光液,进行曝光并记录条带的吸光度做定量分析。
4 统计学处理
使用SPSS 19.0软件进行数据分析,计量资料以均数±标准差(mean±SD)表示,口服糖耐量数据以曲线下面积进行统计分析,多组间比较用单因素方差分析,各组均数间两两比较采用SNK-q检验,重复测量的数据比较采用重复测量的方差分析,以P<0.05为差异有统计学意义。
结 果
1 临床肥胖2型糖尿病患者血清总胆汁酸术前与术后变化及相关数据
收集2011年6月~2016年6月期间暨南大学附属第一医院收治的胃旁路手术治疗肥胖2型糖尿病患者,排除有数据缺失的病例后共87例,其中男性55例,女性32例,经进一步统计,平均年龄为(35.1±10.2) 岁,收集术前及术后半年以后随访时血糖、糖化血红蛋白、体重及血清总胆汁酸的数据并统计,结果表明胃旁路手术具有较好的减轻体重和控制血糖效果,并且术后半年以上的血清总胆汁酸水平明显升高,见表1。
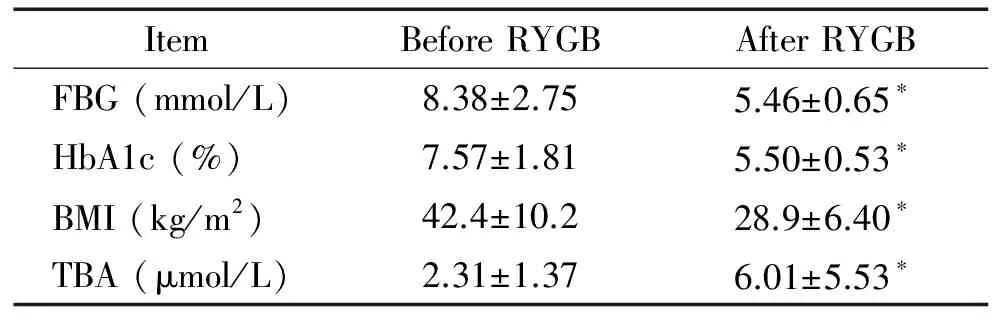
表1 临床肥胖2型糖尿病患者手术前后血糖、糖化血红蛋白、身体质量指数及胆汁酸的变化
*P<0.05vsbefore RYGB.
2 大鼠胃旁路手术前后体重变化
NC组作为普通饲料喂养对照组仅作制作模型时的参照及各种因素干预后除体重外其它指标的对照,术前RYGB组体重与sham组比较无统计学差异,均高于NC组(P<0.05)。Sham组和RYGB组第4、10周体重均比术前下降,第10周时显著低于NC组(P<0.05),RYGB组比sham组体重下降更明显,差异有统计学意义(P<0.05),提示胃旁路手术能够明显降低大鼠体重,见表2。

表2 大鼠胃旁路手术前后体重
*P<0.05vsNC group;#P<0.05vssham group.
3 大鼠胃旁路手术前后空腹血糖变化
与sham组比较,胃旁路术后第4、10周RYGB组大鼠空腹血糖水平明显降低,差异有统计学意义(P<0.05),提示胃旁路手术具有治疗2型糖尿病的作用,见图1。

Figure 1.Fasting blood glucose in rats before and after gastric bypass surgery. Mean±SD. n=8~9. *P<0.05 vs NC group; #P<0.05 vs sham group.
4 大鼠胃旁路手术后糖耐量变化
空腹糖耐量检测显示,RYGB组胃旁路术后第10周大鼠糖耐量曲线接近NC组,曲线下面积明显低于sham组(P<0.05),提示胃旁路手术具有确切的长期改善高血糖状态的作用,见图2。
5 大鼠胃旁路手术后胰腺组织病理学改变
术后第10周胰腺组织病理HE染色,与NC组比较,sham组胰岛萎缩,β细胞凋亡,存留β细胞肥大代偿,部分颗粒脱失,脂质沉积;RYGB组胰岛细胞增生,向外分泌部沿伸,提示胃旁路手术可以促进胰岛细胞的增殖,抑制其凋亡,见图3。
6 大鼠胃旁路手术前后血清总胆汁酸水平变化
与NC组比较,术前RYGB组及sham组血清总胆汁酸水平稍高;术前RYGB组与sham组比较差异无统计学意义;术后第10周,RYGB组较sham组显著升高,差异有统计学意义(P<0.05),见表3。

Figure 2.Glucose tolerance in rats after gastric bypass surgery. AUC: area under the curve. Mean±SD. n=8~9. *P<0.05 vs NC group; #P<0.05 vs sham group.
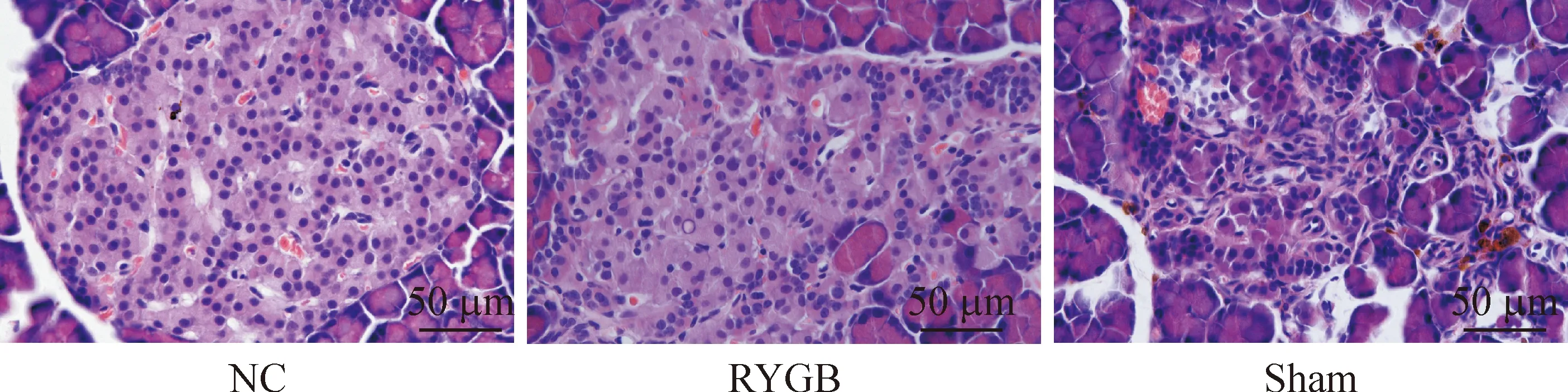
Figure 3.Pathological changes of pancreatic tissue in rats.

表3 大鼠胃旁路手术前后血清总胆汁酸水平
*P<0.05vsNC group;#P<0.05vssham group.
7 双抗夹心ELISA法检测大鼠胃旁路手术后肝组织CYP7A1含量
双抗夹心ELISA法检测结果显示,术后第10周RYGB组与sham组比较肝组织胆汁酸合成限速酶CYP7A1含量明显降低。RYGB术后胆汁酸合成应该是减少,然而血清胆汁酸水平却较高,提示有其它途径导致胃旁路术后血胆汁酸水平升高,见表4。

表4 大鼠胃旁路手术后肝组织CYP7A1含量
*P<0.05vsNC group;#P<0.05vssham group.
8 大鼠胃旁路手术后肝组织CYP7A1和SHP mRNA相对水平
Real-time PCR结果显示,RYGB组CYP7A1 mRNA水平较sham组显著降低;RYGB组SHP mRNA水平较sham组显著增高(P<0.05),提示胃旁路手术后肝组织胆汁酸合成经典途径的限速酶CYP7A1受抑制,且负反馈调节因子SHP激活,见图4。

Figure 4.The relative expression levels of CYP7A1 mRNA and SHP mRNA in rat liver tissue after gastric bypass surgery. Mean±SD. n=8~9. *P<0.05 vs NC group; #P<0.05 vs sham group.
9 大鼠胃旁路手术后肝组织CYP7A1和SHP蛋白水平
Western blot结果显示,RYGB组术后肝组织CYP7A1蛋白表达低于sham组,差异有统计学意义,见图5; RYGB组术后肝组织SHP蛋白表达高于sham组,差异有统计学意义(P<0.05),见图6,进一步提示胃旁路手术后肝组织胆汁酸合成经典途径的限速酶CYP7A1受抑制,且负反馈调节因子SHP激活。

Figure 5.The expression level of CYP7A1 protein in rat liver tissue after gastric bypass surgery. Mean±SD. n=8~9. *P<0.05 vs NC group; #P<0.05 vs sham group.

Figure 6.The expression level of SHP protein in rat liver tissue after gastric bypass surgery. Mean±SD. n=8~9. *P<0.05 vs NC group; #P<0.05 vs sham group.
讨 论
大量研究表明,胃旁路手术后肥胖2型糖尿病患者的体重和高血糖状态持续改善,胃旁路术后食物摄入量减少,体重明显降低,高血糖状态逐步改善,多数患者可以停用抗血糖药物,长期疗效确切[15]。我们的动物实验显示术后第10周大鼠体重明显降低,空腹血糖及口服糖耐量接近或达到正常水平,提供了进一步的依据。在临床胃旁路手术后,血清总胆汁酸水平明显升高是近些年关注的热点[16-17],我们的临床回顾性研究也证实了这种结果。良好的动物模型在疾病的研究中具有重要作用,本课题研究采用联合高脂饲料和低剂量链脲佐菌素的方法,制作肥胖2型糖尿病动物模型,该方法造价便宜,可操作性强,一定程度上符合人类糖尿病的生化和病理特征,最为常用[18]。
从本临床病例回顾研究表明,胃旁路手术后空腹血糖和糖化血红蛋白较术前明显降低,指标多恢复正常范围,提示胃旁路手术具有较好的减轻体重和缓解2型糖尿病的作用。动物实验研究也表明,胃旁路手术后大鼠体重明显降低,低于sham组和NC组,RYGB组术后胰腺组织病理结果表明胰岛细胞增殖,向外分泌部沿伸,改变了向萎缩、凋亡的方向发展,促进胰岛素的分泌,进而调控空腹血糖及糖耐量,起到良好的治疗2型糖尿病的效果,与临床结论一致[19]。
CYP7A1作为胆汁酸合成的经典途径的限速酶,在胆固醇的稳态和胆汁酸的平衡中起重要作用,其基因表达受反馈和负反馈机制以及复杂的转录级联网络的严格控制,胆固醇可以通过反馈调节直接激活CYP7A1的表达,促进胆固醇向胆汁酸的转化;胆汁酸的负反馈调节有多条通路,主要是通过激活FXR,诱导靶基因SHP表达,SHP与LRH-1和LXRα结合从而抑制CYP7A1的表达[9]。SHP作为FXR的靶基因,是孤儿受体超家族的一员,但与其它核受体相比缺少DNA结合结构域,因此也是一个非典型的核受体,SHP在FXR负反馈调节CYP7A1中起到重要的中介作用[10]。
本研究中临床病例及模型大鼠胃旁路术后血总胆汁酸水平显著升高,大鼠肝组织SHP mRNA水平升高,蛋白表达增加,提示胆汁酸负反馈通路可能被激活,抑制了胆汁酸合成的限速酶CYP7A1的表达,本研究结果也显示肝组织CYP7A1活性下降,mRNA水平降低,蛋白表达下降,提示正是这种负反馈机制被激活的结果,胆汁酸的经典合成途径受抑制,但是血中总胆汁酸水平却显著升高,有可能因为胃旁路手术改变了胆汁酸的肠-肝循环,重吸收增加,排泄持续减少有关[20]。由于胃旁路手术即在保留小部分胃底及胃体小弯的方法制作胃小囊,胃小囊与空肠以Roux-en-Y形式吻合,大部分胃、十二指肠全部和近端空肠旷置,食物绕过该部分直接在下段空肠与排入肠道的胆汁汇合又迅速到达回肠,胆汁与食糜混合尚未充分即被大量重吸收,从而增加了血胆汁酸水平[21],然而这种胆汁酸水平的增加从临床数据来看并不是不受限制的完全病理状态的增加,是在逐渐增加到一定范围后通过负反馈作用对经典合成途径起到一定抑制,从而使人体总胆汁酸水平达到一个相对高的水平,而具体机制有待进一步研究。血中总胆汁酸水平较高更有利于内源性配体激活胆汁酸相关核受体和膜受体家族相关信号通路,进而调节体内糖脂代谢[22],维持糖脂代谢平衡。本研究中sham组大鼠血清总胆汁酸含量较NC组高,有统计学意义,是由于肥胖2型糖尿病导致肝脏脂质沉积,脂肪和胆固醇沉积肝细胞促进了胆固醇向胆汁酸转化的调节,并且已有实验和临床数据证实[23-24]。但本研究中胃旁路术后血清胆汁酸增加与其比较更明显,且具体机制不同。
我们的这一研究进一步证实了临床肥胖2型糖尿病患者术后半年以上及肥胖2型糖尿病大鼠术后血清总胆汁酸水平升高,其分子机制并非胆汁酸的经典合成途径增加,而是有其它途径,比如有可能胆汁酸的肠-肝循环过程中重吸收增加等最终导致血清总胆汁酸水平增加。我们这一发现为研究胆汁酸在胃旁路手术治疗肥胖合并糖尿病中作用提供了依据,其分子机制有待进一步深入研究。
[1] Franks PW, McCarthy MI. Exposing the exposures responsible for type 2 diabetes and obesity[J]. Science, 2016, 354(6308):69-73.
[2] Yang W, Lu J, Weng J, et al. Prevalence of diabetes among men and women in China[J]. N Engl J Med, 2010, 362(12):1090-1101.
[3] 武阳丰, 马冠生, 胡永华, 等. 中国居民的超重和肥胖流行现状[J]. 中华预防医学杂志, 2005, 39(5):316-320.
[4] Garber AJ. Obesity and type 2 diabetes: which patients are at risk?[J]. Diabetes Obes Metab, 2012, 14(5):399-408.
[5] Schauer PR, Kashyap SR, Wolski K, et al. Bariatric surgery versus intensive medical therapy in obese patients with diabetes[J]. N Engl J Med, 2012, 366(17):1567-1576.
[6] Patti ME, Houten SM, Bianco AC, et al. Serum bile acids are higher in humans with prior gastric bypass: potential contribution to improved glucose and lipid metabolism[J]. Obesity, 2009, 17(9):1671-1677.
[7] Li TG, Chiang JY. Bile acids as metabolic regulators[J]. Curr Opin Gastroenterol, 2015, 31(2):159-165.
[8] Watanabe M, Horai Y, Houten SM, et al. Lowering bile acid pool size with a synthetic farnesoid X receptor (FXR) agonist induces obesity and diabetes through reduced energy expenditure[J]. J Biol Chem, 2011, 286(30):26913-26920.
[9] Goodwin B, Jones SA, Price RR, et al. A regulatory cascade of the nuclear receptors FXR, SHP-1, and LRH-1 represses bile acid biosynthesis[J]. Mol Cell, 2000, 6(3):517-526.
[10]Malerod L, Sporstol M, Juvet LK, et al. Bile acids reduce SR-BI expression in hepatocytes by a pathway involving FXR/RXR, SHP, and LRH-1[J]. Biochem Biophys Res Commun, 2005, 336(4):1096-1105.
[11]Cai S, Huo TG, Xu JH, et al. Effect of mitiglinide on streptozotocin-induced experimental type 2 diabetic rats: a urinary metabonomics study based on ultra-performance liquid chromatography-tandem mass spectrometry[J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2009, 877(29):3619-3624.
[12]He B, Piao DX, Yu C, et al. Amelioration in hepatic insulin sensitivity by reduced hepatic lipid accumulation at short-term after Roux-en-Y gastric bypass surgery in type 2 diabetic rats[J]. Obes Surg, 2013, 23(12):2033-2041.
[13]赵乐萍, 金雷钢, 施立华, 等.CXCL16缺失缓解 STZ诱导的糖尿病小鼠的肾脏病变[J].中国病理生理杂志, 2016, 32(2):327-332.
[14]Stylopoulos N, Hoppin AG, Kaplan LM. Roux-en-Y gastric bypass enhances energy expenditure and extends lifespan in diet-induced obese rats[J]. Obesity, 2009, 17(10):1839-1847.
[15]Cummings DE, Arterburn DE, Westbrook EO, et al. Gastric bypass surgery vs intensive lifestyle and medical intervention for type 2 diabetes: the CROSSROADS randomised controlled trial[J]. Diabetologia, 2016, 59(5):945-953.
[16]Kohli R, Bradley D, Setchell KD, et al. Weight loss induced by Roux-en-Y gastric bypass but not laparoscopic adjustable gastric banding increases circulating bile acids[J]. J Clin Endocrinol Metab, 2013, 98(4):E708-E712.
[17]Sachdev S, Wang Q, Billington C, et al. FGF 19 and bile acids increase following Roux-en-Y gastric bypass but not after medical management in patients with type 2 diabetes[J]. Obes Surg, 2016, 26(5):957-965.
[18]King AJ. The use of animal models in diabetes research[J]. Br J Pharmacol, 2012, 166(3):877-894.
[19]Esposito K, Maiorino MI, Petrizzo M, et al. Remission of type 2 diabetes: is bariatric surgery ready for prime time?[J]. Endocrine, 2015, 48(2):417-421.
[20]Goncalves D, Barataud A, De Vadder F, et al. Bile routing modification reproduces key features of gastric bypass in rat[J]. Ann Surg, 2015, 262(6):1006-1015.
[21]颜 勇, 李旭忠, 胡 承, 等. 胆汁酸在减重手术缓解2型糖尿病中的作用[J].中华糖尿病杂志, 2015, 7(7):454-457.
[22]徐文静, 范静慧, 杜从阔, 等. 核受体FXR硫氢化修饰后缓解非酒精性脂肪肝[J].中国病理生理杂志, 2016, 32(8):1535-1536.
[23]王晓凌, 崔海平, 赵瑞巧, 等. 2型糖尿病大鼠肝胆汁酸代谢的变化[J].中国老年学杂志, 2013, 33(16):3907-3909.
[24]Vincent RP, Omar S, Ghozlan S, et al. Higher circulating bile acid concentrations in obese patients with type 2 diabetes[J]. Ann Clin Biochem, 2013, 50(4):360-364.
(责任编辑: 卢 萍, 罗 森)
Effects of gastric bypass surgery on serum total bile acid in obese diabetic patients and rats
HE Wei-li1, ZHAI He-ning2, XU Ge-yang3, YANG Jing-ge1, YANG Hua1, WANG Cun-chuan1
(1DepartmentofGeneralSurgery,TheFirstAffiliatedHospital,2DepartmentofEndoscopyCenter,TheFirstAffiliatedHospital,3DepartmentofPhysiology,SchoolofMedicine,JinanUniversity,Guangzhou510632,China.E-mail:yzhn@foxmail.com;twcc@jnu.edu.cn)
AIM: To observe the effects of gastric bypass surgery on the levels of serum total bile acid in the obese diabetic patients and rats. METHODS: Anthropometric data of obese diabetic patients with gastric bypass surgery from June 2011 to June 2016 were collected in the First Affiliated Hospital of Jinan University. Obese diabetic animal mo-del was established in SD rats by high-fat diet feeding combined with intraperitoneal injection of low-dose streptozocin. Gastric bypass surgery or sham operation was performed on the rats with successful modeling. The levels of serum total bile acid were measured by a Hitachi automatic biochemistry analyzer, and the content of hepatic cholesterol 7α-hydroxylase (CYP7A1) was detected by ELISA. The expression of hepatic CYP7A1 and small heterodimer partner (SHP) at mRNA and protein levels was determined by real-time PCR and Western blot, respectively. RESULTS: The serum levels of total bile acid were significantly increased in postoperative obese diabetic patients and rats as compared with control groups. Gastric bypass surgery inhibited rat hepatic CYP7A1 content, mRNA level and protein level, but stimulated hepatic SHP expression. CONCLUSION: Total serum bile acid increases in both patients and rats after gastric bypass surgery by non-typical bile acid synthesis pathway.
Gastric bypass; Obesity; Type 2 diabetes mellitus; Bile acid
1000- 4718(2017)03- 0462- 07
2017- 01- 05
2017- 01- 18
国家自然科学基金资助项目(No. 31401001);广东省自然科学基金资助项目(No. 2016A030310086);广州市科技计划(No. 2014Y2-00097); 中央高校基本科研业务费专项资金资助项目(No. 21615333);暨南大学第一临床医学院科研培育专项基金资助项目(No. 2013104)
△通讯作者 翟贺宁 Tel: 020-38688447; E-mail: yzhn@foxmail.com; 王存川 Tel: 020-38688685; E-mail: twcc@jnu.edu.cn
R363; R587.1
A
10.3969/j.issn.1000- 4718.2017.03.013

