PI3K/CTGF信号通路在TGF-β1诱导A549细胞表达collagen I过程中的作用*
应赵建, 黄晓敏, 余垭妮, 林晓晓, 陈 晶, 李文君, 董 年, 陈成水
(温州医科大学附属第一医院呼吸与危重症医学科,浙江 温州 325000)
PI3K/CTGF信号通路在TGF-β1诱导A549细胞表达collagen I过程中的作用*
应赵建, 黄晓敏▲, 余垭妮, 林晓晓, 陈 晶, 李文君, 董 年△, 陈成水△
(温州医科大学附属第一医院呼吸与危重症医学科,浙江 温州 325000)
目的: 研究磷脂酰肌醇3-激酶/结缔组织生长因子(PI3K/CTGF) 信号通路在转化生长因子β1(TGF-β1)诱导人肺腺癌A549细胞表达I型胶原蛋白(collagen I)过程中的分子机制。方法: 体外培养A549细胞,予TGF-β1刺激,观察CTGF和collagen I的mRNA和蛋白表达及PI3K信号通路的活化;PI3K抑制剂LY294002预先处理A549细胞后,观察TGF-β1刺激下CTGF和collagen I mRNA和蛋白表达的变化;CTGF特异性siRNA干扰A549细胞中CTGF的表达后,观察TGF-β1刺激下collagen I mRNA和蛋白表达的变化和PI3K信号通路的活化。结果: TGF-β1可以诱导A549细胞中CTGF和collagen I的mRNA和蛋白表达以及PI3K信号通路的活化;PI3K特异性抑制剂LY294002可以部分逆转TGF-β1诱导的A549细胞中CTGF和Collagen I mRNA和蛋白表达的升高。干扰CTGF可以降低TGF-β1诱导的A549细胞collagen I mRNA和蛋白表达,而不影响PI3K信号通路的活化。结论: CTGF是TGF-β1/PI3K信号通路调控的即刻早期反应效应蛋白,参与了TGF-β1诱导的A549细胞中collagen I表达。
转化生长因子β1; I型胶原蛋白; 结缔组织生长因子
细胞外基质(extracellular matrix,ECM)代谢异常是肿瘤的重要特征之一,肺癌是高度纤维化的肿瘤,以I型胶原蛋白(collagen I)为代表的ECM过度沉积在肺癌的发生发展中扮演了重要角色[1-2]。既往认为肿瘤间质中成纤维细胞的激活及表型转化是ECM沉积的中心环节,目前认识到肺癌细胞在转化生长因子β1(transforming growth factor β1,TGF-β1)诱导下可以向成纤维细胞等间质细胞分化从而参与ECM的异常沉积[3-4]。结缔组织生长因子(connective tissue growth factor,CTGF)是新近发现的早期即刻反应蛋白,是TGF-β1调控的效应蛋白,可以协同TGF-β1促进细胞表型转化和ECM沉积[5],然而关于其在肺癌ECM代谢异常中的确切机制尚不清楚。结合我们之前的研究发现磷脂酰肌醇3-激酶(phosphatidyl-inositol 3-kinase,PI3K)信号通路的活化与上皮-间质转化和ECM的沉积密切相关[6-7],本研究拟进一步探讨PI3K信号通路和效应蛋白CTGF在TGF-β1诱导人肺腺癌A549细胞 collagen I表达中的潜在角色,阐明TGF-β1/PI3K/CTGF信号通路在A549细胞ECM合成的调控机制。
材 料 和 方 法
1 细胞
人肺腺癌细胞A549细胞购于上海中科院细胞库。
2 主要试剂
RPMI-1640培养基和胎牛血清购自Gibco;人重组TGF-β1购自PeproTech;PI3K抑制剂LY294002购自Biovision;BCA蛋白浓度测定试剂盒、预染蛋白Marker和ECL发光液购自Thermo;兔抗人p-Akt和Akt单抗购自CST;兔抗人CTGF和collagen I单抗购自Abcam;TRIzol购自Invitrogen;cDNA逆转录试剂盒购自TaKaRa;其它生化试剂购自上海生工生物工程公司。Real-time PCR引物由上海生工生物工程公司设计合成,见表1;siRNA-CTGF由上海吉凯基因技术有限公司设计合成,见表2。

表1 Real-time PCR引物序列

表2 CTGF干扰RNA序列
3 方法
3.1 细胞培养 A549细胞株使用包含10%胎牛血清和1%双抗的RPMI-1640培养基于37 ℃、5% CO2恒温培养箱中培养。
3.2 细胞干预 取生长状态良好处于对数生长期的细胞,接种于12孔板(抽提RNA)或6孔板(抽提蛋白),待细胞长至孔板面积80%时,进行分组干预,每个分组设立3个复孔,每个实验重复3次。
3.3 Real-time PCR实验 按照TRIzol说明书提取细胞总RNA,分光光度法测定计算提取的总RNA含量及浓度。取总RNA 2 μg反转录为cDNA,再以适量cDNA为模板进行real-time PCR实验。PCR反应条件为95 ℃10 min; 95 ℃ 30 s, 60 ℃ 30 s, 72 ℃ 30 s,共40个循环。结果以GAPDH为内参照,对目的基因进行相对定量。
3.4 Western blot实验 收集各组细胞,提取总蛋白,BCA法测定蛋白浓度。每组取30 μg蛋白进行凝胶电泳,湿转至PVDF膜,5%脱脂牛奶室温下封闭2 h, Ⅰ抗(1∶1 000)4 ℃孵育过夜,TBST缓冲液洗膜10 min、3次,Ⅱ抗(1∶5 000)室温孵育1.5 h,再用TBST缓冲液洗膜10 min×3次,ECL化学发光法显影。以β-actin为内参照,结果以各蛋白与β-actin灰度值比值表示。
3.5 siRNA转染 siRNA转染方法按照Lipofectamine 2000产品说明书进行,提前1 d将1×105个细胞接种于24孔板,次日按照24孔板每孔取2 μL CTGF-siRNA、1 μL Lipofectamine 2000和50 μL Opti-MEM I的比例配制CTGF-siRNA-转染试剂混合液,将siRNA-转染试剂混合液添加入细胞培养板中,置于37 ℃、5% CO2的培养箱中培养,6 h后更换为含10%胎牛血清的RPMI-1640培养基。
4 统计学处理
使用SPSS 20.0统计软件进行统计分析。数据均以均数±标准差(mean±SD),多组间比较采用单因素方差分析(one-way ANOVA),组间两两比较采用Bonferroni校正的t检验,以P<0.05为差异有统计学意义。
结 果
1 TGF-β1诱导collagen I表达升高
选取不同浓度的TGF-β1刺激A549细胞不同时间, real-time qPCR和Western blot法检测collagen I的mRNA和蛋白的表达。结果显示,TGF-β1可以诱导A549细胞中collagen I的表达,呈现浓度和时间依赖性升高,其中5 μg/L TGF-β1是最适刺激浓度,TGF-β1刺激48 h collagen I升高最为显著,差异有统计学意义(P<0.05),见图1。

Figure 1.The expression of collagen I induced by TGF-β1. A: the mRNA expression of collagen I induced by TGF-β1 at different doses for the indicated time; B: the protein level of collagen I changed by TGF-β1 at different doses for 48 h; C: the protein level of collagen I changed by TGF-β1 at 5 μg/L for the indicated time. Mean±SD. n=3. *P<0.05, **P<0.01 vs 0 h; #P<0.05, ##P<0.01 vs 0 μg/L.
2 TGF-β1诱导CTGF的即刻早期表达
选取5 μg/L TGF-β1刺激A549细胞不同时间,结果显示TGF-β1可以诱导A549细胞中CTGF即刻早期表达,mRNA和蛋白在TGF-β1刺激3 h时即发生升高,TGF-β1刺激6 h时CTGF蛋白表达最高,差异有统计学意义(P<0.05),见图2。

Figure 2.The expression of CTGF induced by TGF-β1. A: the mRNA expression of CTGF induced by TGF-β1 at different doses for the indicated time; B: the protein level of CTGF changed by TGF-β1 at different doses for 48 h; C: the protein level of CTGF changed by TGF-β1 at 5 μg/L for the indicated time. Mean±SD. n=3. *P<0.05, **P<0.01 vs 0 h group; #P<0.05, ##P<0.01 vs 0 μg/L.
3 TGF-β1活化PI3K信号通路,PI3K抑制剂逆转TGF-β1诱导的CTGF和collagen I表达升高
选取不同浓度的TGF-β1刺激A549细胞不同时间,用Western blot法检测,可见TGF-β1可以激活PI3K信号通路,呈现浓度和时间依赖性。使用不同浓度的PI3K抑制剂LY294002预先处理A549细胞,再使用5 μg/L TGF-β1刺激48 h,结果可见PI3K抑制剂 LY294002可以逆转TGF-β1诱导的A549细胞中CTGF和collagen I表达,呈现剂量依赖性,差异有统计学意义(P<0.05),见图3。
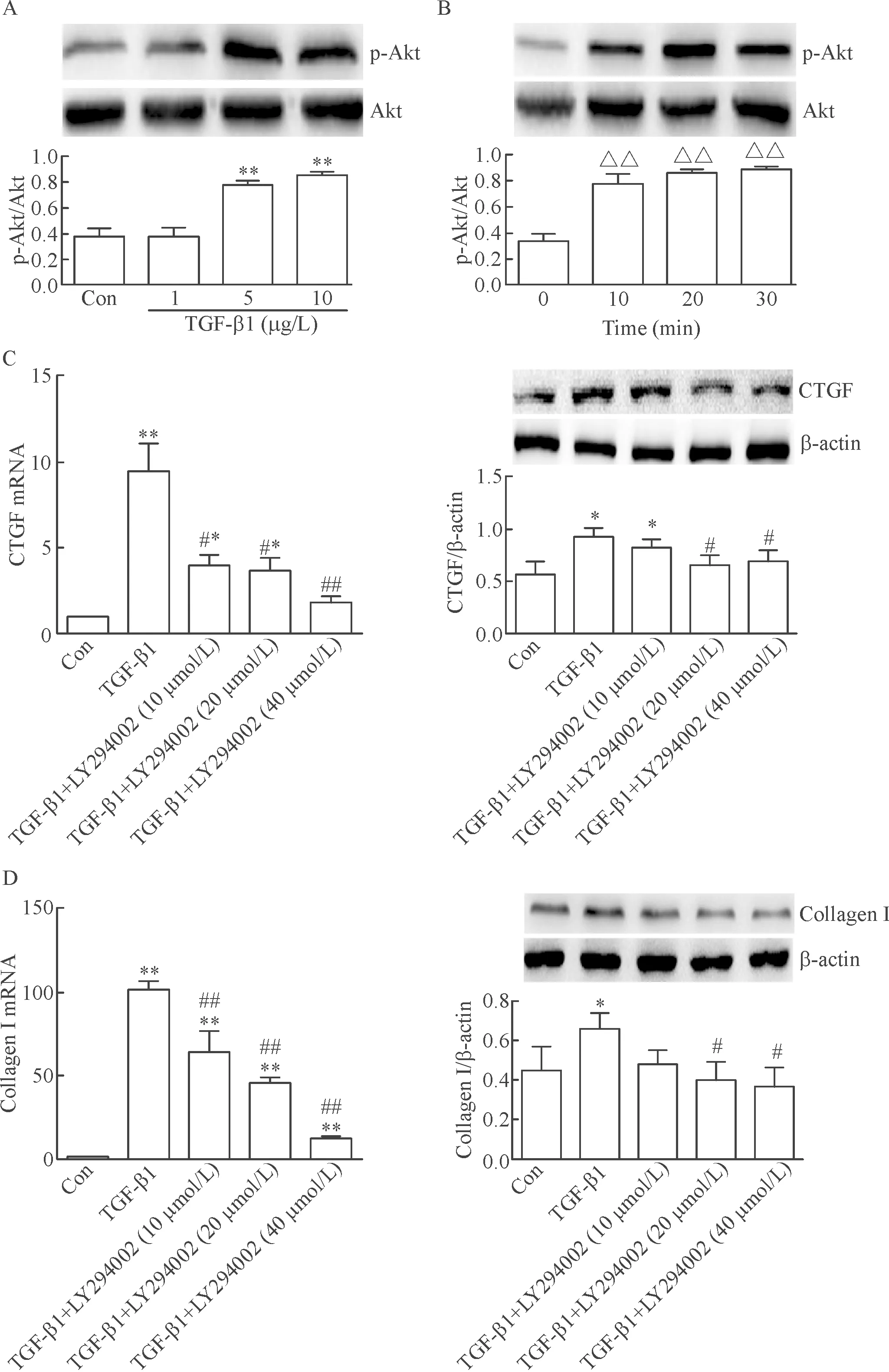
Figure 3.TGF-β1 induced PI3K/Akt signaling pathway activation, and PI3K inhibitor reversed the expression of CTGF and collagen I induced by TGF-β. A: the protein levels of Akt and p-Akt changed by with the vehicle or TGF-β1 at different doses for 10 min; B: the protein levels of Akt and p-Akt changed by TGF-β1 at dose of 5 μg/L for different time; C: the mRNA and protein levels of CTGF were measured after incubation with PI3K inhibitor LY294002 at different doses and TGF-β1 (5 μg/L) for 6 h; D: the mRNA and protein levels of collagen I were measured after incubation with PI3K inhibitor LY294002 at different doses and TGF-β1 (5 μg/L) for 48 h. Mean±SD. n=3. *P<0.05, **P<0.01 vs Con (control) group; △△P<0.01 vs 0 min group; #P<0.05, ##P<0.01 vs TGF-β1 group.
4 siRNA-CTGF-2是最佳干扰序列并影响collagen I的基础表达
4条不同的干扰序列siRNA-CTGF转染A549细胞24 h后,用real-time qPCR和Western blot分别检测CTGF的mRNA和蛋白表达,结果可见siRNA-CTGF-2干扰A549细胞中CTGF表达的效果最佳,见图4A。与对照组及siRNA阴性对照组相比,siRNA-CTGF-2组的collagen I基础表达降低,差异具有统计学意义(P<0.05),见图4B。
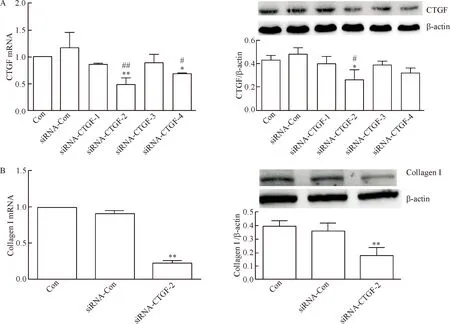
Figure 4.siRNA-CTGF-2 was the best interference sequence and impaired the basal collagen I synthesis. A: the mRNA and protein expression of CTGF modified by different siRNAs; B: the mRNA and protein expression of collagen I were measured after CTGF interference by siRNA-CTGF2. Mean±SD. n=3. *P<0.05,**P<0.01 vs Con (control) group; #P<0.05, ##P<0.01 vs siRNA-Con group.
5 干扰CTGF表达影响TGF-β1诱导的collagen I表达升高而不影响PI3K信号通路的活化
siRNA-CTGF-2转染24 h干扰A549细胞中CTGF的表达,再用5 μg/L TGF-β1刺激10 min,结果显示siRNA-CTGF-2转染并不影响TGF-β1活化PI3K信号通路,差异无统计学显著性,见图5A。然而,siRNA-CTGF-2转染明显降低TGF-β1诱导的collagen I表达升高,差异有统计学意义(P<0.05),见图5B。

Figure 5.Interference of CTGF expression impaired TGF-β1-induced collagen I synthesis but not PI3K/AKT signaling pathway activation. A: the protein levels of Akt and p-Akt changed by the vehicle or TGF-β1 at dose of 5 μg/L for 10 min after CTGF interference; B: TGF-β1-induced mRNA and protein expression of collagen I was measured after CTGF interference. Mean±SD. n=3. *P<0.05, **P<0.01 vs Con (control) or siRNA-Con group; ##P<0.01 vs siRNA-CTGF-2 group; △P<0.05, △△P<0.01 vs TGF-β1+siRNA-Con group.
讨 论
既往认为肿瘤间质中成纤维细胞的激活及表型转化是肿瘤胞外基质代谢异常的关键[8],目前逐渐认识到肿瘤细胞可以发生间质转化不仅扮演了ECM沉积启动细胞,释放的TGF-β1等转化生长因子参与肿瘤间质中成纤维细胞的活化,更扮演了继发受体的角色,其分泌的炎症因子可以以自分泌或旁分泌的方式作用于自身[9]。TGF-β1是关键的促纤维化因子,主要激活经典的Smad通路和非经典Smad通路共同介导ECM中胶原蛋白(collagen)和纤连蛋白(fibronectin)等的沉积[10-11]。近来的研究揭示非经典Smad通路PI3K的过度活化参与了肺癌的发生发展,我们之前的实验发现PI3K抑制剂可以逆转慢性气道重塑中胶原的沉积,然而关于PI3K如何参与肺癌胞外机制代谢异常研究甚少。CTGF属于早期即刻反应蛋白,影响成纤维细胞的活性,在纤维化的发生发展中发挥重要作用[12-13]。作为TGF-β1的调控蛋白,研究报道TGF-β1主要是经Smad通路调控CTGF,然而有报道称哺乳动物雷帕霉素靶蛋白抑制剂可以反向激活PI3K通路促进肺癌细胞中CTGF的过度表达,协同TGF-β1参与了ECM沉积[14-15]。本研究旨在探究PI3K信号通路和效应蛋白CTGF在TGF-β1诱导A549细胞的collagen I表达中的的潜在角色,为未来针对肺癌ECM代谢异常揭示潜在的干预靶点。
我们研究发现TGF-β1可以诱导A549细胞的collagen I的表达升高,与之前的研究报道类似,除此之外,TGF-β1可以诱导CTGF的早期表达和PI3K信号通路的活化。使用PI3K抑制剂可以逆转TGF-β1诱导的CTGF的早期表达和collagen I的表达升高,提示我们PI3K信号通路和经典的Smad通路共同参与了TGF-β1调控的CTGF早期表达。我们进一步经siRNA-CTGF特异性降低A549细胞中CTGF的表达,发现A549细胞的collagen I基础表达及TGF-β1诱导的collagen I表达同时发生了降低,而不影响TGF-β1活化PI3K信号通路。
总而言之,我们研究发现TGF-β1经活化PI3K信号通路调控A549细胞中collagen I的表达升高,CTGF是TGF-β1/PI3K信号通路潜在的调控蛋白,协同TGF-β1诱导A549细胞中collagen I的表达升高,初步阐述了TGF-β1/PI3K/CTGF信号通路在调控A549细胞collagen I表达中的分子机制。CTGF和PI3K信号通路可能是未来针对肺癌ECM过度沉积的潜在干预靶点。
[1] Hanahan D, Weinberg RA. Hallmarks of cancer: the next generation[J]. Cell, 2011, 144(5): 646-674.
[2] Shintani Y, Maeda M, Chaika N, et al. Collagen I promotes epithelial-to-mesenchymal transition in lung cancer cells via transforming growth factor-beta signaling[J]. Am J Respir Cell Mol Biol, 2008, 38(1): 95-104.
[3] 岳喜磊, 成 莹, 许继德, 等. TRPC1在 TGF-β1诱导支气管上皮细胞间充质转化中的作用[J]. 中国病理生理杂志, 2015,31(3): 492-498.
[4] Wang X, Adler KB, Erjefalt J, et al. Airway epithelial dysfunction in the development of acute lung injury and acute respiratory distress syndrome[J]. Expert Rev Respir Med, 2007, 1(1): 149-155.
[5] 杨 敏, 黄海长, 王海燕. 结缔组织生长因子促纤维化作用及其表达调节的研究进展[J]. 中国病理生理杂志, 2005, 21(1): 199-202,208.
[6] Chen C, Fang X, Wang Y, et al. Preventive and therapeutic effects of phosphoinositide 3-kinase inhibitors on acute lung injury[J]. Chest, 2011, 140(2): 391-400.
[7] Fang X, Li K, Tao X, et al. Effects of phosphoinositide 3-kinase on protease-induced acute and chronic lung inflammation, remodeling, and emphysema in rats[J]. Chest, 2013, 143(4): 1025-1035.
[8] Phan SH. Genesis of the myofibroblast in lung injury and fibrosis[J]. Proc Am Thorac Soc, 2012, 9(3): 148-152.
[9] Yang J, Velikoff M, Canalis E, et al. Activated alveolar epithelial cells initiate fibrosis through autocrine and paracrine secretion of connective tissue growth factor[J]. Am J Physiol Lung Cell Mol Physiol, 2014, 306(8): L786-L796.
[10]王来亮, 罗 群. 肾小管上皮间充质转化与肾脏纤维化[J]. 中国病理生理杂志, 2014, 30(10): 1910-1914,1920.
[11]马文东, 袁 媛, 杨 奕, 等. TGF-β1介导的RhoA/ROCK通路在大鼠肺肌成纤维细胞分化中的调节作用[J]. 中国病理生理杂志, 2013, 29(10): 1758-1763.
[12]王达安, 林逸心, 王 峥, 等. 沙利度胺抑制 TGF-β1诱导的 HELF 细胞中结缔组织生长因子基因启动子的激活[J]. 中国病理生理杂志, 2014,30(4): 693-697.
[13]Mason RM. Connective tissue growth factor(CCN2), a pathogenic factor in diabetic nephropathy. What does it do? How does it do it? [J].J Cell Commun Signal, 2009, 3(2): 95-104.
[14]Xu X, Wan X, Geng J, et al. Rapamycin regulates connective tissue growth factor expression of lung epithelial cells via phosphoinositide 3-kinase[J]. Exp Biol Med (Maywood), 2013, 238(9): 1082-1094.
[15]Xu X, Dai H, Geng J, et al. Rapamycin increases CCN2 expression of lung fibroblasts via phosphoinositide 3-kinase[J]. Lab Invest, 2015, 95(8): 846-859.
(责任编辑: 林白霜, 罗 森)
Effects of PI3K/CTGF signaling pathway on TGF-β1-induced collagen I expression in A549 cells
YING Zhao-jian, HUANG Xiao-min, YU Ya-ni, LIN Xiao-xiao, CHEN Jing, LI Wen-jun, DONG Nian, CHEN Cheng-shui
(DepartmentofPulmonaryandCriticalCareMedicine,TheFirstAffiliatedHospital,WenzhouMedicalUniversity,Wenzhou325000,China.E-mail:wzmudongnian@foxmail.com;wzchencs@163.com)
AIM: To investigate the molecular mechanism of transforming growth factor β1/phosphatylinositol 3-kinase/connective tissue growth factor (TGF-β1/PI3K/CTGF) signaling pathway in the induction of collagen I expression in human lung adenocarcinoma A549 cells. METHODS: The A549 cells were culturedinvitroand stimulated by TGF-β1. The expression of CTGF and collagen I at mRNA and protein levels as well as the activation of PI3K was measured. The A549 cells were pre-treated with PI3K inhibitor LY294002, the expression of CTGF and collagen I at mRNA and protein levels was measured upon TGF-β1 stimulation. Under the condition ofCTGFinterference by siRNA-CTGF, the expression of collagen I at mRNA and protein levels as well as the activation of PI3K by TGF-β1 stimulation was measured. RESULTS: TGF-β1 stimulated the expression of CTGF and collagen I at mRNA and protein levels as well as the activation of PI3K at a dose- and time-dependant manner. PI3K inhibitor LY294002 partly reversed TGF-β1-induced CTGF and collagen I expression. Interference ofCTGFdown-regulated TGF-β1-induced collagen I expression without the effect on the activation of PI3K. CONCLUSION: PI3K signaling pathway plays a pivotal role in TGF-β1-induced collagen I expression in the A549 cells. CTGF is an immediate early response effector protein of TGF-β1/PI3K signaling pathway and synergizes with TGF-β1 in the induction of collagen I expression in the A549 cells.
Transforming growth factor β1; Collagen I; Connective tissue growth factor
1000- 4718(2017)03- 0489- 06
2016- 09- 21
2016- 12- 01
国家自然科学基金资助项目(No. 81270131; No. 81570075)
△通讯作者 董 年 Tel: 0577-86352962; E-mail: wzmudongnian@foxmail.com; 陈成水 Tel: 0577-55578186; E-mail: wzchencs@163.com
▲并列第1作者
R730.23
A
10.3969/j.issn.1000- 4718.2017.03.017

