SIRT1对早期脑缺血大鼠水通道蛋白4表达的影响
贺 伟, 展宏刚
(山东省泰山医院,山东 泰安 271000)
SIRT1对早期脑缺血大鼠水通道蛋白4表达的影响
贺 伟, 展宏刚△
(山东省泰山医院,山东 泰安 271000)
目的: 检测水通道蛋白4(AQP4)及沉默信息调节因子1(SIRT1)在脑缺血大鼠脑组织中的表达变化,探究SIRT1对AQP4的调节作用,明确二者在脑缺血及脑水肿发生发展中的作用。方法: 雄性SD大鼠随机分成假手术组(sham组)和脑缺血模型组(MCAO组),其中MCAO组又分为6 h、12 h、24 h和48 h 4个时点组别。采用线栓法阻塞大脑中动脉建立局灶性脑缺血模型,于相应时点进行神经症状评分,Morris水迷宫检测大鼠学习认知功能,TTC染色观察脑梗死体积,干湿重法检测脑含水量的变化,HE染色观察大脑皮层周围组织神经细胞形态学变化,Western blot检测AQP4、SIRT1和基质金属蛋白酶9(MMP-9)的表达情况。结果: 与sham组相比较,随着再灌注时间增加,MCAO组大鼠神经功能评分、脑梗死体积、脑组织通透性和脑组织含水量均持续增加,而大鼠学习认知功能则降低显著,HE染色显示脑缺血大脑皮层周围组织神经元细胞形态不规则,数目减少;Western blot实验结果显示AQP4表达水平呈增高趋势,SIRT1表达降低,MMP-9表达增高,MCAO-48 h组与sham组比较差异最明显(P<0.01)。结论: 脑缺血后,伴随脑组织损伤的加剧,SIRT1和MMP-9信号通路的表达激活影响了AQP4的表达活化,共同参与了脑水肿的形成。
脑缺血; 脑水肿; 沉默信息调节因子1; 水通道蛋白4
脑缺血可发生于多种脑血管疾病过程中,涉及多环节、多因素、多途径损伤的复杂酶促级联反应,引起严重的神经损伤。而脑水肿是缺血性脑血管病中常见的并发症之一,引起颅内高压、加重病情,甚至造成病人死亡。而血脑屏障(blood-brain barrier,BBB)通透性改变既是脑缺血损伤后的结果,又是导致损伤进一步加重的重要因素[1]。水通道蛋白4(aquaporin 4,AQP4)是膜水通道蛋白家族的一员,在脑组织中广泛表达,是控制水进出脑组织的通道,在脑组织水平衡、 星形细胞迁移、神经兴奋及炎症等方面均起着重要作用[2]。大量研究[3]表明,AQP4与脑水肿关系密切, 参与了多种疾病所引起的脑水肿的病理过程。先前的大量研究[4]显示,脑缺血早期,迅速引起脑损伤,损伤程度随时间变化很大,这一时期所造成的脑水肿程度也最为严重。更有研究[5]指出,中脑动脉闭塞(middle cerebral artery occlusion,MCAO)发生48 h之内是脑水肿的发展的关键时期,也是临床药物治疗的黄金时期。沉默信息调节因子1(silent information regulator 1,SIRT1)为哺乳动物sirtuins家族成员之一,是一种依赖于烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD+)的去乙酰化酶,在成人组织中广泛表达。研究显示,SIRT1通过去乙酰化相关因子调节基质金属蛋白酶9(matrix metalloproteinase-9,MMP-9)在内的多个细胞信号通路,参与心脑血管内皮细胞保护作用[6];另有研究显示,MMP-9信号通路可以激活AQP4的表达,参与心血管疾病的发生过程[7],但在脑缺血后继发脑水肿病理生理过程中的作用仍不清楚。为了进一步研究脑缺血发生早期SIRT1、MMP-9信号通路与AQP4的表达存在具体的病理生理关系,我们建立大鼠MCAO模型,选取了MCAO 6 h、12 h、24 h及48 h这4个重要的时点分别进行研究,以期探寻大鼠脑缺血后早期SIRT1对水通道蛋白4的调控规律及其与脑水肿的关系。
材 料 和 方 法
1 材料与试剂
水合氯醛(中国医药);0.9%氯化钠注射液(湖南科伦制药);生物素标记山羊抗兔IgG/小鼠IgG Ⅱ抗试剂盒(北京中杉金桥生物);Western blot Ⅰ抗Ⅱ抗去除液、Western blot 转膜液、BCA蛋白浓度测定试剂盒、SDS-PAGE凝胶配制试剂盒和SDS-PAGE电泳液均购自碧云天生物;蛋白markers(Lonza Rockland);PVDF膜(0.45 μm;购自SERVA);增强型化学发光试剂(Millipore);所用单克隆抗体为 AQP4(Abcam)、MMP-9(Cell Signaling Technology)、SIRT1(LifeSpan)和β-actin(Ambobio)。
2 实验动物
健康雄性Sprague-Dawley大鼠,SPF级,体重250~300 g,由山东省医学科学院动物中心提供,合格证号为SCXK(鲁)2016-0007。
3 实验方法
3.1 动物分组及给药 健康成年雄性SD大鼠110只,将动物随机分为假手术组(sham组)和MCAO模型组。MCAO模型组按照时点不同分为MCAO 6 h、12 h、24 h和48 h 4个亚组。每个MCAO亚组各25只大鼠,假手术组大鼠20只。
3.2 模型构建 将麻醉成功的大鼠仰卧位固定在手术台上,剪毛,常规消毒皮肤,颈部正中切口约2~3 cm,逐层分离,暴露左侧颈总动脉,钝性分离左侧颈总动脉(common carotid artery,CCA)、颈外动脉(external carotid artery,ECA)、颈内动脉(internal carotid artery,ICA)及迷走神经,仔细分离尽量减少对迷走神经的刺激。在近颅底处分离颈内动脉颅外段唯一分支——翼腭动脉,并将其起始部结扎,游离颈外动脉主干一段,在颈外动脉下垫双线分别2次结扎颈外动脉,两节点之间保留一定距离(约2 mm),提起一端,将颈内、外动脉分叉处分离干净。用血管夹夹闭颈总动脉、颈内动脉,将右侧颈外动脉近心段剪开一小口,将渔线所做成的线栓子缓慢插入ECA及ICA入颅至大脑中动脉(middle cerebral artery,MCA)开口处,线栓子插入的平均深度为(18.5±0.5) mm,外留1 cm长渔线,此时即在大脑中动脉起始端堵塞大脑中动脉,造成局灶性脑缺血,结扎渔线与血管,消毒并逐层缝合皮肤。假手术组除不插鱼线外,其余操作与手术组相同。
3.3 神经行为学评分 模型制作成功后,按照Bederson[8]评分标准在4个时点对实验鼠的行为缺陷进行神经功能评分:没有观察到神经症状,行为正常者为0分;提尾悬空时,动物的手术对侧前肢表现为腕肘屈曲,肩内旋,肘外展,紧贴胸壁者为1分;将动物置于光滑平面上,推手术侧肩向对侧移动时,阻力降低者为2分;动物自由行走时向手术对侧环转或转圈者为3分;软瘫,肢体无自发活动或死亡者为4分。分数越高,大鼠行为障碍越严重。评分结束后,挑选评分在1~3分者入组,造模后死亡及评分为4分的实验鼠排除入组。
3.4 Morris水迷宫检测大鼠学习认知功能 大鼠MCAO术后第7天,在无平台情况下将小鼠放于水迷宫,驯化2次。于第14天开始测试,连续进行5 d。水池直径150 cm,水深40 cm,水温(25±2)℃,逃避平台直径10 cm,其平面没在水面下1 cm。按照东、西、南、北4个方位,将水池均分为4个象限,将平台置于第1象限的中心。水池外接摄像和计算机分析系统[9]。(1)定位航行试验:将大鼠从每一象限起点面朝池壁放入水中,依次记录其游到平台的时间,即为逃避潜伏期,时限为120 s。此时限内找不到平台,则由实验者将其引导到平台上,并停留15秒,该次潜伏期记录为120 s。将大鼠擦干放入笼子,5 min后再进行下一次试验。每天以4次训练潜伏期的平均值作为当日记录结果。(2)空间探索试验:于第5天开始进行空间探索试验,用于评估短期记忆能力。将平台移除,大鼠于原象平台的对侧限入水,记录120 s内每只大鼠穿越原放置平台位置的次数。
3.5 血脑屏障通透性测定 大鼠MCAO术后48 h,经尾静脉注射伊文思蓝(Evans blue, EB; 2%, 4 mL/kg),注射后2 h麻醉大鼠,将其固定于鼠板上,打开胸腔,用12号针头经左心室插入心脏,并在右心耳处剪口,用静脉滴注的方式将0.9%生理盐水灌注入心脏(灌注压为110 mmHg),至右心耳流出无色清亮的液体,断头取脑,去除硬脑膜,生理盐水冲洗后,滤纸吸干表面水分,取缺血侧大脑称其湿重后置于甲酰胺溶液(每100 mg脑组织中加入1 mL甲酰胺)中,56 ℃水浴24 h。24 h后1 000 r/min 离心5 min,用吸管轻吸出上清液,可见光分光光度计测定上清液632 nm处的吸光度(A)值,甲酰胺作为空白比色,按公式计算脑组织EB含量:脑组织EB渗透率=(左脑A值/左脑重量)/(右脑A值/右脑重量)。
3.6 脑含水量的测定 采用干湿重法测定脑含水量。不同时相点,大鼠处死后迅速取脑,将取出的脑组织放在一个内有生理盐水湿润的定性滤纸的培养皿中,以防止脑组织水分蒸发。去除皮质表面的软脑膜、小脑、脑干,用滤纸轻轻拭去脑组织表面的血迹,分离获取梗死侧大脑半球,置于称量杯中称取湿重,从取脑到称重完毕时间控制在5 min内。然后将脑组织放入电热恒温箱中,100 ℃烘干24~48 h烘烤至恒重,记录干重(两次干重之差≤0.2 mg)。按如下公式计算:脑组织含水量(%)=(湿重-干重)/湿重×100%。
3.7 脑梗死体积百分比的测定 缺血再灌注之后,将各实验鼠麻醉后迅速断头取脑,切除嗅球和低位脑干,用生理盐水冲洗后迅速将脑组织置于-20 ℃冰箱中速冻15~20 min,取出脑组织放入脑槽中,在冰床上进行操作。大脑沿冠状面自前脑额极起向后连续切片,一般切成5~6 片、厚度相近(平均2 mm)的冠状脑切片。小心地将脑片置于 2% TTC 溶液中,放入37 ℃恒温箱中避光孵育30 min。正常脑组织可染成深红色,梗死灶为白色,将脑片置于4%多聚甲醛中固定12 h,数码照相机拍照。选择每一切面的额侧面用Image-Pro Plus 6.0图像分析软件计算每张脑片的面积和梗死面积。大鼠脑梗死灶体积百分比(%)=(正常侧大脑半球体积-梗死侧非梗死区大脑半球的体积)/正常侧大脑半球体积×100%=[(A1’+A2’+…+An’)d-(A1+A2+…+An)d]/(A1’+ A2’+…+An’)d×100%,An’表示每片正常脑组织面积,An表示梗死侧非梗死区每片脑组织面积,d表示每片厚度。以此脑梗死灶体积百分比来反映MCAO后脑损伤的严重程度。
3.8 脑组织取材 将各实验组剩余大鼠麻醉,断头处死,迅速置于冰盘上分离脑组织,在视交叉前行冠状切取脑组织,取右侧脑组织块在冰冷的生理盐水中漂洗称重,分离的梗死脑组织半球再分为2部分:一部分用4%多聚甲醛固定,后续经脱水、透明、包埋,制成脑组织石蜡块;另一部分置于液氮中保存待用。
3.9 大脑皮层周围组织的HE染色 取大鼠脑组织石蜡块,切片机连续切片,厚度约4 μm,置60 ℃烤箱烘烤备用。取石蜡切片常规脱蜡至水,苏木素染色10 min,流水稍洗,体积分数1%的盐酸乙醇分化,流水冲洗数分钟,伊红染色5 min,流水稍洗,梯度乙醇常规脱水,中性树胶封片。染色后,BX51普通生物显微镜对脑组织观察并拍照,观察脑组织病理结构的改变。
3.10 Western blot实验 在研钵中放入约100 mg缺血侧脑组织冰冻标本,加入少量液氮,敲碎,然后把组织研磨成细小的组织碎片,置于2 mL的匀浆器中,加入Western blot或IP细胞裂解液,混匀。加入含1 mmol/L PMSF的裂解液1 mL研磨均匀,移入EP管中。高速冷冻离心机中以14 000×g,4 ℃离心10 min,小心取出上清,用BCA法测定总蛋白浓度。30~50 μg总蛋白上样量以浓度为8%的凝胶电泳分离。冰水浴下恒流(300 mA)湿法转膜1.5 h,以体积分数5%的脱脂奶粉封闭1 h,加Ⅰ抗[SIRT1(1∶500)、AQP-4(1∶2 000)、MMP-9(1∶1 000)和β-actin(1∶5 000)]。4 ℃共孵育过夜。TBST洗涤,与Ⅱ抗共孵育2 h,用增强型化学发光试剂进行显色,并利用灰度分析软件定量分析,以β-actin的灰度值标化蛋白表达水平。
4 统计学处理
应用SPSS 19.0 统计软件进行数据处理,数据均以均值±标准差(mean±SD)表示,组间差异比较采用单因素方差分析(one-way ANOVA),以P<0.05表示差异有统计学意义。
结 果
1 MCAO大鼠的一般特征
实验期间,sham组大鼠一般状态良好,对外界反应灵敏,无死亡。与sham组比较,MCAO组大鼠精神萎靡,出现运动功能障碍,行走向对侧旋转或倾倒,甚至瘫痪。Sham组造模全部成功,MCAO模型组造模成功71只,成功率约80.0%。
2 神经功能评分
Sham组未闭塞大脑中动脉,故评分均为0分;造模后MCAO模型组神经功能评分如表1,表明各模型组均出现不同程度的神经功能缺损症状,随着再灌注时间延长,自6 h~48 h神经功能评分呈逐渐增高趋势;与MCAO-6 h组比较,MCAO-24 h及MCAO-48 h组神经功能评分差异有统计学显著性(P<0.05)。
3 Morris水迷宫试验测试结果
与sham组比较,MCAO组大鼠逃避潜伏期逐渐延长,穿越平台次数减少,探索速度及平台象限路程百分比降低,探索路程增加。MCAO组间比较,随着缺血时间延长,MCAO-48 h组逃避时间延长明显,差异具有统计学显著性(P<0.01);与MCAO-6 h组比较,24 h及48 h时点均显著降低,差异具有统计学显著性(P<0.05);探索速度均降低,尤其在MCAO-48 h组降低最为显著(P<0.01);平台象限路程百分比降低,探索路程增加(P<0.05),MCAO-48 h组增加最显著(P<0.01),见表1、2。

表1 MCAO大鼠不同时点神经功能评分、平均逃避潜伏期、MCAO脑组织EB外渗率的变化
#P<0.05,##P<0.01vssham;*P<0.05,**P<0.01vsMCAO-6 h.
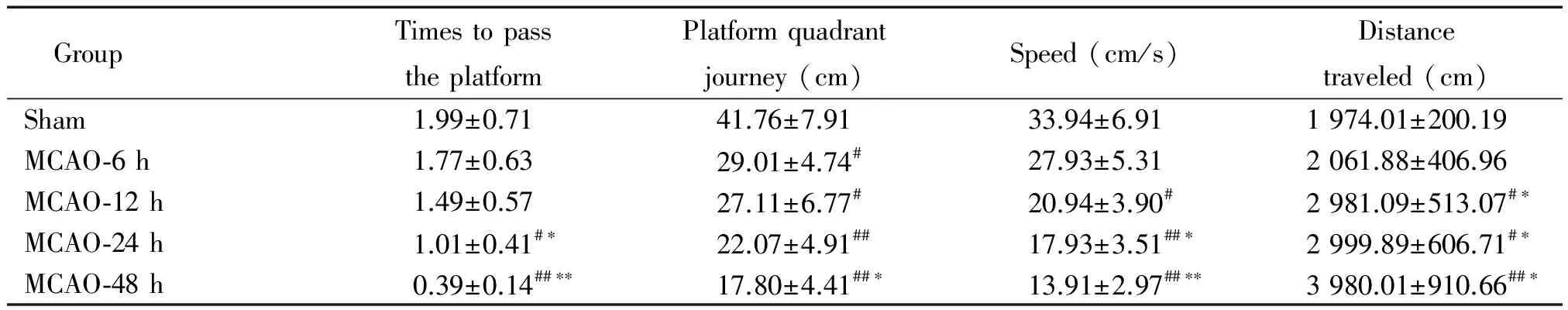
表2 各组大鼠空间探索实验各项指标的比较
#P<0.05,##P<0.01vssham;*P<0.05,**P<0.01vsMCAO-6 h.
4 大鼠血脑屏障通透性的变化
实验结果如表1所示,EB染色范围反映了大鼠血脑屏障通透性。MCAO组与假手术组相比,血脑屏障通透性显著增加(P<0.01);随着时间的持续,与MCAO-6 h组相比较,MCAO-24 h及MCAO-48 h组脑组织均显著增加血脑屏障通透性(P<0.05),而MCAO-12 h与MCAO-6 h组相比较略有增加,但相互之间无显著差异。
5 脑组织含水量的变化
实验结果如图1所示,sham组各时点脑组织含水量都维持在较低的正常水平,组间变化不大,相互之间差异无统计学显著性;与sham组相比较,MCAO组各时点的脑含水量显著增加;随着再灌注时间延长,各组脑含水量均逐渐升高,尤其在MCAO-12 h组脑含水量显著激增,与MCAO-6 h组比较,差异有统计学显著性(P<0.05);MCAO-24 h及48 h组的脑含水量均维持在较高的水平。
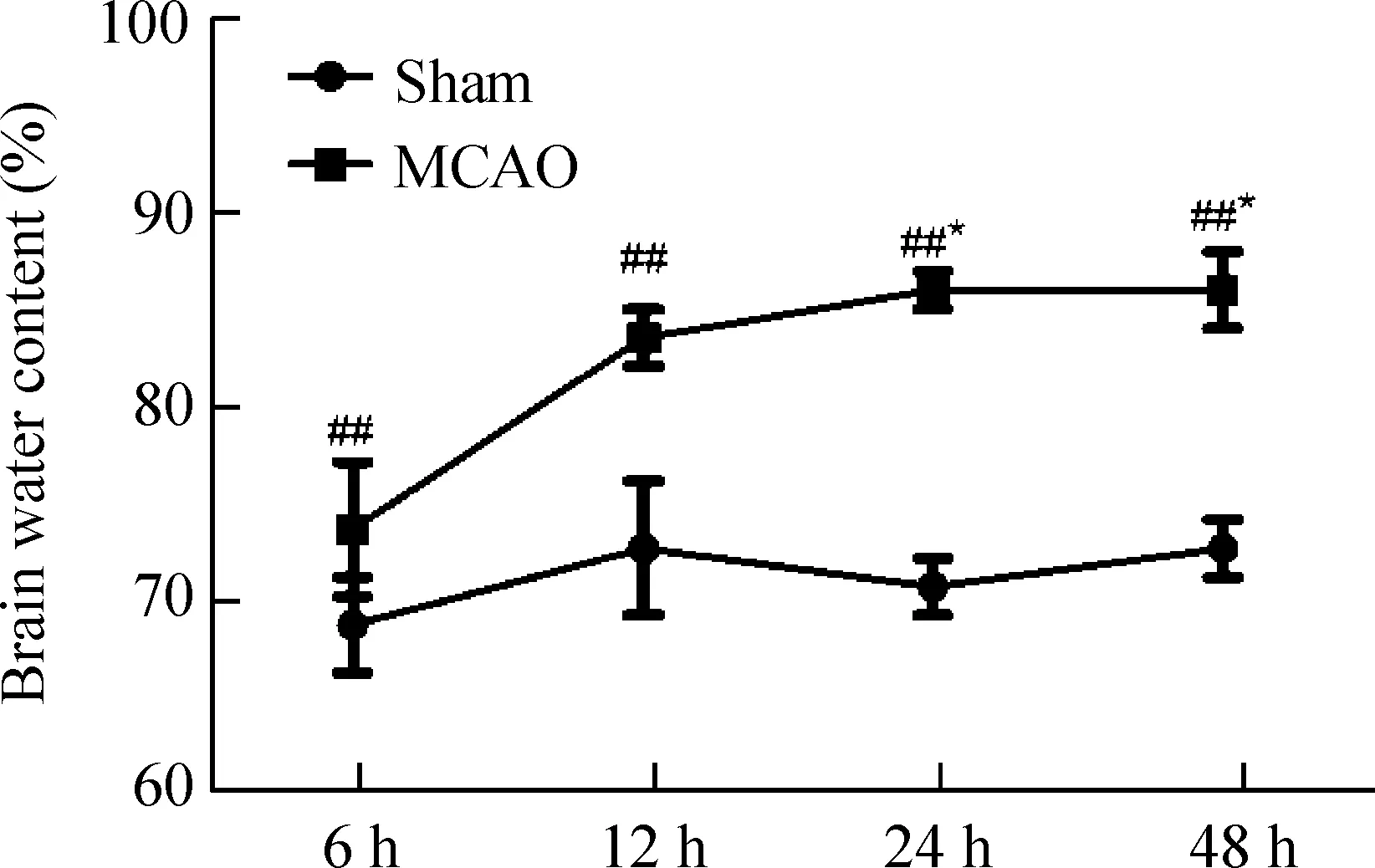
Figure 1.The changes of brain water content in the MCAO rats at different time points. Mean±SD. n=6. ##P<0.01 vs sham; *P<0.05 vs MCAO-6 h.
6 脑梗死体积的变化
与假手术组相比,缺血再灌注各组脑组织梗死范围从再灌注6 h逐渐升高(P<0.05),再灌注48 h达到峰值,差异有统计学显著性(P<0.01)。假手术组无缺血改变,TTC 染色呈均匀红色。MCAO 组梗死体积百分比随再灌注时间的延长逐渐增加(P<0.05),在48 h达到最大,见图2。
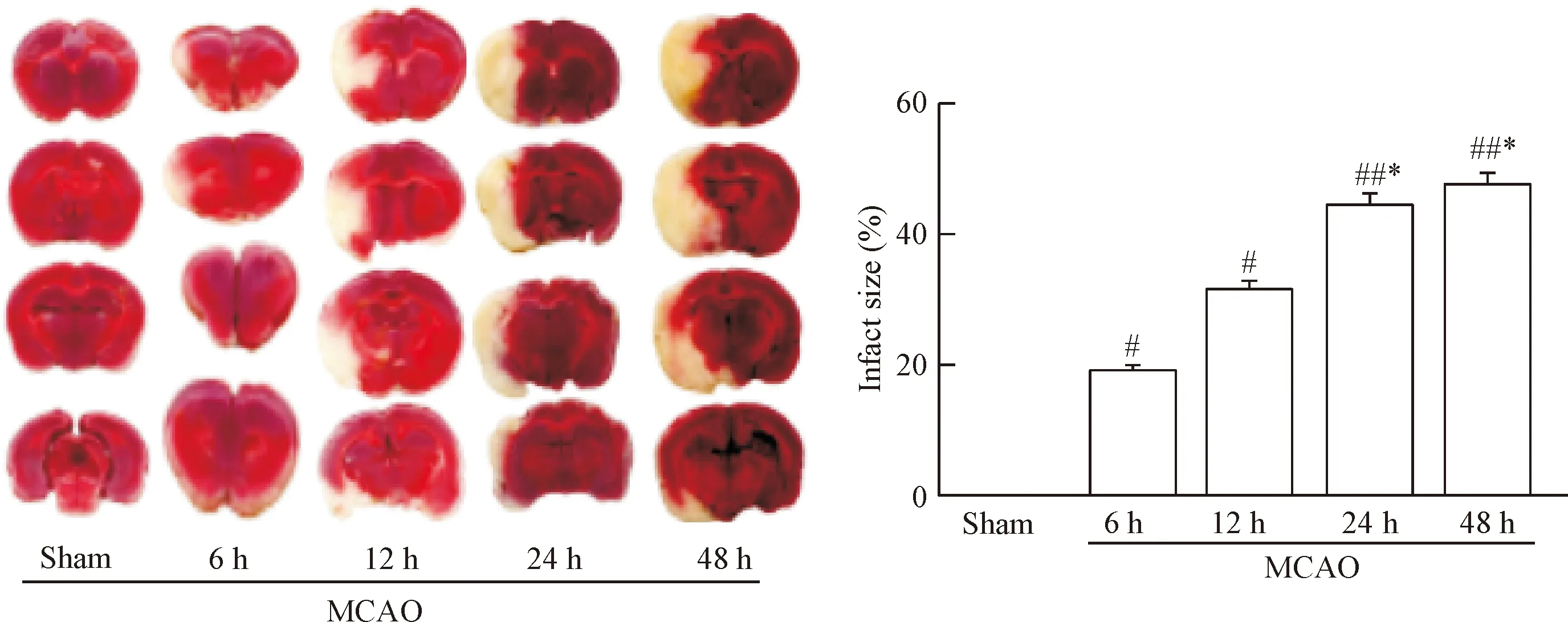
Figure 2.The cerebral infarct sizes in the MCAO rats at different time points. Mean±SD. n=6. #P<0.05, ##P<0.01 vs sham; *P<0.05 vs MCAO-6 h.
7 光镜检查
光镜下大脑海马组织HE染色可见,sham组神经元和胶质细胞形态正常,CA1区神经元排列整齐、均匀,无间质水肿。MCAO组缺血周边大脑组织结构水肿明显,神经元、胶质细胞细胞数目锐减,细胞间隙增宽,神经纤维网呈空泡样变,随着缺血时间增加,神经元胞浆及胞膜形态不规则,边界不清,胞核浓缩程度加重,部分细胞肿胀显著;尤其在缺血48 h前后,神经元胞体体积明显增大,细胞水肿显著,见图3。

Figure 3.The pathological changes of the hippocampus of the MCAO rats observed with HE staining (×100).
8 Western blot检测MCAO大鼠脑组织相关蛋白表达
Western blot条带及灰度定量分析结果可见,MCAO模型组各时点AQP4蛋白表达升高,其中MCAO-24 h及48 h蛋白表达升高显著,与sham组存在显著性差异(P<0.01);与MCAO-6 h组相比较,MCAO-24 h及48 h组,AQP4蛋白表达增加显著(P<0.05),MCAO-12 h组表达增加不显著,见图4。
MCAO模型组各时点MMP-9蛋白表达持续升高,与sham组差异存在统计学显著性(P<0.05);与MCAO-6 h组相比较,MCAO-12 h及24 h组MMP-9蛋白表达量略有增加,差异无统计学显著性,MCAO-48 h组MMP-9蛋白表达水平增加显著(P<0.05),见图5。
如图6结果所示,sham组的SIRT1蛋白呈较高水平表达,MCAO模型组中,随着缺血时间的延长,SIRT1蛋白表达水平持续降低。与sham组比较,MCAO-12 h、24 h及48 h组SIRT1蛋白表达水平均降低显著,差异存在统计学显著性(P<0.05);MCAO-6 h组降低不明显;与MCAO-6 h组相比较,MCAO-24 h及48 h组的SIRT1蛋白表达均显著降低,差异具有统计学显著性(P<0.05);MCAO-12 h组SIRT1的表达水平略有降低,但差异无统计学显著性。
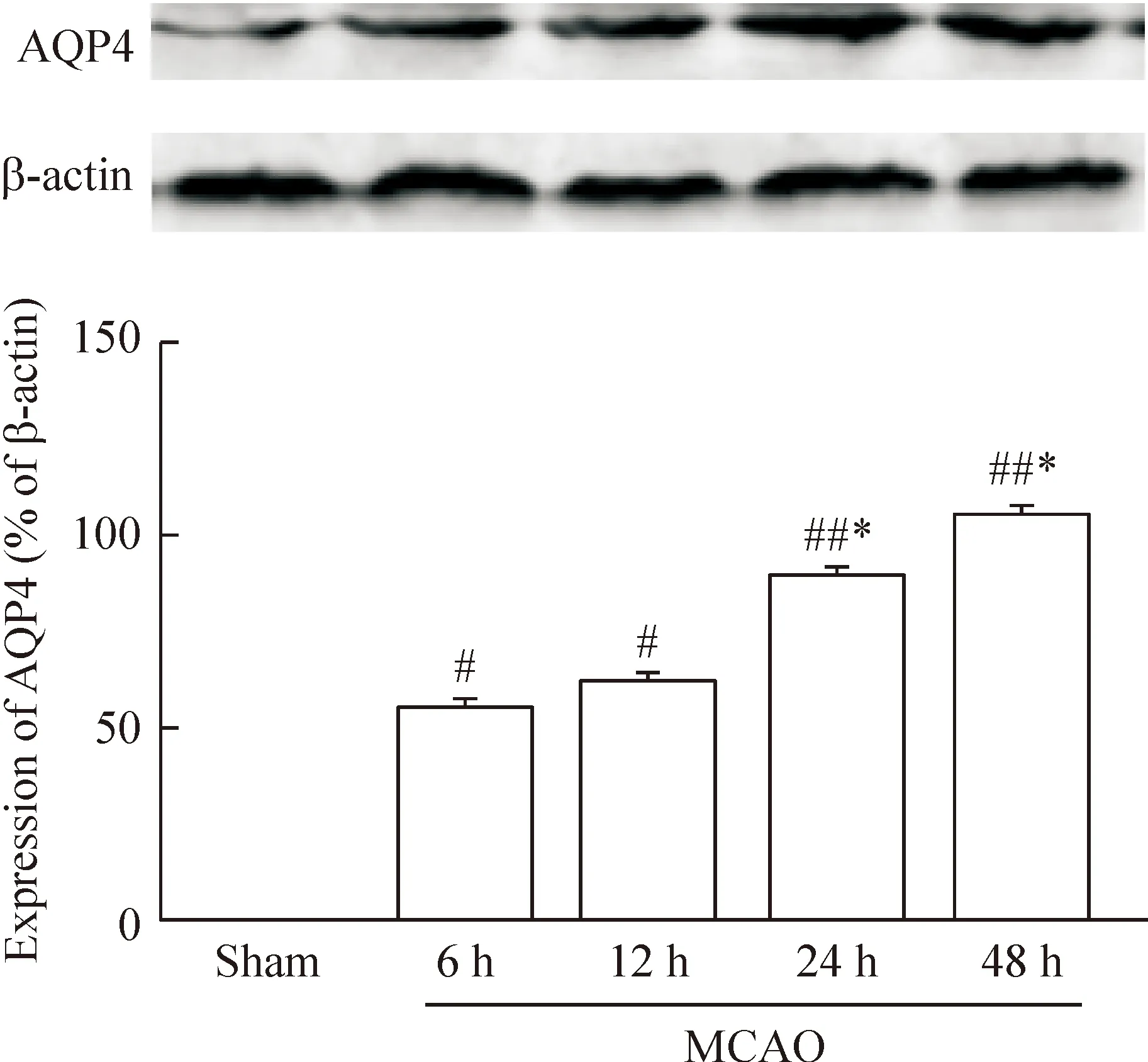
Figure 4.The expression of AQP4 in brain tissues of the MCAO rats at different time points. Mean±SD. n=8. #P<0.05, ##P<0.01 vs sham; *P<0.05 vs MCAO-6 h.

Figure 5.The expression of MMP-9 in the brain tissues of the MCAO rats at different time points. Mean±SD. n=8. #P<0.05, ##P<0.01 vs sham; *P<0.05 vs MCAO-6 h.
讨 论
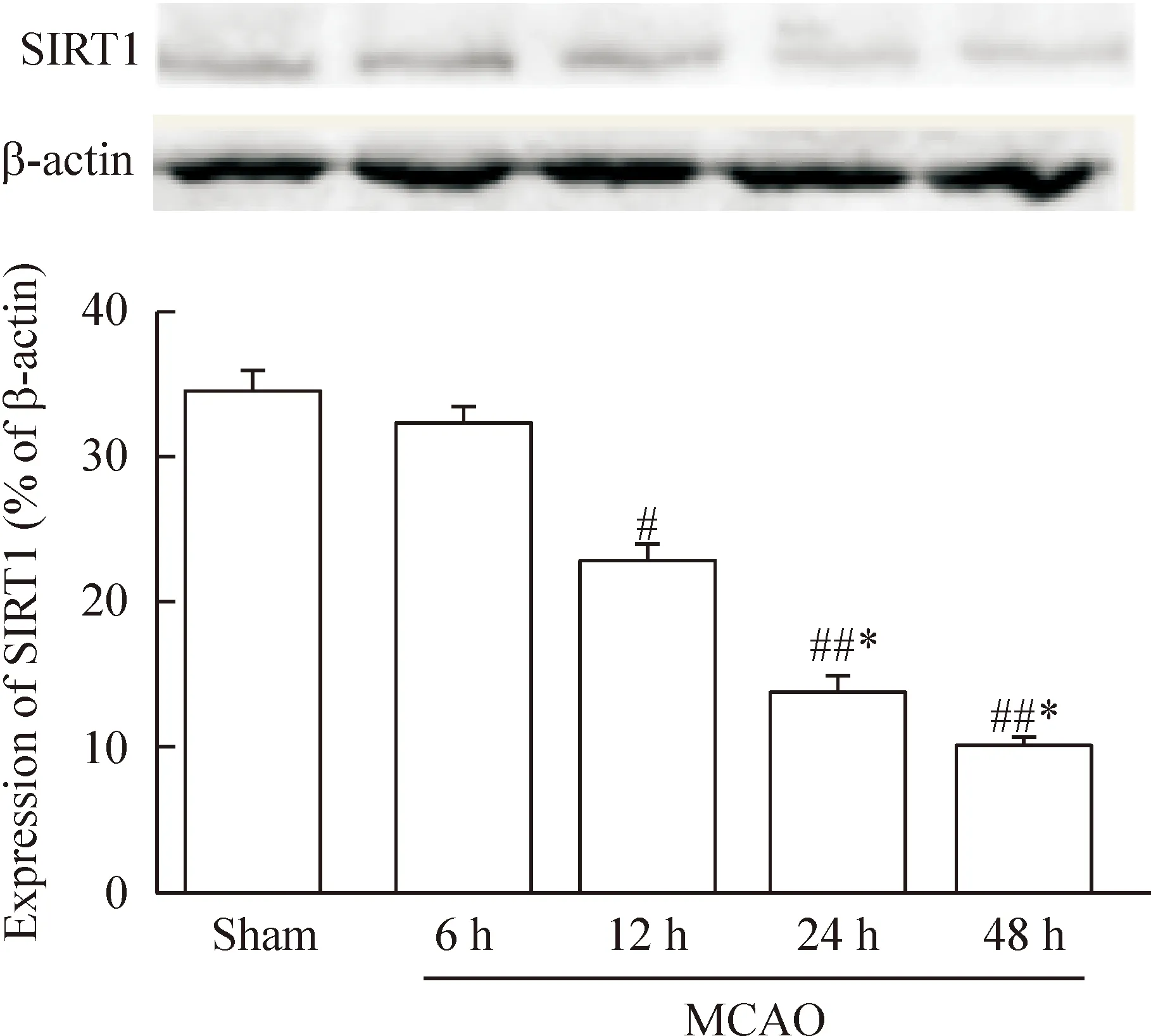
Figure 6.The expression of SIRT1 in the brain tissues of the MCAO rats at different time points. Mean±SD. n=8. #P<0.05, ##P<0.01 vs sham; *P<0.05 vs MCAO-6 h.
缺血性脑损伤过程中,除缺氧和能量代谢衰竭外,由缺血诱导的一系列瀑布样效应是导致神经元死亡的重要机制[10]。AQP4是膜水通道蛋白家族的一员,在脑组织中广泛表达,是控制水进出脑组织的通道,在脑组织水平衡、 星形细胞迁移、神经兴奋及炎症等方面均起着重要作用[11]。SIRT1是一种烟酰胺腺嘌呤二核苷酸依赖的蛋白去乙酰化酶类,在抑制炎症级联反应,抑制氧化应激,调节内皮细胞稳态,介导基因组沉默,减少蛋白表达、代谢及能量消耗,抑制细胞凋亡等途径发挥神经保护作用[12-13]。在大鼠脑缺血模型中,白藜芦醇通过增加SIRT1的活性实现对缺血预处理大鼠模型海马CA1区神经元的保护作用[14];先前研究发现,SIRT1参与了肺泡巨噬细胞对MMP-9表达的调控作用,进而在慢性阻塞性肺病的发生发展中起保护性作用[15]。MMP-9是脑缺血后过度表达的炎症因子。研究证实,MMP-9可以通过降解闭合蛋白(occludin)等紧密连接蛋白,导致血脑屏障通透性增加[16-17]。更有研究证实[7],在脑缺血早期,MMP-9可以通过调节AQP4的表达水平,参与脑水肿的发生过程。但是在脑缺血的早期发生发展过程中,SIRT1、MMP-9及AQP4的变化仍鲜有探讨。
本实验结果显示,MCAO模型大鼠各时点神经功能评分都增加,且随着时间延长,神经功能评分也就越高,学习认知能力也不断降低;随后的脑组织取材研究中也显示,无论是脑组织含水量还是脑梗死体积分数都随着时间的延长而进行性加重。HE染色选取海马脑组织观察,显示神经细胞水肿进行性加重。
本研究通过免疫组化及Western blot等技术手段研究缺血区AQP4蛋白的表达水平及脑组织分布特征,结果表明AQP4蛋白表达水平随着时间的延长迅速的增加,在MCAO-48 h达到最大表达水平。伴随着脑水肿程度加重,AQP4蛋白的表达增强,这一结果表明AQP4的表达变化与MCAO模型脑水肿的形成密切相关。为进一步阐明脑水肿发生过程中TJPs表达降低的具体病理生理过程,我们检测了MMP-9蛋白的表达水平。结果显示MCAO后随着脑损伤的加剧,MMP-9的表达也是相伴增加的。而SIRT1蛋白在MCAO模型早期则显示出持续降低的表达水平。
由此,我们推测MCAO后伴随着脑组织损伤而产生的脑水肿可能是因为在缺血状态下SIRT1信号分子表达受到抑制,对MMP-9蛋白表达抑制作用减弱,引起MMP-9的过表达,破坏了血脑屏障的结构与功能,引发后续信号通路中AQP4蛋白的表达增加,使得脑组织水及电解质转运紊乱,各种炎性介质也随之进入脑组织,从而导致脑水肿的发生与不断的发展。本部分研究内容从分子角度初步探究了脑缺血及其继发脑水肿早期的病理生理过程,为进一步药物干预研究提供了研究基础和理论依据,也为临床预防和治疗脑水肿提供重要的参考。
[1] Zhu MX, Xing D, Lu ZH, et al. DDR1 may play a key role in destruction of the blood-brain barrier after cerebral ischemia-reperfusion[J]. Neurosci Res, 2015, 96: 14-19.
[2] Ikeshima-Kataoka H. Neuroimmunological implications of AQP4 in astrocytes[J]. Int J Mol Sci, 2016, 17(8): E1306.
[3] Han D, Sun M, He PP, et al. Ischemic postconditioning alleviates brain edema after focal cerebral ischemia reperfusion in rats through down-regulation of aquaporin-4[J]. J Mol Neurosci, 2015, 56(3):722-729.
[4] Sadana P, Coughlin L, Burke J, et al. Anti-edema action of thyroid hormone in MCAO model of ischemic brain stroke: possible association with AQP4 modulation[J]. J Neurol Sci, 2015, 354(1-2):37-45.
[5] Gao D, Ding F, Lei G, et al. Effects of focal mild hypothermia on thrombin-induced brain edema formation and the expression of protease activated receptor-1, matrix metalloproteinase-9 and aquaporin 4 in rats[J]. Mol Med Rep, 2015, 11(4):3009-3014.
[6] 尹茂山, 牟艳玲. Sirt1与心肌保护[J]. 生命科学, 2015, 27(5): 601-607.
[7] Xu SH, Yin MS, Liu B, et al. Tetramethylpyrazine-2’-O-sodium ferulate attenuates blood-brain barrier disruption and brain oedema after cerebral ischemia/reperfusion[J]. Hum Exp Toxicol, 2016 Jul 6. pii: 0960327116657401. [Epub ahead of print]
[8] Bederson JB, Pitts LH, Tsuji M, et al. Rat middle cerebral artery occlusion: evaluation of the model and development of a neurologic examination[J]. Stroke, 1986, 17(6): 472-476.
[9] Gordan ML, Jungwirth B, Ohl F, et al. Evaluation of neurobehavioral deficits following different severities of cerebral ischemia in rats: a comparison between the modified hole board test and the Morris water maze test[J]. Behav Brain Res, 2012, 235(1):7-20.
[10]王 来, 祝世功. 线粒体生成与脑缺血再灌注损伤的研究进展[J]. 中国病理生理杂志, 2016, 32(8):1478-1483.
[11]许淑红, 尹茂山, 吴玉林. 吡拉格雷钠对氧糖剥夺/复氧后星形胶质细胞水肿及AQP4表达的影响[J]. 中国药理学通报, 2015, 31(12):1661-1667.
[12]张玉佩, 邓远军, 胡巢凤, 等. 柴胡疏肝散对NAFLD大鼠肝脏脂质代谢及AMPK/SIRT1通路的影响[J]. 中国病理生理杂志, 2016, 32(2):307-313.
[13]尤慧敏, 康祥锦, 杨 洁, 等. EGCG 通过调控 SIRT1-P53 通路诱导人卵巢癌SKOV- 3细胞凋亡[J]. 中国病理生理杂志, 2016, 32(1):76-82.
[14]Wu Y, Li X, Zhu JX, et al. Resveratrol-activated AMPK/SIRT1/autophagy in cellular models of Parkinson’s disease[J]. Neurosignals, 2011, 19(3):163-174.
[15]Yao H, Hwang JW, Sundar IK, et al. SIRT1 redresses the imbalance of tissue inhibitor of matrix metalloprotei-nase-1 and matrix metalloproteinase-9 in the development of mouse emphysema and human COPD[J]. Am J Physiol Lung Cell Mol Physiol, 2013, 305(9):L615-L624.
[16]Dong X, Song YN, Liu WG, et al. MMP-9, a potential target for cerebral ischemic treatment[J]. Curr Neuropharmacol, 2009, 7(4):269-275.
[17]Jiao H, Wang Z, Liu Y, et al. Specific role of tight junction proteins claudin-5, occludin, and ZO-1 of the blood-brain barrier in a focal cerebral ischemic insult[J]. J Mol Neurosci, 2011, 44(2):130-139.
(责任编辑: 林白霜, 罗 森)
Effect of SIRT1 on dynamic expression of AQP4 in early stage of cerebral ischemia in rats
HE Wei, ZHAN Hong-gang
(TaishanHospitalofShandongProvince,Tai’an271000,China.E-mail:zhhgang@126.com)
AIM: To investigate the pathological changes of aquaporin 4 (AQP4) and related proteins in the rats with focal cerebral ischemia injury, and to observe the effect of silent information regulator 1 (SIRT1) on the AQP4 expression in order to explore the pathological mechanism of cerebral ischemia and brain edema. METHODS: Adult male SD rats were randomly divided into sham group and middle cerebral artery occlusion (MCAO) model group. The MCAO model group was divided into the 4 time point (6 h, 12 h, 24 h and 48 h) subgroups. The animal model of MCAO was established by suture method in mature SD rats. The neural symptom score was measured at the corresponding time points. Morris water maze test was used to study the cognitive function. The cerebral infarction volume was evaluated by TTC staining. The changes of brain water content was analyzed by a dry/wet weight method. The morphological changes of the brain tissues were observed under microscope with HE staining. The protein expression of SIRT1, MMP-9 and AQP4 was determined by Western blot. RESULTS: Compared with sham group, the neural function score of the rats in MCAO model group was significantly elevated. With the increasing reperfusion time, the cerebral infarction volume, brain tissue permeability and the brain water content were also increased. The increases in the protein levels of AQP4 and the related proteins showed apparent changes. The protein expression of SIRT1 was decreased, while the MMP-9 expression was increased. The most obvious differences of the protein level changes in MCAO-48 h model group were observed (P<0.01). CONCLUSION: Accompanied with the aggravating cerebral injury after cerebral ischemia, the process of AQP4 expression is activated with the increasing expression levels of MMP-9 and SIRT1. These factors are combined to induce the formation of brain edema.
Cerebral ischemia; Cerebral edema; Silent information regulator 1; Aquaporin 4
1000- 4718(2017)03- 0455- 07
2016- 09- 20
2016- 11- 15
△通讯作者 Tel: 13335298880; E-mail: zhhgang@126.com
R363.2
A
10.3969/j.issn.1000- 4718.2017.03.012

