生物解离大豆蛋白酶解物体外模拟消化抗氧化活性变化
佟晓红,王 欢,刘宝华,张巧智,李 红,田 然,赵晋菡,齐宝坤,李 杨,江连洲*
(东北农业大学食品学院,黑龙江 哈尔滨 150030)
自由基是通过身体内的正常生理反应产生的物质[1]。过量的自由基生成可能会引发一系列慢性疾病,如衰老、癌症、心血管疾病和其他疾病[2]。因此,人们越来越关注寻找能够清除自由基的天然来源抗氧化剂[3]。许多蛋白质酶解产物及其分离的肽显示出较好的体外抗氧化活性,例如大豆蛋白、乳清蛋白、玉米醇溶蛋白、小麦蛋白质及酪蛋白等[4],这些酶解产物的抗氧化特性很大程度上取决于酶的特异性、分子质量分布、氨基酸组成和释放肽的序列[5]。大豆蛋白在大豆干种子中约占其质量的40%,被认为是适合人类食用产品的重要成分。大豆生物解离技术是一种同时从大豆中提取油和蛋白质的环保提油技术,生物解离过程中提取的蛋白质主要分布在水解液中(富含蛋白质的水相),水解液中蛋白质主要为大豆蛋白酶解产物[6]。因此,研究水解液中大豆蛋白酶解物(soy protein hydrolysate,SPH)是十分必要的。SPH可以发挥其对胃肠(gastrointestinal,GI)系统的作用或通过肠道吸收作用于其他系统,在GI消化过程中由于消化酶和极端pH值条件可能影响蛋白或肽的结构及活性,因此应该研究在GI消化过程中SPH抗氧化活性的变化,体外模拟GI消化是模拟SPH消化过程的一种快速有效的方法[7]。本课题组前期研究7 种不同蛋白酶(碱性蛋白酶、中性蛋白酶、木瓜蛋白酶、菠萝蛋白酶、风味蛋白酶、复合蛋白酶和胰蛋白酶)对生物解离油脂提取率及蛋白质水解物苦味和功能特性的影响[8]。结果表明,采用碱性蛋白酶进行酶解时,提油率最高,为91.23%,SPH溶解性最好,为91.12%,但是苦味值较大,为4.0;采用风味蛋白酶处理时,SPH苦味值最小,为1.5,乳化性最好(乳化活性指数185.06 m2/g、乳化稳定性指数78.9 min),提油率为87.73%。通过整体对比得出碱性蛋白酶和风味蛋白酶效果较好,因此本实验研究大豆碱性蛋白酶和风味蛋白酶酶解物及经过体外模拟GI消化后产物的抗氧化活性变化,了解SPH的消化行为可为后续昂贵动物或临床实验提供参考。
1 材料与方法
1.1 材料与试剂
挤压膨化大豆 山东省高唐蓝山集团总公司;碱性蛋白酶Protex 6 L 杰能科(中国)生物工程有限公司;风味蛋白酶、胃蛋白酶、胰酶 北京索莱宝科技有限公司;氨基酸混合标准品、偶氮二异丁脒盐酸盐(2,2'-azobis(2-amidinopropane)dihydrochloride,AAPH)、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、2,2'-联氨-双(3-乙基苯并噻唑啉-6-磺酸)(2,2'-azinobis(3-ethylbenzothiazoline-6-sulfonic acid) diammonium salt,ABTS)、荧光素钠、水溶性VE(Trolox) 美国Sigma-Aldrich公司;本实验所用其他化学试剂均为国产分析纯。
1.2 仪器与设备
磁力搅拌器 广州仪科实验仪器有限公司;PHSJ-4A型实验室pH计 上海雷磁公司;HH-4型数显恒温水浴锅 金坛市双捷实验仪器厂;GL-21M型高速冷冻离心机 上海卢湘仪离心机仪器有限公司;3-18K型高速冷冻离心机 美国Sigma公司;FD5-3型冷冻干燥机 美国SIM公司;UV-1600PC型紫外-可见分光光度计 上海菁华科技仪器有限公司;L-8900型全自动氨基酸分析仪 日本日立公司;AL204型分析天平北京京国艺科技发展有限公司;电子分析天平(0.000 1 g) 上海书俊仪器设备公司;Synergy多动能酶标仪 美国Bio-Tek公司;e2695高效液相色谱(high performance liquid chromatography,HPLC)仪 美国Waters公司;Q Exactive质谱(mass spectrometry,MS)仪、Easy-nLC 1000超高效液相色谱系统 美国Thermo Fisher Scientific公司。
1.3 方法
1.3.1 生物解离SPH的制备
参考Zhang Qiaozhi等[9]的方法制备生物解离SPH,并作适当修改。首先将挤压膨化大豆粉碎过60 目筛,称取一定量的挤压膨化大豆粉,用蒸馏水调节固液比为1∶6,调节温度、pH值,加入1%(质量分数)酶制剂酶解3 h后,在100 ℃沸水中灭酶10 min。灭酶后离心(8 000×g、20 min),将得到的水解液调节pH值至7,冷冻干燥后用正己烷脱脂处理得到SPH。碱性蛋白酶酶解得到产物记为SPH-A,风味蛋白酶酶解得到产物记为SPH-F。
1.3.2 水解蛋白回收率
参照Jung等[10]的方法测定水解蛋白回收率,按式(1)计算。
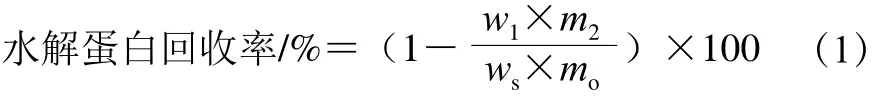
式中:ws为挤压膨化大豆粉中蛋白质量分数/%;m0为挤压膨化大豆粉的质量/g;w1为残渣中蛋白质量分数/%;m2为不溶部分的质量/g。
1.3.3 体外模拟GI消化
参照Minekus等[11]描述的方案并稍作修改,使用胃蛋白酶和胰酶对SPH进行模拟GI消化。用磷酸盐缓冲液(0.1 mol/L、pH 7.0)将SPH配制成质量浓度为50 mg/mL的溶液,与模拟胃液(simulated gastric fluid,SGF)以体积比1∶1混合,并使用1 mol/L HCl将pH值调节至3.0,在消化混合物中加入胃蛋白酶使之浓度达到2 000 U/mL,将混合物在水浴振荡器(37 ℃、170 r/min)中反应2 h。SGF消化2 h后,将消化样品与模拟肠液以体积比1∶1混合,用1 mol/L NaOH将pH值增加至7.0,添加胰酶,并使胰蛋白酶的终浓度为100 U/mL,混合物在相同条件下再温育2 h。水浴加热(75 ℃、20 min)停止消化后,用0.5 mol/L NaOH将pH值调节至7.0。在10 000×g条件下离心20 min,收集上清液冷冻干燥。分别在SGF和肠液反应后收集消化样品,分别记为SPH-G和SPH-GI,以测定SPH在体外消化过程中抗氧化活性的变化。
1.3.4 蛋白水解度的测定
参照Nielsen等[12]的方法,即邻苯二甲醛(orthophthalaldehyde,OPA)法。采用0.1 mol/L pH 7.0的磷酸盐缓冲液配制质量浓度为2 mg/mL的样品溶液,样品溶液与OPA试剂充分混匀后,避光反应2 min,在340 nm波长下测定吸光度。水解度(degree of hydrolysis,DH)按式(2)计算。

式中:h为水解的肽键数;htot为总肽键数(大豆htot为7.8)。
1.3.5 总氨基酸含量分析
将样品在密封的水解管中用6 mol/L HCl在110 ℃条件下水解24 h。水解后转移到25 mL容量瓶中用去离子水定容。过滤后取1 mL溶液进行真空干燥,将干燥的样品用1 mL HCl重新溶解后,在16 000×g条件下离心15 min取上清液,进样量为50 μL,利用氨基酸分析仪进行测定[13]。
1.3.6 游离氨基酸含量分析
参照Wu Huichun等[14]描述的方法并稍作修改。将样品用10%三氯乙酸沉淀2 h,然后在11 000×g条件下离心15 min。取上清液,调节pH值至2.0,并用0.45 μm滤膜过滤。将滤液利用氨基酸分析仪进行测定。
1.3.7 分子质量分布的测定
利用尺寸排阻色谱-HPLC法测定SPH、SPH-G、SPH-GI样品的分子质量分布,参数参照Zhang Qiaozhi等[15]的方法。
色谱条件为:色谱柱为AdvanceBio SEC柱(300 mm×4.6 mm,2.7 μm);流动相为pH 7.0的0.1 mol/L磷酸盐缓冲液;流速为0.2 mL/min,紫外检测波长为220 nm,进样量10 μL。将样品配制为质量浓度为1 mg/mL的溶液,经0.45 μm滤膜过滤后待测。
根据以下标准品的校准曲线计算每个样品的分子质量范围:甲状腺球蛋白(670 kDa)、牛γ球蛋白(158 kDa)、鸡卵白蛋白(44 kDa)、马肌红蛋白(17 kDa)和VB12(1.35 kDa)。
1.3.8 抗氧化能力测定
1.3.8.1 DPPH自由基清除能力
DPPH自由基清除能力根据Arise等[16]的方法进行测定。使用96 孔酶标板,将100 μL样品溶液(1 mg/mL)与100 μL DPPH溶液(0.1 mmol/L,溶解于95%甲醇溶液中)混合并在室温下暗处反应30 min。然后利用酶标仪在517 nm波长处测定吸光度。以磷酸盐缓冲液作为空白溶液。DPPH自由基清除率按式(3)计算。
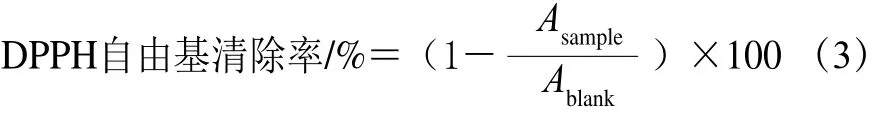
式中:Asample为样品溶液吸光度;Ablank为空白溶液吸光度。
1.3.8.2 ABTS阳离子自由基清除能力
参照Re等[17]方法进行ABTS阳离子自由基清除能力测定。用0.2 mol/L pH 7.4的磷酸盐缓冲液配制质量浓度为3.0 mg/mL的样品溶液。7 mmol/L ABTS储备液与2.45 mmol/L过硫酸钾在暗处反应16 h制备ABTS工作液,随后用磷酸盐缓冲液稀释,使其在734 nm波长处的吸光度为0.70±0.02。取50 μL样品溶液加入到4 mL已稀释的ABTS溶液中并在黑暗中反应6 min,在734 nm波长处测定吸光度。以磷酸盐缓冲液作为空白溶液。ABTS阳离子自由基清除率按式(4)计算。

式中:Asample为样品溶液吸光度;Ablank为空白溶液吸光度。
1.3.8.3 氧化自由基吸收能力测定
参照Bitzer等[18]的方法进行氧化自由基吸收能力(oxidative radical absorption capacity,ORAC)测定,并稍作调整。将样品用75 mmol/L pH 7.4磷酸盐缓冲液溶解至终质量浓度为0.2 mg/mL,Trolox(12.5、25、50、75、100 μmol)作为对照。加入20 μL样品溶液及Trolox于96 孔酶标板中,再加入120 μL荧光素钠溶液,在37 ℃条件下反应12 min后,加入60 μL AAPH诱发反应,设定酶标仪的激发波长为485 nm、发射波长为535 nm,每1 min测定1 次荧光强度,测定120 min。测定结束后计算荧光强度-时间曲线即荧光衰减曲线下面积(area under curve,AUC),用磷酸盐缓冲液作为空白,AUC样品-AUC空白与以Trolox溶液绘制的标准曲线相较,将样品的抗氧化能力转化为Trolox浓度(μmol/L)。
1.3.9 LC-MS/MS鉴定
SPH-F和SPH-F-GI样品经毛细管HPLC脱盐及分离后用Q Exactive MS仪进行分析。将样品从自动取样器加载到Zorbax 300SB-C18peptide traps柱,再通过C18反相柱(150 mm×75 μm,5 μm)进行分离。流动相洗脱液A为含体积分数0.1%甲酸的超纯水,洗脱液B为含0.1%甲酸的乙腈溶液(体积分数84%)。洗脱流速为250 nL/min,洗脱条件:0~50 min,洗脱液B体积分数为4%~50%;50~54 min,洗脱液B体积分数为50%~100%;54~60 min,洗脱液B体积分数保持在100%。多肽和多肽碎片的质荷比按照下列方法采集:每次全扫描后采集10 个碎片图谱(MS2 scan);采用正离子模式扫描,扫描范围m/z100~2 300;使用maxquant数据库进行搜索;根据BIOPEP数据库查找具有抗氧化活性的肽的序列。
1.4 数据统计与分析
所有实验均重复3 次,利用方差分析进行差异显著性分析,并用Origin 8.0和Excel软件分析数据并作图,P<0.05时为差异显著。
2 结果与分析
2.1 大豆蛋白DH和回收率分析

图1 SPE和模拟GI消化样品的DEFig. 1 Degree of hydrolysis of SPHs and their digests
DH是监测蛋白质水解的关键参数[12]。由图1可知,在模拟GI消化期间,SPH-A和SPH-F的DH遵循类似的趋势,都呈上升趋势,胃蛋白酶消化2 h后,SPH-A-G和SPH-F-G的DH分别仅达到18.78%和13.49%,DH低可能是由于胃蛋白酶是一种内肽酶,它对切割肽键具有高度特异性,其中羧基由芳香族氨基酸如苯丙氨酸、酪氨酸和色氨酸提供[19]。然而,在随后的胰酶消化期间样品DH均迅速增加,尤其是SPH-A-GI的DH达到29.31%。这是由于胰酶是一种酶混合物,胰酶表现出胰蛋白酶(精氨酸和赖氨酸位点肽键断裂)、胰凝乳蛋白酶(苯丙氨酸、酪氨酸、色氨酸和亮氨酸位点肽键断裂)和弹性蛋白酶(丙氨酸和其他脂肪族氨基酸的肽键断裂)的活性[20]。计算得到SPH-A和SPH-F的水解蛋白回收率分别为79.28%和77.41%。
2.2 SPH及其模拟GI消化后产物的分子质量分布分析
利用HPLC法测定SPH、SPH-G、SPH-GI样品的分子质量分布如图2所示。

图2 SPH和模拟GI消化样品的分子质量分布Fig. 2 Molecular mass distribution of SPHs and their digests

表1 SPH和模拟GI消化样品的分子质量分布Table 1 Percentages of fractions with different molecular masses in SPHs and their digests
由表1可知,未消化的SPH-A和SPH-F样品中,分子质量大于10 kDa的肽的相对含量分别为23.21%和44.15%,这表明原料经过碱性蛋白酶和风味蛋白酶酶解后产生了相当大量的大豆蛋白多肽,但是一些蛋白质对酶水解具有抗性并且保持完整。SPH-A和SPH-F经过胃蛋白酶消化后,分子质量大于10 kDa的肽相对含量明显降低,分子质量为5~10 kDa的肽相对含量增加,这说明胃蛋白酶破坏了链内肽键,主要产生较大的肽段。而经胰酶消化后,分子质量小于1 kDa的肽相对含量明显增加,说明胰酶不仅将SPH-A-G和SPH-F-G水解成更小的片段,而且由于其更大的水解活性而产生更多的游离氨基酸[21],这些变化与上述DH变化一致,其中SPH-F-GI样品中分子质量小于1 kDa的肽相对含量最高,为17.35%。Zhang Qiaozhi等[15]也报道了同样的多肽水解趋势,大豆蛋白水解物经胃蛋白酶和胰酶消化后,大于10 kDa的肽相对含量降低,小于1 kDa的肽相对含量同时增加。水解产物的分子质量分布也可能对其抗氧化活性产生影响,因为较低分子质量的肽具有更强的抗氧化活性[22]。据报道,抗氧化肽大多含有20 个以内的氨基酸残基,分子质量越低,穿过肠屏障并发挥生物效应的可能性就越高[23]。源自食物来源的大多数抗氧化肽的分子质量范围为0.5~1.8 kDa[4]。
2.3 SPH及其模拟GI消化后产物的氨基酸组成分析
尽管氨基酸组成不是评估肽抗氧化能力的唯一标准,但是模拟GI消化过程中确定其变化也很重要,在模拟GI消化期间释放的游离氨基酸和肽的含量和组成可以提供关于蛋白质水解产物抗氧化活性的信息[24]。在酶水解和GI消化过程中,一些氨基酸会失去其生物利用度。例如,当蛋白质暴露于高温和强碱性条件下时,通过美拉德反应、异肽交联及氨基酰基残基的外消旋化可以发生赖氨酸的损失[25]。肽的抗氧化活性是基于分子质量、特定氨基酸的存在及其在序列中的特定定位[26]。

表2 SPH和模拟GI消化样品的氨基酸组成Table 2 Amino acid compositions of SPHs and their digests
由表2可知,与SPH-A相比,SPH-F中游离氨基酸含量更高,这可能由于风味蛋白酶是复合蛋白酶,其含有的氨肽酶和羧肽酶会通过末端水解多肽,因此游离氨基酸更多。SPH-A和SPH-F经过模拟GI消化后,游离氨基酸含量增加。同时相对于胃蛋白酶消化后,经过胰酶消化后,游离氨基酸含量明显增加,这是由于胃蛋白酶消化期间,一些肽主要被分解成小片段,然而在胰酶消化后,这些肽水解更完全[27]。经过模拟消化后,SPH-F-GI样品中肽的相对含量相对于SPH-A-GI更高,为75.86%,即超过70%的最终消化物仍然以肽的形式存在,这使它们更易于吸收和具有抗氧化活性。
2.4 SPH及其模拟GI消化后产物的抗氧化活性测定结果

表3 SPH和模拟GI消化样品的抗氧化活性Table 3 Antioxidant activity of SPHs and their digests
由表3可知,SPH-A比SPH-F抗氧化活性更高。这可能是由于SPH-A中的肽含量更高,并且肽中HAA和组氨酸含量也更高(表2)。水解产物中HAA残基的存在可以增强与食物中脂质的相互作用,通过与膜脂双层发生疏水相互作用增强抗氧化剂进入靶器官[28]。而组氨酸由于存在咪唑环,因此尤其具有强烈的自由基清除活性[29]。经过模拟GI消化后,SPH-F-GI样品的抗氧化活性比SPH-A-GI样品更高,可能是由于肽的相对含量更高,并且肽中HAA、AAA及NCAA含量更高。据报道,富含AAA的肽通过直接电子转移显示出自由基清除作用,并抑制脂质氧化副产物的产生[30]。已有报道显示,NCAA具有很强的抗氧化作用,因为它们可以提供电子来猝灭自由基[31]。
2.4.1 ABTS阳离子自由基清除能力测定结果
ABTS阳离子自由基清除率的测定可以应用于亲脂性和亲水性化合物,并且已经广泛用作抗氧化活性测定[32]。由表3可知,相对于SPH-F,SPH-A的ABTS阳离子自由基清除率更高,为55.84%。SPH-F和SPH-A经过胃蛋白酶消化后,ABTS阳离子自由基清除率增加不明显甚至减小,这是因为胃蛋白酶处理后消化产物的疏水性增加,使得它们不太可能与水溶性ABTS反应,胃蛋白酶在切割疏水性和芳香族氨基酸如Phe、Trp和Try之间的肽键方面最有效[20]。当胃蛋白酶消化产物用胰酶水解时,额外的肽键裂解导致较短肽(三肽和二肽)和游离氨基酸积累,因此变得更亲水,可以更容易地与水溶性ABTS反应[33],因此ABTS阳离子自由基清除率增加。SPH-A-GI的ABTS阳离子自由基清除率比SPH-F-GI小,这可能是由于SPH-A经过模拟GI消化后水解过度,产生大量游离氨基酸。
2.4.2 DPPH自由基清除能力测定结果
DPPH自由基是一种稳定的自由基,其与抗氧化剂发生单电子配对而被清除,DPPH自由基清除率的测定已被认为是评价抗氧化活性的有效方法[34]。由表3可知,SPH-F和SPH-A经过胃蛋白酶消化后,DPPH自由基清除率增加,但是经过胰酶消化后,DPPH自由基清除率降低,这可能是由于在胰酶消化后较短的肽(三肽和二肽)和氨基酸积累,使肠道消化物更加亲水,导致与脂溶性DPPH自由基反应更加困难[33]。SPH-A-GI和SPH-F-GI的DPPH自由基清除率相近,分别为25.98%和27.29%,这可能由于它们分子质量在1~5 kDa范围内的相对含量十分接近。Kimatu等[35]在测定食用菌(双孢蘑菇)蛋白水解物的DPPH自由基清除率时,发现1~3 kDa的肽具有比小于1 kDa和3~5 kDa的肽更高的抗氧化活性。同时,Yu Min等[36]研究表明,大豆豆粕水解产物中1~3 kDa的部分可能具有良好的抗氧化活性。因此说明用分子质量在1~5 kDa范围内的肽主要发挥DPPH自由基清除活性。
2.4.3 ORAC测定结果
ORAC是一种通过氢原子转移(hydrogen atom transfer,HAT)对自由基进行清除的方法[37]。与DPPH自由基和ABTS阳离子自由基测定结果不同,SPH-A和SPH-F的ORAC通过胃蛋白酶消化后均降低,这可能是由于检测方法的反应机制不同,ORAC测定基于HAT,而DPPH自由基和ABTS阳离子自由基测定主要基于电子转移[38]。另一方面,其他可能的植物化学物质,如酚类化合物、类黄酮、多糖也可以产生抗氧化活性[39],导致不同的抗氧化作用结果。相对于SPH-A-GI,SPH-F-GI的ORAC更高,为69.15 μmol/mg,这可根据前面多肽分子质量分布和肽内氨基酸组成进行解释,即SPH-F-GI中分子质量小于1 kDa的肽相对含量更高,并且肽中HAA、AAA及NCAA含量相对更高。
2.7 LC-MS/MS鉴定
综上可知,相对于SPH-A,SPH-F经过模拟GI消化后,抗氧化活性更好,所以对SPH-F和SPH-F-GI进行LC-MS/MS鉴定。根据前期研究可知,食物来源的大多数抗氧化肽的N-末端包含疏水氨基酸残基[4]。以MS的可信度、丰度及抗氧化肽的构效关系为标准对得到的肽段序列进行筛选。SPH-F中得到4 种多肽,氨基酸序列分别为AIPVNKPGRFESF、ALPEEVIQH、SRNELDKGIGTII、AFPGSAKDIENLIK。SPH-F-GI中得到5 种多肽,氨基酸序列分别为ALPEEVIQH、A I P V N K P G R F E S F、F G R E E G Q Q Q G E E R、ALPEEVIQHT、FREGDLIAVPT。后续可对这些肽进行合成,并鉴定其抗氧化特性。
3 结 论
在模拟GI消化期间,胰酶处理使SPH-A和SPH-F的DH显著增加,分别达到29.31%和20.42%,相对于SPH-F-GI,SPH-A-GI有更大的DH。经过模拟GI消化后,SPH-A和SPH-F分子质量大于10 kD组分的相对含量降低,小于1 kDa组分的相对含量增加,其中,其中SPH-F-GI样品中分子质量小于1 kDa的肽相对含量最高,为17.35%。SPH-F-GI样品中肽的含量较SPH-A-GI更高,为75.86%,并且肽中HAA、AAA及NCAA含量更高。整体而言,相对于SPH-A-GI,SPH-F-GI的抗氧化活性更好,ORAC为69.15 μmol/mg,DPPH自由基清除率为27.29%,ABTS阳离子自由基清除率为56.21%;同时,通过胃蛋白酶和胰酶的消化改善了SPH-F的抗氧化活性。以后可进一步研究并鉴定SPH-F经过模拟GI消化后得到肽的抗氧化活性。

