miR-203a-3p抗弥漫性大B细胞淋巴瘤的作用及机制研究
赵 婷, 刘安生, 王 华
弥漫性大B细胞淋巴瘤(diffuse large B cell lymphoma,DLBCL)是一种非霍奇金淋巴瘤,也是一种具有高度侵袭性的淋巴系统弥漫性恶性增生性疾病,存在生发中心B细胞样和活化B细胞样两个主要分子亚型[1-4]。现阶段治疗DLBCL多采用利妥昔单抗联合化疗,虽然可以有效治疗大多数患者,但仍有约1/3的患者存在难治愈和复发的情况[5-6]。因此,有必要进一步了解DLBCL发生的分子机制,确定新分子靶点和治疗策略,提高DLBCL患者的预后率。
微小RNA(microRNA,miRNA)是一组长度为18~23个核苷酸的非编码RNA[7]。越来越多的研究发现,miRNA作为肿瘤的抑制剂或者癌基因参与人类多种不同类型的疾病[8]。有研究报道,miRNA可通过与mRNA 3′-UTR碱基互补配对来调节基因的表达,因此miRNA的失调与肿瘤的发生、转移和预后密切相关[9-10]。miR-203a-3p在很多肿瘤中已被研究,如在鼻咽癌中,通过抑制LASP1蛋白的表达抑制鼻咽癌细胞的增殖和代谢[11],在胃癌中下调胰岛素样生长受体-1(insulin like growth factors receptor 1, IGF-1R)抑制肿瘤的增殖[12]。然而,在DLBCL细胞中,miR-203a-3p的生物学作用和机制尚不清楚。FOXP1是FOXP家族成员之一[8],参与机体的多种生理过程,且过表达于多种肿瘤组织中,与肿瘤的发生发展密切相关[13-15]。本研究拟检测miR-203a-3p和FOXP1在DLBCL组织中的表达水平,同时探究二者对DLBCL细胞增殖和侵袭的作用,揭示miR-203a-3p和FOXP1在DLBCL发生发展中的作用机制,为DLBCL患者的预后提供新的实验依据。
1 材料与方法
1.1材料
1.1.1组织 收集30例DLBCL组织,均经病理证实(根据2008年世界卫生组织的分类),患者均未接受过相关治疗。另取20例淋巴结反应性增生(reactive hyperplasia of lymphnode, RH)组织作为对照。本研究经医院伦理委员会批准,患者均知情同意。
1.1.2细胞 人DLBCL细胞株SU-DHL-4和HBL-1(编号:BNCC 340176和BNCC 341660,上海中国科学院细胞库),用含体积分数为10%的胎牛血清、100 U/mL青霉素和100 μg/mL链霉素的RPMI 1640培养液培养细胞,培养温度为37 ℃,二氧化碳的体积分数为5%。
1.1.3试剂 RPMI 1640培养液(批号:R8758,美国Sigma公司);胎牛血清(南美特级,批号:40130ES76,美国Hyclone公司);miR-203a-3p模拟物(miR-203a-3p mimic)及其相应的对照物(NC-mimic)(广州日博生物有限公司);FOXP1小干扰RNA(si-FOXP1)及其对照物(Scramble)(美国Santa公司);荧光素酶报告基因质粒(美国Promega公司);FOXP1过表达质粒(pcDNA-FOXP1)(美国Addgene公司);Cell Counting Kit-8(CCK-8)试剂盒(批号:C0029,碧云天生物技术有限公司);Wnt1(货号:ab105740)、β-catenin(货号:ab6302)、Cyclin D1(货号:ab134175)及c-Myc(货号:ab32072)(艾博抗生物科技有限公司);山羊抗兔二抗(货号:31402,美国赛默飞科技公司)。
1.1.4仪器 Esco CelSafe CO2培养箱(艺思高生物科技有限公司);奥林巴斯倒置显微镜(CKX53,明美光电技术有限公司);SpectraMax iD5多功能微孔板读板(Molecular Devices公司);流式细胞仪(FACS Calibur,美国BD公司);实时荧光定量PCR仪(美国ABI StepOne公司);SDS-PAGE凝胶电泳仪(JX196552JY-JX5,邢台润联科技有限公司)。
1.2方法
1.2.1细胞转染 将SU-DHL-4和HBL-1细胞接种到24孔板中,待细胞密度达70%时进行转染。3 μL的Lipofectamine RNAiMAX试剂和1 μL miRNA或siRNA分别稀释到50 μL无血清的培养液中,混合5 min后,将稀释好的Lipofectamine RNAiMAX试剂加入稀释好的miRNA或siRNA中孵育10 min,再加入培养板中孵育24 h。将2.5 μg的pcDNA-FOXP1与空载质粒(Vector)分别与5 μL Lipofectamine RNAiMAX共同混合在125 μL的无血清培养液中,与细胞共孵育。
1.2.2RNA提取和实时定量PCR 组织和细胞总RNA的提取使用TRIzol试剂,按照说明书的要求操作。检测miRNA采用实时定量聚合酶链反应,使用TaqMan微小RNA逆转录试剂盒,反转录条件:16 ℃ 30 min→42 ℃ 30 min→85 ℃ 5 min。U6为miRNA的内参标准。mRNA检测采用M-MLV逆转录酶,cDNA扩增采用PrimeScript RT Master Mix,反转录条件:95 ℃ 10 min,40个循环,95 ℃ 15 s→60 ℃ 60 s。GAPDH作为内参基因,采用2-ΔΔCt方法计算miR-203a-3p和FOXP1的表达。引物如下:
miR-203a-3p:
正向:5′-GGCGGGCTGAAATGTTTAGGA-3′
反向:5′-GTGCAGGGTCCGAGGTATTC-3′
FOXP1:
正向:5′-TCAGTGGTAAC CCTTCCCTTA-3′
反向:5′-GTACAGGATGCACGGCTTG-3′
1.2.3细胞增殖 采用CCK-8试剂评估细胞增殖。收集对数期的细胞接种在96孔板中,并调整细胞密度为每孔3×104个,培养24 h后进行转染,继续培养24,48和72 h。培养结束后每孔加入10 μL CCK-8,37 ℃孵化2 h后,用微型平板分析仪测定光密度值(OD值)。
1.2.4细胞侵袭 细胞以每孔3×104个接种到24孔板小室,下层添加含10%胎牛血清的培养基。孵育24 h后,仔细去除未迁移的细胞,用体积分数为4%的多聚甲醛固定后,用体积分数为0.1%的结晶紫染色15 min。在显微镜下计算5个视野的细胞侵袭数并计算平均值。
1.2.5细胞凋亡 将细胞消化处理后收集到对应的EP管中,用磷酸盐缓冲液清洗3次,将5 μL Annexin V-FITC和5 μL碘化丙啶在黑暗中加入装有样品的EP管中,室温下孵育20 min,采用流式细胞仪检测细胞凋亡情况。
1.2.6荧光素酶报告基因分析 使用microrna.org数据库预测miR-203a-3p和FOXP1之间的靶向关系。构建野生型FOXP1质粒(WT-FOXP1)和突变型FOXP1质粒(Mut-FOXP1)荧光素酶报告载体,采用脂质体3 000分别将WT-FOXP1和Mut-FOXP1与miR-203a-3p mimic和NC-mimic共转染,24 h后使用双荧光素酶测定系统测定荧光素酶活性。
1.2.7免疫印迹 收集细胞并用RIPA裂解液提取总蛋白,使用BCA试剂盒测定蛋白浓度。上样后用转膜仪将蛋白转移至PVDF膜,用5%脱脂牛奶封闭1 h,洗膜后一抗孵育4 ℃过夜,加二抗室温孵育2 h,ECL试剂检测蛋白。
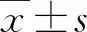
2 结 果
2.1miR-203a-3p在DLBCL组织中的表达水平 与RH组织比较,DLBCL组织中miR-203a-3p的表达水平显著降低(P<0.01,图1A)。在SU-DHL-4和HBL-1细胞中,与转染NC-mimic比较,转染miR-203a-3p mimic可显著增加两种细胞株中miR-203a-3p的表达水平,差别均具有统计学意义(P<0.01,图1B)。
2.2过表达miR-203a-3p对DLBCL细胞的增殖、侵袭和凋亡的影响 与NC-mimic组比较,过表达miR-203a-3p能够明显抑制SU-DHL-4和HBL-1细胞的增殖(P<0.01,图2A和2B);Transwell实验结果显示,两种细胞株的相对侵袭细胞数在转染miR-203a-3p mimic后明显降低(P<0.01,图2C)。而凋亡实验结果显示,过表达miR-203a-3p可显著诱导细胞凋亡(P<0.01,图2D和2E)。

nRH=20; nDLBCL=30. A:qPCR检测miR-203a-3p 在RH和DLBCL组织中的表达;B:转染miR-203a-3p mimic后,qPCR检测转染效率. 与NC-mimic组比较,△△:P<0.01.图1 miR-203a-3p在DLBCL组织中的表达水平Fig 1 The expression of miR-203a-3p in DLBCL tissues
2.3FOXP1与miR-203a-3p的关系研究 采用microrna.org数据库预测到在FOXP1的3′-UTR区域存在与miR-203a-3p的结合位点(图3A)。荧光素酶报告基因结果显示,WT-FOXP1质粒和miR-203a-3p mimic共转染后的荧光强度显著低于WT-FOXP1质粒和NC-mimic共转染组(P<0.01,图3B),而Mut-FOXP1质粒和miR-203a-3p mimic共转染后的荧光强度与Mut-FOXP1质粒和NC-mimic共转染后无明显区别。DLBCL患者组织中FOXP1的表达水平显著高于RH组(P<0.01,图3C和3D),SU-DHL-4和HBL-1细胞转染miR-203a-3p mimic后,显著抑制FOXP1的表达(P<0.01,图3E)。
2.4下调FOXP1的表达对DLBCL细胞的增殖、侵袭和凋亡的影响 在SU-DHL-4和HBL-1细胞中转染FOXP1小干扰RNA,FOXP1的mRNA和蛋白水平均显著下调(P<0.01,图4A)。下调FOXP1后,细胞增殖能力明显被抑制(P<0.01,图4B和4C),细胞侵袭能力也显著下降(P<0.01,图4D),而细胞凋亡则明显增加(P<0.01,图4E和4F)。

nRH=20, nDLBCL=30. A:生物信息学网站预测miR-203a-3p与FOXP1的靶向位点及FOXP1的突变位点;B:荧光素酶报告基因实验检测荧光素酶的活性;C,D:qPCR检测RH和DLBCL患者组织中FOXP1的mRNA表达及Western-blot检测组织中FOXP1的蛋白表达量;E:转染miR-203a-3p mimic后FOXP1的表达量. 与NC-mimic和FOXP1-WT组比较,△△:P<0.01;与NC-mimic组比较,##:P<0.01.图3 FOXP1与miR-203a-3p的关系Fig 3 Relationship between FOXP1 and miR-203a-3p
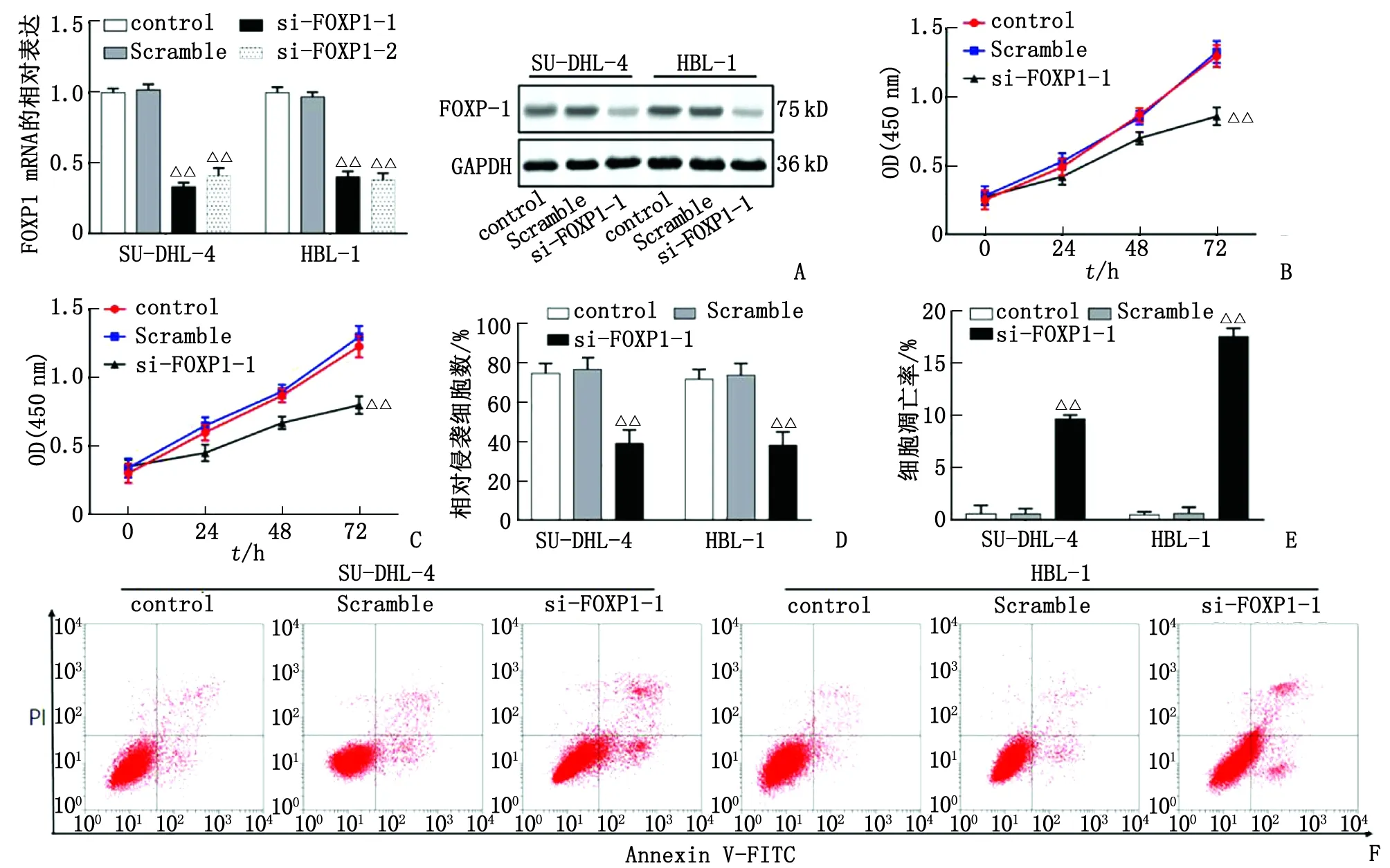
A:qPCR检测转染效率,Western-blot检测FOXP1蛋白表达量;B,C:CCK-8实验检测转染后SU-DHL-4 和HBL-1细胞的增殖能力;D:Transwell实验检测转染后细胞的侵袭能力;E:F图对应的统计分析结果;F:流式细胞仪检测转染后细胞凋亡情况. 与Scramble组比较,△△:P<0.01.图4 下调FOXP1的表达对DLBCL细胞的增殖、侵袭和凋亡的影响Fig 4 Effects of FOXP1 silence on proliferation, invasion and apoptosis of DLBCL cells
2.5过表达FOXP1和miR-203a-3p对DLBCL细胞的增殖和侵袭的影响 单独过表达FOXP1时,FOXP1的mRNA和蛋白水平均高于Vector组(P<0.01),而同时过表达miR-203a-3p和FOXP1时,可逆转单独过表达FOXP1对FOXP1水平的增加作用(P<0.01,图5A和5B)。细胞增殖实验和Transwell实验显示,当细胞转染pcDNA-FOXP1或共转染pcDNA-FOXP1和NC-mimic时,细胞的增殖和侵袭能力均增加,而共转染pcDNA-FOXP1与miR-203a-3p mimic时,FOXP1对细胞增殖和侵袭的促进作用得到逆转(P<0.01,图5B~5F)。凋亡实验结果显示,与Vector组比较,过表达FOXP1可显著抑制细胞凋亡(P<0.05,图5G和5H);而共转染pcDNA-FOXP1与miR-203a-3p mimic时,逆转过表达FOXP1对细胞凋亡的抑制作用。
2.6miR-203a-3p和FOXP1对Wnt/β-catenin信号通路的影响 免疫蛋白印迹实验结果显示,过表达miR-203a-3p或下调FOXP1时,Wnt1,β-catenin,Cyclin D1和c-Myc的蛋白水平显著降低(P<0.01);共转染miR-203a-3p mimic和si-FOXP1时,可进一步降低Wnt/β-catenin信号通路相关蛋白的表达(P<0.01);而过表达FOXP1可显著增加Wnt1,β-catenin,Cyclin D1和c-Myc的蛋白表达水平(P<0.01);当共转染miR-203a-3p mimic和pcDNA-FOXP1时,Wnt1,β-catenin,Cyclin D1和c-Myc的表达水平得到逆转(P<0.01,图6)。

1:NC mimic+Scramble;2:NC mimic+Vector;3:miR-203a-3p mimic+Scramble;4:NC mimic+ si-FOXP1-1;5:NC mimic+pcDNA-FOXP1;6:miR-203a-3p mimic+si-FOXP1-1;7:miR-203a-3p mimic+pcDNA-FOXP1. A:Western-blot实验检测SU-DHL-4转染后Wnt/β-catenin信号通路相关蛋白的表达水平;B:Western-blot实验检测HBL-1转染后Wnt/β-catenin信号通路相关蛋白的表达水平;C,D分别是A,B对应的统计分析结果. 与NC-mimic+Scramble组比较,△:P<0.05;与NC-mimic+Vector组比较,#:P<0.05;与miR-203a-3p+Scramble组比较,☆:P<0.05.图6 miR-203a-3p和FOXP1对Wnt/β-catenin信号通路的影响Fig 6 Effects of miR-203a-3p and FOXP1 on Wnt/β-catenin signaling pathway
3 讨 论
研究报道,miRNA在人类癌症发展的过程中扮演着重要的角色,其在肿瘤中的生物学作用和机制也逐渐明确[16]。miRNA通过与靶基因的3′-UTR结合来调控与癌症发生发展相关的基因。miRNA的失调同样参与DLBCL的发展过程,如耐泼尼松的DLBCL耐药细胞中,miR-148b表达下调,可促进肿瘤细胞对泼尼松的抗性[17];下调miR-195的表达,可促进DLBCL的发生和免疫逃逸[3];高表达miR-27a通过抑制MET/PI3K/AKT通路促进DLBCL细胞凋亡,进而抑制DLBCL的发展[18]。
以往研究表明,miR-203a-3p在多种肿瘤组织中表达异常,包括肝癌、骨肉瘤及结直肠癌等,提示miR-203a-3p参与肿瘤的发展[19-21]。本研究以miR-203a-3p在DLBCL进展中的作用为出发点,结果发现,在DLBCL组织中,miR-203a-3p的表达量较RH组织显著降低,提示miR-203a-3p在DLBCL中也存在异常表达的现象。当SU-DHL-4和HBL-1细胞过表达miR-203a-3p时,细胞增殖与侵袭受到抑制,且具有显著性,表明miR-203a-3p在DLBCL中发挥抑癌作用。
FOXP1蛋白是多功能转录因子,从参与器官的发生到调节免疫功能代谢都发挥着重要的作用[22]。研究报道FOXP1在多种肿瘤中表达失调,既有抑癌作用,也有作为癌基因的作用,这取决于细胞环境,如Sheng等报道FOXP1在肺癌的发生发展中通过促进肺癌细胞的凋亡而起到保护作用[23];相反,Wang等报道FOXP1能够促进多发性骨髓瘤的进展[24];另有文献报道FOXP1可增强非小细胞肺癌的致瘤性[25],促进肺癌细胞的增殖与侵袭[26]。本研究发现,DLBCL组织中FOXP1的表达水平显著升高,当下调FOXP1时,可显著抑制DLBCL细胞的增殖与侵袭,促进凋亡,说明FOXP1在DLBCL中扮演着癌基因的作用。
通过生物信息学网站预测到FOXP1是miR-203a-3p的一个靶基因,当细胞过表达miR-203a-3p时,FOXP1的表达受到抑制,说明miR-203a-3p可下调FOXP1的表达,而逆转实验同样也说明miR-203a-3p可调节FOXP1的表达。文献报道FOXP1可通过激活Wnt/β-catenin信号通路来促进肿瘤的发生发展[27],因此本研究也进一步探讨miR-203a-3p对FOXP1的调控是否与Wnt/β-catenin信号通路有关。当过表达miR-203a-3p或者下调FOXP1,Wnt/β-catenin信号通路相关蛋白的表达受到抑制,而当高表达FOXP1时,Wnt/β-catenin信号通路处于激活状态,相关蛋白表达水平显著升高,以上结果均说明miR-203a-3p调控FOXP1表达参与DLBCL的发展是通过Wnt/β-catenin信号通路实现的。
综上所述,miR-203a-3p在体外能够抑制DLBCL细胞的增殖、侵袭,促进凋亡,过表达miR-203a-3p能够抑制FOXP1表达,导致Wnt/β-catenin信号通路的失活。这些结果均提示miR-203a-3p是DLBCL中一个重要的抑癌分子,可能成为DLBCL患者早期诊断或治疗的潜在靶点。
——一道江苏高考题的奥秘解读和拓展

