小檗碱调控PI3K/AKT信号通路干预糖尿病动脉硬化的实验研究
朱昌国, 李 帅, 孙艳君, 王玉涛, 孙 岩
(1.山东省济南市人民医院全科医学科, 山东 济南 271100 2.山东省济南市中医医院周围血管病科, 山东 济南 250012 3.山东第一医科大学附属省立医院血管外科, 山东 济南 250021)
全世界约有4.25亿人罹患2型糖尿病(type 2 diabetes mellitus, T2DM),到2045年,这一数字可能增长为6.93亿[1]。糖尿病动脉硬化(diabetic atherosclerosis, DA)是T2DM的并发症之一,可导致肢体缺血、糖尿病足等严重不良后果。T2DM诱发DA的具体机制尚不完全明确。小檗碱(berberine, BBR)属生物碱,是中药黄连的主要成分。近年来,随着现代药理学研究的深入,BBR干预T2DM的效果已被证实[2],且有研究表明,BBR具有抗动脉粥样硬化的作用[3]。在前期的研究中,本课题组利用网络药理学工具探索发现,BBR可能通过调控PI3K/AKT信号通路发挥治疗DA的作用。基于上述理论,课题组拟通过实验研究,观察PI3K/AKT信号通路在DM模型大鼠腹主动脉中的表达变化及BBR的干预作用,为DA的治疗提供新的思路。
1 材料与方法
1.1实验动物:SPF级SD雄性大鼠70只,7周龄,体重(180±20)g。由济南朋悦实验动物繁育有限公司提供,实验动物许可证号:SCXK(鲁)2019-0003。每笼饲养5只大鼠,自由饮水,室温维持在(20±2)℃,普通全价颗粒饲料喂养,适应1周后开始实验。
1.2实验仪器:见表1。

表1 实验仪器
1.3药物及试剂
1.3.1实验用药及制备:盐酸小檗碱溶液(50mg/mL):盐酸小檗碱购于上海麦克林生化科技有限公司,纯度98%,黄色至橙色粉末。溶液制备方法:称取10g盐酸小檗碱,加入200mL生理盐水混匀。
1.3.2主要试剂:见表2。

表2 主要试剂
1.4实验方法
1.4.1建立动物模型:① STZ溶液制备:用0.1M无菌柠檬酸钠缓冲液配制浓度为1%的STZ溶液(PH 4.4)。②分组及造模:将大鼠随机分为正常对照组(NC组)、糖尿病模型组(DM组)和盐酸小檗碱干预组(BBR组)。DM组和BBR组大鼠禁食12h后,按照35mg/kg标准腹腔注射STZ溶液;NC组大鼠腹腔注射相同剂量的无菌柠檬酸钠缓冲液,造模72h后,尾静脉取血测血糖,血糖≥16.65mmoL/L为造模成功[4]。排除造模过程中死亡和造模后未达标的大鼠,每组选用20只开展实验。
1.4.2干预方法:BBR组按照100mg/kg/d的标准每日灌胃给药;DM组和NC组每日给予相同剂量的生理盐水灌胃;每周根据大鼠重量调整用药剂量,连续灌胃6周。
1.4.3标本取材:各组大鼠禁食12h,按照3mL/Kg的标准,采用10%水合氯醛腹腔注射麻醉大鼠,固定于动物手术台上,修剪腹毛,沿腹部正中进入腹腔,显露腹主动脉,收集血液,将腹主动脉标本迅速置入4%多聚甲醛中固定。
1.4.4指标检测:检测各组大鼠血糖(GLU)、血清总胆固醇(TC)、甘油三酯(TG)变化;免疫组化法检测PI3K、AKT、p21的表达水平,于显微镜下观察标本切片免疫组化染色的显色,以细胞核和(或)细胞质出现棕黄色颗粒为阳性。用Image J软件测定标本切片染色的平均光密度值(OD)。
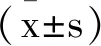
2 结 果
2.1一般情况:造模前各组大鼠体重差异无显著统计学意义(P>0.05)。造模后,NC组大鼠正常进食,体重平稳增长。DM组和BBR组大鼠活动量减少,进食饮水量增多,尿量增加。与NC组大鼠相比,DM组和BBR组大鼠体重明显下降,差异有显著统计学意义(P<0.05);DM组与BBR组大鼠体重差异无显著统计学意义(P>0.05)(见表3,图1)。

表3 造模前后各组大鼠体重变化(g)
2.2血糖水平变化:造模后,DM组和BBR组大鼠血糖水平较造模前及NC组大鼠升高,差异有显著统计学意义(P<0.05);DM组和BBR组大鼠血糖水平差异无显著统计学意义(P>0.05)。经药物干预后,BBR组血糖水平较治疗前降低,差异有显著统计学意义(P<0.05);DM组和NC组大鼠治疗前后血糖水平无明显变化(P>0.05)(表4,图2)。

表4 治疗前后各组大鼠血糖水平变化(mmoL/L)

图1 造模前后各组大鼠体重变化

图2 治疗前后各组大鼠血糖水平变化
2.3血脂水平变化:各组大鼠TC、TG治疗前后差异无显著统计学意义(P>0.05);各组大鼠之间TC、TG差异无显著统计学意义(P>0.05)(表5、6,图3)。

表5 各组大鼠治疗前后血清总胆固醇水平变化(mmoL/L)

表6 各组大鼠治疗前后甘油三酯水平变化(mmoL/L)

图3 各组大鼠治疗前后血脂水平变化
2.4免疫组化结果:灌胃6周后,免疫组化检测各组大鼠腹主动脉PI3K、AKT、p21表达水平。结果显示:与NC组大鼠相比,DM组及BBR组大鼠PI3K表达水平明显升高,差异有显著统计学意义(P<0.05);与DM组相比,BBR组PI3K表达水平明显降低,差异有显著统计学意义(P<0.05);与NC组大鼠相比,DM组及BBR组大鼠AKT表达水平明显升高,差异有显著统计学意义(P<0.05);与DM组相比,BBR组AKT表达明显降低,差异有显著统计学意义(P<0.05);与NC组大鼠相比,DM组大鼠p21表达水平降低,BBR组大鼠p21表达水平明显升高,差异有显著统计学意义(P<0.05);与DM组相比,BBR组p21表达明显升高,差异有显著统计学意义(P<0.05)(表7,图4~8)。

表7 各组大鼠免疫组化结果(OD值)

图4 各组大鼠PI3K免疫组化结果

图5 各组大鼠PI3K免疫组化染色(×400)

图6 各组大鼠AKT免疫组化染色(×400)

图7 各组大鼠p21免疫组化结果

图8 各组大鼠p21免疫组化染色(×400)
3 讨 论
BBR是中药黄连的主要成分。既往的研究证实,BBR可以通过调节脂质代谢、改善血管平滑肌细胞增殖和抑制炎性反应等途径发挥抗动脉硬化作用[5]。此外,BBR还可以降低糖尿病模型大鼠的血糖水平,通过抑制炎性反应、抗氧化等途径干预糖尿病[6]。但BBR是否能调控PI3K/AKT信号通路干预糖尿病动脉硬化发病,尚缺乏研究。
本研究以糖尿病模型大鼠为研究对象,观察BBR对模型大鼠腹主动脉PI3K/AKT信号通路的干预作用。在动物模型制备方面,鉴于STZ诱导大鼠糖尿病模型的性别差异和年龄体重差异,本研究选用7周龄、体重(180±20)g的SD雄性大鼠为研究对象,采用STZ腹腔注射的方法制备糖尿病大鼠模型,模型大鼠均符合实验需求。
诸多研究证实,BBR可以通过改善胰岛素抵抗、促进胰岛素及胰高血糖素样肽-1的分泌、抑制肝脏糖异生、减少肠道细胞对糖的摄取吸收、抑制氧化应激及炎性反应、调控肠道菌群等途径降低血糖水平[7]。结果表明,经治疗,BBR组大鼠血糖水平较治疗前降低,且低于DM组大鼠血糖水平,再次证实了BBR的降糖作用。除血脂异常外,高血糖导致的炎性反应是动脉硬化发病的重要因素。研究证实,颈动脉粥样硬化斑块的检出率与患者空腹血糖、血糖动态变化以及糖化血红蛋白的水平具有相关性,提示高血糖是发生动脉硬化的独立危险因素之一[8]。此外,高血糖水平可以激活核转录因子κB(nuclear factor-κB, NF-κB)信号通路及其下游的细胞间黏附分子(intercellular cell adhesion molecule-1, ICAM-1)的表达水平,促进动脉内皮细胞内炎性因子的聚集和黏附,诱导动脉硬化发病[9]。为验证高血糖对动脉硬化发病的独立影响,本研究采用链脲佐菌素腹腔注射的方法构建糖尿病大鼠模型,以普通全价颗粒饲料喂养并开展实验研究,结果表明,各组大鼠TC、TG治疗前后以及组间比较差异无显著统计学意义,表明该造模方法未对大鼠血脂水平产生影响。
本研究采用免疫组化技术检测了模型大鼠腹主动脉标本PI3K、AKT、p21的表达,发现大鼠糖尿病模型复制成功后,其腹主动脉PI3K、AKT的表达较正常对照大鼠显著升高,而p21的表达则减少;经BBR干预的糖尿病模型大鼠,腹主动脉PI3K、AKT的表达较糖尿病模型大鼠减少,p21的表达增加。上述结果表明,糖尿病模型大鼠腹主动脉PI3K、AKT的表达增加,p21的表达减少,这可能是糖尿病动脉硬化发病的机制之一;BBR可以降低糖尿病模型大鼠血糖水平,减少其腹主动脉PI3K、AKT的表达并上调p21的表达。
磷脂酰肌醇3-激酶/蛋白激酶B(Phosphoinositide 3-kinases/protein kinase B, PI3K/AKT)信号通路广泛参与调控细胞的生长、增殖和分化。近年来,PI3K/AKT信号通路参与动脉硬化发病的研究愈加深入。已有研究证实,与血管内皮细胞损伤的多种信号分子与PI3K/AKT信号通路关系密切,PI3K/AKT信号通路可以通过影响血管内皮细胞的途径,干预动脉硬化发病[10]。此外,研究证实PI3K/AKT参与炎性反应和脂质代谢途径,抑制PI3K/AKT信号通路能够降低动脉硬化模型小鼠血清游离脂肪酸、胆固醇和甘油三酯水平[11]。PI3K/AKT信号通路还可以抑制脂多糖(lipopolysaccharide,LPS)诱导的肿瘤坏死因子α(tumor necrosis factor-α, TNF-α)等促炎介质水平[12]。AKT是PI3K信号通路中处于核心地位的蛋白激酶。在PI3K作用下,AKT可被磷酸化为p-AKT,参与下游因子的激活。国内学者研究发现,C57BL/6动脉硬化模型小鼠的PI3K和p-AKT表达水平显著提高[13]。内皮细胞增殖是动脉硬化发病的重要过程。p21是细胞周期蛋白依赖性激酶(cyclin-dependent kinases, CDK)的抑制因子,可以负向调节细胞周期,即过表达p21,可抑制细胞增殖[14]。研究表明[15],动脉粥样硬化病理状态下,动脉平滑肌细胞内p21表达减少,促使平滑肌细胞增殖,参与动脉硬化发病。上述研究表明,PI3K/AKT信号通路与动脉硬化的发生发展关系密切。
综上所述,BBR可能会通过调控PI3K/AKT信号通路,发挥抑制细胞增殖等作用,干预糖尿病动脉硬化发病。但糖尿病动脉硬化病理过程复杂,且PI3K/AKT参与细胞增殖、凋亡等多种生理病理过程,本研究仅验证了BBR对糖尿病动脉硬化模型大鼠腹主动脉PI3K/AKT信号通路的干预作用,未能对多靶点多通路在糖尿病动脉硬化病理过程中的交互作用开展研究,存在一定的局限性。糖尿病动脉硬化的病理机制和治疗靶点需要进一步研究。

