气相色谱-电子捕获检测器法分析不同产地、不同香型白酒中活性羰基化合物
司波,袁雯雯,贾梦玮,顾会会,卢永翎,吕丽爽*
1(江苏省宿迁市产品质量监督检验所,江苏 宿迁,223800) 2(南京师范大学 食品与制药工程学院,江苏 南京,210023)
白酒是我国传统蒸馏酒,随着我国经济的高速发展,白酒产量和销量逐年增长。白酒发酵过程中产生的醛类化合物通常视为白酒中的呈香、呈味物质[1],近年来,其中甲醛(formaldehyde, FOR)、乙醛(acetaldehyde, ACE)[2]、乙二醛(glyoxal, GO)、丙酮醛(methylglyoxal, MGO)、丙烯醛(acrolein, ACR)、巴豆醛(crotonaldehyde, CRO)、糠醛(furfural, FUR)[3]、5-羟 甲基糠醛(5-hydroxymethylfurfural,5-HMF)、丙醛(propionaldehyde、PRO)、戊醛(valeraldehyde、VAL)、己醛(hexanal、HEX)、苯甲醛(benzaldehyde、BEN)和苯乙醛(phenylacetaldehyde、PHE)等小分子活泼羰基化合物对人体的危害引起医药、食品行业的高度重视[4]。活泼羰基化合物(reactive carbonyl species,RCS)能通过迈克尔加成反应(Michael addition reaction)或席夫碱反应(Schiff base reaction)与蛋白质、核酸、磷脂的亲核位点发生共价结合,导致细胞毒性和致突变性[5-6]。研究证明,RCS体内蓄积可导致癌症、神经退行性疾病、糖尿病并发症、阿尔茨海默症、衰老、动脉粥样硬化等多种疾病[7]。目前白酒中有害物质的研究主要集中在氨基甲酸乙酯[8]、生物胺[9]、氰化物[10]等,而对醛类的研究报道主要集中在FOR[11-12]和ACE[13-14],多种RCS检测研究刚刚起步,如FUR[15]。因此,建立分析白酒中多种RCS检测方法,监控白酒加工过程及成品酒中含量,提高白酒的安全性,具有重要的现实意义。
目前,国外报道的酒类中RCS的检测方法有:采用高效液相色谱-荧光检测器检测葡萄酒[16-17]、酒精饮料[18]中的MGO和GO;气质联用技术检测葡萄酒[19]、啤酒[20]中的MGO、GO和ACR;采用气相色谱-氮磷检测器测定酒精饮料[21]中的MGO和GO,苹果酒中的ACR[22];超高效液相质谱联用技术测定葡萄酒中5-HMF[23];高效液相色谱-光电二极管阵列检测器分析葡萄汁、葡萄酒中5-HMF、FUR和2-糠酸[24]以及朗姆酒中的5-HMF和CRO[25]等其他醛和酯类。白酒生产工艺异于啤酒、葡萄酒,其成品中各类化合物组成、含量也大不相同,方法难以直接套用。迄今除质谱外,尚未有报道同时测定多种RCS的分析方法。采用质谱检测器,成本昂贵,操作难度相对较高,不易在企业和相关行业中推广普及[26-27]。相比而言,高效液相色谱-紫外分析方法简便、易于普及,不过衍生化试剂难以满足多种RCS的同步衍生化,实现同时分析多种RCS。因此,本文拟采用气相色谱法建立同时检测白酒中多种RCS的分析方法。
由于酒体中含有非常多的小分子挥发性物质,如:醇、醛以及各种酯类风味物质等,造成干扰,采用常规气相色谱分析方法难以一次性检出多种RCS。故本文采用衍生化方法,采用气相色谱-电子捕获检测器(gas chromatography-electron capture detector,GC-ECD),旨在建立针对RCS分析的专属方法。方法运行过程中酒体中部分风味醛类也同时检出,故顺势一并进行了定量分析。而后采用该方法对国内市场白酒12种香型,9个产地100多种白酒样品进行了检测,统计学聚类分析了白酒中的7种RCS含量,本研究为检测白酒中存在的RCS含量提供了方法。
1 材料与方法
1.1 材料与试剂
ACR(98%),萨恩化学技术(上海)有限公司;MGO、GO(40%)美国Sigma-Aldrich公司;CRO(99%),Adamas-beta试剂;FUR(99%)、ACE(40%),上海展云化工有限公司;FOR(100 mg/L),生态环境部标准样品研究所;PRO(98%)、VAL(95%)、HEX(98%)、BEN(98%)、O-(2,3,4,5,6-五氟苄基)羟胺盐酸盐[O-(2,3,4,5,6-pentafluorobenzyl) hydroxylamine, PFBHA](98%),日本TCI公司;PHE(95%),阿法埃莎(中国)化学有限公司;1,2-二溴丙烷(98%),上海安谱实验科技股份有限公司;以上均为质量分数;正己烷(色谱纯),德国Merck公司;实验用水为超纯水;其余试剂均为国产分析纯。
实验用成品酒均通过市售或酒厂取样方式获得,12种香型酒样见表1。

表1 白酒样品
1.2 仪器与设备
Agilent 6890 N 气相色谱仪(配有电子捕获检测器)、HP-5MS色谱柱(30 m×0.32 mm,0.25 μm),美国Agilent公司;Thermo Biofuge Stratos超速冷冻离心机、Nanopure超纯水机,美国Thermo公司;Organomation N-EVAP 氮气吹干仪,美国Organomation公司;PWC 254型分析天平,英国ADAM公司。
1.3 实验方法
1.3.1 溶液的配制
1.3.1.1 标准储备液的配制
精确吸取适量ACR、MGO、GO、CRO、FUR、FOR、ACE、PRO、VAL、HEX、BEN和PHE标准品于100 mL棕色容量瓶中,加入乙腈溶解并定容后配制成质量浓度分别为0.03、0.03、0.03、0.12、0.6、0.03、3.0、0.12、0.12、0.3、0.12、0.12 mg/mL的标准品储备液,置于4 ℃条件下避光保存备用。
1.3.1.2 标准系列溶液的配制
精确吸取1.3.1.1中储备液适量于容量瓶中,用乙腈逐级稀释至标准系列溶液,其中ACR、MGO、GO和FOR质量浓度为0.005、0.01、0.02、0.05、0.1、0.25、 0.5、0.75 μg/mL,CRO、PRO、VAL、BEN和PHE质量浓度为0.02、0.04、0.08、0.2、0.4、1、2、3 μg/mL,HEX浓度为0.05、0.1、0.2、0.5、1、2.5、5、7.5 μg/mL,FUR质量浓度为0.1、0.2、0.4、1、2、5、10、15 μg/mL,ACE质量浓度为0.5、1、2、5、10、25、50、75 μg/mL。
1.3.1.3 衍生化试剂溶液的配制
精确称取MOREIRA等[18]适量于干燥的容量瓶中,加入超纯水溶解并定容后配制成质量浓度为5 mg/mL 的水溶液。
1.3.1.4 1,2-二溴丙烷溶液的配制
精确吸取1,2-二溴丙烷标准品适量于容量瓶中,加入正己烷溶解并定容后配制成质量浓度为1 mg/mL 1,2-二溴丙烷储备液,-10 ℃保存。临使用前精确吸取适量储备液于100 mL容量瓶中,加入正己烷溶解并定容后配制成质量浓度为0.5 μg/mL内标1,2-二溴丙烷溶液。
1.3.2 样品前处理
参考文献[28]的方法并进行优化,取适量白酒样品用超纯水将其酒精度(乙醇体积分数)稀释至10%,涡旋混匀,取出3 mL加入5 mg/mL PFBHA 1 mL[29],盖紧试管塞,摇匀,于60 ℃摇床中避光反应1 h,反应结束后冷水冷却,加入50 μL浓硫酸,然后加入4 mL正己烷,涡旋3 min,静置5 min,取出正己烷层(上层)入10 mL玻璃管(含有3 mL0.2 mol/L 硫酸)中,涡旋30 s,静置5 min,取出正己烷层(上层)氮气吹干,300 μL正己烷复溶,用0.22 μm有机滤膜过滤,GC-ECD检测。
1.3.3 色谱条件
色谱柱:HP-5MS色谱柱;升温程序:50 ℃保持1 min, 以4 ℃/min升至220 ℃,再以20 ℃/min升温至250 ℃,保持10 min;载气(N2)流速1 mL/min,压力34.2 kPa,进样量1 μL;不分流进样模式;进样口温度230 ℃,ECD检测器温度300 ℃。
1.4 数据统计及图表绘制方法

2 结果与分析
2.1 色谱峰确立
由图1可知,通过对醛类物质共衍生化条件及色谱条件的优化,各待测物质在气相色谱中分离度良好,空白无杂质峰干扰,达到分析要求。
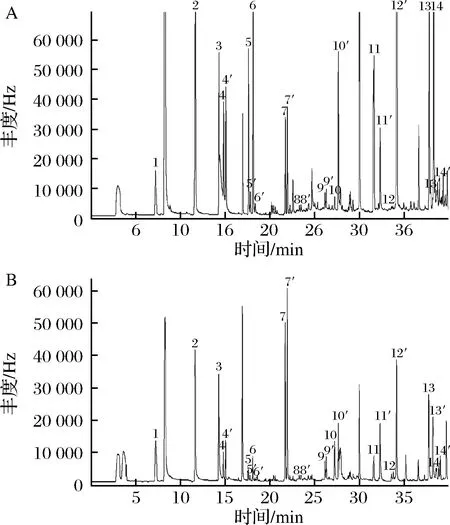
1-1,2-二溴丙烷;2-FOR;3-PFBHA;4,4′-ACE;5,5′-ACR;6-PRO;7、7′-CRO;8、8′-VAL;9、9′-HEX;10、10′-FUR;11、11′-BEN;12、12′-PHE;13、13′-GO;14、14′-MGO
2.2 方法学考察
2.2.1 标准曲线、线性范围、检出限及定量限测定
取标准溶液按照1.3.2方法处理,按1.3.3条件进行GC-ECD分析。以质量浓度为横坐标x,以醛类化合物和内标峰面积比值为纵坐标y,分别绘制标准曲线并计算回归方程。根据信噪比确定检出限(limit of detection, LODs)(信噪比=3)以及定量限(limit of quantitation, LOQs)(信噪比=10)。如表2所示12种 醛类化合物呈现良好的线性关系,相关系数在0.998以上,LODs和LOQs满足分析要求。

表2 醛类化合物的标准曲线、相关系数、线性范围、检出限和定量限
2.2.2 样品稳定性测定结果
将混合标准溶液按1.3.2中的方法处理后,分别4 ℃ 避光放置0、1、2、4、8、16、24 h后在1.3.3中的色谱条件下测定各醛类化合物和内标的峰面积,ACR、MGO、GO、CRO、FUR、FOR、ACE、PRO、VAL、HEX、BEN、PHE衍生物与内标峰面积比值的相对标准偏差(relative standard deviation, RSD)分别为1.18%、2.69%、 1.98%、0.47%、3.70%、1.20%、1.56%、0.61%、 1.94%、1.93%、2.94%、0.62%,结果表明衍生化后样品溶液在24 h内稳定性良好。
2.2.3 加标回收率和精密度测定结果
向已知12种醛类化合物的白酒样品中分别加入高、中、低3个质量浓度水平的混合标准溶液,混合均匀后将样品酒精度稀释至10%,取3 mL按1.3.2方法处理,每个加标水平平行做6次实验,计算相应组分的加标回收率和RSD,结果见表3。12种醛类化合物平均加标回收率为86.98%~109.55%,RSD均<5%,表明该方法精密度良好,准确度高。

表3 加标回收率和精密度结果(n=6)
综上所述,我们采用常用色谱GC-ECD,通过衍生化,建立一种同时定量测定多种RCS (ACR/MGO/GO/CRO/FUR/FRO/ACE)以及风味醛类物质(PRO/VAL/HEX/BEN/PHE)共12种醛类的方法,由此,在没有质谱条件下,采用GC同样可以一次性检测白酒中的风险因子和风味物质等多种醛类。GC成本低,方法简单,稳定性高,能达到较高的精密度和准确度,易于在行业中推广使用。在此基础上,我们对不同香型不同产地的白酒进行了全面分析。
2.3 不同香型成品酒中醛类化合物的分析
不同香型的白酒配料、酒曲、生产工艺、发酵温度、产地等各不相同,根据主体香气成分可分为酱香型、浓香型、清香型、兼香型、米香型、凤香型、芝麻香型、豉香型、特香型、药香型、老白干香型、馥郁香型共12种香型[30]。每种香型选取5种酒样,共定量检测出FRO、ACE、GO、MGO、ACR、CRO、FUR、5-HMF、PRO、VAL、HEX、BEN、PHE 12种醛类物质,与之前的报道相似[31]。由表4可知,酱香型白酒中12种醛类物质总含量最高,芝麻香型次之,豉香型最少;丁醛、VAL、HEX的含量均处于国家标准允许的安全范围[32],其余醛类无国家标准规定。
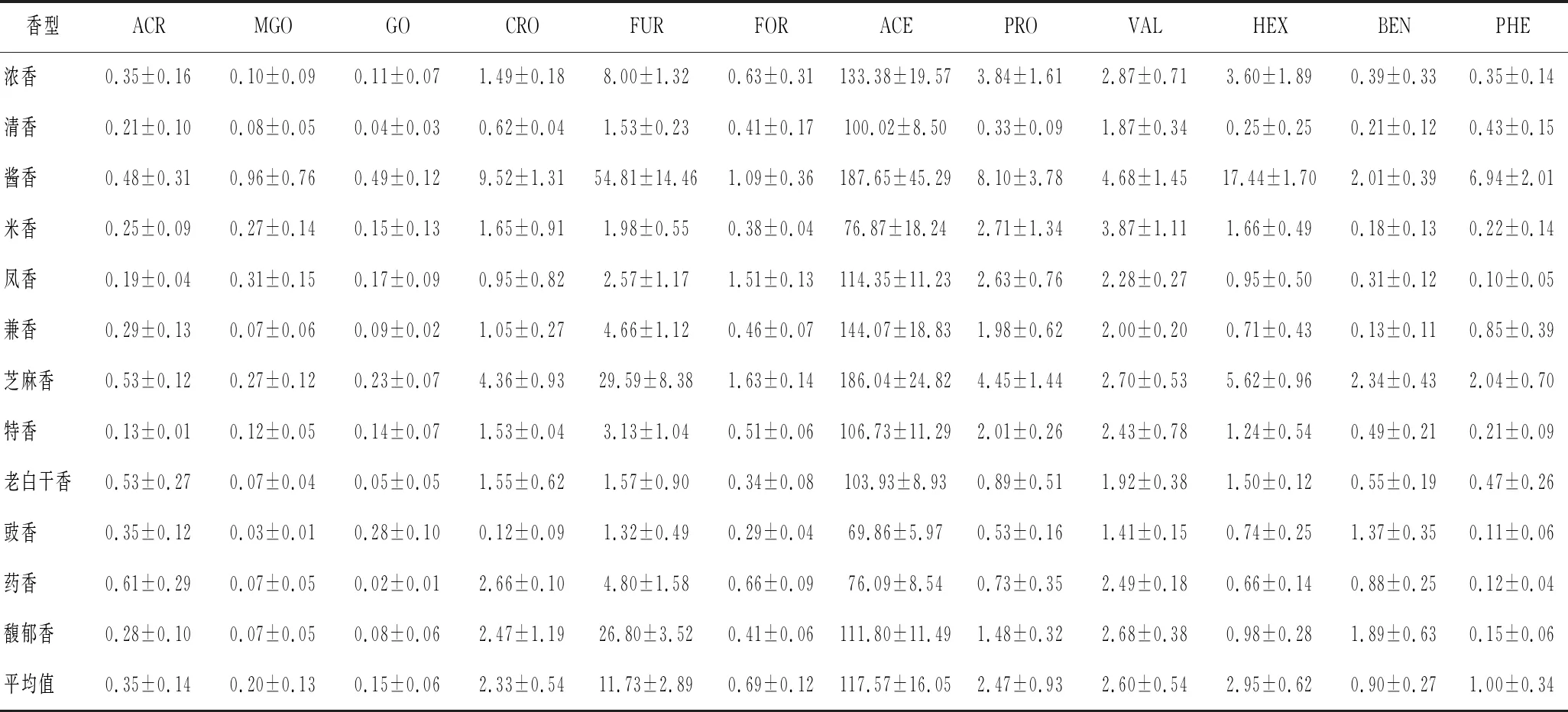
表4 不同香型成品酒中醛类物质含量(n=3) 单位:μg/mL
基于ACR、MGO、GO、CRO、FUR、FOR和ACE 7种RCS含量绘制热图,并对12个香型进行聚类分析。如图2所示,12个香型可归为两大类,第Ⅰ大类包括酱香型和芝麻香型,ACR、MGO、GO、CRO、FUR、FOR和ACE均相对较高,其中GO、CRO、FUR和ACE含量最高,国内已有文献报道芝麻香型酒中ACE含量最高,酱香型次之[13-14];可能是酱香型白酒和芝麻香型白酒均采用高温发酵的生产工艺,酱香型采用高温制曲、高温堆积、高温发酵、高温馏酒,其生产周期长,贮藏时间长;芝麻香型白酒采用高氮配料、高温堆积、高温发酵、高温馏酒[33-34],而较高的温度和高氮配料均有利于美拉德反应进行,已有大量文献报道RCS来源于美拉德反应或部分微生物发酵过程。因此,有必要对酒配料和发酵过程中RCS的形成进一步研究。其余香型可归为第Ⅱ大类。其中,药香型因其ACR含量较高而聚集,药香型白酒采用百草入曲,大、小曲发酵,双醅串蒸,偏碱性筑窑材料,究竟是哪种因素导致ACR含量增高尚需对各种因素综合分析研究。相比而言药香型的其他醛类含量明显较低。凤香型因其FOR含量较高而聚集。豉香型因其GO,ACR含量高而聚集,豉香型白酒在加工工艺会将酒泵入浸肉池,肥肉酝浸多天,而肥肉富含油脂。大量文献报道油脂氧化过程中会产生GO、ACR等[35],这可能是导致酒体中RCS含量增高的原因。老白干香型白酒3种聚类中,7种RCS含量均较低。清香型和特香型白酒中,RCS含量均较低,其中ACR含量最低。馥郁香型白酒除FUR略高,其他RCS含量均较低。浓香型白酒未能聚类,不同样品中7种RCS含量各不相同,反复抽取多种样品实验均未果。酒厂内容调研发现,浓香型白酒基酒存在异地采购勾兑而成现象。是否由于基酒不同造成的影响而不能聚类,有待进一步研究。
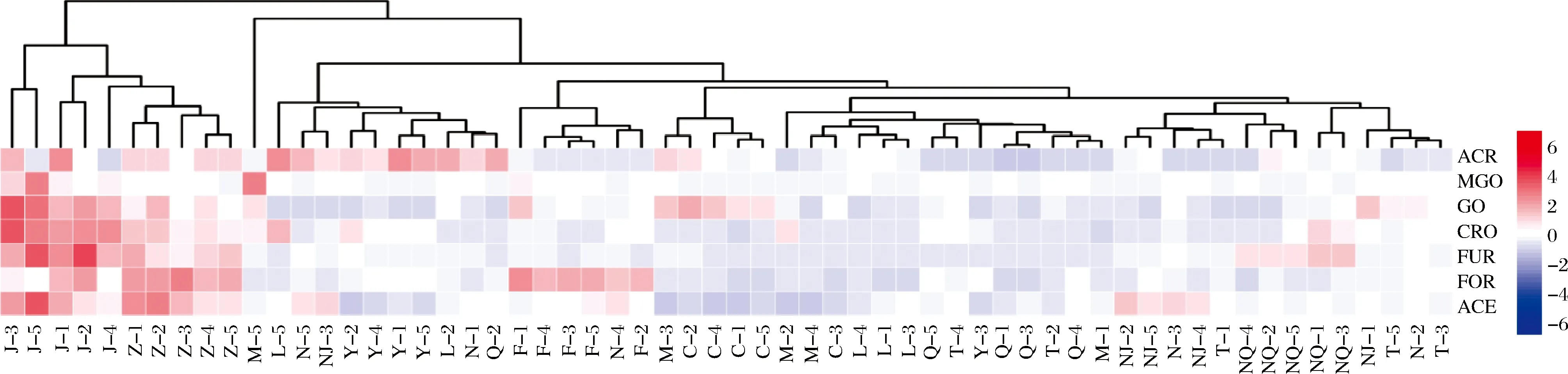
N-浓香型;Q-清香型;J-酱香型;M-米香型;F-香型;NJ-兼香型;Z-芝麻香型;T-特香型;L-老白干香型;C-豉香型;Y-药香型;NQ-馥郁香型
2.4 不同产地成品酒中醛类化合物的分析
各类白酒差异性不仅归因于不同的加工工艺,其地域差异性导致气候、温湿度、水质、发酵微生物等因素也会影响白酒质量。白酒按产区可大致分为6大板块,分别为川黔板块、苏皖板块、鲁豫板块、两湖板块、东北板块和华北板块。本实验初步考察了9个产地的不同成品酒含量,其中RCS采用统计学方法,如表5所示。基于ACR、MGO、GO、CRO、FUR、FOR和ACE 7种RCS含量绘制热图,并对9个产地进行聚类分析。如图3所示,9个产地可归为2大类。贵州单独为Ⅰ类,7种RCS含量均较高,MGO、GO、CRO、FUR和ACE含量最高。四川、湖南、河北、广东,7种RCS含量总和略低,除少数GO含量较高,其余几种RCS含量均较低。江苏和陕西FOR含量较高,其余几种RCS含量略高。此外,贵州、湖南、河北、广东、陕西3个样品完全聚类,四川、山西、江苏其2个样品也能聚类,安徽3个样品各不相同,无法聚类。
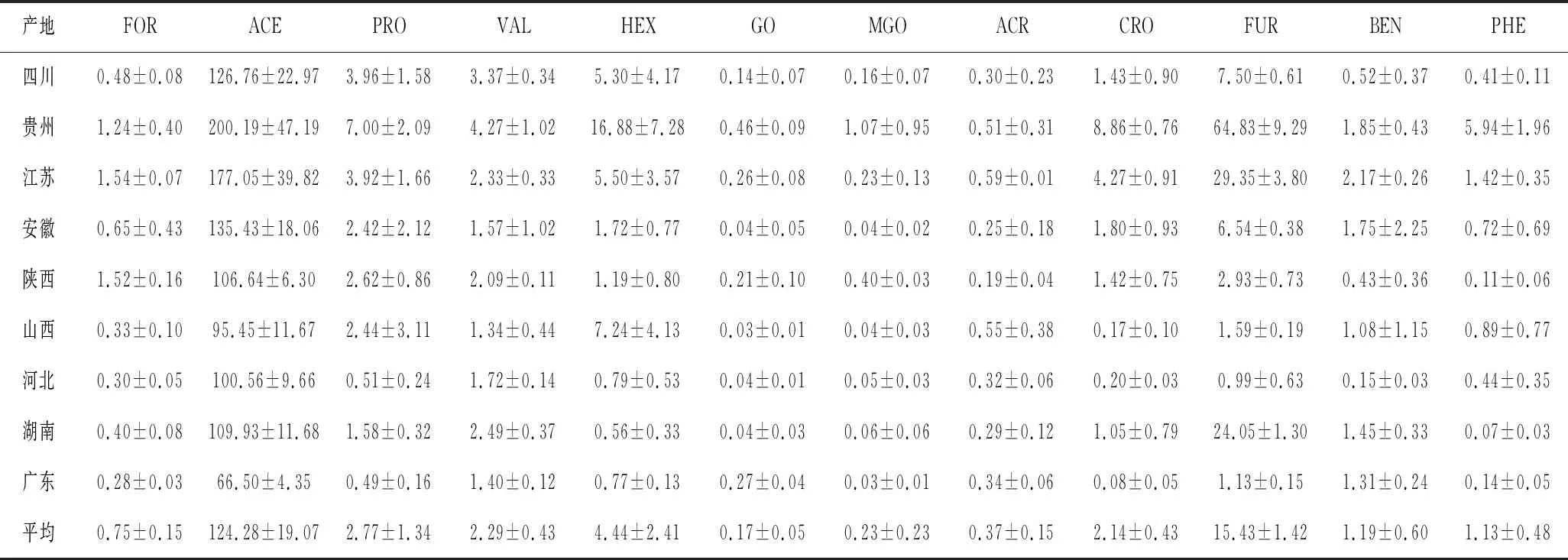
表5 不同产地成品酒中醛类物质含量(n=3) 单位:μg/mL
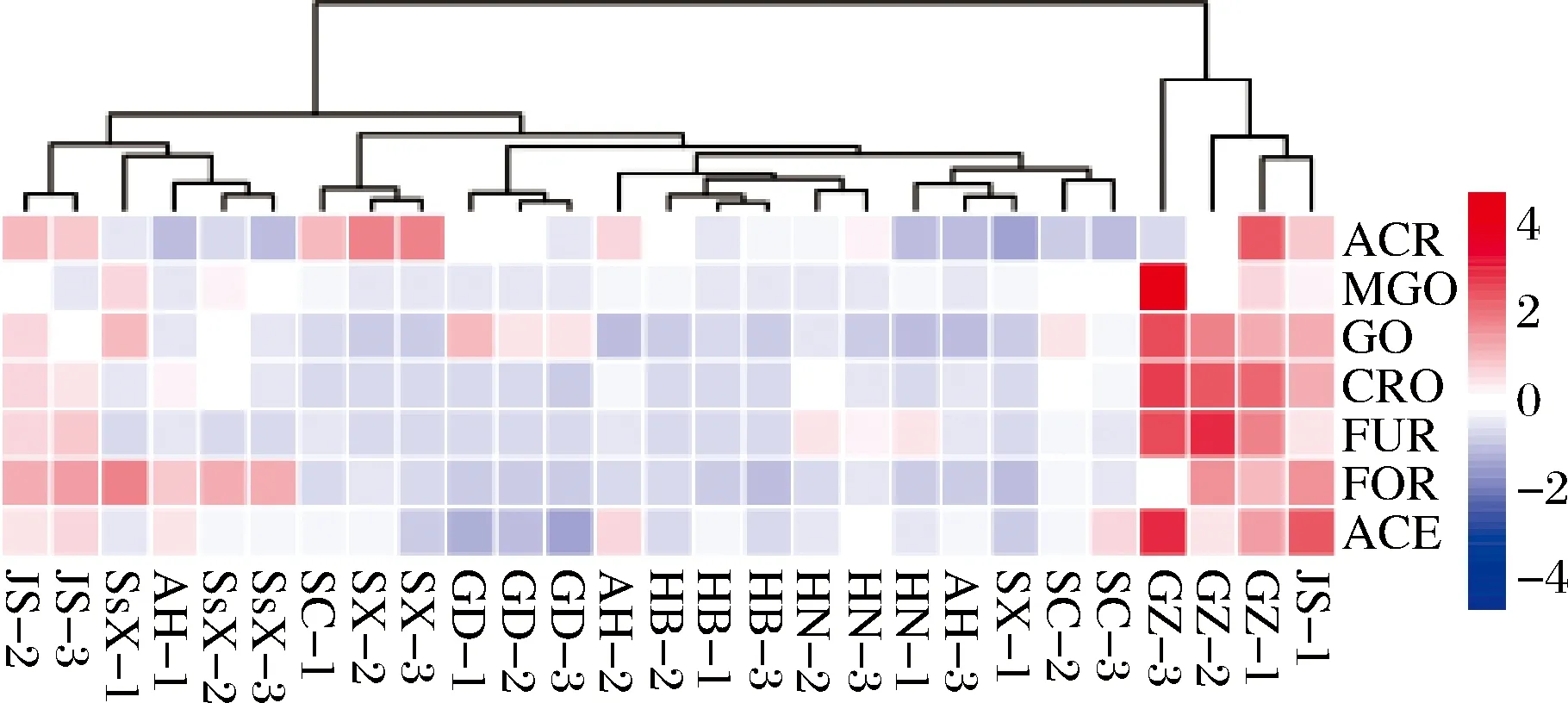
JS-江苏;GZ-贵州;SC-四川;SX-山西;AH-安徽;HN-湖南;HB-河北;GD-广东;SsX-陕西
3 结论
本文建立了一种同时检测白酒中ACR、MGO、GO、CRO、FUR、FOR、ACE、PRO、VAL、HEX、BEN和PHE共12种醛类的GC-ECD分析方法。该方法LODs为0.3~2.0 ng/mL,LOQs为0.9~6.0 ng/mL,回收率86.98%~109.55%,方法的精密度高、稳定性好,灵敏度高,操作简便易行。采用统计学聚类分析法分析了12种香型、9个产地白酒中RCS含量。结果表明,不同香型白酒中7种RCS差异明显,其中酱香型和芝麻香型白酒中RCS含量较高。不同产地对RCS的影响也较为明显。贵州地区生产的白酒中RCS含量较高。而由于白酒配方迥异、加工工艺复杂,水质、气候、微生物等影响因素众多,导致酒体RCS含量高的原因尚需针对具体加工工艺进一步深入研究。