抗HER-2 纳米抗体的筛选、表达及功能鉴定
王丽燕, 李艳宁, 王红霞, 蒋 丹, 张艳婷, 张爱君, 徐广贤,
(1.宁夏医科大学临床医学院,银川 750004; 2.宁夏医科大学基础医学院,银川 750004; 3.广东医科大学医学技术学院,广东医科大学广东省医学分子诊断重点实验室,广东医科大学检验医学研究所,东莞 523808)
人表皮生长因子受体2(human epidermal growth factor receptor-2,HER-2)属于原癌基因,定位于染色体17q21,编码HER-2 受体[1]。20%~30%的原发性浸润性乳腺癌患者过表达HER-2 基因[1],与疾病复发率增加和预后不良密切相关[2]。随着许多类型肿瘤基因组图谱的增加,发现HER-2 基因的过度表达不仅出现于乳腺癌,也出现在其他类型肿瘤中,如胃癌、结肠癌等[3-5]。曲妥珠单抗(trastuzumab)是第一个靶向HER-2 的单克隆抗体[6],具有一定的疗效,但会引发患者心脏毒性,并且容易产生耐药性[7]。因此,寻求更为有效的抗体用于HER-2 基因过表达癌症的治疗显得尤为迫切。
纳米抗体具有分子质量小(15 kDa)、亲和力高、免疫原性低、组织穿透力强、易与隐蔽抗原结合等特点,临床上既可用于肿瘤治疗,也可作为诊断工具[8-9],具有很大发展空间。基于此,本研究在驼源天然噬菌体纳米抗体展示库中,以生物素化HER-2 抗原为靶点,筛选特异性抗HER-2纳米抗体,并与人IgG1 Fc 片段偶联,对重组纳米抗体进行表达与鉴定分析,以期为以HER-2为靶点的疾病检测、诊断与治疗药物研究提供理论参考。
1 材料与方法
1.1 材料
天然噬菌体纳米抗体展示库、大肠杆菌TG1以及辅助噬菌体KM13 均为本实验室保存;SKBR-3 细胞购自中科院细胞典藏库;HER-2 抗原及生物素化HER-2 抗原购自北京百普赛斯生物科技股份有限公司;链霉亲和素磁珠(InvitrogenTMDynabeadsTMM-280 Streptavidin)购自Thermo Fisher Scientific 公司;HRP 标记的羊抗人IgG(H+L)、FITC 标记的羊抗人IgG(H+L)购自Proteintech 公 司;Albumin Bovine、ELISA 包 被 液、ELISA 终止液、TMB 单组份显色液购自北京索莱宝科技有限公司;CCK-8 试剂盒购自日本同仁公司;氯化钠、葡萄糖均为国产分析纯;酵母提取物、胰蛋白胨购自OXOID 公司;脱脂奶粉购自BD公司;HRP 标记的小鼠抗M13 抗体购自北京义翘神州生物技术有限公司;异丙基-β-D-硫代半乳糖苷(isopropyl beta-D-thiogalactoside,IPTG)购自Sigma 公司;DMEM 高糖培养基、胎牛血清购自BI 公司;DNA 测序由上海生工生物工程有限公司提供;其余试剂均为国产分析纯。
离心机购自Sigma 公司;金属浴购自无锡沃信仪器有限公司;酶标仪购自Thermo Fisher Scientific 公司;二氧化碳培养箱购自上海齐欣科学仪器有限公司;超净工作台购自苏州安泰空气技术有限公司;涡旋混匀器购自海门市其林贝尔仪器制造有限公司;水平和垂直电泳仪购自Bio-Rad公司;半干转膜仪购自GenScript 公司。
1.2 方法
1.2.1 抗HER-2 纳米抗体的筛选 1)磁珠清洗:取200 μL 链霉亲和素磁珠用PBS 清洗2 次,弃去洗涤PBS,用新的PBS 补充至200 μL。2)离心管封闭:用含有2%脱脂牛奶的PBS 封闭2 个1.5 mL 离心管,室温孵育1 h,弃去封闭液。3)磁珠封闭:在1.5 mL 离心管中用2% PBSM 封闭100 μL 清洗过的链霉亲和素磁珠,转动台室温孵育1 h,弃去封闭液补充100 μL PBS。4)磁珠和噬菌体文库预孵育:另取2 个1.5 mL 离心管,分别加入救援后的噬菌体文库及50 μL 磁珠,转动台室温孵育1 h 后,弃磁珠,收集噬菌体(抗体)。5)生物素化抗原结合噬菌体(抗体):在已封闭过的2 个1.5 mL 离心管中分别加入500 μL 削减后的噬菌体抗体,向其中1 个离心管加入500 μL 经PBS 稀释的5 μg 生物素化HER-2 抗原,另1 个离心管加入500 μL PBS 作为阴性对照。6)磁珠结合筛选生物素化抗原-噬菌体(抗体):转动台室温孵育1 h,分别加入50 μL 封闭后的磁珠,转动台室温孵育30 min,收集磁珠。7)磁珠洗涤:用含有0.2%Tween-20 的PBS(即PBST)洗涤磁珠7 次,接着用2% PBSM 洗涤2 次,最后用PBS洗涤1 次;每洗涤2~3 次换新的离心管。8)噬菌体(抗体)洗脱:洗涤完成后,分别向离心管中加入800 μL pH 为2.7 的甘氨酸-盐酸,在涡旋混匀器上涡旋8 min 洗脱噬菌体。9)噬菌体(抗体)中和:弃磁珠并向洗脱液中立即加入100 μL pH为9.1 的Tris-HCl 进行中和。10)噬菌体(抗体)侵染TG1 和筛选:取中和液500 μL 加入4 mL OD600 约为0.5 的TG1 菌液中,37 ℃侵染30 min。侵染后的培养物9 000 r·min-1离心5 min,弃上清用100 μL 无抗2×YT 培养基重悬沉淀,涂布于含有100 μg·mL-1氨苄青霉素(ampicillin,Amp)及2 mol·L-1葡萄糖的2×YT 固体培养基上(每个固体培养基20 μL 重悬菌液),过夜培养后收集平板上的菌落用于下一轮筛选,共筛选3 轮。从第2 轮开始,生物素化抗原使用量依次为5 μg、3 μg,且洗涤次数增加。
1.2.2 phage-ELISA 鉴定阳性克隆 从第3 轮筛选后的固体培养基上随机挑取50 个单菌落,按照文献[10]所述,获得噬菌体抗体即上清。将获得的上清与2% PBSM 按4∶1 比例混合后于37 ℃孵育1 h 作为一抗。1)包被:提前一天将HER-2抗原经ELISA 包被液稀释至10 μg·mL-1,按每孔100 μL 加至96 孔酶标板4 ℃过夜包被,同时用PBS 包被作为阴性对照,噬菌体KM13 包被作为阳性对照。2)封闭:次日,用0.05% PBST 洗板3次,每孔加入200 μL 5% PBSM 于37 ℃封闭2 h,洗板3 次。3)一抗孵育:每孔加入100 μL 一抗37 ℃孵育1 h,洗板3 次。4)二抗孵育:每孔加入100 μL 按1∶5 000 比例稀释的HRP 标记小鼠抗M13 抗体,37 ℃孵育1 h 后再次洗板。5)显色及检测:加入TMB 单组份显色液,每孔100 μL,37 ℃避光孵育15~20 min,加入终止液100 μL/孔,于酶标仪上测定450 nm 处OD 值。样品孔OD 值大于阴性对照孔OD 值3 倍及以上界定为阳性克隆,并取相应菌液进行测序。
1.2.3 纳米抗体的表达及纯化 将测序得到的经Blast 比对确定为VHH 的序列,与人IgG1 Fc段偶联后连入载体pET-30a 的NdeI-XhoI 位点之间,然后将重组质粒转入TOP10 克隆菌株。挑取阳性克隆子测序并酶切鉴定后,转入表达菌株大肠杆菌Arctic Express。挑取转化平板上的单克隆扩大培养后,加入IPTG 至终浓度为0.5 mmol·L-1,11 ℃、200 r·min-1振摇过夜,诱导融合蛋白表达。离心后收集菌体沉淀用PBS 重悬后进行超声破碎(功率400 W,工作4 s,间歇8 s,共20 min),并对得到的融合蛋白粗提液经Ni 柱亲和纯化。
1.2.4 重组抗HER-2 纳米抗体的验证 采用表面等离子共振(surface plasmon resonance,SPR)测定重组抗HER-2 纳米抗体与HER-2 抗原的亲和力,Western blot 法对其特异性进行验证。取5 μg HER-2 抗原(1 μg·μL-1),加入5 μL 6×蛋白上样缓冲液及20 μL 去离子水,混匀后在金属浴上95 ℃变性10 min,上样进行SDS-PAGE,转膜后用含5% BSA 的TBST 室温封闭1 h,按1∶1 000 加入纯化后的重组抗HER-2 纳米抗体作为一抗,于低温摇床上4 ℃过夜孵育。次日,洗膜后按1∶5 000 加入HRP 标记的羊抗人IgG,室温孵育1 h 后洗膜并显影。
1.2.5 SKBR-3 细胞的复苏与培养 将SKBR-3细胞复苏后,加入5 mL DMEM 完全培养基于T25细胞培养瓶中,置于37 ℃、5% CO2细胞培养箱进行培养,及时观察细胞状态并进行传代、冻存。
1.2.6 细胞免疫荧光 将处于对数生长期的SKBR-3 细胞用胰酶消化后进行细胞计数,制成1×105个/mL 细胞悬液,向放置了细胞爬片的六孔板中每孔加入2 mL,于细胞培养箱中培养。待细胞贴壁后弃去培养基,4%组织细胞固定液室温固定30 min,PBS 清洗3 次,0.1% Triton 通透10~20 min,PBS 清洗3 次。用含5% BSA 的PBS封闭1 h 后,按1∶20 加入重组抗HER-2 纳米抗体于4 ℃冰箱过夜孵育。次日,用PBS 清洗3 次,按1∶1 000 加入FITC 标记的羊抗人IgG 抗体室温孵育1 h,PBS 清洗3 次,用DAPI 染液染色后进行封片,于激光共聚焦显微镜下进行观察。
2 结果
2.1 抗HER-2 纳米抗体的筛选
采用生物素-链霉亲和素液相筛选法,经3轮筛选后,从每一轮扩大培养的平板上,随机挑取15 个菌落,phage-ELISA 检测450 nm 波长处的吸光度值,初步验证抗HER-2 纳米抗体的富集。如图1 所示,吸光度值逐渐升高,表明3 轮筛选后目的抗体得到了一定程度的富集。在第3 轮筛选后的平板上随机挑取50 个菌落,经ELISA鉴定为阳性克隆(图2),并选取对应菌液测序。测序后经比对得到一条目的序列,并在ExPASy网站对其理化性质进行分析(表1)。

图1 各轮筛选中吸光度值的变化

图2 阳性单克隆吸光度值

表1 抗HER-2 纳米抗体理化参数分析
2.2 原核表达载体的构建及鉴定
基于PAS 的方法设计全长拼接引物,合成基因HER-2-人IgG1 Fc 并与pET-30a 载体连接,转入TOP10 菌株。挑取阳性克隆子测序,结果表明序列与预期相符(图3)。提取重组pET-30a 质粒并进行酶切鉴定(图4),片段符合预期大小,表明原核载体构建成功。
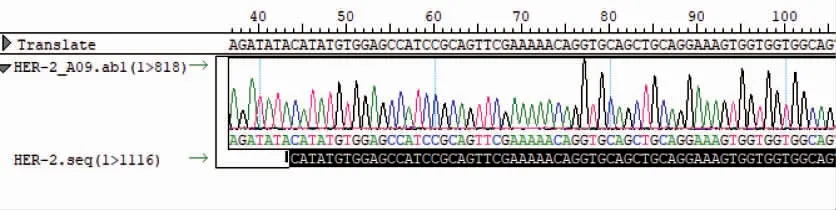
图3 测序结果与预期序列部分比对图
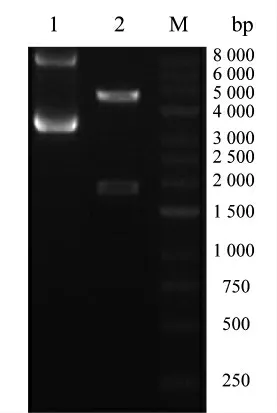
图4 重组pET-30a 质粒酶切鉴定
2.3 纳米抗体的表达及纯化
将重组质粒pET-30a-HER-2-人IgG1 Fc转化至大肠杆菌Arctic Express 中,过夜培养后,挑取单菌落加入IPTG 低温诱导表达,发现目标蛋白主要存在于沉淀中(图5A)。对包涵体变复性重溶目标蛋白,经Ni 柱亲和纯化后进行SDSPAGE 分析,结果显示纯化的目的蛋白符合预期大小,且纯度较高(图5B)。

图5 蛋白表达及纯化SDS-PAGE 分析
2.4 纳米抗体的鉴定
采用SPR 技术对重组抗HER-2 纳米抗体与HER-2 抗原的亲和力进行检测,亲和力测定曲线及拟合曲线见图6A。使用Biacore 8K 分析软件计算亲和力值,为9.34 μmol·L-1,说明重组抗HER-2纳米抗体与HER-2 抗原亲和力较高。以HER-2分子为抗原,纯化得到的重组抗HER-2 纳米抗体为一抗,进行Western blot 实验,结果表明重组抗HER-2 纳米抗体可以与HER-2 抗原特异性结合(图6B)。SKBR-3 细胞表面高表达HER-2,因此以SKBR-3 细胞铺板进行免疫荧光实验,经激光共聚焦显微镜拍照后的结果显示重组抗HER-2 纳米抗体可与SKBR-3 细胞结合(图7)。
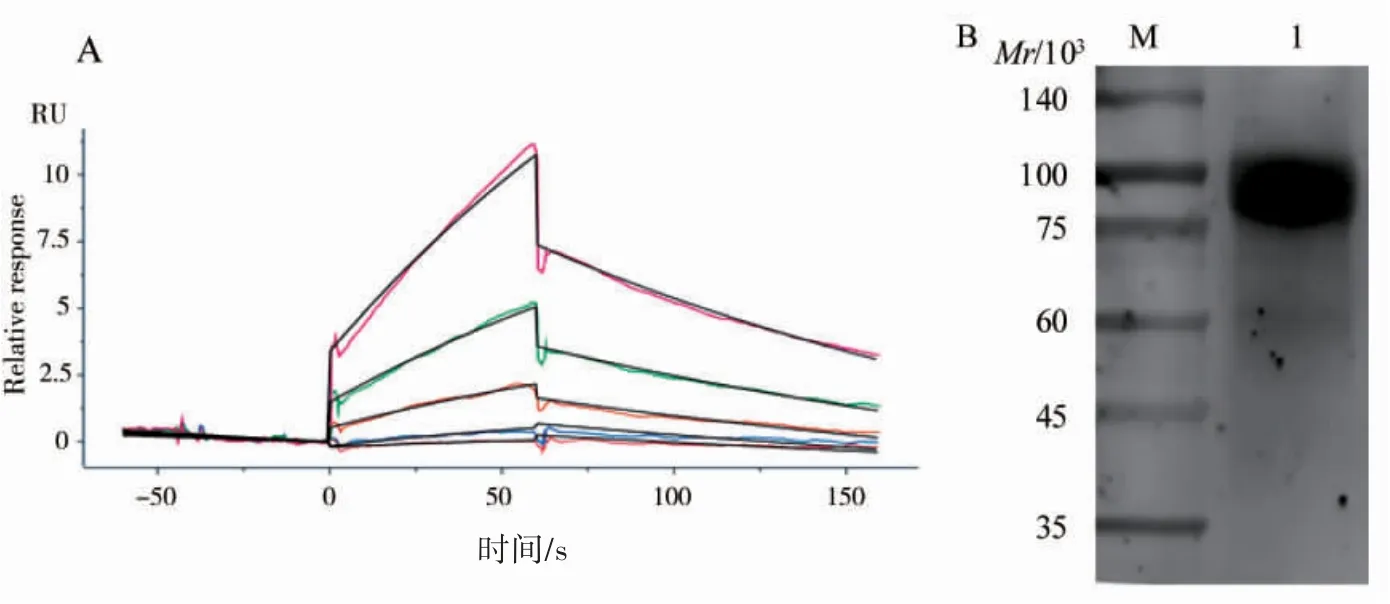
图6 重组抗HER-2 纳米抗体的鉴定
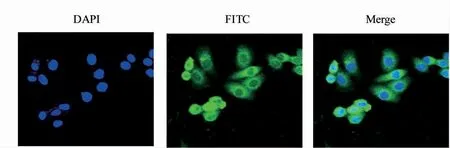
图7 重组抗HER-2 纳米抗体SKBR-3 细胞免疫荧光(×200)
3 讨论
致癌基因HER-2 与人类乳腺癌的发生发展密切相关[11-12],HER-2 基因的过度表达抑制了内部环境中的抗肿瘤免疫[13]。据报道,HER-2 基因过表达与包括乳腺癌和胃癌在内的许多癌症的预后较差有关[14]。曲妥珠单抗是批准用于HER-2 基因过表达的乳腺癌和胃癌患者的第一种单克隆抗体药物[15]。研究[16-17]表明,曲妥珠单抗和化学治疗药物的联合使用可以有效改善乳腺癌患者的无病生存率和总体生存率。曲妥珠单抗联合紫杉醇和多西紫杉醇已被证实可以降低HER-2 阳性乳腺癌患者的病死率并能改善预后[18-20]。然而,曲妥珠单抗并不是对所有患者都有效,有些患者最终会获得耐药性[21]。此外,不可逆转的心脏毒性,特别是充血性心力衰竭,是使用曲妥珠单抗后不可忽视的不良反应,曲妥珠单抗还可以破坏心肌细胞线粒体的功能[22]。因此,发明一种更有效、副反应更少、更容易获得的靶向药物迫在眉睫。
纳米抗体于1993 年首次报道,是在骆驼外周血液中存在的一种天然缺失轻链的抗体[23],是目前已知的可结合目标抗原的最小分子[24]。纳米抗体适合于原核表达和各种真核表达系统[25-26],可广泛应用于治疗抗体药物、诊断试剂、亲和纯化基质和科学研究的开发,并成为新一代治疗性生物医学和临床诊断试剂中的新兴力量。例如,基于纳米抗体构建的嵌合抗原受体(chimeric antigen receptor,CAR)T 细胞能更好地靶向肿瘤微环境,抑制黑色素瘤实体瘤的生长[27]。Mo 等[28]研究利用CRISPR/Cas9 技术将抗CD105 纳米抗体与CAR 结构相连,产生的抗人CD105 CAR-T 细胞在体外表现出对CD105+靶细胞的特异性杀伤效应,体内可显著抑制CD105+移植瘤的生长。Deken 等[29]将针对HER-2的单价纳米抗体与光敏剂偶联,结合光学成像验证了纳米抗体-光敏剂偶联物在肿瘤中的积聚,且在照射后能够在体外诱导选择性的细胞杀伤,特别是HER-2 过表达的细胞。此外,纳米抗体可应用于分子成像,靶向性好,肿瘤部位摄取率高[30-31]。
本研究以HER-2 为靶点,采用生物素-链霉亲和素液相筛选法,增加了筛选到目的抗体的可能性,并且提高了目的抗体的特异性。在驼源天然噬菌体纳米抗体展示库中经过三轮淘筛后,获得了一条抗HER-2 纳米抗体序列。纳米抗体分子质量小,其快速清除的特点对于成像诊断是有利的,但它在治疗学中的应用可能不够。为了延长纳米抗体的半衰期,常见的策略是与白蛋白或Fc 结构域融合。另外,纳米抗体本身可能不足以用于肿瘤治疗,因为它缺乏能够介导细胞毒作用的Fc 结构域[32]。因此,在肿瘤治疗中,纳米抗体相比单克隆抗体更需要与毒素或细胞毒剂偶联。基于此,本研究将筛选到的目的纳米抗体序列与人IgG1 Fc 片段偶联,通过原核表达系统表达并纯化后,经SPR 技术与Western blot 初步鉴定,得到的重组抗HER-2 纳米抗体亲和力与特异性均较好。细胞免疫荧光实验也证实,重组抗HER-2 纳米抗体可以与SKBR-3 细胞表面的HER-2 分子特异性结合。
综上所述,本研究筛选了抗HER-2 纳米抗体序列,与人IgG1 Fc 段偶联后通过原核表达并纯化,所得到的重组抗HER-2 纳米抗体经实验证实其亲和力与特异性均良好,能与表面高表达的HER-2 细胞结合,为后续用于分子成像或疾病的检测治疗提供了有力的技术支持。

