炎性因子与睡眠质量的交互作用对产后抑郁症的影响
尹娇娜, 孙雪玲, 拓明花, 陈 璐, 张思齐, 尚玉秀
(1.宁夏医科大学公共卫生与管理学院,宁夏环境因素与慢性病控制重点实验室,银川 750004; 2.宁夏中卫市人民医院产科,中卫 755000; 3.宁夏中卫市中医医院妇产科,中卫 755000; 4.山东省淄博市张店区疾病预防控制中心,淄博 255000)
产后抑郁症是一种产后精神、情感性障碍的表现,产妇无既往情感障碍史,主要表现为心境持续低落,可能出现妄想、自杀等症状与行为。典型的产后抑郁症在产后4~6 周时症状最为明显。产后抑郁症检出率为12.71%~51.41%[1-2],它还与下一代的行为发育相关[3]。研究[4]显示炎性因子会损伤小鼠脑细胞,从而产生抑郁症。白细胞介素(interleukin,IL)-1β、IL-6、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)是人体内的主要炎性因子,在抑郁的发生、发展中起着重要作用[5]。随着IL-6 水平的升高,患抑郁症风险也相应增加[6];IL-1β 降低会减少海马细胞的凋亡,减少抑郁症的发生[4];TNF-α 的释放使促肾上腺激素、糖皮质激素浓度升高,导致海马神经元萎缩,使下丘脑-垂体-肾上腺轴(hypothalamic-pituitary-adrenal axis,HPA)功能亢进引发抑郁症[7-8]。大多数产妇(69.2%)都有睡眠障碍[9],睡眠质量会影响大脑对情绪的控制,干扰一些激素(促甲状腺素)的分泌,间接导致抑郁症的发生[10]。睡眠障碍能否加剧炎性因子对产后抑郁症的影响目前尚不清楚。本研究旨在探讨炎性因子(IL-1β、IL-6、TNF-α)和睡眠质量及其交互作用对产后抑郁症的影响,为促进孕产妇的心理健康提供依据。
1 对象与方法
1.1 研究对象
选择银川市妇幼保健院与中卫市中医院妇产科住院孕妇220 例,其中有效问卷200 份。纳入标准:1)年龄18~50 岁;2)正常足月妊娠(37~42 周);3)既往无抑郁及精神病史;4)意识清晰,能够清楚回答问题。排除标准:1)身体虚弱不能回答问题者;2)有严重内科疾病史;3)有严重产科合并症及并发症者;4)存在人格、智力以及认知功能障碍。
1.2 研究方法
1.2.1 血清炎性因子水平检测 住院次日抽取空腹12 h 肘静脉血4 mL,3 000 r·min-1离心15 min 分离上层血清,子弹头分装血清于-80 ℃保存。采用酶联免疫分析法(enzyme-linked immunoassay assay,ELISA)测定产妇血清中IL-1β、IL-6、TNF-α 含量,试剂盒购于武汉基因美生物科技有限公司。严格按照说明书要求操作,测量完成后剔除超过检测范围样本。
1.2.2 睡眠质量调查 采用匹兹堡睡眠质量指数量表(pittsburgh sleep quality index,PSQI)[11],共分为3 个等级,睡眠质量较好(0~5 分)、一般(6~10 分)、较差(≥11 分)。
1.2.3 产后42 d 抑郁症调查 采用爱丁堡产后抑郁量表(edinburgh postnatal depression scale,EPDS)[12],此量表包括10 个条目,每个条目有4个等级的描述,赋值0~3 分(从未至总是),总分<13 分为正常,≥13 分为有抑郁症。采用电话随访的方式,由统一培训的调查员口述问卷内容,产妇自行判断后,由调查员代为填写。共随访到194 例,失访6 例。以产后42 d 的EPDS 得分≥13 分为抑郁症组,<13 分为对照组。
1.3 统计学方法
采用SPSS 23.0 软件建立数据库及统计分析。资料呈偏态分布,计量资料以中位数、四分位数[M(QL,QU)]描述。根据四分位数对IL-1β、IL-6、TNF-α 进行分组(3 个等级:<QL、QL~QU、>QU),组间比较采用秩和检验。计数资料以率或构成比描述,组间比较采用χ2检验。采用Logistic 回归分析交互作用对产后抑郁症的影响。其中Logistic 回归分析交互作用赋值为:血清IL-6、IL-1β、TNF-α<QL赋值为1,QL~QU赋值为2,>QU赋值为3;睡眠质量较好赋值为1,一般赋值为2,较差赋值为3。α入=0.05,α出=0.10,变量筛选用向后法。检验水准α=0.05,双侧检验。
2 结果
2.1 产后42 d 抑郁症组与对照组血清炎性因子比较
194 例产妇中,产后42 d 检出30 例抑郁症(15.5%)作为抑郁症组;其余164 例(84.5%)作为对照组。抑郁症组产妇血清IL-1β、TNF-α 水平均高于对照组(P 均<0.05);抑郁症组产妇IL-6水平与对照组差异无统计学意义(P>0.05),见表1。
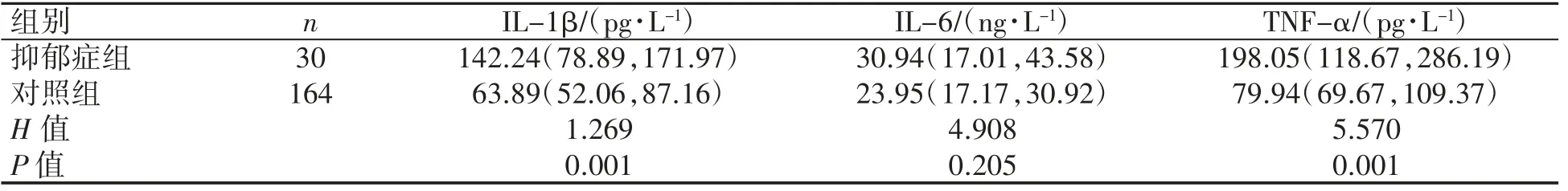
表1 产后42 d 抑郁组与对照组血清炎性因子比较[M(QL,QU)]
2.2 不同水平血清炎性因子产后42 d 抑郁症检出率比较
不同水平血清IL-1β、IL-6、TNF-α 产后42 d抑郁症检出率差异均有统计学意义(P 均<0.05),见表2。
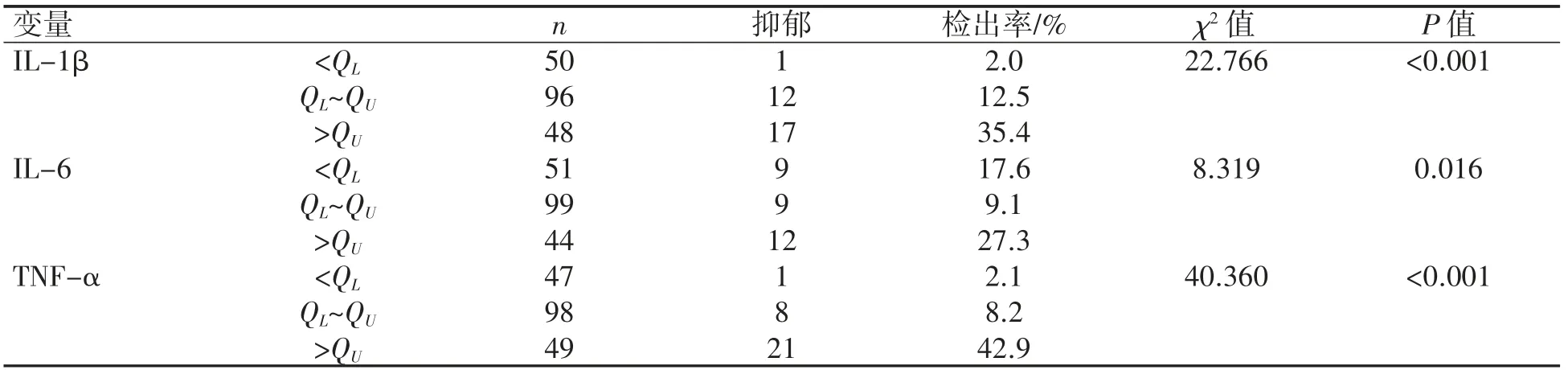
表2 不同水平血清炎性因子产后42 d 抑郁症检出率比较
2.3 产后42 d 抑郁症Logistic 回归分析
以产后42 d 抑郁症为因变量(0=无,1=有),血清IL-6、IL-1β、TNF-α(实际值进入)、睡眠质量为自变量,进行Logistic 回归分析。结果显示血清IL-1β、TNF-α 是产后42 d 抑郁症的影响因素,见表3。
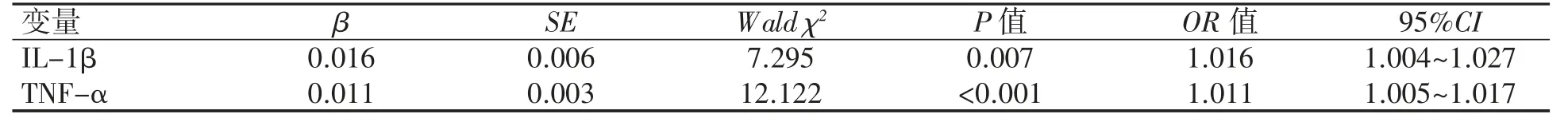
表3 产后42 d 抑郁症Logistic 回归分析
2.4 炎性因子与睡眠质量的交互作用对产后42 d抑郁症的影响
以产后42 d 抑郁症为因变量(0=无,1=有),血清IL-6、IL-1β、TNF-α(等级资料)与睡眠质量的3个交互模型(相乘交互)为自变量,分析其对产后42 d 抑郁症的影响。结果显示血清TNF-α 与睡眠质量的交互作用对产后42 d 抑郁症有影响,见表4。

表4 炎性因子与睡眠质量交互作用对产后42 d 抑郁症的影响
3 讨论
本研究结果显示,产后抑郁症组血清IL-1β、TNF-α 水平均高于对照组,与刘传新等[13]研究结果一致;血清IL-1β、TNF-α 升高是产后42 d 抑郁的危险因素,与许多学者的研究结果一致[14-15]。IL-1β 是促炎性细胞因子,其影响神经元功能,导致抑郁症的发生[13,16-17]。IL-1β 还可增强神经细胞突触后膜的某些受体(NMDDA 受体、AMPA 受体)而产生神经元毒性,导致海马体凋亡或者坏死,致使认知功能障碍,发生抑郁症。徐宇浩[4]的研究也证实了以上机制的可能性,其研究发现抑制IL-1β 的产生,可以减少海马细胞的凋亡,降低抑郁症的发生。Khandaker 等[6]研究提示,该因子在调节抑郁障碍存在潜在作用,可能是通过影响脑产生神经化学物质及神经内分泌激素,使得神经免疫和行为发生改变,导致抑郁症的发生。也有研究[18]提示IL-1β 是HPA 轴的有效激活剂,其在HPA 调节轴中有重要作用,可以通过间接机制导致抑郁症。
TNF-α 与抑郁症及其严重程度有关[14]。TNFα 对产后抑郁症的影响可能是由于HPA 功能轴的调控,TNF-α 的释放导致糖皮质激素浓度升高,过多糖皮质激素使海马神经元萎缩、凋亡及神经再生减少,使HPA 轴功能亢进,该轴功能亢进通过损伤脑海马体,导致以该轴为主的重要情感调节中枢功能失常引发抑郁症[8,19-20]。还有研究[18]发现TNF-α 增加多巴胺代谢,导致抑郁症。
本研究发现,血清TNF-α 与睡眠质量之间存在交互作用,且为协同作用,即血清TNF-α 水平升高与睡眠质量差同时存在可增加产后抑郁症的发生。可能是因为睡眠质量差影响性激素分泌功能[21],性激素水平降低导致产后抑郁症发生[22],性激素的主要调节系统之一为褪黑素(melatonin,MT)分泌影响下丘脑-垂体-性腺轴(hypothalamus-pituitary-gonadal axis,HPGA)影响性激素分泌[23];而TNF-α 的分泌使HPA 功能亢进[4],HPA 功能亢进会抑制HPGA[24],以致诱发产后抑郁症的效应大于其单独作用。也可能是因为TNF-α 使HPA 功能亢进,HPA 功能异常是引起失眠的因素之一[25],睡眠质量差,MT 分泌更少,HPGA 的抑制作用更加明显,使产后抑郁症进一步加重。由此可见,睡眠质量差,HPGA 被抑制可能引发抑郁症。升高的TNF-α 激活HPA,破坏HPA 调节系统的稳定性,引发抑郁症。
目前对炎性因子与睡眠质量的交互作用如何影响产后抑郁症研究有限,深入探讨多种因素交互作用对产后抑郁症的影响机制,将更好地预防产后抑郁症。这可能比单纯地研究单因素的影响,或者被动治疗产后抑郁更具意义。

