人胎盘间充质干细胞外泌体促进人肺血管内皮细胞血管形成和迁移
吕玉珍,喻文琴,马晓薇
(1.宁夏医科大学,银川 750004;2.宁夏医科大学总医院干细胞研究所,银川 750004;3.宁夏医科大学总医院心脑血管病医院ICU,银川 750012)
间充质干细胞(mesenchymal stem cells,MSCs)是一类具有多向分化潜能和自我更新的成纤维样干细胞,来源广泛,且不同组织来源的MSCs免疫原性、功能作用都各有侧重[1]。胎盘组织作为MSCs的丰富储库,具有易于分离、无须侵入性操作等优点而被广泛关注[2]。研究[3-6]表明,人胎盘间充质干细胞(human placental mesenchymal stem cells,HPMSCs)在调节炎症、血管反应性和组织修复方面发挥着重要作用。近期发现,HPMSCs旁分泌的外泌体(HPMSCs-Exosomes,HPMSCs-EX)不仅继承了与母体细胞相似的治疗作用,还能避免其栓塞及成瘤等副作用[7]。外泌体是一类体内含有多种DNA、RNA和脂类活性物质的纳米级囊泡[8-10]。研究[11]表明,HPMSCs-EX对于急性肺损伤(acute lung injury,ALI)的治疗具有极大潜力。ALI是一种具有高病死率的破坏性疾病,目前认为[12]人肺血管内皮细胞(human pulmonary vascular endothelial cells,HPVECs)破坏、肺屏障功能降低是ALI的重要发病因素。HPVECs位于血管壁内层,是血液和组织之间的重要屏障[13]。ALI时HPVECs受到打击发生损伤或凋亡、细胞间连接解聚、细胞结构改变、屏障功能降低,同时也会释放炎性因子进一步损害HPVECs[14],因此HPVECs是损伤的主要靶细胞和活性效应细胞[15]。课题组前期已经证明HPMSCs-EX对HPVECs具有保护作用,但机制尚未阐明[16]。该实验将进一步探讨HPMSCs-EX对HPVECs血管形成和迁移的影响,探索潜在的作用机制,为ALI的治疗提供理论依据。
1 材料与方法
1.1 材料与仪器
HPMSCs来自宁夏医科大学总医院干细胞研究所,无血清培养基购自LONZA公司,血清替代物购自PALL公司,间充质干细胞无血清促贴壁基质胶、成脂肪诱导分化培养基、成骨诱导分化骨培养基、成软骨诱导分化培养基购自STEMCELL公司,Exo-Quick-TC外泌体提取纯化试剂盒购自SBI公司,蛋白浓度测定试剂盒购自凯基生物公司,HPVECs、内皮细胞培养基购自ScienCell公司,PBS、胰酶替代物购自Gibco公司,4%多聚甲醛购自Solarbio公司,VEGFA、Vimentin抗体购自Abcam公司,脂多糖(LPS)购自Sigma公司,Matrigel基质胶购自BD公司,各规格细胞培养皿(板)、Transwell小室购自Corning公司,Dio、Dil及DAPI购自碧云天公司。倒置显微镜购自OLYMPUS公司,高速离心机购自Eppendorf有限公司,CO2细胞培养箱购自Thermo Fisher Scientific公司,透射电镜购自日本日立公司。
1.2 方法
1.2.1 细胞培养及分组 HPMSCs及HPVECs分别以无血清培养体系及内皮细胞专用培养基培养,置于37℃、5%CO2培养箱。HPVECs分为对照组(NC组)、外泌体组(NC+HPMSCs-EX组)、损伤组(LPS组)及外泌体治疗组(LPS+HPMSCs-EX组),NC组以培养基培养,NC+HPMSCs-EX组以终浓度为100μg·mL-1的HPMSCs-EX进行培养,LPS组与LPS+HPMSCs-EX组均以浓度为100 ng·mL-1的LPS刺激6 h建立损伤模型,其中,治疗组在损伤后,以100μg·mL-1的HPMSCs-EX与HPVECs进行直接共培养24 h。
1.2.2 HPMSCs诱导分化 HPMSCs按2×104个/孔接种于提前用明胶包被好的六孔板,待细胞生长至85%~90%密度时,更换相应的诱导分化培养基继续培养21 d,期间,每2~3 d更换培养基,21 d后弃去培养基并用磷酸盐平衡生理盐水(phosphate buffered saline,PBS)冲洗3遍,按照说明书分别用油红O、茜红素和甲苯胺蓝对成脂、成骨和成软骨分化组细胞进行染色,显微镜下拍照观察。
1.2.3 HPMSCs-EX提取 按照说明书将HPMSCs培养上清与Exo-Quick-TC以5∶1混合于4℃冰箱过夜,次日以4℃、3 000×g离心10 min弃上清,先加入200μL缓冲液B,后加入200μL缓冲液A重悬,静置数分钟。在此期间去除色谱柱里的缓冲液并清洗色谱柱2次。在色谱柱内加入100μL的缓冲液B,将外泌体样本加入色谱柱振荡混匀,并移入新的离心管中,在低温离心机中1 000×g离心30 s,管中即为提取的外泌体。
1.2.4 透射电镜下观察HPMSCs-EX 将10μL网上,静置30 s后HPMSCs-EX悬液轻柔滴在铜用滤纸吸干,此步骤重复1次。然后滴加2%磷钨酸10μL在铜网上,负染30 s后用滤纸吸干,此步骤重复1次。室温静置30 min,在透射电镜下观察HPMSCs-EX的形态特征及粒径大小。
1.2.5 HPMSCs-EX摄取 首先以浓度为20μmol·mL-1的Dil红色荧光探针对HPMSCs-EX避光孵育进行染色15~20 min,加入HPVECs中并继续在细胞培养箱中孵育4~6 h。PBS冲洗3次,Dio绿色荧光探针按说明书配置后加入避光孵育20 min,PBS继续冲洗3次洗去多余荧光染料,最后DAPI染色溶液完全覆盖,对细胞核进行荧光染色约1 min,吸去多余料,用PBS冲洗干净,注意全程操作轻柔。最后用4%多聚甲醛进行固定,倒置荧光显微镜观察并拍照。
1.2.6 血管形成实验 提前预冷枪头及96孔板,以50μL/孔Matrigel基质胶铺满96孔板底部,防止气泡产生,放置37℃温箱2 h待其凝固。HPVECs消化计数,以1×104个/孔接种于96孔板,每隔1 h观察内皮细胞成管情况,采集图片并用Image J软件进行数据分析。
1.2.7 迁移实验 细胞以1×104个/孔接种于0.8μm Transwell小室(24孔),下室加入含血清的培养基,8 h上室弃去培养基,并用4%多聚甲醛溶液固定30 min,再用PBS清洗2次,用1%结晶紫染液对其进行染色8 min,再用PBS清洗2次,风干并采集图片,用Image J软件进行数据分析。
1.2.8 划痕实验 将HPVECs密度调整为2.5×105个/mL,每个孔中加入100μL细胞悬液及1.5 mL培养基,待细胞密度达到80%~90%融合时,200μL枪头在六孔板中各孔中间区域划出直线痕迹,PBS清洗2遍。于0 h和24 h对划痕区域拍照,使用Image J进行图像分析。计算公式:伤口愈合率(100%)=[划痕面积(0 h)-划痕面积(24 h)]/划痕面积(0 h)×100%。
1.2.9 细胞免疫荧光 HPVECs弃去培养基,用4%多聚甲醛固定30 min,0.5%Triton X-100室温孵育5 min后滴加山羊血清封闭30 min,加入一抗(Vimentin,1∶200)于4℃孵育过夜;次日PBS清洗3次,吸干多余液体,滴加相应种属荧光二抗(1∶250)室温孵育1 h,PBS清洗3次,最后滴加DAPI避光孵育1 min,PBS清洗3次,荧光显微镜下观察并采集图像。
1.2.10 Western blot 提取各组细胞蛋白,通过SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)进行电泳,然后转移至PVDF膜,将膜在Tris缓冲盐溶液(tris buffered saline with tween 20,TBST)中洗涤5 min×3次,然后将膜放入一抗(Vimentin 1∶3 000;VEGFA 1∶200)于4℃孵育过夜。次日将膜放入TBST中洗涤5 min×3次,并与相应种属二抗(1∶5 000)于37℃温育120 min。在膜上滴入ECL化学发光液,并使用凝胶成像系统显影。
1.3 统计学方法
采用SPSS 21.0统计学软件进行数据分析,计量资料以均数±标准差(±s)表示,组间比较采用单因素方差分析,组内两两比较采用LSD-t检验。P≤0.05为差异有统计学意义。
2 结果
2.1 HPMSCs形态观察
显微镜下可见HPMSCs大小均匀,生长状态良好,整体密度均匀,细胞增殖以后呈漩涡状生长,有序、均匀排列,单个细胞呈长梭状或纺锤状,见图1。

图1 倒置显微镜下HPMSCs形态
2.2 HPMSCs诱导分化
诱导分化21 d后,成脂肪诱导分化组经油红O染色后可见大量紫红色圆形脂肪颗粒;成骨诱导分化组经茜素红染色后可见红色钙沉积斑块;成软骨诱导分化组经甲苯胺蓝染色后可见紫蓝色软骨簇,见图2。
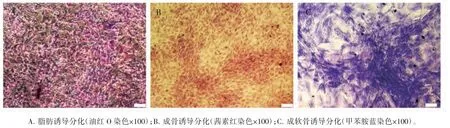
图2 HPMSCs诱导分化染色图
2.3 外泌体鉴定
透射电镜观察HPMSCs-EX形态及粒径大小,可见圆形双层膜,直径小于150 nm,见图3A;Western blot实验显示,提取的HPMSCs-EX表面特异抗原CD9、CD63表达呈阳性、Calnexin表达呈阴性,符合外泌体的鉴定标准,见图3B。
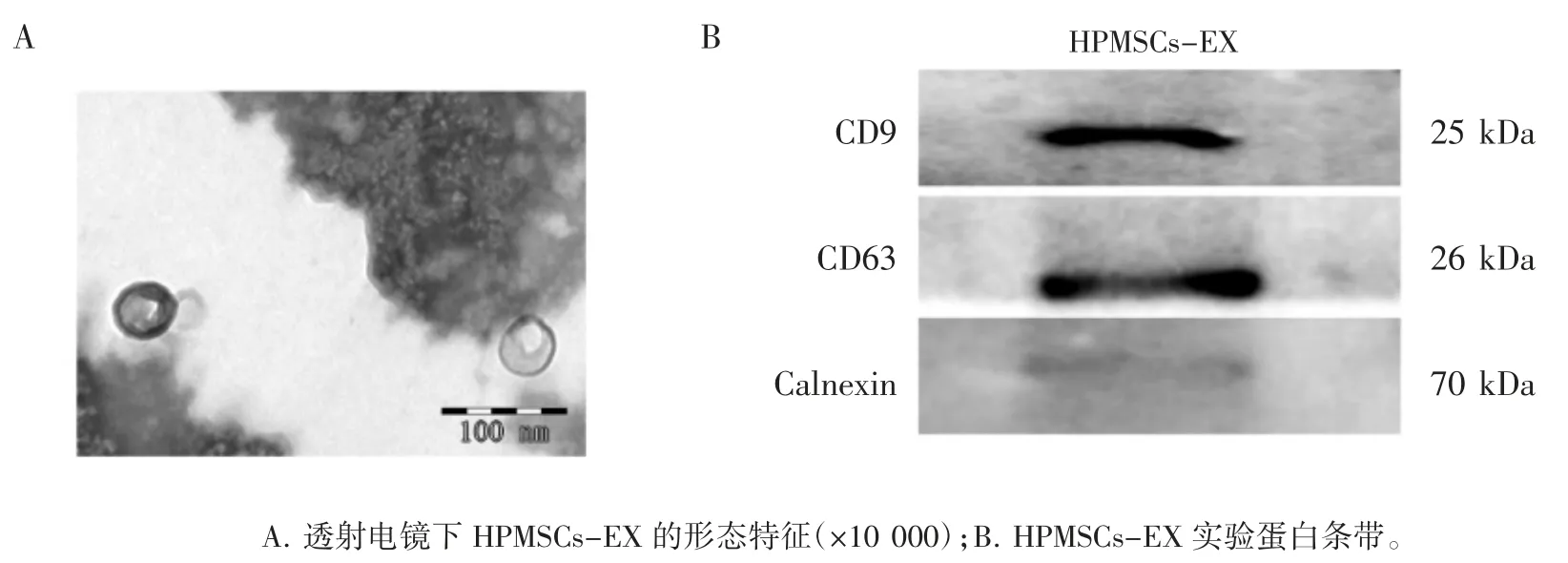
图3 HPMSCs-EX的生物学特征
2.4 外泌体摄取
荧光显微镜下可见被染成绿色的HPVECs胞质内出现标记为红色的HPMSCs-EX,并且聚集在染为蓝色的细胞核周围,结果表明,HPVECs可有效摄取HPMSCs-EX,见图4。
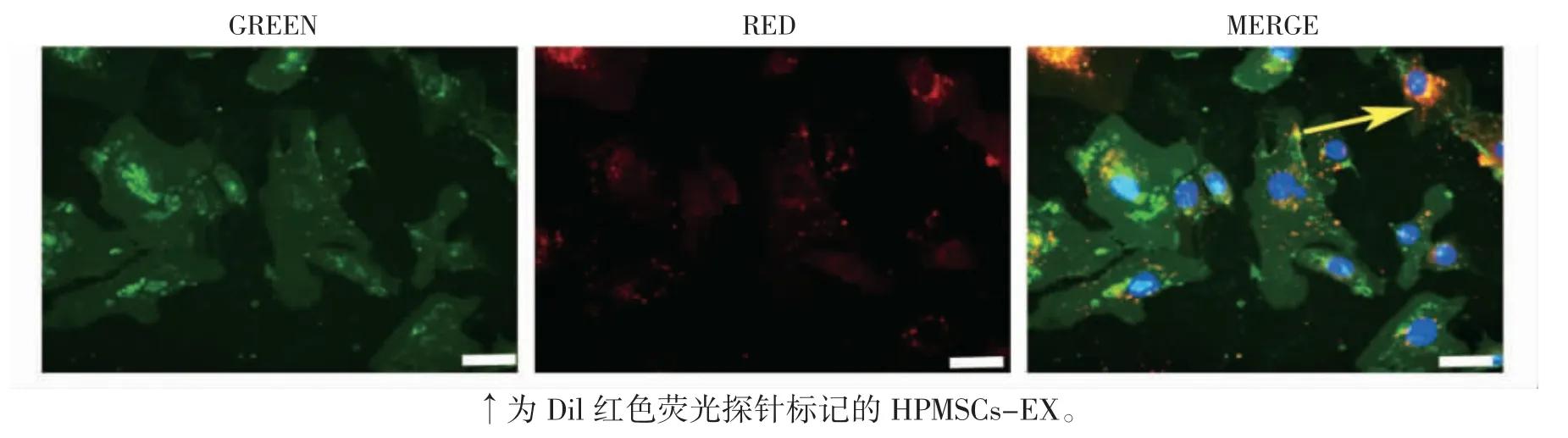
图4 荧光显微镜观察HPVECs对HPMSCs-EX的摄取情况(×400)
2.5 HPVECs形态变化
倒置显微镜下观察HPMSCs-EX对HPVECs形态的影响,NC组和NC+HPMSCs-EX组HPVECs形态呈铺路石样,大小均一,长势良好;LPS组部分细胞则变圆皱缩,密度降低,逐渐停止增殖,部分细胞肿胀变大,细胞间连接松散;LPS+HPMSCs-EX组细胞普遍增大,部分细胞变圆变亮飘起,但多数细胞形态尚存,见图5。

图5 倒置显微镜观察各组HPVECs形态变化图(×100)
2.6 血管形成实验检测HPMSCs-EX对LPS诱导的HPVECs血管形成情况
血管形成实验结果显示,与NC组相比,NC+HPMSCs-EX组细胞血管形成能力差异无统计学意义(P>0.05),均有环状结构存在(P>0.05),LPS组细胞血管形成能力下降,细胞环状结构较少(P<0.05);与LPS组相比,LPS+HPMSCs-EX组细胞血管形成能力增加,可见管状结构有所增加(P<0.05),见图6。

图6 HPMSCs-EX对LPS诱导的HPVECs血管形成能力的影响
2.7 迁移实验检测HPMSCs-EX对LPS诱导的HPVECs迁移能力
Transwell法检测结果显示,与NC组相比,NC+HPMSCs-EX组细胞迁移数量差异无统计学意义(P>0.05),LPS组细胞迁移数量降低(P<0.05);与LPS组相比,LPS+HPMSCs-EX组细胞迁移数量增加(P<0.05),见图7。

图7 HPMSCs-EX对LPS诱导的HPVECs细胞迁移数的影响
2.8 划痕实验检测HPMSCs-EX对HPVECs划痕愈合能力
划痕实验结果显示,与NC组相比,NC+HPMSCs-EX组细胞划痕愈合率差异无统计学意义P>0.05);LPS组细胞划痕愈合率降低(P<0.05);与LPS组相比,LPS+HPMSCs-EX组细胞划痕愈合率升高(P<0.05),见图8。

图8 HPMSCs-EX对LPS诱导的HPVECs划痕愈合率的影响
2.9 细胞免疫荧光实验检测各组HPVECs中Vimentin蛋白的分布
免疫荧光结果显示,Vimentin蛋白主要分布在胞质中。与NC组相比,NC+HPMSCs-EX组HPVECs大小均一,且呈多边形;与LPS组相比,LPS+HPMSCs-EX组HPVECs显示细胞形状更为细长,且有伪足伸出,提示HPMSCs-EX可通过改变细胞Vimentin的表达进而增强HPVECs的迁移能力(图9)。
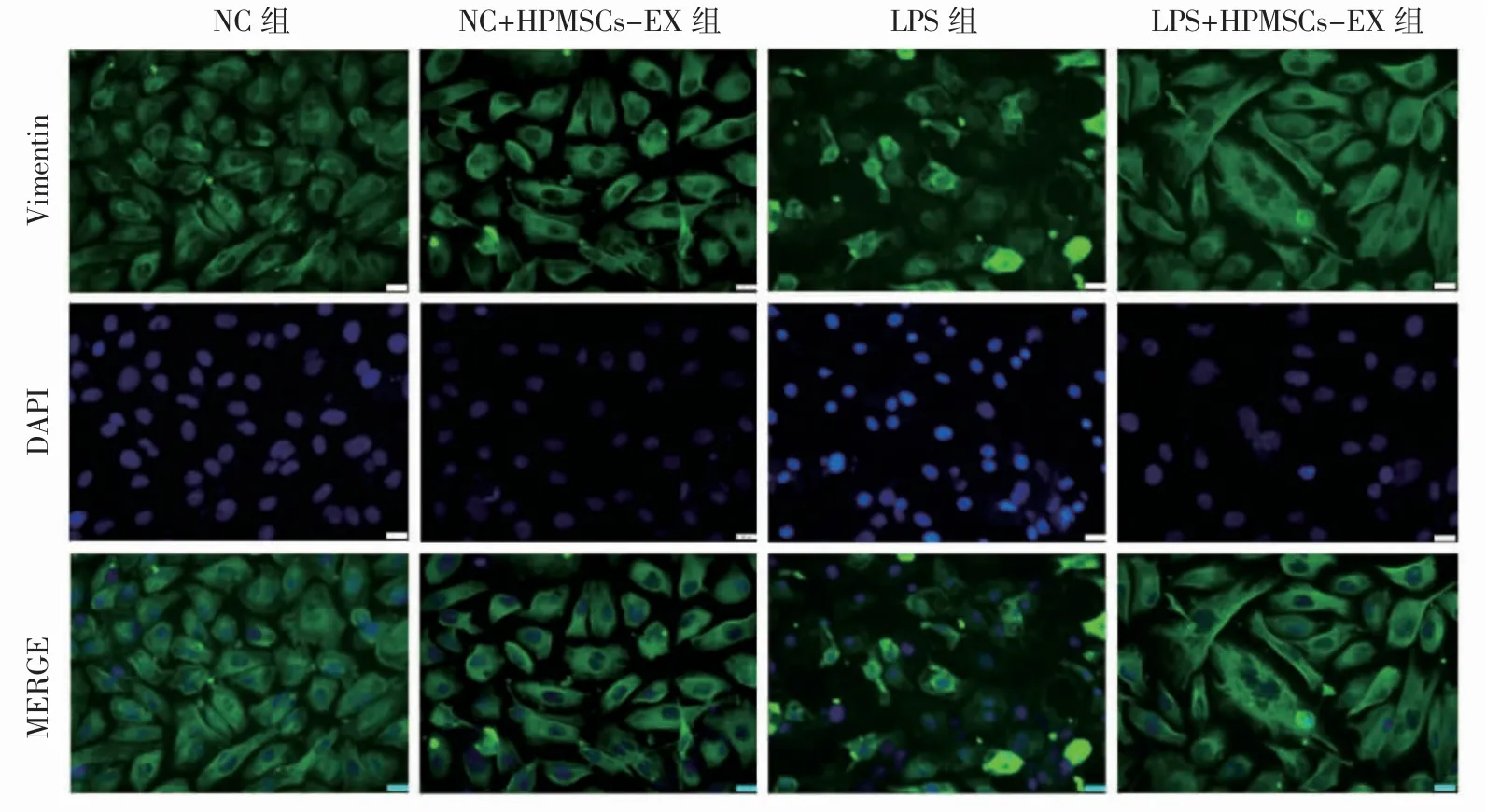
图9 细胞免疫荧光实验检测各组Vimentin的表达(×100)
2.10 Western blot实验检测各组细胞VEGFA和Vimentin蛋白表达差异
Western blot实验结果显示,与NC组相比,NC+HPMSCs-EX组细胞蛋白表达差异无统计学意义(P>0.05),LPS组细胞蛋白表达均下调(P均<0.05)。与LPS组相比,LPS+HPMSCs-EX组中细胞内VEGFA和Vimentin蛋白表达均上调(P均<0.05)(图10)。

图10 Western blot检测Vimentin和VEGFA表达的影响
3 讨论
ALI可由多种非心源性致病因素导致,致病机制虽因病各异,但血管内皮损伤这一病理过程是其共有途径,并且在ALI发生发展中起着重要作用[15]。LPS是革兰阴性细菌细胞壁的关键成分,肺组织接触到LPS以后,主要表现出以血管内皮细胞损伤为主要特征的病理过程,是直接和间接肺损伤的常见原因[17]。LPS诱导的损伤与ALI发病过程非常相似,因此被认为是ALI体内体外模型的经典诱导剂[18]。目前ALI的治疗方法多以液体管理、呼吸支持、抗感染等对症支持治疗为主[19],虽然治疗手段已有很大进步,但是都未从根本上解决问题,病死率仍高达40%[20],亟须寻求更先进的治疗理念和方法。目前以MSCs为中心的治疗在ALI相关研究中显示了巨大潜力,其中HPMSCs因具有容易从胎盘组织分离,不具有伦理争议等优点而备受关注。
本研究利用酶消化法分离HPMSCs,并以无血清培养基培养扩增以消除血清中的外泌体对结果的影响。倒置显微镜下可以看到同其他来源的MSCs一样,HPMSCs呈长梭状、纺锤状。在适当条件下,MSCs可以分化成脂肪细胞、成骨细胞和成软骨细胞,实验通过特定的诱导分化培养基对细胞进行诱导分化,并在第21天进行染色鉴定。结果显示,成脂肪诱导分化后出现大量紫红色圆形脂肪颗粒,成骨诱导分化后可见红色钙沉积斑块,软骨诱导分化后可见紫蓝色软骨簇,说明提取细胞符合MSCs的基本生物学特征。通过收集HPMSCs培养上清,提取外泌体,采用透射电镜、Western blot法对外泌体表征进行验证,均与外泌体研究的有关报道相一致[21]。研究[22]表明,外泌体与靶细胞共培养可被吸收内化从而发挥功能。实验中采用不同颜色且不影响细胞活力的荧光探针分别标记HPMSCs-EX和HPVECs,在荧光显微镜下观察HPMSCs-EX被HPVECs摄取情况,结果显示在绿色的细胞质中出现红色荧光标记的外泌体,分布在细胞核周围,表明外泌体可以被HPVECs内化,为本课题后续研究奠定了基础。
HPVECs及其之间的黏附连接是肺屏障的重要组成部分[23],而血管形成和迁移能力是HPVECs重要的功能,ALI时肺血管内皮细胞的管状结构的形成和迁移能力决定着新生血管的形成情况[24]。在本研究中,采用血管形成实验检测HPMSCs-EX对HPVECs血管形成能力的影响,发现经HPMSCs-EX处理后,内皮细胞血管网状结构有所恢复,生成长度增加。VEGFA是血管形成过程中的重要分子[25],利用Western blot实验检测VEGFA蛋白表达水平,结果显示HPMSCs-EX可逆转LPS引起细胞VEGFA蛋白水平的下调改变,这些实验结果均说明HPMSCs-EX具有促进HPVECs血管形成的能力。进一步采用Transwell和划痕实验检测HPMSCs-EX对HPVECs迁移能力的影响,该结果同血管形成实验结果一致,表明HPMSCs-EX可促进HPVECs血管形成以及细胞迁移。Vimentin是一种细胞骨架蛋白,在细胞迁移、收缩、增殖、蛋白质合成、基因表达、细胞凋亡和机械力传递中发挥重要作用[26]。免疫荧光显示给予外泌体,HPVECs形态发生改变,细胞体积拉长,伸出伪足,提示HPVECs发生迁移。Western blot检测Vimentin蛋白的表达水平,显示LPS+HPMSCs-EX组细胞Vimentin蛋白表达增加,进一步表明HPMSCs-EX可能通过上调Vimentin蛋白表达增强HPVECs迁移能力。
综上所述,HPMSCs-EX具有促进HPVECs血管形成和迁移能力,从而在ALI体外模型中发挥其治疗作用,可能为未来ALI的治疗提供一定的理论基础。

