缓释音猬因子的PLGA纳米微球对大鼠脊髓损伤的修复作用
夏 宇,孙 佳,齐争艳,马 琳,牛建国,文玉军
(1.宁夏医科大学基础医学院人体解剖与组织胚胎学系,银川 750004;2.宁夏医科大学颅脑疾病重点实验室,银川 750004)
脊髓损伤(spinal cord injury,SCI)是指脊髓受到创伤、炎症、肿瘤或其他原因的损害,导致损伤水平以下运动、感觉或自主神经功能受损[1]。SCI多发于青壮年,目前尚无有效的治疗方法,很多患者瘫痪并伴有膀胱功能障碍、性功能障碍、胃肠道和呼吸问题以及尿路感染等并发症[2],需要长期康复治疗,给家庭和社会带来了巨大负担。改善SCI后患者的神经功能尤其是运动功能是亟待解决的问题。组织工程技术为SCI的修复提供了一种很有前景的策略[3]。
聚乳酸-羟基乙酸共聚物[poly(lactic-co-glycolic acid),PLGA]由乳酸和羟基乙酸单体共聚而成,是一种可降解的高分子有机化合物,无毒且具有良好的生物相容性,被广泛应用于制药、医用工程材料等领域[4]。作为载体,PLGA是目前应用最广泛的生物材料,用于制造能够缓释药物的递送系统[5]。
音猬因子(sonic hedgehog,Shh)是在果蝇中发现的刺猬分泌蛋白家族的同源物之一[6]。在哺乳动物中,Shh参与了中枢神经系统、眼、四肢、皮肤、肺等多种组织器官的发育,并在神经发生、抗炎、抗氧化、抗凋亡等多种生理过程中发挥作用[7-8]。研究[9]表明,Shh是一种多功能生长因子,在脊髓发育的各阶段均发挥重要作用。本研究以PLGA为载体,包载Shh形成一种缓释纳米微球,将此缓释Shh的纳米微球注射于大鼠SCI部位,观察其对脊髓组织的修复效果和对动物运动功能的改善情况。
1 材料与方法
1.1 实验动物
SPF级雌性SD大鼠36只,体质量230~280 g,由宁夏医科大学实验动物中心提供,质量检测单位为陕西省实验动物质量监督检测中心[许可证号:SCXK(宁)2020-0001]。大鼠在安静环境下饲养,不限制摄食和饮水。本研究经宁夏医科大学医学伦理委员会批准(宁医大伦理第2020-051号)。
1.2 主要试剂及仪器
PLGA、Shh、牛血清白蛋白购自Sigma公司,Nissl染色试剂盒购自北京索莱宝科技有限公司,兔抗NeuN单克隆抗体(ab177487)购自Abcam公司,ELISA试剂盒购自上海江莱生物科技有限公司,脊髓打击器购自深圳市瑞沃德生命科技有限公司。
1.3 动物分组
将SD大鼠随机分为3个组,每组12只。假手术组(Sham组):大鼠麻醉后打开T9椎板再逐层缝合;SCI组:打开T9椎板,建立脊髓T9撞击模型;PLGA-Shh组:建立脊髓T9撞击模型后,于损伤部位注射包载Shh的PLGA悬液。
1.4 包载Shh的PLGA纳米微球的制备及释放检测
将0.5 g PLGA溶解于5 mL二氯甲烷中,得到质量体积分数为10%的PLGA溶液;将25μg Shh溶解于2.5 mL牛血清白蛋白(BSA)溶液(50 mg·mL-1)中,将上述溶液混合后用涡旋振荡器振荡使其成乳白色悬液;加入1%聚乙烯醇25 mL,使用超声波细胞粉碎机乳化,得到PLGA乳液;加入0.3%聚乙烯醇溶液200 mL,用保鲜膜封住烧杯口并留孔透气,搅拌12 h,使二氯甲烷充分挥发;将产物离心重悬3次,用冷冻真空干燥仪冻干备用。扫描电镜下观察其形态。取1 mg包封Shh的PLGA微球,溶于100μL磷酸盐缓冲液(PBS)中为1份检测用PLGA-Shh悬液;制备14×6份,用EP管密封置于恒温摇床37℃孵育;每天取6份,离心、取上清液,用EP管密封置于-20℃冰箱内;连续取样14 d后,用Shh的ELISA检测盒,检测其释放量。
1.5 大鼠SCI模型建立及纳米微球注射
大鼠经异氟烷吸入麻醉后,俯卧位固定于手术台上,备皮,消毒,以T11椎体棘突作为定位标志,行背正中切口,切开皮肤,依次分离皮下筋膜、肌肉,暴露T8~T11棘突及椎板,用单关节骨剪咬去T8~T11棘突及T9椎板,充分暴露脊髓,使用脊髓打击器对大鼠脊髓T9节段进行撞击,建立脊髓撞击损伤模型。对于PLGA-Shh组,在损伤部位注射PLGA-Shh悬液。依次缝合肌肉、筋膜和皮肤,消毒后将大鼠置于恒温台等待麻醉苏醒。术后单笼饲养,每天2次予以腹部按摩辅助排尿,直至建立完整的排尿反射。
1.6 大鼠后肢运动功能评价
术后每周对大鼠后肢运动功能进行评价,采用Basso Beattie Bresnahan运动评定量表(BBB评分)和旷场实验。BBB评分前让大鼠在开放环境适应10 min,每次评分至少观察5 min。旷场实验时将大鼠置于100 cm×100 cm的旷场内自由运动5 min,统计其在旷场中的总移动距离。
1.7 脊髓组织灌注取材及染色
术后4周和8周取各组6只大鼠,异氟烷吸入麻醉,依次使用37℃预热的0.9%氯化钠溶液及4℃预冷的4%多聚甲醛溶液灌注,打开椎板取出包含损伤部位在内的脊髓4 cm,在4%多聚甲醛溶液中固定4 h。将脊髓组织转入20%蔗糖PBS溶液中进行脱水。用包埋剂(OCT)包埋,液氮速冻后冰冻切片,切片厚度30μm。
将切片用PBS洗3次,每次5 min,在Nissl染液中浸染15 min,流水冲洗后入分化液分化30 s,上行梯度乙醇脱水,二甲苯透明,中性树脂封片,室温晾干后显微镜下观察拍片。
将切片在磷酸盐曲拉通X-100缓冲液(PBST)中通透3 h;PBS洗后加入内源性过氧化物酶阻断剂,于37℃孵育20 min;PBS洗后滴加5%BSA溶液,于37℃封闭30 min;加入兔抗NeuN单克隆抗体(1∶100),4℃孵育过夜;PBS洗后滴加反应增强液于37℃温箱内孵育20 min;PBS洗后滴加增强酶标山羊抗兔IgG聚合物,37℃孵育1 h;PBS洗后加入新鲜配制的3,3ˊ-二氨基联苯胺四盐酸盐(DAB)显色液,室温孵育6 min;自来水冲洗后上行梯度乙醇脱水,二甲苯透明,中性树脂封片,室温晾干后显微镜下观察拍片。
1.8 统计学方法
使用Image J软件分析Nissl染色和免疫组织化学染色的数据,使用Graphpad Prism 8软件进行统计分析并作图。计量资料用均数±标准差(±s)表示,组间比较用单因素方差分析,两两比较采用LSD-t法。P≤0.05为差异有统计学意义。
2 结果
2.1 PLGA-Shh纳米微球形态及释放
在扫描电镜下可见包载Shh的PLGA微球呈圆球形,直径为0.1~0.6μm,表面光滑,大小均一,散在分布(图1A)。ELISA法检测包载Shh的PLGA微球的释放情况,发现14 d内微球持续释放,在前10 d Shh释放浓度维持在2 500 pg·mL-1左右(图1B)。

图1 PLGA-Shh纳米微球形态及释放
2.2 大鼠后肢运动功能恢复情况
所有大鼠术前BBB评分均为满分,术后无意外死亡。除Sham组外,其余大鼠术后1 d均呈截瘫痪状态,后肢运动功能丧失,靠前肢爬行,BBB评分为0分;从术后2周大鼠后肢运动功能开始恢复,PLGA-Shh组大鼠术后第7、8周的评分高于SCI组(P均<0.05)。旷场实验发现,术后6~8周PLGA-Shh组大鼠运动距离高于SCI组(P均<0.05),见图2。
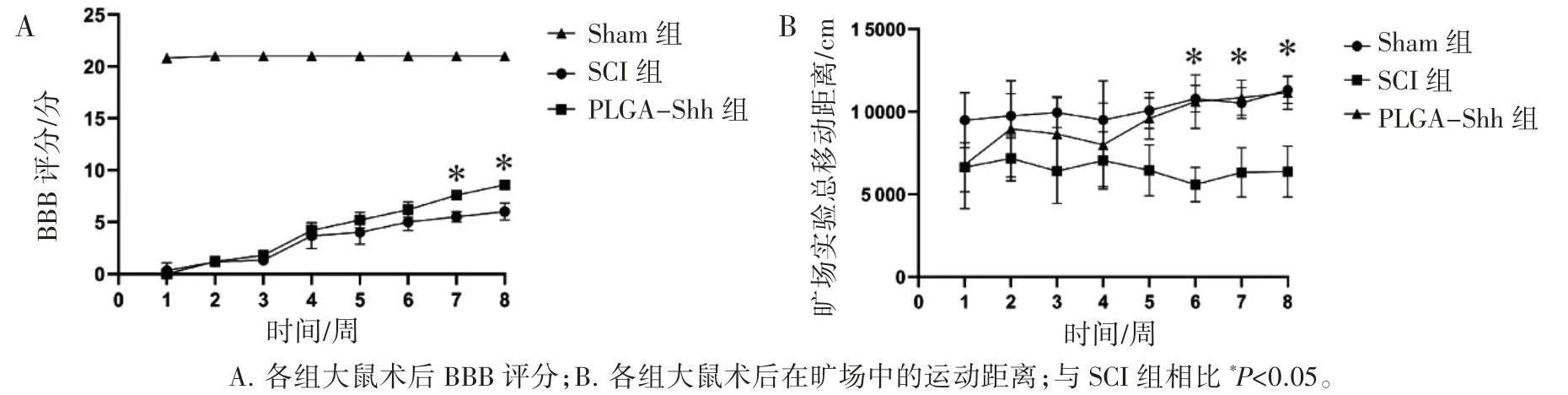
图2 术后大鼠后肢运动功能评估
2.3 大鼠SCI情况
大鼠脊髓T9撞击模型制备8周后,Nissl染色显示,受撞击处脊髓内神经元坏死,纤维断裂,组织结构紊乱,坏死区域有瘢痕及空洞形成,见图3。

图3 大鼠脊髓T9撞击损伤(Nissl染色,bar=1 mm)
2.4 SCI区吻侧和尾侧灰质前角运动神经元(motor neurons,MNs)的变化
术后4周、8周,对SCI区吻侧和尾侧6~8 mm处的脊髓断面进行Nissl染色发现,与Sham组相比,SCI组和PLGA-Shh组大鼠SCI区吻侧和尾侧脊髓灰质前角MNs均不同程度地减少。术后8周,PLGA-Shh组大鼠SCI区吻侧和尾侧脊髓灰质前角MNs均高于SCI组(P均<0.05),见图4。

图4 SCI区吻侧和尾侧灰质前角MNs的变化
2.5 SCI区吻侧和尾侧灰质前角NeuN表达情况
术后4周、8周,对SCI区吻侧和尾侧6~8 mm处的脊髓断面进行NeuN免疫组织化学染色并统计NeuN阳性细胞与灰质前角面积占比,发现与Sham组相比,SCI组和PLGA-Shh组大鼠SCI区吻侧和尾侧灰质前角NeuN阳性细胞占比均不同程度地减少(P均<0.05);术后8周,PLGAShh组大鼠SCI区吻侧和尾侧灰质前角NeuN阳性细胞占比均高于SCI组(P<均0.05),见图5。

图5 SCI区吻侧和尾侧灰质前角NeuN表达情况
3 讨论
本研究以PLGA为载体,包载Shh形成一种缓释纳米微球,将其用于大鼠SCI区,发现可提高损伤区周围脊髓灰质内神经元数量,并改善大鼠后肢的运动功能。
SCI严重危害患者的生活质量,目前的治疗方法主要集中在对症治疗、康复治疗以及对并发症的治疗上[10],亟待开发能够促进脊髓再生进而改善患者神经功能的新疗法。纳米材料的发展为SCI修复提供了具有前景的新手段[3]。本研究采用油水乳液挥发有机溶剂法[11]将Shh包埋在可生物降解的PLGA纳米微球中,实验结果表明PLGAShh纳米微球能够持续稳定地释放Shh,将此缓释微球注射于SCI区,该药物系统能够在SCI区局部、缓慢、持续地释放治疗药物。Shh是一种具有多种功能的生长因子,对中枢神经系统发育中神经元的形成、轴突生长、增殖、存活和分化至关重要[12],尤其对脊髓MNs的分化、成熟、髓鞘及突触形成起着重要作用,是SCI修复的理想选择[13]。
在我国,造成SCI的原因主要是交通意外所致的外伤。本实验采用脊髓撞击损伤模型[14],撞击后可见脊髓局部形成血肿,损伤处神经元坏死、神经纤维断裂,组织结构紊乱,有瘢痕及空洞形成。脊髓撞击模型相较于脊髓横断、脊髓半切等模型更能够模拟临床病患的实际情况,更具有代表性[15]。
本研究发现,PLGA-Shh微球治疗7周、8周后大鼠的BBB评分和在旷场中的运动距离均高于SCI组,在术后护理中也发现PLGA-Shh组大鼠比SCI组大鼠恢复自主排尿时间更短,表明PLGA-Shh微球治疗能促进大鼠SCI后肢的运动功能恢复以及膀胱排尿反射的建立。尼氏小体对病理刺激非常敏感,通常被认为是神经细胞损伤的良好指标,NeuN是一种神经元特异性核标记蛋白[16]。Nissl染色和NeuN表达结果显示,术后8周PLGA-Shh组SCI区吻侧和尾侧灰质前角MNs数量均高于SCI组,表明PLGA-Shh缓释微球能够持续发挥作用,促进损伤区周边MNs的存活[17]。最新研究[18]发现,脊髓撞击伤后动物后肢运动功能的恢复与残存的下行脊髓固有束(descending propriospinal tract,dPST)密切相关,这些dPST与腰髓灰质MNs形成突触连接,传导来自损伤区吻侧下行皮质脊髓束、皮质红核束的神经冲动,从而控制后肢的随意运动。本研究中大鼠后肢运动功能的恢复可能与投递到损伤区的Shh促进MNs的存活并进而增加了dPST与腰髓灰质MNs的突触连接有关。
综上所述,本研究成功制备了一种可缓释Shh的PLGA纳米微球,将其注射于大鼠SCI区后,PLGA-Shh持续释放,促进了损伤区周边灰质MNs的存活,并有效改善了大鼠后肢的运动功能。PLGA-Shh缓释纳米微球为SCI修复提供了一种新疗法,有望进一步向临床应用转化。

