N-甲基-4-异亮氨酸环孢素通过抑制线粒体通透性转换孔减轻凋亡诱导因子的核易位和细胞凋亡
曾 玥,罗思晴,马鑫喆,潘泓乐,刘红梅,张鸣号,3
(1.宁夏医科大学,银川 750004;2.宁夏医科大学基础医学院,银川 750004;3.国家卫健委代谢性心血管疾病研究重点实验室,银川 750004)
帕金森病(parkinson's disease,PD)是老年人群中一种常见的神经系统退行性疾病,以黑质多巴胺能神经元的选择性死亡导致纹状体的多巴胺水平降低为特征[1]。PD的病因和发病机制尚不明确。研究[2]发现,氧化损伤和线粒体功能障碍在PD的发病机制中起着重要作用。活性氧(reactive oxygen species,ROS)产生的增加可以触发线粒体膜通透性转换孔(mitochondrial permeability transition pore,MPTP)的形成[3-4]。MPTP引起线粒体释放促凋亡蛋白,包括细胞色素C(cytochrome C,cyto C)、caspase-9、Smac/DIABLO、核酸内切酶G(EndoG)、凋亡诱导因子(apoptosis-inducing factor,AIF),引起细胞内钙超载,最终导致细胞死亡[3-4]。AIF是一种进化保守的黄素蛋白,能够诱导caspase非依赖性细胞凋亡。线粒体形态是由细胞器裂变和融合之间的平衡动态控制的[5],而AIF缺乏可破坏这种动态平衡,从而导致线粒体损伤[6]。作为对促凋亡信号的反应,AIF从线粒体易位到细胞核,并与DNA相互作用,刺激染色质凝结和高分子量DNA碎片化[7]。因此推测,如能减少鱼藤酮诱导的ROS产生、维持线粒体膜电位和抑制AIF产生,将对维持线粒体膜稳定和细胞内环境稳态,减少细胞死亡发挥重要作用。
环孢素A(cyclosporin A,CsA)是一种通过与Cyp-D结合抑制MPTP的免疫抑制剂,N-甲基-4-异亮氨酸环孢素(N-methyl-4-isoleucine-cyclosporin,NIM811)是一种CsA衍生物。在本实验中,我们研究了NIM811对鱼藤酮诱导的海马神经元细胞死亡的体外影响,通过检测ROS的产生、线粒体膜电位、线粒体cyto C的释放、caspase-9的激活和AIF核易位,阐明NIM811通过抑制MPTP减轻AIF核易位和细胞凋亡的可能机制,为NIM811的神经保护作用和PD的防治提供基础实验依据。
1 材料与方法
1.1 资料
HT22细胞株由夏威夷大学Jun Panee博士提供;DMEM高糖培养基、PBS(GE Healthcare Life Sciences,Logan,UT,USA),FBS、胰蛋白酶、L-谷氨酰胺、青霉素-链霉素溶液(Thermo Fisher Scientific,USA);NIM811(Zymes LLC,Hasbrouck Heights,NJ,USA);鱼藤酮(Sigma,USA);Alamar Blue(Thermo Fisher Scientific,USA),二氢乙二胺(DHE)荧光探针、四甲基罗丹明甲酯(tetramethylrhodamine methyl ester,TMRM)、Hoechst(Life Technologies,Grand Island,NY,USA);亚细胞结构胞核与胞浆蛋白抽提试剂盒和BCA蛋白定量试剂盒(Abcam,USA);抗cyto C抗体(1∶1 000,Cell Signaling Technology,USA);抗caspase-9抗体(1∶1 000,Abcam,USA);抗AIF抗体(1∶500,Cell Signaling Technology,USA);抗Bcl-2抗体(1∶1 000,Thermo Fisher Scientific,USA);抗Bax抗体(1∶1 000,Thermo Fisher Scientific,USA);抗GAPDH抗体(1∶1 000,Cell Signaling Technology,USA);PVDF膜(Millipore,USA)。
1.2 细胞培养
用含10%胎牛血清的DMEM/F12的高糖培养基培养HT22细胞,细胞置于5%CO2、37℃、相对湿度90%~95%培养箱中培养,每2 d换液1次,当细胞密度达到80%~90%时传代,使用第3~7代的细胞进行后续实验。
1.3 细胞模型的建立与分组
使用第3~7代的HT22细胞,分成control组、鱼藤酮组、鱼藤酮+NIM811组和NIM811组。鱼藤酮组给予4.0μmol·L-1鱼藤酮刺激24 h,鱼藤酮+NIM811组在鱼藤酮刺激前3 h给予400 nmol·L-1的NIM811,NIM811组给予400 nmol·L-1的NIM811,control组给予等量的培养基[8]。
1.4 Alamar Blue法检测HT22细胞活性
用第3~7代的HT22细胞,按照1.5×104个/孔细胞的密度接种于96孔板,各组给予不同刺激。在实验结束前3 h,每孔加入10μL Alamar Blue溶液,避光,37℃培养箱中孵育3 h,PHERAstar酶标仪(BMG Labtech,Ortenberg,Germany)分别在520 nm和570 nm的激发波长和发射波长下读取荧光强度。
1.5 DHE荧光探针测定细胞内ROS的含量
第3~7代的HT22细胞,按照1.5×104个/孔细胞的密度接种于96孔板(黑色底板),各组给予不同刺激。在实验结束前30 min,每孔加入2.5μmol·L-1的DHE溶液100μL,避光,37℃培养箱中孵育30 min,PBS清洗3次,使用FluoroMax-4荧光光谱仪(HORIBA Jobin Yvon Inc,Edison,NJ,USA)在480 nm和590 nm的激发波长和发射波长下读取荧光强度。
1.6 TMRM测定线粒体膜电位(mitochondrial membrane potential,MMP)
第3~7代的HT22细胞,按照1.5×104个/孔细胞的密度接种于96孔板,各组给予不同刺激。在实验结束前30 min,每孔加入100μL的TMRM(100 nmol·L-1)和10μg·mL-1的Hoechst溶液,避光,37℃培养箱中孵育30 min,PBS清洗3次,使用PHERAstar酶标仪在590 nm和670 nm的激发波长和发射波长下读取荧光强度。
1.7 Western blot检测AIF、cyto C、caspase-9、Bax和Bcl-2蛋白的表达
HT22细胞在各组干预因子刺激24 h后,按亚细胞结构胞核与胞浆蛋白抽提试剂盒操作流程提取细胞胞浆蛋白和胞核蛋白,BCA蛋白定量试剂盒进行蛋白定量,配制十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),上样,120 V恒压凝胶电泳,PVDF(0.22μm)膜转膜,5%脱脂奶粉封闭2 h,PBST液洗膜3次,加入一抗[anticyto c(1∶1 000)、anti-caspase-9(1∶1 000)、anti-AIF(1∶500)、anti-Bax(1:1 000)、anti-Bcl-2(1∶1 000)、anti-GAPDH(1∶1 000)],4℃孵育过夜,PBST液洗膜后加入二抗(1∶5 000),室温孵育2 h,4-氯-1-萘酚显色,曝光检测内参和目的蛋白,使用Image Lab软件对条带进行相对定量分析,结果以目的蛋白的值与内参值的比值表示。
1.8 统计学方法
采用Prism 6.0统计学软件进行数据分析,计量资料以均数±标准差(±s)表示,多样本均数间比较采用One-way ANOVA分析。检验水准α=0.05。
2 结果
2.1 NIM811对鱼藤酮诱导的HT22细胞毒性的保护作用
与control组相比,4.0μmol·L-1鱼藤酮刺激24 h后,HT22细胞的活力降低到56.26%(P<0.01)。细胞明显缩小,核浓缩,细胞周围形成透明圈,符合光学显微镜下凋亡细胞的典型特征,显示鱼藤酮诱导了HT22细胞凋亡。给予400 nmol·L-1的NIM811干预后,细胞活力从56.26%上升到83.37%,凋亡细胞数量较鱼藤酮组减少(P<0.05),见图1。
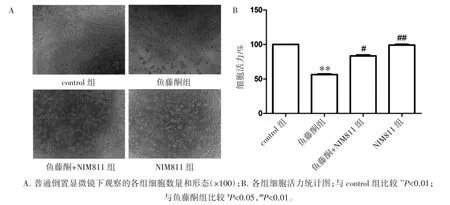
图1 NIM811对鱼藤酮诱导的HT22细胞毒性的保护作用
2.2 NIM811对HT22细胞中ROS含量的影响
DHE可被超氧化物氧化形成乙二醛,并在产生超氧化物阴离子的位置沉淀。鱼藤酮孵育HT22细胞24 h后,与control组比较,ROS增加了61%(P<0.05)。400 nmol·L-1的NIM811预处理使ROS水平基本恢复正常(P<0.05)。而单独给予NIM811并没有增加超氧化物的形成,见图2。
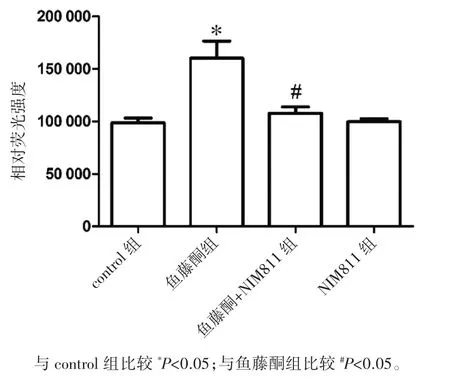
图2 NIM811对HT22细胞中ROS含量的影响
2.3 NIM811对MMP的影响
鱼藤酮孵育后,HT22细胞MMP降低(P<0.01)。400 nmol·L-1的NIM811预处理抑制了鱼藤酮引起的MMP去极化,MMP升高(P<0.01),见图3。

图3 NIM811对MMP的影响
2.4 NIM811阻断了鱼藤酮诱导的AIF核易位
与control组比较,鱼藤酮刺激HT22细胞24 h后,核蛋白中的AIF水平增加(P<0.01),用400 nmol·L-1的NIM811预处理鱼藤酮孵育的HT22细胞,降低了细胞核中AIF的蛋白水平(P<0.01),表明NIM811阻断了AIF的核易位,见图4。
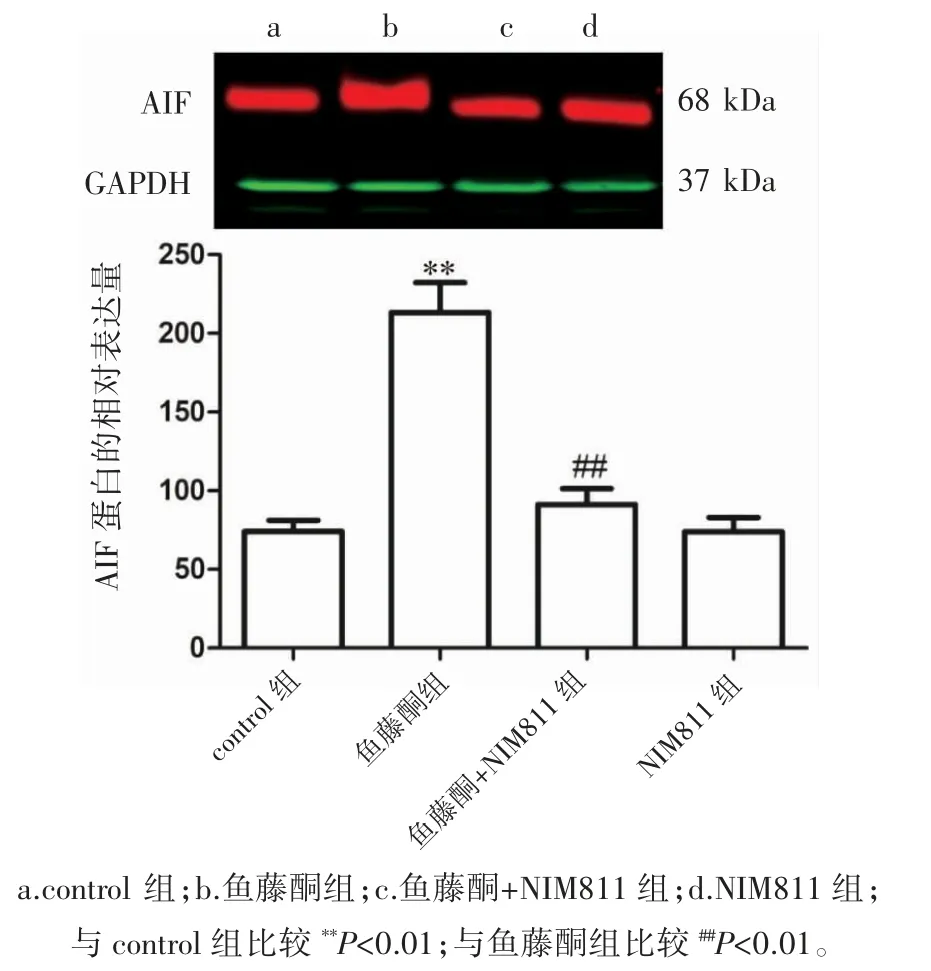
图4 NIM811对核蛋白中AIF表达的影响
2.5 NIM811对胞质cyto C、caspase-9、Bax和Bcl-2的影响
与control组比较,鱼藤酮刺激后胞质中的cyto C、caspase-9和Bax蛋白表达增高(P均<0.05),Bcl-2蛋白表达降低(P<0.01)。用400 nmol·L-1的NIM811预处理鱼藤酮孵育的HT22细胞后,与鱼藤酮组比较,cyto C、caspase-9和Bax蛋白表达降低,而Bcl-2蛋白表达升高(P均<0.05),见图5。
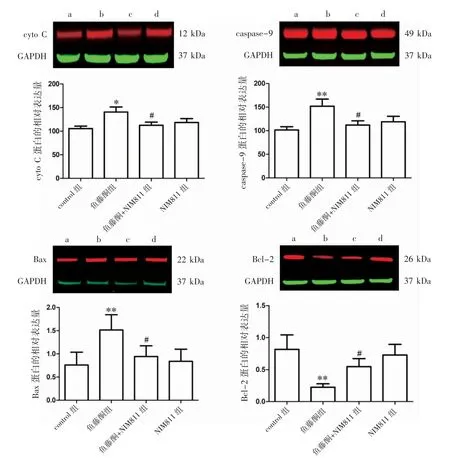
图5 NIM811对胞质cyto C、caspase-9、Bax和Bcl-2蛋白表达的影响
3 讨论
本研究发现4.0μmol·L-1鱼藤酮可以诱导海马神经元细胞凋亡,CsA衍生物NIM811可以减轻鱼藤酮诱导的HT22细胞凋亡,而单独给予NIM811刺激对HT22细胞的活力没有显著影响。进一步证明NIM811的神经保护作用与其降低ROS的产生,维持线粒体膜电位,抑制AIF核易位,减轻线粒体cyto C的释放与caspase-9的激活相关。
鱼藤酮是一种应用广泛的农药,多年来一直被用作在体外和体内诱导PD模型,并被证明具有可重复性[9-10]。鱼藤酮可以抑制线粒体电子转运链复合物Ⅰ,其神经毒性可能与ROS的产生和干扰线粒体氧化磷酸化有关[11]。ROS水平升高导致线粒体膜去极化和AIF等促凋亡因子释放,最终导致神经元死亡[12-13]。
MPTP位于线粒体内膜上,是调节线粒体生理功能的重要组成部分,参与调节钙依赖的细胞信号传导、基因表达的调节、细胞毒性ROS的合成和释放、cyto C和其他凋亡细胞死亡因子的释放[14]。
本研究发现,鱼藤酮孵育的HT22细胞中ROS水平显著升高,这与之前的报道[15]结果一致。ROS主要产生于线粒体内膜呼吸链中的电子传递链复合物Ⅰ和Ⅲ中,线粒体受内外环境因素刺激时,如射线、香烟烟雾、抗生素、高血糖、炎症因子、高血脂、缺氧等,ROS的产生会增加[16]。ROS产生的增加可以触发MPTP的形成。MPTP可导致线粒体氧化磷酸化降低,细胞能量代谢障碍。作为线粒体复合物Ⅰ抑制剂,鱼藤酮可与电子传递链复合物Ⅰ结合,阻碍电子从复合物Ⅰ向Ⅲ传递,从而促进超氧化物的生成[10-11]。显示鱼藤酮可能通过增强ROS的产生导致线粒体功能障碍和细胞凋亡。
在本研究中,鱼藤酮孵育后,HT22细胞MMP降低。400 nmol·L-1的NIM811预处理抑制了鱼藤酮引起的MMP去极化,MMP升高。显示鱼藤酮刺激诱导了线粒体膜电位去极化,促进MPTP的形成,而NIM811可以抑制这一过程。线粒体是ROS的主要靶细胞器,ROS的大量产生可诱导线粒体MPTP的开放,释放钙离子、cyto C、AIF等,引起caspase-9激活。caspase-9作为经典的促凋亡caspases,参与了线粒体信号通路细胞凋亡的启动,并能激活caspase-3/6/7,后者参与了细胞凋亡过程的执行。同时,ROS可诱导线粒体电子传递链解耦联,下调腺嘌呤核苷三磷酸的产生,上调促凋亡蛋白Bax的表达水平,最终使线粒体外膜破裂,导致细胞凋亡[17-18]。AIF通常位于线粒体双层膜的间隙,在控制细胞存活和死亡方面具有双重作用[19]。AIF在细胞质中合成,然后输入线粒体膜间空间,在那里它是维持线粒体形态和嵴结构所必需的[20]。当细胞受到内外环境因素刺激时,AIF转移到细胞核导致DNA和核膜损伤。在氧化应激等病理情况下,AIF从线粒体释放到细胞核,激活线粒体启动的caspase非依赖性细胞死亡途径,也称为AIF介导的细胞凋亡[8,21-22]。在本研究中,我们观察到鱼藤酮孵育导致胞核中的AIF蛋白含量增加,线粒体膜电位显著去极化,提示AIF可能是通过MPTP释放的。说明鱼藤酮激活了线粒体启动的、caspase非依赖性细胞死亡途径。进一步研究鱼藤酮是否还激活caspase依赖的细胞死亡途径,以及鱼藤酮诱导的线粒体膜电位去极化及MPTP形成与HT22凋亡的关系,在鱼藤酮孵育24 h后,检测了细胞质中的cyto C、caspase-9和细胞凋亡标志蛋白Bax和Bcl-2的蛋白表达。结果表明,胞质蛋白中cyto C、caspase-9和Bax的蛋白质含量增加,而Bcl-2的蛋白含量降低。提示鱼藤酮刺激诱导了线粒体cyto C从线粒体释放到细胞质中,caspase-9被激活并引起HT22细胞凋亡,说明鱼藤酮激活了caspase依赖的细胞凋亡途径。
CsA是一种通过与Cyp-D结合抑制MPTP的免疫抑制剂。由于CsA的严重副作用和潜在毒性[23],很难对其进行大剂量的检测。实验证据表明[24],MPTP诱导的神经元死亡是缺血性脑损伤的重要组成部分,特异性MPTP抑制剂CsA可减少脑缺血动物模型的神经元死亡和梗死面积。研究[25]发现,在沙鼠缺血模型中再灌注早期给予CsA可以阻断缺血诱导的线粒体cyto C的释放(MPTP打开的标志),并减少海马CA1区神经元的丢失。NIM811是一种CsA衍生物,因其缺乏任何免疫抑制特性,毒性相对较小,可在比CsA更高的剂量下使用[26]。课题组前期研究发现[27],NIM811通过抑制鱼藤酮诱导的NLRP3炎症小体和细胞焦亡,在PD中发挥保护作用。在急性胰腺炎中,NIM811可以保护腺泡和导管细胞中的线粒体功能,并保存了胰腺导管细胞中的碳酸氢盐转运机制[28]。这些研究结果为NIM811和CsA通过抑制MPTP的形成表现出神经保护作用提供了强有力的证据。
综上所述,给予NIM811预处理增强了HT22细胞活力,降低了ROS的产生,维持了线粒体膜电位,抑制了AIF核易位,减轻了线粒体cyto C的释放和caspase-9的激活,抑制了HT22细胞凋亡。说明NIM811通过抑制ROS的产生,维持线粒体MMP,抑制MPTP的形成,减少线粒体cyto C的释放和caspase-9的激活,减轻AIF核易位,从而减轻鱼藤酮诱导的HT22细胞凋亡,对PD具有保护作用。

