GABRG2基因敲除小鼠和HT22细胞通过激活PKA/NF-κB信号通路影响MMP3的表达
陈章平,李信晓,郭胜楠,孙 涛,扈启宽,4
(1.宁夏医科大学宁夏颅脑疾病重点实验室,银川 750004;2.郑州大学第五附属医院神经外科,郑州 450052;3.郑州大学第五附属医院康复医学科,郑州 450052;4.宁夏医科大学基础医学院,银川 750004)
癫痫是大脑神经环路中出现的一种以异常性同步放电为特征的神经系统疾病。癫痫发病机制复杂,部分癫痫发作与遗传因素有关,在GABAA受体基因的编码过程中,单一亚基的基因突变可导致癫痫综合征的产生[1]。癫痫发作的主要特征是由高度同步的大脑神经元异常放电活动引起身体的异常运动或大脑的异常认知,具有一定程度的慢性倾向性,而将遗传因素作为解释其产生的原因逐渐被人们认可[2]。γ-氨基丁酸(GABA)作为大脑中主要的抑制性神经递质,与突触后膜上的GABAA受体结合,通过突触传递信号,发挥抑制性神经调控作用。GABAA受体是一种抑制性配体门控氯离子通道,通常由围绕中心氯离子孔的5个亚基构成,其种类大多由2个α亚基、2个β亚基和1个γ或δ亚基组成。多个GABAA受体γ2亚基(GABRG2)基因的突变位点可能与癫痫的发病有关,部分突变类型(剪接位点变异或剪接位点突变)可导致γ2亚基蛋白滞留于内质网(ER)内;γ2亚基也可发生错义突变,并可能通过降低其超极化效应影响正常的GABA受体功能[3]。GABRG2基因突变也可能与儿童失神发作、热性惊厥[4-5]和全面性癫痫综合征有关[6]。
基质金属蛋白酶家族(matrix metalloproteinases,MMPs)是一个含锌离子的肽链内切酶家族,其失调可能会加速细胞基质屏障的降解。在脑组织中,MMPs参与降解细胞紧密连接蛋白,破坏血脑屏障,激活多种MMPs前体(ProMMPs),调节N-甲基-D-天冬氨酸(NMDA)受体信号转导功能和突触的可塑性过程,并与多种疾病的致病机制存在关联。当MMPs出现功能障碍时还可导致癫痫发生,探究它们的作用机制,可能会对癫痫的治疗起到积极作用[7]。目前,关于MMP3与癫痫的相关性研究较少,本研究使用GABRG2基因条件性敲除小鼠模型[8]进行体内实验,同时用GABRG2基因敲除的HT22细胞[9]进行体外实验,来探究GABRG2基因敲除后对MMP3表达的影响及可能参与的机制。
1 材料与方法
1.1 实验动物、细胞和分组
动物实验对象:实验组(KO组)为GABRG2基因条件性敲除小鼠模型,对照组(WT组)为野生型小鼠,雌性,8~12周,每组各6只。小鼠饲养配繁均在宁夏医科大学实验动物中心SPF级环境中进行,昼夜交替时间各为12 h/12 h,正常饮水进食,室温20~26℃,湿度40%~70%,在宁夏医科大学机构动物护理和使用委员会的规定下进行实验动物操作及处理。
细胞实验对象:实验组为GABRG2基因敲除的HT22细胞,对照组为正常的HT22细胞。在37℃、5%CO2细胞培养箱中进行培养。
1.2 主要试剂
牛血清白蛋白(bovine serum albumin,BSA)、尼氏染色试剂盒(焦油紫法)、青链霉素、胰蛋白酶、含4ˊ,6-二脒基-2-苯基吲哚(DAPI)的抗荧光衰减封片剂购自索莱宝公司;GABRG2(ab87328)、MMP3(ab52915)、p-PKA(ab75991)、NF-κB(ab32536)、Mouse Anti-BetaⅢtubulin(Tuj1;ab78078)抗体及荧光二抗Goat Anti-Rabbit IgG H&L(Alexa FluorR488)(ab150077)、Goat Anti-Mouse IgG H&L(Alexa FluorR647)(ab150115)均购自Abcam;GAPDH(60004-1-Ig)抗体购自Proteintech;PKA(AF7746)抗体购自Affinity;免疫荧光中GABRG2(PA5-77404)抗体购自Thermo Fisher Scientific;IRDyeR800CW Goat Anti-Mouse IgG(H+L)(926-32210)和IRDyeR680RD Goat Anti-Rabbit IgG(H+L)(925-68071)抗体购自Li-Cor Bioscience;胎牛血清(fetal bovine serum,FBS)和DMEM培养基购自Gibco;嘌呤霉素购自Sigma;全蛋白提取试剂盒和BCA法蛋白含量检测试剂盒购自南京凯基生物科技公司;OCT冷冻切片包埋剂购自美国樱花公司。HT22细胞的完全培养基由含10%FBS和1%青链霉素的高糖DMEM培养基组成。含7μg·mL-1嘌呤霉素的完全培养基用于维持GABRG2基因敲除的HT22细胞正常生长。
1.3 动物实验方法
1.3.1 实验小鼠脑组织获取和全脑冰冻切片 分别从KO组与WT组小鼠中,随机选取3只小鼠,用3%异氟烷吸入麻醉,麻醉满意后,四肢固定,进行心脏灌注。先用生理盐水灌注,待肝脏血色褪去,再用4%多聚甲醛灌注5~10 min。取出脑组织并置于4%多聚甲醛溶液内4℃过夜;组织修块,依次放入20%和30%的蔗糖溶液内4℃各24 h。OCT包埋剂进行组织包埋,液氮速冻20~60 s。于-80℃冰箱放置2~3 d后进行全脑冰冻切片,切片厚度为20μm,将带有海马组织的组织切片自然晾干后,保存于-20℃冰箱备用。
1.3.2 Western blot检测海马组织中GABRG2、PKA、p-PKA、NF-κB、MMP3蛋白表达情况 组织蛋白提取:选取各组剩余的3只小鼠,用3%异氟烷吸入麻醉,取全脑组织,冰上分离得海马组织,放入EP管中,加入裂解液,超声破碎仪进行组织裂解破碎。4℃离心机12 000 r·min-1离心5 min,上清液为所需蛋白液。用BCA法检测蛋白浓度,将蛋白液、ddH2O和5×上样缓冲液混合后配成4μg·μL-1蛋白工作液。100℃变性5 min;配10%分离胶,5%浓缩胶的凝胶;上样体积为15μL,先在恒压80 V条件下电泳30 min,再在恒压110 V条件下电泳90 min;在恒流300 mA条件下转膜65 min;5%脱脂牛奶封闭1.5 h;加一抗GABRG2(1∶1 000)、PKA(1∶1 000)、p-PKA(1∶1 000)、NF-κB(1∶1 000)、MMP3(1∶1 000)、GAPDH(1∶2 000),4℃摇床过夜。第2天取出,复温1 h,吸去一抗,用1×TBST(1×TBS+1%Tween 20)洗膜5次,5 min/次;加入荧光二抗IRDyeR800CW Goat Anti-Mouse IgG(H+L)(1∶2 000)或IRDyeR680RD Goat Anti-Rabbit IgG(H+L)(1∶2 000),避光室温孵育1.5 h。避光条件下吸去二抗,用1×TBST洗膜5次,5 min/次,用Odyssey仪器曝光,将所获得的目的蛋白和内参条带,使用软件分析得到灰度值,与内参灰度值均一化处理后,统计分析,绘图。
1.3.3 免疫荧光检测海马组织中GABRG2和MMP3的含量变化 取出组织切片,放于暗盒中复温1 h。加PBS在水平摇床上洗3次,每次5 min;吸去液体;组化笔画圈;3%H2O2室温10 min;PBS洗3次,每次5 min;5%BSA在37℃封闭1 h;加一抗GABRG2(1∶200),MMP3(1∶200),暗盒中加水保湿,水平放置4℃过夜。第2天取出,复温1 h,吸去一抗,PBS洗3次,每次5 min;加荧光二抗Goat Anti-Rabbit IgG H&L(Alexa FluorR488)(1∶500),室温避光孵育2 h。避光下吸去二抗,PBS洗3次,每次5 min;加含DAPI的抗荧光衰减封闭剂并封片。DAPI在曝光时间40 ms,波长λ=340 nm;GABRG2、MMP3在曝光时间100 ms,波长λ=488 nm下,用高分辨率荧光显微镜获取荧光图像,观察DAPI、GABRG2和MMP3表达情况。
1.3.4 尼氏染色观察GABRG2基因缺失对海马神经元的影响 取出组织切片于室温下复温1 h。浸没于纯水10~20 s,吸干液体。使用尼氏试剂盒染液,在56℃下浸染1 h。再置于分化液中分化,镜下观察组织背景接近无色时停止分化,依次转入100%乙醇Ⅰ、100%乙醇Ⅱ、二甲苯Ⅰ及二甲苯Ⅱ中各5 min,中性树脂封片,在20倍光镜视野下获取图像,观察海马神经元形态变化。
1.4 细胞实验方法
1.4.1 Western blot检测HT22细胞中GABRG2、PKA、p-PKA、NF-κB、MMP3蛋白表达情况 细胞蛋白提取:将细胞的培养基吸去,加PBS洗3次,每次5 min。用细胞刮刀收集细胞,1 000 r·min-1离心5 min,吸去上清液,加入裂解液,超声破碎仪进行细胞裂解破碎。4℃离心机12 000 r·min-1离心5 min,上清液为所需蛋白液。余下步骤同1.3.2中实验方法。
1.4.2 免疫荧光检测HT22细胞中GABRG2和MMP3的含量变化 在超净台中,将用0.1 mg·mL-1左旋多聚赖氨酸包被的圆形玻片放于12孔培养板中,将细胞接种于玻片上并培养,待观察细胞状态和密度适宜后,吸去培养基,PBS洗2次,每次3 min;4%多聚甲醛固定1 h;PBS洗3次,每次5 min;0.2%Triton X-100,冰上通透15 min;PBS洗3次,每次5 min;5%BSA室温封闭1 h;加一抗GABRG2(1∶200),MMP3(1∶200),Tuj1(1∶250),4℃孵育保湿过夜。第2天取出,复温1 h,吸去抗体,PBS洗3次,每次5 min。加入荧光二抗Goat Anti-Rabbit IgG H&L(Alexa FluorR488)(1∶500)和Goat Anti-Mouse IgG H&L(Alexa FluorR647)(1∶500)。DAPI在曝光时间30 ms,波长λ=340 nm;GABRG2、MMP3在曝光时间60 ms,波长λ=488 nm;Tuj1在曝光时间100 ms,波长λ=647 nm下,获取荧光图像。其余步骤同1.3.3。
1.5 统计学方法
使用Image J和Image-Pro Plus软件对图片进行量化分析,数值均一化处理后使用SPSS 23.0统计学软件进行分析,使用GraphPad Prism 8.0软件绘图。计量资料以均数±标准差(±s)表示,组间比较采用t检验。P≤0.05为差异有统计学意义。
2 结果
2.1 GABRG2基因敲除小鼠海马组织中GABRG2、PKA、p-PKA、NF-κB、MMP3蛋白表达情况和免疫荧光和尼氏染色结果
Western blot结果显示,与WT组小鼠相比,KO组小鼠海马组织中GABRG2蛋白表达降低(P<0.05);p-PKA、NF-κB、MMP3蛋白表达均升高(P均<0.05);PKA蛋白表达差异无统计学意义(P>0.05),见图1。免疫荧光结果显示,与WT组小鼠相比,KO组小鼠海马区GABRG2表达降低,MMP3表达升高,特别在海马CA3区明显升高,见图2。尼氏染色结果显示,与WT组小鼠相比,KO组小鼠海马神经元的结构松散,离散程度提高,而且离散分布的神经元数量明显增加,见图3。

图1 GABRG2基因敲除小鼠海马组织中GABRG2、PKA、p-PKA、NF-κB、MMP3蛋白表达情况

图2 GABRG2基因敲除小鼠海马CA3中GABRG2和MMP3蛋白表达情况(bar=100μm)
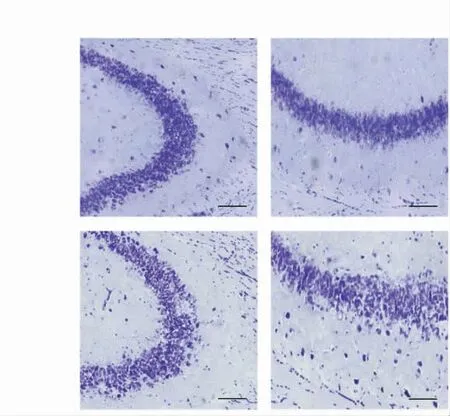
图3 GABRG2基因敲除小鼠海马CA1、CA3区尼氏染色结果(bar=100μm)
2.2 GABRG2基因敲除的HT22细胞中GABRG2、PKA、p-PKA、NF-κB、MMP3蛋白表达情况和免疫荧光结果
Western blot结果显示,与WT组细胞相比,KO组细胞GABRG2蛋白表达降低(P<0.05);p-PKA、NF-κB、MMP3蛋白表达均升高(P均<0.05);PKA蛋白表达差异无统计学意义(P>0.05),见图4。免疫荧光结果显示,与WT组细胞相比,KO组细胞GABRG2的表达降低,MMP3的表达升高,见图5。

图4 GABRG2基因敲除的HT22细胞中GABRG2、PKA、p-PKA、NF-κB、MMP3蛋白表达情况

图5 GABRG2基因敲除的HT22细胞中GABRG2和MMP3蛋白表达情况(bar=100μm)
3 讨论
GABRG2在哺乳动物大脑中大量表达,主要分布于大脑皮质、海马和小脑神经元的突触后膜上。γ2亚基在突触的转运和聚集中发挥着重要作用。γ2亚基合成后先停留在ER内,与其他亚基结合(如α和β亚基),进一步组装为五聚体,正确组装后通过ER,经过高尔基体加工后,到达细胞表面,当GABAA受体激活后,传递氯离子电流,发挥抑制性效应[10-11]。γ2亚基的突变与遗传性癫痫密切相关,其突变类型包括错义突变、无义突变、移码突变以及剪接位点和缺失突变等,并且与单纯性热性惊厥(FS)和遗传性癫痫综合征(如儿童典型失神发作、遗传性癫痫伴热性惊厥附加症、重度肌阵挛性癫痫)相关。总之,目前已知的功能主要有三方面,一是参与离子通道的构成;二是参与苯二氮 等药物结合位点的构成;三是在对各亚基协同组装形成GABAA受体并向膜上的装配过程中发挥主导作用。除此之外,γ2亚基还有可能通过未知途径参与到诸如炎性反应、损伤修复、突触可塑性、学习记忆等多种功能过程中[12]。
MMPs广泛存在于中枢神经系统中,在神经元和胶质细胞中合成,释放到细胞外间隙,作为神经可塑性和神经炎性因子的调节因子[13]。癫痫的发生与MMPs的表达增加及MMPs的表达异常有关,其中MMP2、MMP3和MMP9在大脑中的含量最为丰富[14]。临床研究显示,脑损伤后不久,抑制过多的MMP3产生可能会减缓癫痫的发生[15]。MMP3本身作为信号分子在炎性反应中起到正反馈作用,可引起小胶质细胞的激活和细胞因子的合成[16]。MMP3在损伤的神经元、少突胶质细胞、星形胶质细胞和反应性小胶质细胞或侵袭性巨噬细胞中均可表达,其可能具有参与破坏血脑屏障,引起神经炎症和凋亡的作用[17]。MMP3可能参与突触可塑性的过程,并在突触传递的长时程增强中是不可或缺的[18]。体外实验研究发现,MMP3可以切割NMDA受体的NR1亚基,影响突触NMDARs功能[19]。在MMP3基因敲除小鼠的视觉皮层中,树突棘的形态受到损害,即MMP3可能通过介导树突棘结构的可塑性影响突触效能[20]。同样,在海马的学习记忆中,Morris水迷宫实验结果显示,抑制MMP3可能会影响空间学习的过程[21]。被动回避实验结果显示,在训练几小时后,海马内MMP3蛋白水平增加,MMP3可能在诱导细胞外基质(ECM)重塑,联想记忆巩固中起到一定作用[22]。
本研究首先通过GABRG2基因敲除小鼠模型研究结果显示,GABRG2基因敲除后可促进海马区MMP3的表达增高。KEGG信号通路结果分析显示,NF-κB信号通路受到白细胞介素家族分子如IL-17及其受体的调控,进而影响MMPs的表达;PKA与NF-κB信号通路存在直接的联系;PKA对cAMP系统起着重要的作用,GABA及其受体也不例外。因此,GABRG2可能通过NF-κB信号通路对MMP3进行调控。通过体内、外实验检测相关蛋白的表达情况,表明当GABRG2基因敲除后,可能通过激活PKA/NF-κB信号通路影响MMP3的表达升高。本实验的研究结果揭示,GABRG2基因敲除后会影响MMP3的表达,为癫痫的临床治疗提供实验依据。

