TRPM2对小鼠脑缺血再灌注损伤中星形胶质细胞活化的影响
王芳姣,焦 岩,和祯泉,张 燕,张 瑞,余建强,何仲义,杨 巍,李芳芳,牛建国,
(1.宁夏医科大学基础医学院人体解剖与组织胚胎学系,银川 750004;2.宁夏医科大学颅脑疾病重点实验室,银川750004;3.宁夏医科大学药学院药理学系,银川 750004;4.浙江大学基础医学院生物物理学系,杭州 310058)
脑缺血是世界范围内导致人类残疾和死亡的主要病因之一,血供不足导致大脑缺少氧气和营养,最终使神经功能缺损[1-2]。恢复脑血供对缓解缺血性脑损伤至关重要,但其可能会进一步加重脑损伤,即脑缺血再灌注(ischemia-reperfusion,I/R)损伤[3]。探索有效预防脑I/R损伤的治疗方法仍是目前临床亟待解决的问题。有研究[4]表明,能够降低卒中后脑梗死体积的治疗往往伴随着反应性星形胶质细胞的减少,提示通过特殊途径促进星形胶质细胞有益功能或降低其有害功能,可能成为改善脑卒中后脑损伤的有效治疗手段。
瞬时受体电位M2(transient receptor potential melastatin 2,TRPM2)通道是一种非选择性Ca2+通透性阳离子通道[5],广泛表达于中枢神经系统(central nervous system,CNS)[6]。TRPM2介导的Ca2+传导参与多个生理过程,包括炎性因子释放、小胶质细胞活化和胰岛素分泌等[7]。研究[8-9]表明,敲除或抑制TRPM2基因可减少缺氧缺血性脑损伤后的脑梗死体积,改善感觉运动功能,减少炎性反应。但TRPM2通道是否通过调控星形胶质细胞的活化从而介导脑I/R损伤目前尚不清楚。
本研究拟利用小鼠脑I/R损伤模型以及原代星形胶质细胞氧糖剥夺再灌注(oxygen and glucose deprivation-reperfusion,OGD/R)模型,探讨造模后星形胶质细胞的活化程度以及TRPM2基因是否参与调控其活化。
1 材料与方法
1.1 实验动物
实验所用SPF级C57BL/6雄性小鼠由宁夏医科大学实验动物中心提供[动物许可证号SCXK(宁)2020-0001],TRPM2-/-小鼠(C57BL/6品系背景)由浙江大学动物实验中心提供,小鼠在安静环境下饲养,自由摄食和饮水。选取体质量26~28 g的小鼠进行在体实验;采用C57BL/6和TRPM2-/-的0~2 d新生乳鼠进行原代星形胶质细胞培养取材。
1.2 主要试剂
TTC购自美国Sigma公司,异氟烷、线栓购自深圳市瑞沃德生命科技有限公司,胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)单克隆抗体购自Cell Signaling Technology公司,含4,6-二脒基-2-苯基吲哚(4,6-diamidino-2-phenylindole,DAPI)封片剂购自Southern Biotech公司,牛血清白蛋白(bovine serum albumin,BSA)购自北京索莱宝科技有限公司,Cy5-AffiniPureDonkey Anti-Mouse IgG(H+L)购自Jackson公司,胎牛血清购自Gibco公司,含各种氨基酸和葡萄糖的培养基(dulbecco's modified eagle medium,DMEM)及磷酸缓冲盐溶液(phosphate buffer saline,PBS)购自美国HyClone公司,聚丙烯酰胺凝胶配制试剂盒、全蛋白提取试剂盒、蛋白定量试剂盒均购自江苏凯基生物技术股份有限公司。
1.3 实验分组
将野生小鼠和TRPM2敲除小鼠按照完全随机的方法进行分组。在体实验设置为野生假手术(WT-sham)组、TRPM2敲除假手术(TRPM2-/--sham)组、野生脑缺血再灌注(WT-I/R)组、TRPM2敲除脑缺血再灌注(TRPM2-/--I/R)组,其中假手术组麻醉小鼠后,游离左侧颈总动脉(common carotid artery,CCA)、颈外动脉(external carotid artery,ECA)及颈内动脉(internal carotid artery,ICA)后,逐层缝合;脑I/R组栓塞小鼠大脑中动脉1.5 h再灌注24 h。离体实验将原代星形胶质细胞设置为野生对照组(WT-CTRL)、TRPM2敲除对照组(TRPM2-/--CTRL)、野生氧糖剥夺再灌组(WTOGD/R)、TRPM2敲除氧糖剥夺再灌组(TRPM2-/--OGD/R)。
1.4 实验方法
1.4.1 小鼠脑I/R模型建立 采用异氟烷持续吸入麻醉小鼠,钝性分离左侧CCA,沿CCA向远心端游离ECA、ICA;结扎ECA远心端,并在其近心端系一松结,用动脉夹阻断ICA血流,活结结扎CCA;在ECA结扎部位的近心端剪一小口,将线栓由该小口沿ECA插入,顺着ICA方向插入1 cm至有阻力时将线栓固定,栓塞部位为左侧大脑中动脉。1.5 h后拔出线栓,即可实现脑I/R。
1.4.2 神经功能检测 脑I/R模型建立24 h后,采用Bederson评分[10]评估小鼠神经功能。0分:无神经功能缺损;1分:优先向一侧转弯;2分:环形转圈;3分:偏向一侧纵向倾倒;4分:小鼠无运动;5分:小鼠死亡。本实验采用双盲法进行评分。
1.4.3 脑梗死体积测定 脑I/R模型建立24 h后,迅速断头取脑,放入预冷的脑槽中,-20℃速冻15 min,将脑组织去除嗅球、小脑及低位脑干,冠状面切成厚度约2 mm的脑片;将脑片置于0.25%的2,3,5-氯化三苯基四氮唑(2,3,5-triphenyltetrazolium chloride,TTC)生理盐水中,37℃避光孵育30 min,4%多聚甲醛中性缓冲液固定过夜;将脑片按顺序摆放在刻度板上拍照。用Image J软件测梗死面积(A)和脑片的总面积(B),脑梗死体积(%)=(A1+A2+…+An)/(B1+B2+…+Bn)×100%(公式为最简式,以抵消分子分母所乘的厚度2 mm)。
1.4.4 脑组织灌注、固定、脱水及切片 脑I/R模型建立24 h后,使用预冷的约100 mL氯化钠溶液(0.9%)灌洗,直至流出液为澄清液体,肝脏由红色转为白色,随后使用约100 mL多聚甲醛(4%)溶液冲灌,待尾巴上翘变硬,其他组织也随之变性变硬后停止灌注。断头取出完整大脑并置于预冷的4%多聚甲醛溶液中,4℃过夜,30%蔗糖溶液脱水后进行冰冻切片,厚度为30μm。
1.4.5 免疫荧光染色检测星形胶质细胞GFAP表达 将冰冻切片室温复温30 min,TBS洗3次,5 min/次。用5%BSA封闭3 h,加入小鼠抗GFAP单克隆抗体(1∶600),4℃孵育过夜。TBS洗3次后,加入Cy3标记驴抗小鼠IgG(H+L)(1∶500),室温孵育3 h,TBS洗3次,10 min/次。用含DAPI的抗荧光淬灭封片剂封片,荧光显微镜观察拍照,用图像分析软件Image J分析平均荧光强度以及阳性细胞数量。每组3只小鼠样本,将包含海马区的脑组织水平切片,选取最中间的一片拍照,并分别计算每个样本缺血侧海马CA1、CA3、DG区和缺血半暗带皮层区平均荧光强度以及阳性细胞数量总和,比较组间差异。
1.4.6 星形胶质细胞的培养与收集 新生0~2 d的C57乳鼠,75%乙醇体表消毒,剪刀断头置于冰板上;固定小鼠头部,使用弯尖眼科剪刀剪开颅骨,取出脑组织;在体视显微镜下将皮层表面脑膜剥离干净,去除嗅球和小脑;用无菌眼科剪将脑组织剪碎,胰酶消化5 min,T75培养瓶接种,置于5%CO2、37℃培养箱中培养;此后每3 d更换1次培养基。培养10 d后,以260 r·min-1的转速在37℃恒温摇床上摇细胞18 h,除去培养液中的小胶质细胞和少突胶质前体细胞,剩余的贴壁细胞即为星形胶质细胞。
1.4.7 细胞OGD/R模型建立 每10 cm大皿接种1×106个细胞,培养48 h后,换成无糖无血清培养基,在细胞培养罐中低氧培养3 h(氧浓度<1%),继续换成含葡萄糖和血清的培养基,常氧条件下培养6 h。
1.4.8 Western blot检测星形胶质细胞中GFAP蛋白表达 收集OGD/R造模后的星形胶质细胞,Western blot法检测GFAP和β-actin的表达。用全蛋白提取试剂盒提取细胞总蛋白,BCA试剂盒分析蛋白定量。取等量的蛋白进行聚丙烯酰胺凝胶电泳,浓缩胶80 V电泳40 min,分离胶120 V电泳60 min,湿转法转至聚偏二氟乙烯膜上,350 mA 90 min,5%脱脂奶粉封闭2 h。分别加入适当浓度的一抗4℃孵育过夜,PBST液清洗3遍后加入二抗室温孵育2 h。PBST液漂洗后曝光显影。
1.5 统计学方法
使用Image J软件处理TTC染色、免疫荧光染色和Western blot检测结果,使用GraphPad Prism 8作图。数据运用SPSS 20.0统计学软件进行分析,计量资料用均数±标准差(±s)表示,组间比较采用单因素方差分析。P≤0.05为差异有统计学意义。
2 结果
2.1 小鼠脑I/R模型建立
选取26~28 g雄性C57BL/6小鼠,实验分为WT-sham组、TRPM2-/--sham组、WT-I/R组、TRPM2-/--I/R组,每组6只。其中假手术组小鼠只游离左侧CCA、ECA、ICA,不插线栓;脑I/R组小鼠正常建模,缺血1.5 h,再灌注24 h。小鼠左侧CCA分支及脑I/R后实验鼠向右侧偏转的体态,见图1。
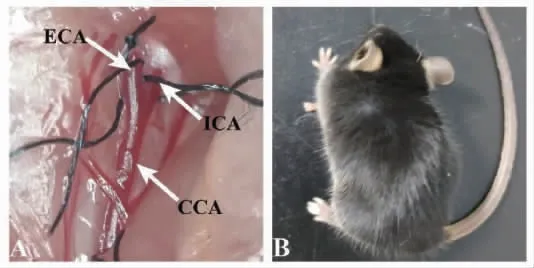
图1 小鼠脑I/R模型建立
2.2 TRPM2基因敲除可促进脑I/R小鼠神经功能的恢复
Bederson评分结果显示,WT-sham、TRPM2-/--sham组小鼠均无神经功能缺损表现,与sham组相比,在I/R 24 h后,WT-I/R组小鼠Bederson评分升高(P<0.05);TRPM2-/--I/R组小鼠Bederson评分较WT-I/R组降低(P<0.05),见图2。
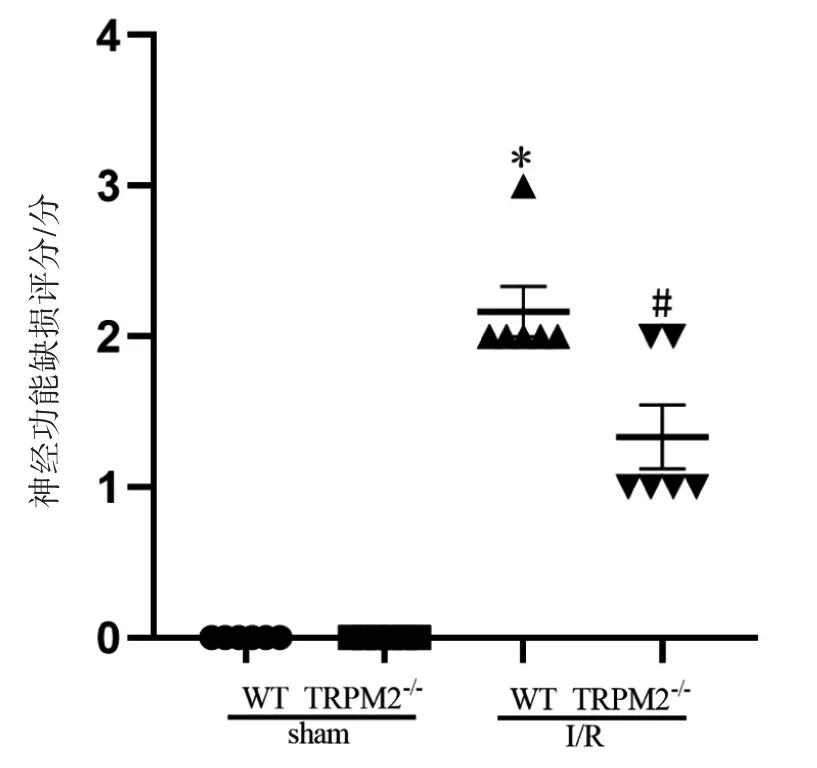
图2 TRPM2基因敲除对脑I/R小鼠神经功能恢复的影响
2.3 TRPM2基因敲除有效降低脑I/R小鼠脑梗死体积
TTC染色结果显示,大脑正常组织被染为红色,脑梗死部分未着色。WT-sham、TRPM2-/--sham组小鼠均无脑梗死表现。与sham组相比,WT-I/R组小鼠脑梗死体积增大(P<0.05);与WT-I/R组相比,TRPM2-/--I/R组小鼠脑梗死体积减小(P<0.05),见图3。
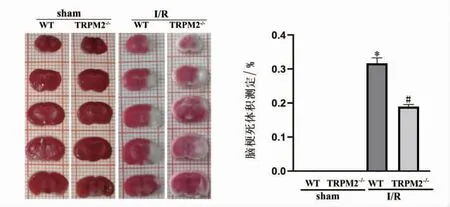
图3 TRPM2基因敲除对脑I/R小鼠脑梗死体积的影响
2.4 TRPM2基因敲除有效降低脑I/R小鼠星形胶质细胞的活化水平
脑I/R 24 h后,免疫荧光染色法观察GFAP表达水平。WT-sham、TRPM2-/--sham组小鼠左侧海马CA1、CA3、DG区及皮层缺血半暗带区仅有少量GFAP阳性细胞,且阳性细胞胞体小,突起较少;与WT-sham组相比,WT-I/R组小鼠海马和皮层区出现大量GFAP强阳性细胞(P<0.05),胞体明显增大,突起变粗,活化程度高;与WT-I/R组相比,TRPM2-/--I/R组小鼠GFAP荧光强度(P<0.05)及阳性细胞数(P<0.05)明显减少,见图4。
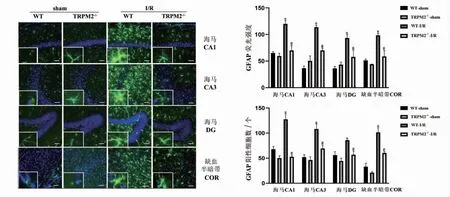
图4 TRPM2基因敲除对脑I/R小鼠缺血侧GFAP表达的影响
2.5 体外原代星形胶质细胞培养纯度鉴定
采用免疫荧光法,对体外培养的原代星形胶质细胞进行GFAP蛋白标记,从而鉴定细胞纯度。星形胶质细胞的纯度高于95%,可以达到后续实验的细胞纯度要求,见图5。
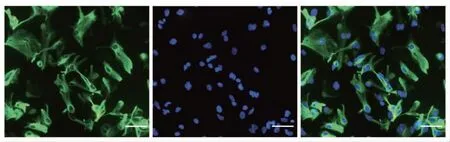
图5 免疫细胞荧光法鉴定星形胶质细胞纯度(bar=50μm)
2.6 TRPM2基因敲除有效降低OGD/R星形胶质细胞GFAP蛋白表达水平
Western blot结果表明,WT-CTRL、TRPM2-/--CTRL组细胞GFAP蛋白表达量差异无统计学意义(P>0.05),与对照组相比,WT-OGD/R组细胞GFAP蛋白表达量增高(P<0.05);与WT-OGD/R组相比,TRPM2-/--OGD/R组GFAP蛋白表达量降低(P<0.05),见图6。
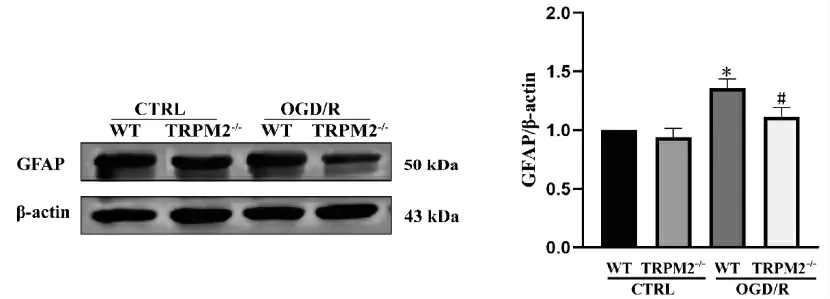
图6 TRPM2基因敲除对OGD/R星形胶质细胞GFAP蛋白表达的影响
3 讨论
脑缺血发生时,随即伴随能量损失、神经兴奋性毒性、活性氧生成等各种平行的级联反应,引起线粒体功能障碍,并进一步导致神经变性。此外,线粒体功能障碍、蛋白质合成功能障碍以及脂质过氧化都会导致损伤进一步加重[11]。脑缺血发生后的几分钟内,由损伤的神经元和胶质细胞产生的炎性细胞因子,如转化生长因子-α(TGF-α)、白细胞介素-1(IL-1)、IL-6和激肽蛋白6(KLK6)[12],在触发星形胶质细胞激活中发挥作用[13]。激活后的星形胶质细胞也称为反应性星形胶质细胞增生[14],是包括脑缺血在内的多种神经系统疾病的病理标志[15]。其激活的特征包括细胞肥大、增殖,增加GFAP、波形蛋白和巢蛋白,释放细胞因子[16],可能导致神经元死亡和增加血脑屏障通透性[17]。
CNS的TRPM2通道介导脑缺血再灌注损伤,但对其调控机制还不甚清楚,为了研究TRPM2介导脑I/R损伤的机制,使用线栓制备小鼠左侧脑I/R模型,结果发现,野生型小鼠的神经损伤程度更高,TRPM2基因敲除组评分低,神经损伤程度明显减轻;TTC染色结果显示,野生型小鼠脑梗死体积更大,TRPM2基因敲除组脑梗死体积减小;我们发现,脑I/R造模后的小鼠缺血侧海马CA1、CA3、DG区以及皮层缺血半暗带区星形胶质细胞增生、活化程度明显增高,而TRPM2基因敲除组相同区域星形胶质细胞数量明显减少,活化程度降低。以上结果证明TRPM2基因敲除确实有助于减轻脑I/R引起的损伤,TRPM2是改善缺血性脑卒中的一个很有前途的靶点。同时初步证明TRPM2通道介导脑缺血损伤可能与调控星形胶质细胞的活化有关。
为进一步探究TRPM2在缺血再灌注损伤中对星形胶质细胞活化的影响,我们体外培养原代星形胶质细胞并进行OGD/R造模后,检测GFAP蛋白的表达量,Western blot结果显示WT组GFAP蛋白表达量明显升高,TRPM2基因敲除组GFAP蛋白表达量减少。因此,本研究从在体和离体水平证明了缺血缺氧后星形胶质细胞活化程度增高,而敲除TRPM2能够降低星形胶质细胞活化。
研究[18]表明,TRPM2能够介导神经元死亡从而导致缺血后严重的脑损伤,同时有研究[19]发现,TRPM2能够通过调控小胶质细胞活化进而在I/R损伤中发挥作用。然而,在缺血再灌注过程中,对TRPM2与星形胶质细胞活化的关系知之甚少。而本研究发现敲除TRPM2可以减少脑I/R过程中星形胶质细胞的激活,因此特异性抑制TRPM2介导的星形胶质细胞活化有望成为脑卒中药物研发中的一个潜在靶点,但是TRPM2在I/R损伤中如何调控星形胶质细胞活化以及潜在的分子机制还有待进一步研究。

