TRPM2通道对氧糖剥夺再灌注后小胶质细胞活化的影响及机制
焦 岩,王芳姣,和祯泉,张 燕,王 鹏,余建强,何仲义,杨 巍,李芳芳,牛建国,
(1.宁夏医科大学基础医学院人体解剖与组织胚胎学系,银川 750004;2.宁夏医科大学颅脑疾病重点实验室,银川750004;3.宁夏医科大学药学院药理学系,银川 750004;4.浙江大学基础医学院生物物理学系,杭州 310058)
脑卒中是由于脑血流中断而发生的破坏性脑血管事件,分为缺血性卒中和出血性卒中。缺血性卒中占脑卒中总数的60%~70%,具有高发病率、高致残率、高病死率的特点[1]。随着我国人口老龄化趋势加剧,我国脑卒中发病率呈上升趋势,有研究[2]报道,我国每年有150万~200万卒中新发病例。脑组织对缺血缺氧非常敏感,缺血缺氧发生的几分钟内就会导致严重的结构损伤和部分脑功能丧失[3]。恢复缺氧区域的血流灌注是治疗缺血性脑卒中的重要疗法,但是会诱发脑缺血再灌注损伤[4-5]。
小胶质细胞是中枢神经系统的重要组成部分,是中枢神经系统固有的免疫细胞[6],占中枢神经系统脑细胞总量的5%~10%。小胶质细胞作为中枢神经系统的第一道防线,起着重要的免疫活性和吞噬细胞的作用[7-8]。当脑缺血再灌注发生时,小胶质细胞会被激活[9],其可通过释放炎性因子、指导细胞迁移活动等多种途径影响缺血性脑卒中的预后。
瞬时受体电位M2(transient receptor potential melastatin 2,TRPM2)通道属于瞬时受体电位(transient receptor potential,TRP)家族,最早于1998年被克隆并报道,是一种非选择性阳离子通道,能够通透各种阳离子[10]。TRPM2通道对活性氧(reactive oxygen species,ROS)高度敏感,可被ROS激活,通过增加细胞内Ca2+浓度或促进细胞因子的产生,在许多生理和病理过程中发挥重要作用[11-12]。近年来一些研究显示TRPM2通道在介导免疫细胞的活化与迁移中有很重要的作用[13-14]。然而在缺血再灌注损伤中,TRPM2通道对小胶质细胞活化的影响还不甚清楚。
课题组前期研究[15]发现,在体层面上,抑制TRPM2通道可以减少大脑中动脉栓塞模型小鼠小胶质细胞活化,为了进一步深入探究,本研究拟在原代小胶质细胞上明确TRPM2通道在氧糖剥夺再灌注(OGD/R)过程中对小胶质细胞形态变化的影响,并在BV2细胞上建立OGD/R模型,探究TRPM2通道调控小胶质细胞活化的潜在分子机制。
1 材料与方法
1.1 实验材料
野生型C57BL/6小鼠由宁夏医科大学实验动物中心提供;TRPM2敲除C57BL/6小鼠由浙江大学基础医学院杨巍教授课题组馈赠;BV2细胞购于广州赛库生物公司;高糖DMEM培养基、青霉素-链霉素混合溶液(10 000 U·mL-1)、谷氨酰胺添加剂GlutaMAX和胎牛血清购于Gibco公司;无糖DMEM培养基、0.25%胰蛋白酶溶液、磷酸盐缓冲溶液(phosphate buffered saline,PBS)购于Biological Industries公司;多聚赖氨酸(Poly-D-lysine,PDL)、Pluronic F-127购于Sigma公司;N-(对戊基肉桂酰基)邻氨基苯甲酸[N-(p-amylcinnamoyl)anthranilic acid,ACA]购于MCE公司;单克隆CD11b抗体、多克隆Iba-1抗体购于Abcam公司;Fluo-4,AM钙荧光探针、Hank's平衡盐溶液购于北京索莱宝公司;肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)和白细胞介素-6(interleukin-6,IL-6)酶联免疫吸附试剂盒购于Elabscience公司;活性氧检测试剂盒购于上海碧云天公司。
1.2 小鼠大脑中动脉栓塞/再灌注模型建立
使用异氟烷吸入麻醉小鼠,钝性分离左侧颈总动脉,沿左颈总动脉向远心端游离颈外动脉和颈内动脉,结扎颈外动脉远心端,并在其近心端系一松结,用动脉夹阻断颈内动脉血流,结扎颈总动脉;在颈外动脉结扎部位的近心端剪一小口,将线栓由该小口插入,顺着颈内动脉方向插入约1 cm至有阻力时将线栓固定。置于恒温床上,缺血1.5 h后拔出线栓,再灌注24 h后灌注取脑。
1.3 脑组织灌注、固定、脱水、切片及染色
小鼠MCAO/R造模24 h后将小鼠麻醉,依次使用预冷的0.9%氯化钠溶液及4%多聚甲醛溶液灌注,断头取大脑,置于预冷的4%多聚甲醛溶液中,置于4℃冰箱过夜。过夜后将脑组织放入20%和30%蔗糖溶液进行梯度脱水。然后进行冰冻切片,厚度为30μm。脑片自然晾干贴附后,使用含有0.3%Triton X-100的PBS溶液清洗3次,每次5 min。加入含有0.3%Triton X-100的PBS溶液浸泡3 h。用免疫组化笔圈定范围。滴加适量5%BSA溶液封闭1 h。弃去BSA溶液,滴加适量山羊来源多克隆Iba-1抗体(1∶100),4℃孵育30 h。清洗3次,每次5 min。滴加适量Cy2标记的驴抗山羊IgG(H+L)二抗(1∶50),室温孵育3 h。清洗3次,每次5 min。用含有4ˊ,6-二脒基-2-苯基吲哚(4ˊ,6-diamidino-2-phenylindole,DAPI)的抗荧光淬灭封片剂封片,高分辨荧光显微镜观察拍照。
1.4 细胞培养及分组
1.4.1 原代小胶质细胞 取0~3 d新生乳鼠,断头取脑,剥离脑膜,去除嗅球、小脑、脑干,将脑组织装入离心管,用枪头轻柔捣碎,加入含乙二胺四乙酸(EDTA)的胰酶,吹打混匀,37℃消化5 min,加入完全培养基(含有10%胎牛血清、1%双抗和1%谷氨酰胺添加剂的高糖DMEM)终止消化,1 000 r·min-1离心5 min,弃去上清液,加入新的完全培养基重悬细胞,将细胞接种于PDL提前包被的T75培养瓶中,每瓶中加入10 mL完全培养基,放入细胞培养箱中静置培养。在第5天、第9天全量换液1次,在第13天使用摇床160 r·min-1摇晃2 h,收集上清液分离提纯小胶质细胞,将收集的小胶质细胞静置培养4~5 d即可用于实验。OGD/R造模分组为野生对照组、野生模型组、野生模型+ACA(10μmol·L-1)组、TRPM2敲除对照组、TRPM2敲除模型组。
1.4.2 BV2细胞 将细胞接种于含有10%胎牛血清、1%双抗的高糖DMEM中,置于37℃、5%CO2培养箱中静置培养,每2~3 d传代1次,所有实验均使用第20~30代的BV2细胞。OGD/R造模分组为空白对照组、模型组、模型+ACA(10μmol·L-1)组。
1.5 细胞OGD/R造模
弃去正常培养细胞的完全培养基,PBS清洗2遍,加入无糖无血清的DMEM培养基,然后将细胞置于缺氧罐中,充入含有95%氮和5%CO2的混合气体,密闭缺氧罐,将其放入37℃恒温箱中培养1.5 h,重新更换为完全培养基,恢复常氧条件进行再灌注培养12 h。对照组在完全培养基中于正常条件下培养相同时间,给药组在再灌阶段加入相应药物。
1.6 细胞免疫荧光染色
将细胞以适量密度接种于爬片,造模完成后弃去培养液,用PBS清洗3遍。加入4%多聚甲醛固定20 min,PBS清洗3遍。加入含有0.25%Triton X-100的PBS溶液孵育10 min,PBS清洗3遍。加入4%BSA溶液封闭30 min,移除BSA溶液。加入兔抗CD11b单克隆抗体(1∶200)或山羊抗Iba-1多克隆抗体(1∶500),4℃孵育过夜,PBS清洗3遍。加入488标记山羊抗兔IgG(H+L)(1∶500)或488标记驴抗山羊IgG(H+L)(1∶500),室温孵育3 h,PBS清洗3遍。用含有DAPI的抗荧光淬灭封片剂封片,高分辨荧光显微镜观察拍照。
1.7 ELISA试剂盒检测细胞炎性因子分泌量
将细胞以适量密度接种于6孔板中,造模完成后,收集各组上清液样本,按照ELISA试剂盒说明书进行操作。在各孔中加入标准品或样品,37℃孵育90 min。倒去孔内液体,加入生物素化抗体/抗原工作液,37℃孵育60 min,洗涤3次。加入酶结合物工作液,37℃孵育30 min,洗涤5次。加入底物溶液,37℃孵育15 min,加入终止液,立即用酶标仪在450 nm波长测量各孔的光密度(OD值),收集处理数据。
1.8 活性氧试剂盒检测细胞活性氧水平
按照说明书,用无血清培养液1∶1 000稀释活性氧荧光探针,使终浓度为10μmol·L-1。将BV2细胞以3×105个/mL的密度接种于共聚焦培养皿中,正常培养12 h后进行OGD/R造模。造模完成后,去除细胞培养液,加入适当体积的探针溶液。37℃细胞培养箱内避光孵育20 min,结束后用无血清培养液清洗3次,充分去除残余探针溶液,用荧光显微镜观察拍摄,固定拍摄条件,每组随机取3个视野采集图片,每个视野内细胞数量控制在200~250个,用Image J软件分析细胞的相对平均荧光强度,将所得结果使用SPSS 20.0统计学软件进行分析。
1.9 钙成像检测胞内钙含量
将BV2细胞以3×105个/mL的密度接种于共聚焦培养皿中,正常培养12 h后进行OGD/R造模。造模完成后,去除细胞培养液,用Hank's液清洗3次。加入1 mL含有3μmol·L-1Fluo-4,AM钙离子探针和0.01%Pluronic F-127的Hank's液,37℃细胞培养箱内避光孵育35 min,结束后用Hank's液清洗3次,用荧光显微镜观察拍摄,固定拍摄条件,每组随机取3个视野采集图片,每个视野内细胞数量控制在200~250个,用Image J软件分析细胞的相对平均荧光强度。
1.10 统计学方法
采用SPSS 20.0统计学软件进行数据分析,计量资料以均数±标准差(±s)表示,组间比较采用单因素方差分析,两两比较采用t检验。P≤0.05为差异有统计学意义。
2 结果
2.1 TRPM2基因敲除减少MCAO/R造模后在体小胶质细胞激活
MCAO/R造模24 h后Iba-1免疫荧光染色结果显示,野生假手术组、TRPM2敲除假手术组及TRPM2敲除模型组小鼠缺血侧海马CA3区及皮质区小胶质细胞呈现分枝状,胞体较小,分枝细长,处于静息状态。野生模型组小鼠缺血侧海马CA3区及皮质区小胶质细胞胞体增大,分枝减少,表现为阿米巴样,处于激活状态,见图1。
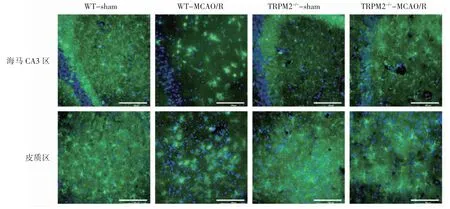
图1 在体小胶质细胞MCAO/R造模后细胞形态(×40,bar=100μm)
2.2 原代小胶质细胞培养及鉴定
原代小胶质细胞混合培养阶段和分离提纯后使用小胶质细胞特异性标记物CD11b和Iba-1分别进行免疫荧光鉴定,CD11b鉴定纯度为97.53%,Iba-1鉴定纯度为98.18%,均>95%,满足实验要求,可用于后续实验,见图2。
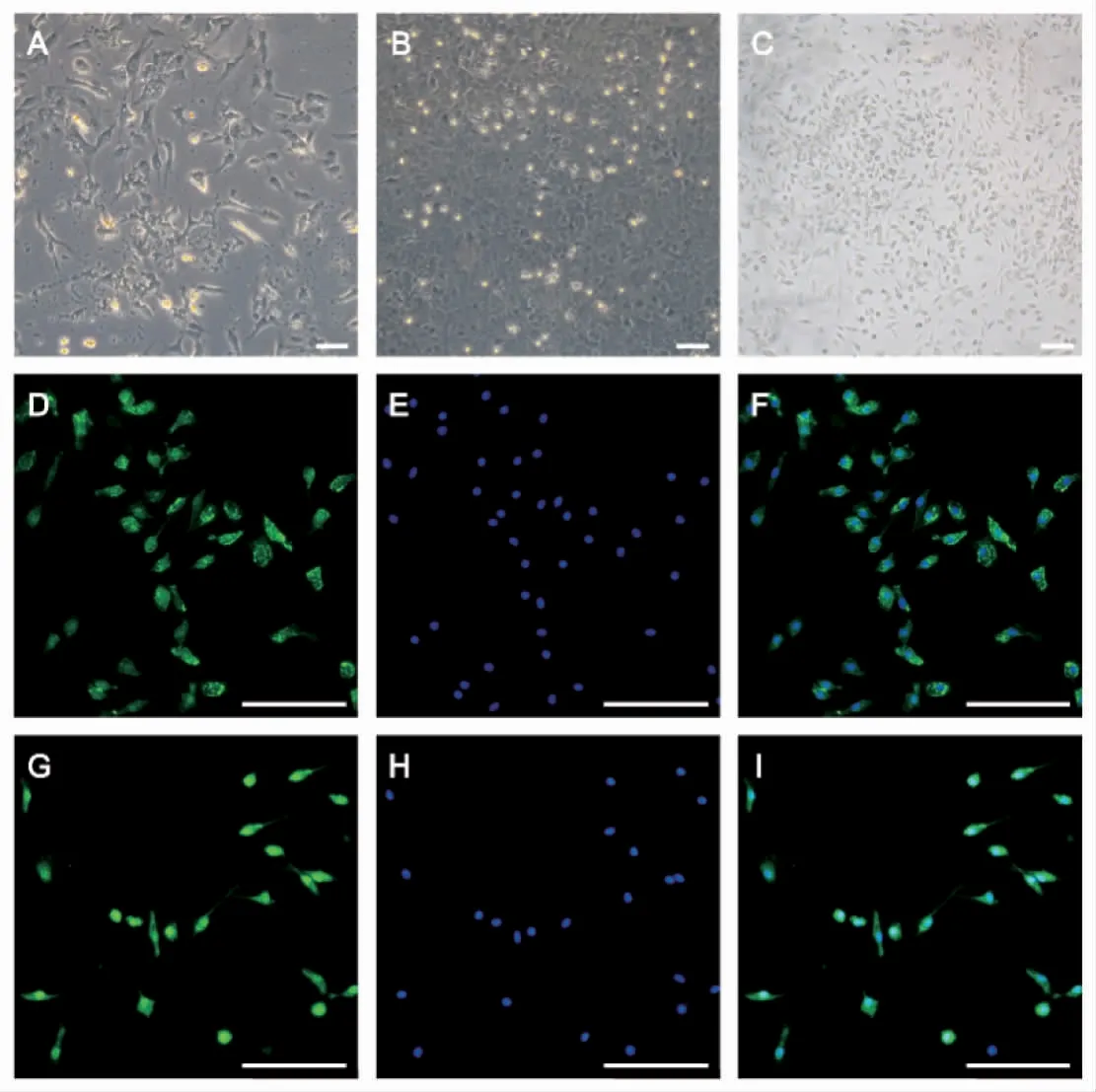
图2 原代小胶质细胞形态及鉴定(A~C:×10,bar=100μm;D~I:×40,bar=100μm)
2.3 敲除或抑制TRPM2减少OGD/R造模后原代小胶质细胞激活
Iba-1免疫荧光染色结果显示,野生和TRPM2敲除对照组细胞大多呈现梭形分枝状(静息态)。进行OGD/R造模后,野生模型组细胞大多分枝减少,胞体增大,逐渐向圆形改变(激活态)。对比野生模型组,TRPM2敲除模型组细胞仍有部分为梭形分枝状。对于野生模型+ACA组,细胞形态与TRPM2敲除模型组相似,有部分细胞呈现梭形分枝状,部分细胞呈现圆形,见图3。

图3 原代小胶质细胞氧糖剥夺再灌注后细胞形态(×40;bar=100μm)
2.4 抑制TRPM2降低BV2细胞OGD/R后活性氧水平
活性氧试剂盒检测BV2细胞ROS水平结果如图4所示。与空白对照组相比,模型组ROS平均荧光强度升高(P<0.05);与模型组相比,模型+ACA组ROS平均荧光强度降低(P<0.05)。

图4 抑制TRPM2对BV2细胞OGD/R后ROS水平的影响
2.5 抑制TRPM2减少BV2细胞OGD/R后炎症因子分泌量
ELISA检测炎性因子分泌量结果显示,与空白对照组相比,模型组TNF-α和IL-6的分泌量均增多(P均<0.05);与模型组相比,模型+ACA组TNFα和IL-6的分泌量均减少(P均<0.05),见图5。
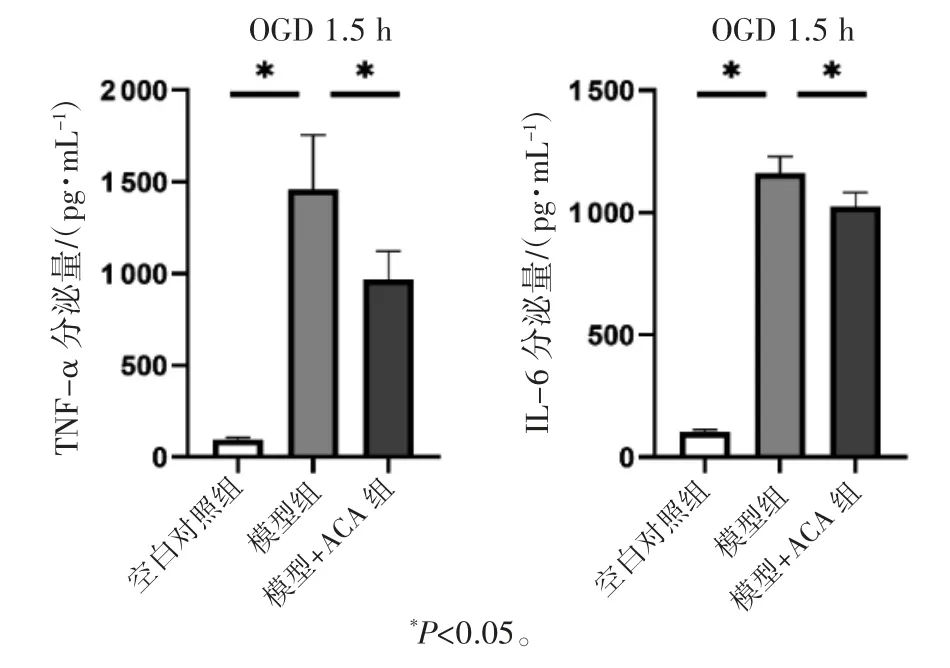
图5 抑制TRPM2对BV2细胞OGD/R后炎性因子的影响
2.6 抑制TRPM2降低BV2细胞OGD/R后胞内钙含量
钙成像检测BV2细胞胞内钙离子水平结果显示,与空白对照组相比,模型组显著上调胞内钙离子平均荧光强度(P<0.05);与模型组相比,模型+ACA组胞内钙离子平均荧光强度降低(P<0.05),见图6。

图6 抑制TRPM2对BV2细胞OGD/R后胞内钙含量的影响
3 讨论
随着人口老龄化问题的出现,脑血管疾病逐渐成为威胁人类健康的主要疾病之一。脑卒中是由于脑血管的阻塞或爆裂,导致脑血流中断发生的破坏性脑血管事件,会引发身体残疾和多重功能损伤等严重后果。缺血性卒中占卒中患者的半数以上,给患者和患病家庭带来巨大压力[16]。针对缺血性脑卒中,尽早恢复血氧供应是挽救患者生命、降低其损伤的重要手段,但是当脑缺血一段时间后,恢复血氧供应会诱发脑缺血再灌注损伤,致使原有损伤加重[17]。因此,探究脑缺血再灌注损伤的潜在细胞分子机制,对于开发治疗脑卒中靶点药物至关重要。
小胶质细胞是中枢神经系统的固有免疫细胞,正常情况下,静息的小胶质细胞呈现分枝状,胞体较小,运用监测功能,可以不断移动寻找受损的细胞,进行吞噬修复。当脑缺血再灌注损伤发生时,小胶质细胞会被活化,活化的小胶质细胞胞体增大,突出回缩,通过产生炎性因子、生物活性分子等介导炎性反应,加重脑损伤[8-9]。TRPM2通道被证实存在于多种细胞表面,如神经元、小胶质细胞、巨噬细胞、内皮血管细胞、心肌细胞等[18]。我们前期研究初步证明,TRPM2通道抑制剂N-(对戊基肉桂酰基)邻氨基苯甲酸[N-(pamylcinnamoyl)a nthranilic acid,ACA]抑制MCAO/R小鼠缺血侧小胶质细胞活化,为了进一步明确TRPM2通道对小胶质细胞活化的调控,本研究利用TRPM2敲除小鼠,建立了MCAO/R模型,结果显示,野生型小鼠在MCAO/R后,小胶质细胞胞体增大,分枝减少,呈现阿米巴形态,提示小胶质细胞激活,而TRPM2敲除小鼠的小胶质细胞活化形态不明显,提示活化得到抑制,以上结果表明敲除TRPM2可以减少大脑中动脉栓塞再灌注造模后在体小胶质细胞的激活。同时,本研究在体外培养原代小胶质细胞并建立了OGD/R模型,使用Iba-1进行免疫荧光染色,结果显示小胶质细胞胞体增大,分枝减少,提示小胶质细胞活化,ACA抑制TRPM2或者TRPM2敲除后,小胶质细胞的活化状态得到抑制,结果表明敲除和抑制TRPM2可以减少OGD/R后原代小胶质细胞的激活。综上所述,本研究结果证明了TRPM2通道在OGD/R过程中参与调控小胶质细胞活化。
TRPM2通道是一个ROS敏感型离子通道,我们之前的研究发现OGD/R导致神经元中ROS大量迸发,激活神经元上的TRPM2通道进而介导神经元死亡[19-20],而且有研究发现ROS参与了小胶质细胞的活化[21]。由于原代细胞提取困难,提取量较少,为了进一步深入探究机制,我们使用小胶质细胞系BV2细胞进行后续实验。首先研究OGD/R是否能够导致小胶质细胞ROS产生从而导致小胶质细胞活化,通过检测ROS水平,结果显示OGD/R提高小胶质细胞ROS水平,使用ACA抑制TRPM2后,小胶质细胞ROS水平下降。
活化的小胶质细胞通过产生炎性因子介导炎性反应,从而加重脑损伤[22],本研究结果显示OGD/R上调小胶质细胞TNF-α和IL-6分泌量,ACA抑制TRPM2后,TNF-α和IL-6分泌量下调,以上结果提示,TRPM2通道调控OGD/R中小胶质细胞的活化以及炎性因子释放。
研究发现,钙离子水平调控着小胶质细胞的活化等一系列反应,TRPM2被ROS激活后,可作为一种阳离子通道,通透钙离子,从而调控细胞内钙离子水平[21-23]。因此为了探究TRPM2通道影响小胶质细胞活化及炎性因子释放的分子机制,本文检测了小胶质细胞内钙离子水平,结果显示,OGD/R可上调小胶质细胞内钙离子水平,ACA抑制TRPM2后,钙离子水平下降,提示OGD/R引起的钙离子水平上调是由TRPM2通道介导的。后续我们将继续探究钙离子调控小胶质细胞活化及炎性因子释放的相关机制。
综上所述,本研究发现抑制TRPM2可以减少小胶质细胞活化及炎性因子释放,从而减轻神经炎性反应,TPRM2通道可作为治疗脑缺血及缺血再灌注损伤的新的药物靶点。

