脱水式热暴露对大鼠海马神经元凋亡相关蛋白的影响
赵尚倩,徐 涛,薛姝婧,常笑语,邓紫薇,李光华,,赵承军
(1.宁夏医科大学基础医学院,银川 750004;2.宁夏医科大学公共卫生与管理学院,银川 750004)
随着全球工业化与城市化的发展,气候变暖日趋显著,高温环境已成为对人类健康影响不可忽略的因素。有报道[1]显示,在对我国130个县进行分析时,热浪第1~2天、第2~3天的总死亡风险分别增加了11.7%和17.0%。目前,因气温升高而逐步升高的病死率也越来越受到人们的关注。长期暴露于高温环境下的工作人员以及高温下训练或作战的军人,机体不能及时补充水分,可造成脱水式热暴露,脱水和体温过高是人们在高温环境下经常经历的主要生理应激源[2]。高温环境下,机体核心体温过高,代谢速率增加,机体负荷过重,可引发心血管循环系统[3]、呼吸系统、神经系统[4]等方面的疾病,甚至可导致死亡。其中,高温对中枢系统的损害主要表现为精神和认知障碍,而认知功能出现障碍常与海马有关[5-6]。然而目前,高温环境特别是脱水式热暴露的环境对神经系统损伤的作用与机制尚不明确。本研究通过探讨不同的热暴露方式对大鼠生理功能、海马神经元形态及凋亡蛋白表达的影响,以期为热应激相关疾病导致的神经系统受损提供新的治疗方向,并为高温从业人员提供预防措施。
1 材料与方法
1.1 实验动物与分组
1.1.1 实验动物 选用SPF级雄性SD大鼠30只,体质量为180~220 g,购自宁夏医科大学实验动物中心,实验动物生产许可证号:SCXK(宁)2020-0001,经宁夏医科大学机构评审委员会批准(批准号:NXMU-2020-326)。大鼠自由饮食,于造模前适应性喂养1周,分笼饲养,12 h/12 h明暗交替光照,环境温度为(24.0±0.1)℃。
1.1.2 动物分组及造模 利用随机数字表法将大鼠分为对照组、热暴露组和脱水热暴露组。对照组置于24℃环境中,热暴露组和脱水式热暴露组置于32℃人工气候舱,每日固定暴露8 h,即8时至16时,连续进行1周。热暴露期间,脱水式热暴露组禁食禁水,热暴露组自由饮食饮水。本实验流程均严格执行中华人民共和国科学技术部发行的《关于善待实验动物的指导性意见》相关规定。
1.2 试剂和仪器
1.2.1 主要试剂 尼氏染色液(G1430,北京索莱宝科技有限公司),兔抗大鼠B淋巴细胞瘤-2(B-celllymphoma-2,Bcl-2)一抗(BS1511,南京巴傲得生物科技有限公司),小鼠抗大鼠Bcl-2相关X蛋白(Bcl-2-associated X protein,Bax)一抗(60267-1-Ig,武汉三鹰生物技术有限公司),兔抗大鼠半胱氨酸蛋白酶-3(caspase-3)一抗(ab184787,英国Abcam公司),山羊抗兔辣根过氧化酶标记IgG二抗(BS13278,南京巴傲得生物科技有限公司)、山羊抗鼠辣根过氧化酶标记IgG二抗(BS12478,南京巴傲得生物科技有限公司),全蛋白提取试剂盒(KGP250)、BCA蛋白含量检测试剂盒(KGPBCA)均购自江苏凯基生物技术股份有限公司,SDS-PAGE上样缓冲液(CW0027,北京康为世纪生物科技有限公司),Omni-EasyTM一步法PAGE凝胶快速制备试剂盒(PG213)、化学发光检测试剂盒(SQ202)购自上海雅酶生物科技有限公司,兔二步法试剂盒(PV-60001)、封闭用山羊血清(ZLI-9022)、柠檬酸钠抗原修复缓冲液(ZLI-9065)购自北京中杉金桥生物技术有限公司,中性甲醛(G1101,武汉赛维尔生物科技有限公司),脱脂牛奶,三乙醇胺缓冲液(tris buffered saline,TBS)粉末,磷酸盐缓冲液(phosphate buffered saline,PBS)粉末,石蜡,无水乙醇,二甲苯等。
1.2.2 主要仪器 人工智能气候培养箱(杭州钱江仪器设备有限公司),大鼠无创血压仪(BP-2010A,北京软隆生物技术有限公司),全自动样品冷冻研磨仪(上海净信实业发展有限公司),超速冷冻离心机(Neofuge5R,香港力康生物医疗科技控股有限公司),恒温孵育器(艾本德上海国际贸易有限公司),震荡混悬器(江苏海门市其林贝尔仪器制造有限公司),电泳仪、电泳槽、转膜夹(美国Bio-Rad生物技术有限公司),化学发光成像仪(美国通用电气设备有限公司),酶标仪、石蜡切片机(美国赛默飞世尔科技有限公司),倒置荧光显微镜(日本奥林巴斯有限公司),智能型电热恒温培养箱(上海琅轩实验设备有限公司),水平摇床,量筒,-80℃冰箱等。
1.3 样本收集与检测方法
1.3.1 样本收集 造模结束后,开始取材。15只大鼠计划用于分子生物学实验,另外15只大鼠用于形态学相关实验。将全部大鼠麻醉后,先取15只大鼠(每组5只)处死后迅速断头,使用手术刀和手术剪暴露脑组织,立即在冰上分离剥开皮质,取出海马,称重后放入-80℃冰箱,等待后续做分子生物学实验;余下的15只大鼠固定于解剖台上,使用生理盐水润湿胸腹部,左手用止血钳提起剑突处皮肤,右手沿剑突处作“V”型切口,打开腹腔,贴着胸壁向上穿透膜,剪开两侧,直至暴露心脏,灌注针插入左心室,剪开右心耳,先用生理盐水冲掉组织内多余的血液,再用4%多聚甲醛固定,小心剥离脑组织后,放进多聚甲醛中24~48 h进行后固定,用于后续做石蜡切片以及染色。后固定结束后,流水冲洗24 h,开始组织脱水,70%乙醇过夜,经80%乙醇、90%乙醇、95%乙醇、100%乙醇Ⅰ和100%乙醇Ⅱ梯度脱水,二甲苯Ⅰ和二甲苯Ⅱ透明;放入干净蜡缸,准备包埋;包埋结束后,可进行连续切片,厚度约5μm,烘干之后放入冰箱等待后续染色。
1.3.2 食物消耗量 经过一周的热暴露后,计算平均每只大鼠的7 d食物消耗量:(暴露前放置食物量-暴露后食物剩余总量)/每组大鼠只数。
1.3.3 血压(blood pressure,BP)和心率(heart rate,HR)大鼠的动脉BP和HR均由大鼠尾动脉无创血压仪测得。实验前将大鼠置于安静环境中,适应环境约30 min。将大鼠的前半身置于合适大小的大鼠套头网中,并包裹固定大鼠的后半身于泡沫板上,待大鼠状态平稳后将鼠尾穿过尾动脉检测孔,测量大鼠的收缩压(systolic blood pressure,SBP)、平均动脉压(mean arterial pressure,MAP)、舒张压(diastolic blood pressure,DBP)和HR。每只大鼠重复测量3次,取平均值记录为最终测量值。
1.3.4 尼氏染色 取出切片,烤片30 min后,常规脱蜡至水,二甲苯Ⅰ和Ⅱ各5 min,100%乙醇Ⅰ和Ⅱ各5 min,95%、90%、80%、70%乙醇各5 min,蒸馏水快洗;5%焦油紫10 min,蒸馏水快洗;0.25%的冰醋酸分色于镜下控制;无水乙醇Ⅰ和Ⅱ各5 min,二甲苯Ⅰ和Ⅱ各5 min,用中性树脂封片。选取各组多张切片的同一区域,于200倍光镜下选取3个不重叠的视野,取其平均值作为每高倍镜视野下神经元数量,重复3次后统计分析结果。
1.3.5 免疫组织化学染色 利用免疫组织化学染色检测Bax、Bcl-2阳性细胞率。取出切片,在烘箱中烤片30 min,开始脱蜡、水化:依次放入二甲苯Ⅰ和二甲苯Ⅱ各10 min,100%乙醇Ⅰ、Ⅱ,95%、90%、80%、75%乙醇各5 min,用PBS清洗3次,每次5 min;进行抗原修复,可用微波炉或高压锅,修复结束待恢复至室温,PBS清洗,方式同上一步;滴加阻断内源性过氧化物酶,山羊血清封闭,减少非特异性染色,滴加一抗(4℃过夜),PBS清洗,滴加反应增强液,37℃孵育20 min,之后滴加相应二抗,PBS清洗后滴加二氨基联苯胺(diaminobenzidine,DAB)显色液,镜下观察到显色即终止反应,使用苏木素复染,1%盐酸乙醇分化后自来水冲洗,开始脱水,中性树脂封片。待玻片晾干后,选取各组多张片子的同一区域进行拍照,每个区域在高倍镜下选择3个不同的视野,利用Image J软件计算阳性细胞表达率,并统计分析。
1.3.6 Western blot 用Western blot法检测海马组织Bax、Bcl-2、caspase-3蛋白表达情况。从-80℃冰箱中取出海马组织,加入组织裂解液,超声波震荡后12 000 r·min-1离心10~15 min,收取上清液。通过BCA法测定蛋白浓度,沸水浴加热,使蛋白充分变性。使用配胶试剂盒进行制胶,并进行电泳,转膜,5%脱脂牛奶封闭2 h,分别加入相应目的蛋白一抗:Bax(1∶2 000),Bcl-2(1∶1 000),caspase-3(1∶1 000),β-actin(1∶2 000),4℃孵育过夜,复温1 h,TBST洗涤3次,每次10 min,根据一抗种属选择相应二抗孵育1 h,经TBST洗涤后,利用超敏发光液将条带可视化,通过Image J软件进行目的蛋白的灰度值分析。
1.4 统计学方法
数据采用SPSS 25.0软件进行统计分析,以GraphPad Prism 8.0作图。计量资料以均数±标准差(±s)来表示,组间比较采用单因素方差分析,组内多重比较采用LSD-t检验。检验水准α=0.05。
2 结果
2.1 不同热暴露对大鼠食物消耗量的影响
经过一周的热暴露,与对照组相比,两个热暴露组的食物消耗量均有所下降(P均<0.05);而与热暴露组相比,脱水式热暴露组的食物消耗量减少(P<0.05),见图1。
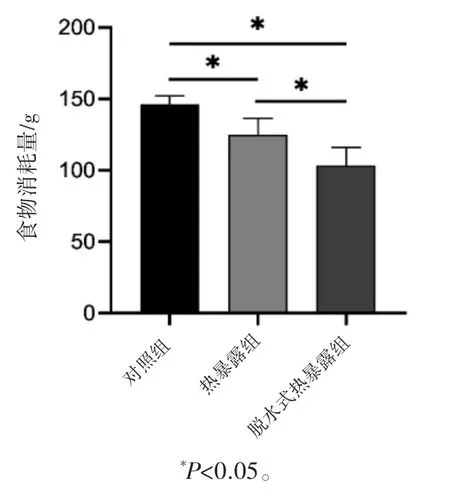
图1 不同热暴露大鼠每只7 d食物消耗量比较
2.2 不同热暴露对大鼠BP和HR的影响
与对照组相比,热暴露组和脱水式热暴露组的SBP、DBP和MAP均升高(P均<0.05),HR加快(P<0.05);与热暴露组相比,脱水式热暴露组的SBP、DBP、MAP及HR均较高(P均<0.05),见图2。

图2 不同热暴露大鼠BP和HR的比较
2.3 不同热暴露对大鼠脑海马神经元的影响
尼氏染色结果显示,对照组大鼠海马神经元排列整齐,层次清晰。与对照组相比,两个热暴露组大鼠海马神经元形态受损,细胞排列紊乱不规则,分层不清,着色浅,海马神经元细胞数量减少(P均<0.05),与热暴露组相比,脱水式热暴露组这一改变加重(P<0.05),见图3。
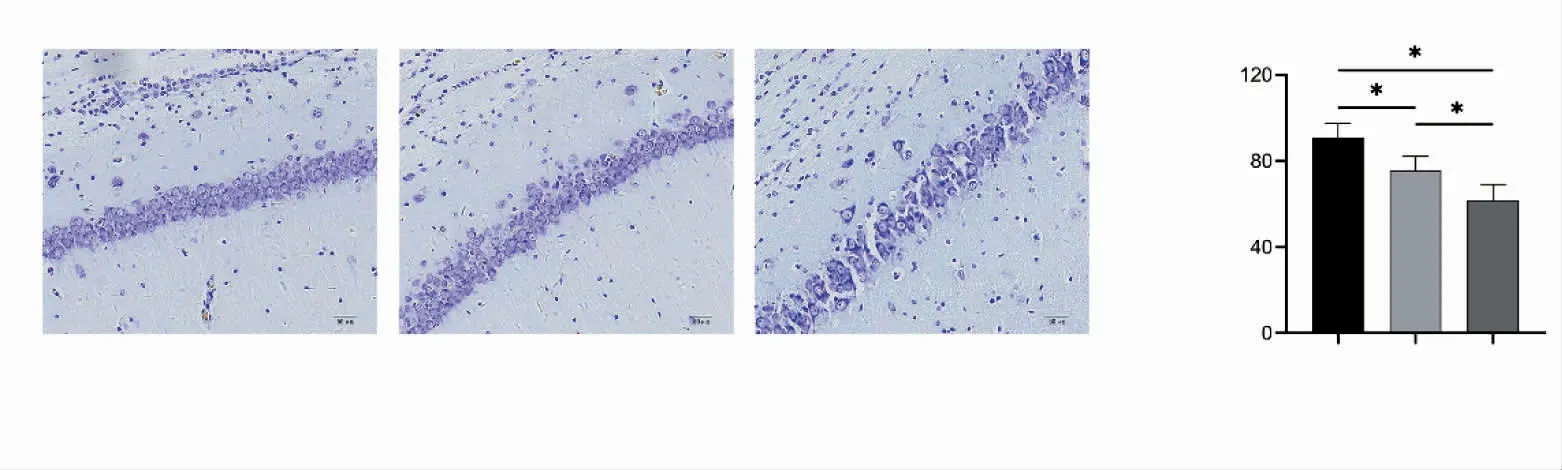
图3 不同热暴露大鼠尼氏染色结果比较
2.4 不同热暴露对大鼠海马神经元Bax、Bcl-2阳性细胞数的影响
与对照组相比,两个热暴露组均可见Bax阳性细胞增多(P均<0.05),Bcl-2细胞均减少(P均<0.05);与热暴露组相比,脱水式热暴露组可见明显Bax的阳性细胞增多(P<0.05),Bcl-2阳性细胞数减少(P<0.05),见图4。

图4 不同热暴露大鼠海马神经元Bax、Bcl-2阳性细胞数比较(免疫组化染色)
2.5 不同热暴露对大鼠海马组织凋亡相关蛋白Bax、Bcl-2、caspase-3表达的影响
与对照组相比,两个热暴露组海马组织Bax蛋白表达均增多(P均<0.05),Bcl-2蛋白表达均下降(P均<0.05),caspase-3蛋白表达均升高(P均<0.05);而与热暴露组相比,脱水式热暴露组的Bax、caspase-3表达升高(P均<0.05),Bcl-2蛋白表达下降(P<0.05),见图5。
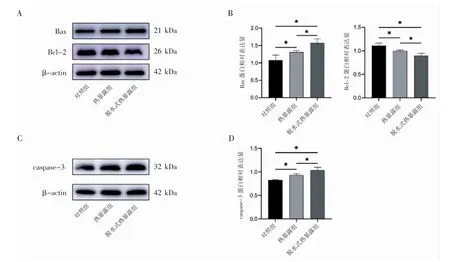
图5 Western blot检测不同热暴露大鼠海马组织凋亡相关蛋白表达结果
3 讨论
由于长期作业于潮湿无风或高温高湿环境中,越来越多的人出现了热应激相关的职业病,如热射病、热痉挛、热衰竭等[7],都与高温环境下长时间没有及时补充水分有关。当机体处于高温时,为了维持核心体温,将会通过增加散热、减少产热、降低代谢速率等一系列途径实现,从而出现活动量减少、疲乏无力、食欲下降等表现[8]。本实验研究结果也显示,经过7 d的热暴露,热暴露组和脱水式热暴露组的食物消耗量均下降,脱水式热暴露组的食物消耗量相对于热暴露组下降更多,与上述文献报道[8]相一致。
机体长时间处于热应激状态时,为了保证重要器官的供应,血液循环会重新分布,致使心脏排血量增加、每搏输出量增加,导致HR加快,外周血管阻力升高[9]。脱水会使体温过高和血浆容量减少,当脱水和高温这两种情况结合在一起,会加重心血管紧张,降低最大摄氧量[10]。而本实验结果也印证了上述观点,当处于热暴露环境时,热暴露组和脱水式热暴露组大鼠相对于对照组,HR加快,SBP、MAP和DBP都上升;相比于热暴露组,脱水式热暴露组改变大于热暴露组。以上结果显示,脱水式热暴露在一定程度上比热暴露对大鼠的HR、BP影响更为显著。
热应激除了能够影响机体的生理状态,还会造成机体的各个系统不同程度的损伤。近年来,热应激对机体的心血管、骨骼肌、肝脏和内分泌等方面的影响都引起了广泛的关注[11-12]。然而,热应激对中枢神经系统的影响报道较少。有报道[13]显示,中枢神经系统受损,认知功能下降,而认知功能主要与海马有关。本研究结果显示,热暴露组出现海马神经元数量减少,细胞排列紊乱不规则,细胞层数减少等现象,而脱水式热暴露组形态上明显观察到细胞间隙增大,排列更紊乱,海马神经元数目下降更多。尼氏小体是神经元特有的结构,也是神经元功能合成的标志。因此,尼氏染色可以判断海马神经元的损伤情况。而本研究的结果,证实了脱水明显加重了因热暴露而造成的海马神经元的损伤。
脱水式热暴露加重了海马神经元形态受损,这一现象引起了我们的深思。有研究显示,神经元受损,其背后可能与细胞凋亡、自噬发生、氧化应激、炎性反应相关[14-15]。也有研究认为,凋亡可能与机体的损伤密切相关[16]。已有研究[17]证实,Bcl-2作为凋亡蛋白家族中的一员,在细胞凋亡中发挥了重要的抑制凋亡作用,而与Bcl-2密切相关的Bax则发挥了重要的促凋亡作用。而在我们的研究结果中,在热暴露组中Bax的蛋白含量比较高,阳性细胞数目较多,Bcl-2的蛋白含量较低,阳性细胞数目较少,而脱水式热暴露组的Bax蛋白含量、阳性细胞数都比热暴露组的多,Bcl-2的表达情况则相反。以上结果说明了脱水式热暴露能够促进Bax的表达,抑制Bcl-2的表达,说明当机体处于高温时,如果不及时补充水分,会加剧损伤。
此外,胞外释放信号半胱氨酸蛋白酶caspase家族也是引起细胞凋亡的关键酶[18],一旦被激活,可将胞内蛋白质降解,使细胞死亡。其中,caspase-3作为该途径的关键执行者[19],可直接降解细胞内的结构蛋白和功能蛋白,引起细胞凋亡。而在大部分因各种原因造成的脑损伤模型中,caspase-3都表现出重要作用[20]。我们的研究数据也表明,在热暴露组中casepase-3的表达上升,而在脱水式热暴露中caspase-3的蛋白表达情况高于热暴露组,进一步表明了脱水式热暴露加重了海马的损伤。
综上所述,当机体处于热应激环境时,生理功能会被改变,同时,对海马神经元的损伤主要是促进神经元凋亡,而脱水式热暴露则会加重上述改变,但如何引起海马神经元凋亡及其内在机制,有待今后深入研究。

