878例副流感病毒在儿童社区获得性肺炎感染中的临床及流行特征分析
马岸文,朱 磊,闫 琰,季 凯,李 芳,韩 磊,孙玉宁
(1.宁夏医科大学基础医学院生物化学与分子生物学系,银川 750004;2.宁夏医科大学临床医学院,银川 750004;3.宁夏医科大学总医院呼吸及重症监护系,银川 750004;4.银川市妇幼保健院,银川 750001)
病毒感染是儿童社区获得性肺炎(CAP)的重要病因,严重可危及患儿生命[1]。人副流感病毒(human parainfluenza viruses,HPIV)是常见的儿童CAP的病原[2],是5岁以下儿童呼吸系统疾病相关住院的常见原因,仅次于呼吸道合胞病毒(RSV)[3]。副流感病毒属于副黏病毒科,是单链包膜RNA病毒,发现于1955年[4]。根据其基因特性和血清学,可分为HPIV-1、HPIV-2、HPIV-3、HPIV-4型[5]。副流感病毒感染后从鼻和口咽开始,在初次感染后2~5 d扩散至下呼吸道并达到复制高峰[6]。HPIV与其他呼吸道病原的合并感染可能导致更复杂和漫长的病程[7]。鉴于缺乏HPIV快速诊断手段及有效的抗病毒治疗药物,常导致HPIV快速传播进而提高其致死率[8],因此,针对该病毒的流行病学和临床的分析与监测十分重要。本研究对2018—2019年于银川市妇幼保健院因CAP就诊的878份病例采用多重聚合酶连锁反应(polymerase chain reaction,PCR)进行检测,结合临床,分析与总结HPIV在儿童CAP感染中的流行特征及规律,为预防及治疗提供理论依据。
1 资料与方法
1.1 研究对象
选取2018—2019年银川市妇幼保健院因CAP就诊的878例患儿,年龄在14岁以下。所有患者均根据世卫组织的CAP临床标准进行诊断,并制作研究问卷(内容包括:呼吸道症状、年龄、性别、入院时间、诊断和临床症状等)[9]。
1.2 标本收集
使用细软的塑料导管抽吸下呼吸道分泌物,立即加入病毒保护液,并做好编号,-80℃以下冰箱保存。
1.3 病毒检测
从样本中提取DNA或RNA、逆转录和多重PCR。根据制造商说明书,使用Quick-DNA/RNA Viral Kit试剂盒(Zymo Research,美国)从100μL样品溶液中提取病毒核酸,该试剂盒能够同时提取病毒RNA和DNA;然后用逆转录试剂盒(TransGen Biotech,中国)合成cDNA;最后使用多重PCR试剂盒(Seegene,韩国)检测病毒(PCR仪器:Bio-Rad MJ MiniTM,PTC-1148,美国),试剂盒分为3个组。A组包括腺病毒(ADV)、人冠状病毒(CoV229E/NL63)和人副流感病毒(HPIV-1、HPIV-2和HPIV-3)。B组包括人冠状病毒(CoVoc43)、RSV(RSVA和RSVB)、轮状病毒(RV)和流感A病毒(IFVA)。C组包括人偏肺病毒(HMPV)、流感B病毒(IFVB)、人副流感病毒4型(HPIV-4)、人博卡病毒(HBoV)和肠道病毒(EV),PCR产物经凝胶电泳鉴定。
1.4 呼吸道细菌检测
所有患儿的下呼吸道标本均于银川妇幼保健医院儿科的临床实验室进行检测。采用常规细菌培养检测方法将标本接种于血液、巧克力(含万古霉素)、麦康基琼脂平板(京药监械准字2013第2400522号)上,培养后检测肺炎链球菌、流感嗜血杆菌、金黄色葡萄球菌、肺炎克雷伯菌、铜绿假单胞菌、大肠埃希菌、阴沟肠杆菌及鲍曼不动杆菌等呼吸道细菌。
1.5 支原体检测
采集患儿静脉血,2 000 r·min-1离心5 min分离血清,用被动颗粒凝集试剂盒(SERODIARMYCOⅡ,日本)(按照试剂盒中指定的方法)进行检测,单个血清抗体滴度>1∶40为阳性。
1.6 统计学方法
采用SPSS 23.0统计学软件对数据进行分析,计数资料以率(%)表示,组间比较采用卡方检验;计量资料均不符合正态分布,以中位数和四分位数[M(P25,P75)]表示,组间比较采用非参数检验。P≤0.05为差异有统计学意义。
2 结果
2.1 HPIV病毒检出情况
878例样本中检测出总HPIV阳性308例(35.1%);其中HPIV-3阳性例数最多,共224例(25.5%),HPIV-1阳性72例(8.2%),HPIV-2阳性42例(4.8%),HPIV-4阳性28例(3.2%)。各分型中HPIV-1和HPIV-3合并感染28例,HPIV-2和HPIV-3合并感染22例,其他各分型合并感染阳性数较少,见表1。
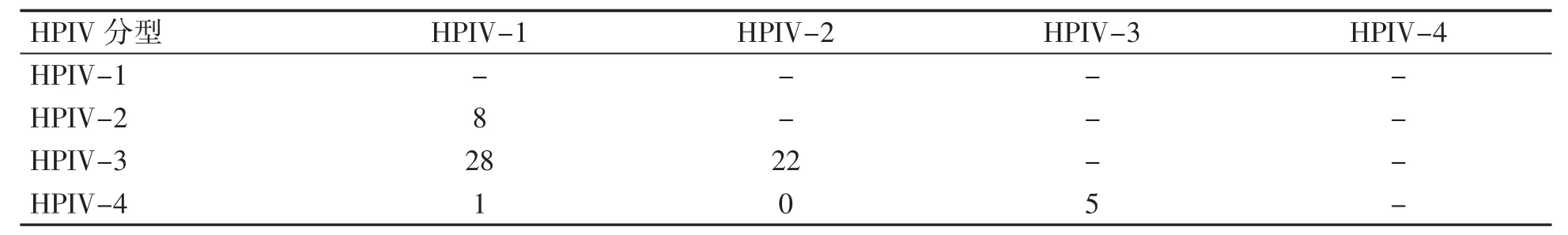
表1 HPIV分型合并感染检出情况(例)
2.2 HPIV合并其他病毒检出情况
HPIV-1、HPIV-2及HPIV-3型合并轮状病毒(RV)、RSV、人偏肺病毒(HMPV)感染阳性率较高;HPIV-4合并RSV、轮状病毒(RV)感染阳性率较高,见表2。

表2 HPIV分型合并其他病毒感染检出情况[例(%)]
2.3 HPIV感染的性别分布
女性患儿HPIV-4阳性率高于男性患儿(P=0.040),在男女分布上其他分型感染阳性率差异无统计学意义(P均>0.05),见表3。

表3 HPIV感染性别分布情况[例(%)]
2.4 HPIV感染的年龄分布
各年龄段的HPIV-3感染构成比比较差异有统计学意义(P=0.044),与<1岁年龄段比较,3~岁和>5岁年龄段HPIV-3感染构成比均下降(P均<0.05),见表4。

表4 各年龄段HPIV感染分布情况[例(%)]
2.5 HPIV感染的月份分布
在878例样本中,HPIV感染主要高发于春秋季,其中HPIV-3在4、5和10月份感染达到高峰,阳性结果分别为35例(15.6%)、46例(20.5%)、36例(16.1%);HPIV-2、HPIV-4感染全年检出率较低,见图1。

图1 HPIV感染的月份分布
2.6 HPIV感染的临床症状分析
在总HPIV感染的临床症状中,咳嗽、喘鸣音、呼吸困难、咽部充血、肺部干湿啰音和体温>39℃感染者与未感染者比较差异均无统计学意义(P均>0.05);HPIV-1型感染的患儿咽部充血发生率较未感染者高(P=0.014);而感染HPIV-4的患儿肺部干湿啰音发生率较未感染者低(P=0.004),见表5。
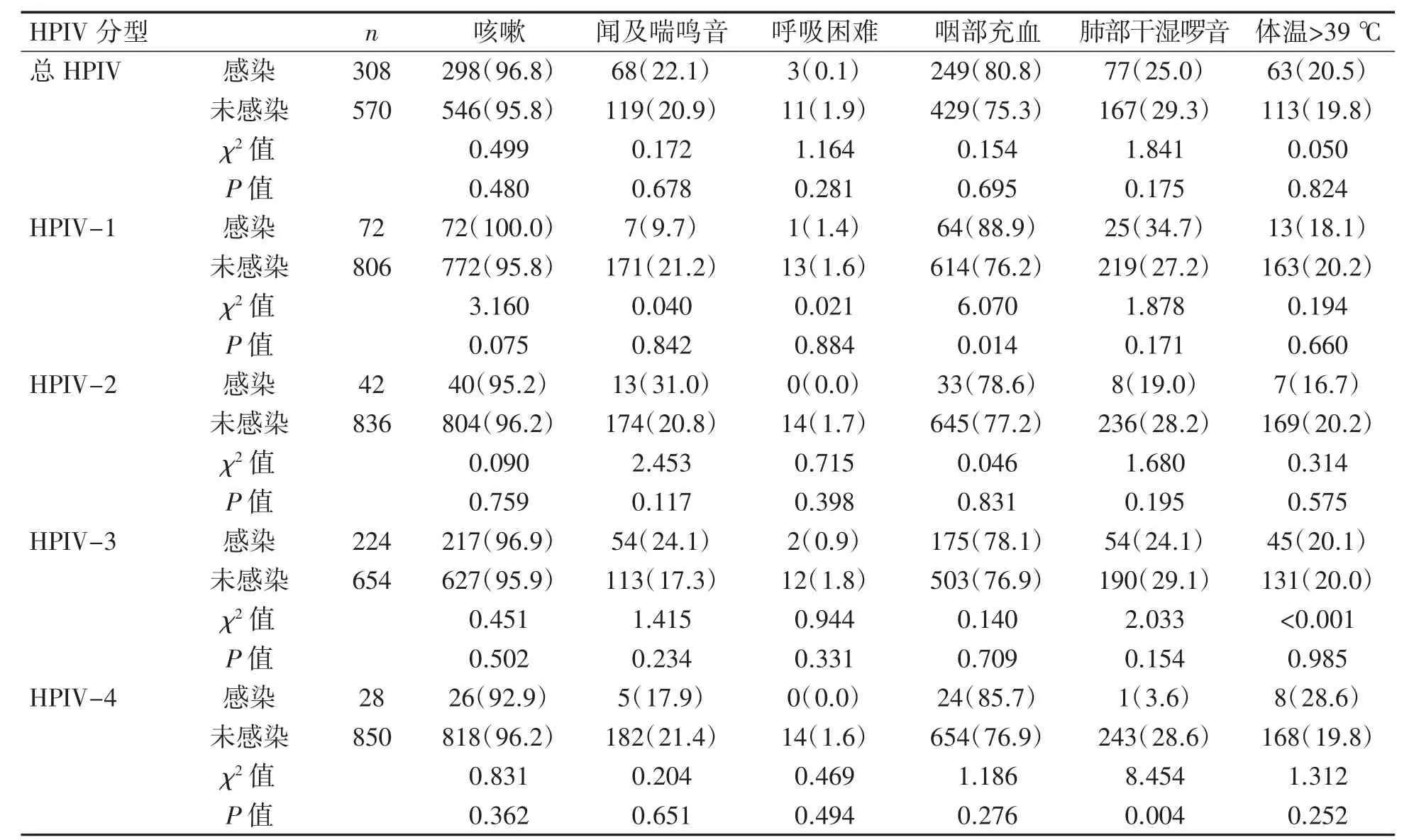
表5 HPIV感染与未感染者临床症状比较[例(%)]
2.7 HPIV感染的实验室指标分析
总HPIV感染者红细胞计数低于未感染者(P=0.021),HPIV-3感染者白细胞计数低于未感染者(P<0.035),而HPIV-3感染者红细胞计数高于未感染者(P<0.001),其他分型各实验室指标差异均无统计学意义(P均>0.05),见表6。
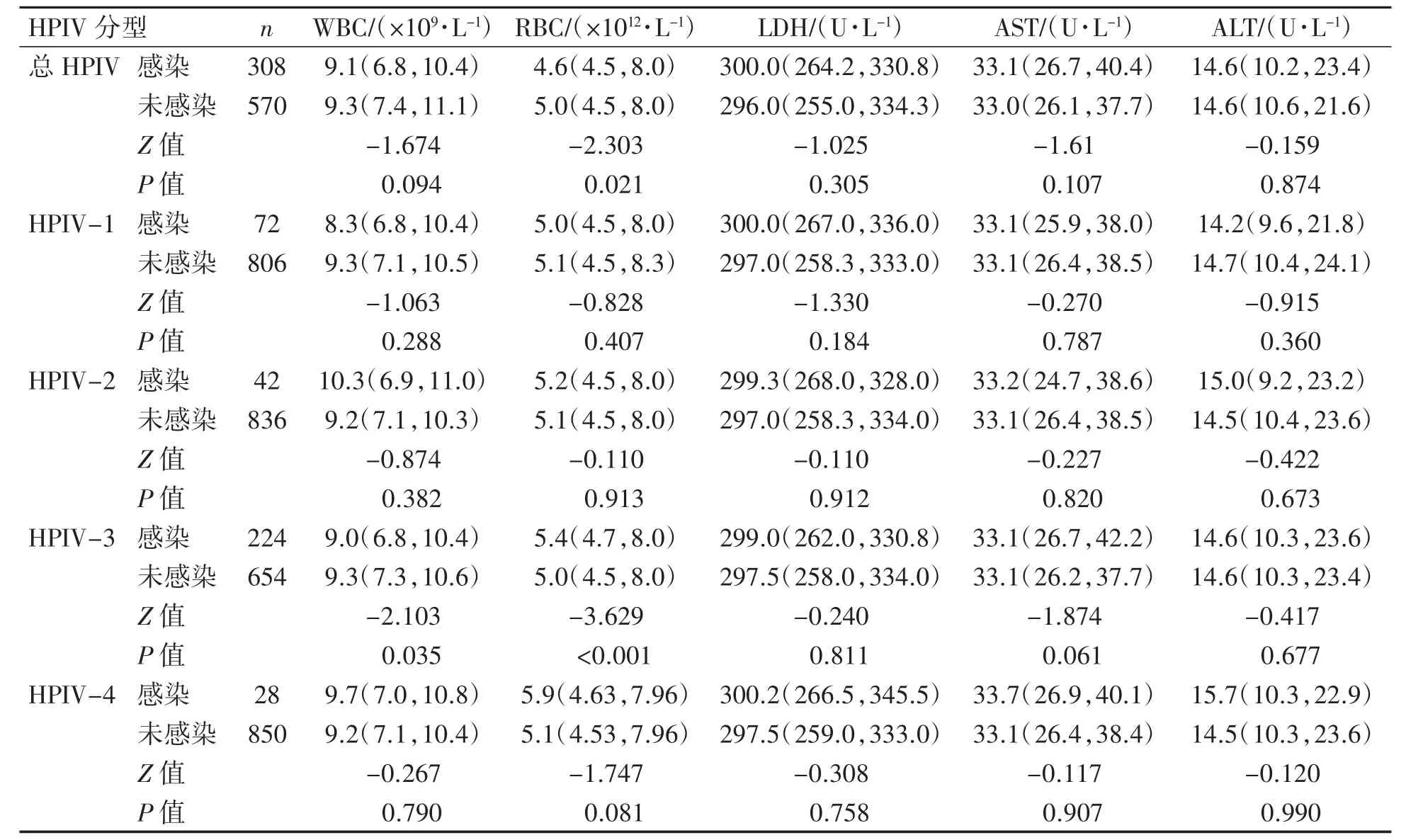
表6 HPIV感染与未感染者实验室指标比较[M(P25,P75)]
2.8 HPIV各分型与细菌混合感染情况
HPIV-3在总HPIV中检出率最高,HPIV-3阳性患儿与细菌合并感染总例数为47例,其中合并肺炎克雷伯菌、大肠埃希菌、铜绿假单胞菌、肺炎链球菌感染较多,分别为13例(27.7%)、8例(17.0%)、5例(10.6%)、5例(10.6%);合并金黄色葡萄球菌、流感嗜血杆菌、嗜麦芽假单胞菌和日沟维肠杆菌感染较少,分别为3例(6.4%)、2例(4.3%)、2例(4.3%)和1例(2.1%),见表7。

表7 HPIV各分型合并细菌及支原体感染情况[例(%)]
2.9 HPIV-3合并细菌、支原体和其他病毒感染的临床症状分析
HPIV-3合并细菌感染者与未合并者相比,肺部干湿啰音发生率低(P=0.016),咳嗽、喘鸣音、咽部充血和体温>39℃比较差异均无统计学意义(P均>0.05)。HPIV-3合并支原体或其他病毒感染者较未合并感染者咳嗽、喘鸣音、咽部充血、肺部干湿啰音和体温>39℃比较差异均无统计学意义(P均>0.05),见表8。

表8 HPIV-3合并与未合并其他病原体感染的临床症状比较[例(%)]
2.10 HPIV-3合并细菌、支原体和其他病毒感染的实验室指标分析
HPIV-3合并细菌感染者比未合并细菌感染者的红细胞计数低(P=0.046),HPIV-3合并细菌感染者天冬氨酸氨基转移酶和丙氨酸氨基转氨酶均高于未合并细菌感染者(P均<0.05),而合并支原体感染者天冬氨酸氨基转移酶和丙氨酸氨基转氨酶均低于未合并支原体感染者(P均<0.05);合并与未合并其他病毒感染者各项指标比较差异均无统计学意义(P均>0.05),见表9。

表9 HPIV-3混合其他病原感染与未合并感染者实验室指标比较[M(P25,P75)]
3 讨论
HPIV是儿童CAP的重要病原之一,尤其是以HPIV-3感染最为常见[10],HPIV-3型的高发病率可能与其病毒结构相关,HPIV-3型有2个副黏蛋白受体结合位点,能吸附于靶细胞,从而导致病毒包膜与宿主靶细胞膜出现融合[11]。在5岁以下的儿童中HPIV-3型的感染率仅次于RSV,是导致儿童CAP的重要病原,也是造成当前我国5岁以下儿童死亡的主要原因。同时,HPIV对全球范围内的儿童均能造成危害,临床表现主要有咳嗽、喘息、发热等,严重时危及患儿生命[12]。本研究从多个维度分析了HPIV在儿童CAP感染中的流行病学特点及临床特征,为做好HPIV感染防控提供理论依据。
据报道[13],聊城CAP儿童中HPIV感染的阳性率为8.81%。本研究结果显示,878例CAP儿童中HPIV的感染率为35.1%,高于上述文献报道,这可能与区域差异有关[14]。本研究显示,HPIV感染的各分型中,HPIV-3阳性检出率最高,其次分别为HPIV-1、HPIV-2、HPIV-4,和上述报道结果一致。HPIV各分型合并其他呼吸道病原为常见情况,本研究结果显示,HPIV合并感染数最多的病毒分别是RV、RSV和HMPV,与细菌合并感染阳性数也较多,可能与病毒感染后患儿免疫力下降有关。有文献[15]显示,湖南省下呼吸道病毒合并感染中,HPIV合并HRV感染例数最多,其次为HBoV,与其他病毒合并感染例数较少,结果与本研究报道结果相似——在细菌合并感染中,肺炎克雷伯菌、大肠埃希菌、铜绿假单胞菌、肺炎链球菌合并感染率较高,而湖南省下呼吸道病毒HPIV合并细菌感染中肺炎链球菌合并感染最多[15],可能与两地的地理位置、气候、环境等有关。
HPIV感染的性别差异分析中,总体HPIV感染比较差异无统计学意义,但HPIV-4感染率女性高于男性,这与HPIV-4在总样本中检出率低,结果可能存在误差有关。<3岁的患儿HPIV-3感染检出率最高,总HPIV及其他分型在年龄分布上检出差异无统计学意义,可能与婴幼儿呼吸道系统和免疫功能发育不完善有关[16],>5岁的儿童检出率较低可能是因为随着年龄的增长自身免疫系统不断完善及产生特异性抗体。在感染季节分布上,HPIV-3、HPIV-4感染高发于春秋季,HPIV-1感染在春季达到高峰。这与之前提及的其他文献中的报道并不一致,如重庆地区HPIV-3感染在春夏季高发[17],厦门地区报道[18]HPIV-3感染春冬季更为高发。有报道[19]称,空气越干燥,越会增加呼吸道感染的机会。因此,HPIV感染的季节性分布存在地理差异。
本研究结果还显示,HPIV-1型感染的患儿咽部充血发生率较未感染者高,而感染HPIV-4的患儿肺部干湿啰音发生率较未感染者低,提示肺部干湿啰音可不作为HPIV-4感染的临床症状指标。其他临床症状中如咳嗽、喘鸣音、咽部充血、肺部干湿啰音和体温>39℃比较差异均无统计学意义,可能由于患儿存在个体差异,所表现出来的临床症状和程度不同。作为检出率最高的HPIV-3型,HPIV-3感染的白细胞计数低于HPIV-3未感染患儿,而HPIV-3感染红细胞计数高于未感染者,红细胞和白细胞变化也可以作为是否有细菌感染的辅助指标,但可能不具有特异性,诊断敏感性较低。HPIV-3合并细菌感染者天冬氨酸氨基转移酶和丙氨酸氨基转氨酶较未合并感染者高,HPIV-3合并支原体感染者较未合并感染者低,可能与HPIV-3合并细菌感染者存在肝损伤有关,但作为辅助指标,统计结果存在一定的局限性。
综上所述,HPIV是银川市妇幼保健院CAP患儿的重要病原之一,总体检出率高,患儿低龄,好发于春秋,常与其他呼吸道病原合并感染。本研究一定程度上为临床诊疗提供思路,有助于尽早对HPIV进行预判及治疗。

