lncRNA XIST靶向miR-302a-3p对IL-1β诱导软骨细胞损伤的调控机制
黄涛 方红育 周少怀 卞峰 任敏 李宏亮 俞诗威 严锦曦 钱慧 李嘉琼
武汉市第三医院骨一科,湖北 武汉 430060
骨关节炎(osteoarthritis,OA)是一种以炎症反应、关节软骨细胞减少和软骨基质丢失为特征的关节退行性疾病[1]。软骨细胞的凋亡增加和过度炎症反应有助于软骨降解[2]。白细胞介素-1β(interleukin-1β,IL-1β)是关节炎症后出现的主要细胞因子,参与OA软骨细胞功能障碍,被广泛用于体外OA模型的建立[3-4]。长链非编码RNA(lncRNA)X染色体失活特异转录因子(X inactive specific transcript,XIST)被报道为肺癌、胶质瘤等多种肿瘤的癌基因[5-6]。有证据证实XIST通过吸附miR-302a-3p促进原发性韧带成纤维细胞成骨分化[7]。3-磷酸肌醇依赖性蛋白激酶1(3-phosphoinositide-dependent protein kinase-1,PDK1)被生物信息学预测为miR-302a-3p的靶基因,有报道[8]称PDK1在OA患者软骨组织中上调。但在OA中XIST和miR-302a-3p的相互作用及其与PDK1的作用并不明确。因此本研究采用IL-1β刺激软骨细胞炎症反应模拟体外OA环境,探讨XIST、miR-302a-3p在OA细胞模型中的功能和调控机制,为OA的发病机制提供新的见解。
1 材料和方法
1.1 主要试剂与仪器
DMEM购自北京诺博莱德公司;XIST的小干扰RNA(si-XIST)和过表达载体(pc-XIST)、miR-302a-3p模拟物(miR-302a-3p mimics)和抑制剂(miR-302a-3p inhibitor)及相应的阴性对照(si-NC、pcDNA、miR-NC mimics和miR-NC inhibitor)购自上海吉玛制药公司;IL-1β购自北京同立海源生物公司;Lipofectamine 3000购自美国英杰公司;Trizol试剂购自上海生工生物公司;TB Green Premix Ex Taq II Kit购自大连宝生物公司;MTT试剂盒购自北京索莱宝公司;膜联蛋白V-异硫氰酸荧光素(Annexin V-FITC)/碘化丙啶(PI)试剂盒购自上海锐赛生物公司;Bcl-2、Bax、PDK1、GAPDH一抗及其二抗购自美国Abcam公司。酶标仪购自美国赛默飞公司;流式细胞仪购自上海伯乐公司。
1.2 方法
1.2.1细胞培养和IL-1β诱导:从青旗(上海)生物公司购买人软骨肉瘤细胞系SW1353后,使用DMEM培养基培养。然后用浓度为10 ng/mL的重组人IL-1β处理SW1353细胞24 h,刺激细胞炎症反应,从而在体外模拟OA样软骨细胞损伤[9]。
1.2.2细胞转染:使用Lipofectamine 3000将1.1中的质粒分别转染至SW1353细胞后再用IL-1β诱导细胞,将其记为IL-1β+si-NC组、IL-1β+si-XIST组、IL-1β+si-PDK1组、IL-1β+si-XIST+miR-NC inhibitor组、IL-1β+si-XIST+miR-302a-3p inhibitor组,仅用10 ng/mL IL-1β诱导的细胞记为IL-1β组,未经任何处理的细胞记为Control组。
1.2.3qRT-PCR实验:使用Trizol试剂从各组SW1353细胞中提取总RNA。将2 μg定量RNA反转录为cDNA,然后按照生产说明书用TB Green Premix Ex Taq II Kit进行PCR扩增。相对表达分析通过2-ΔΔCt法进行。使用GAPDH对TNF-α、IL-1β、IL-4、IL-6、IL-10、XIST或PDK1的表达进行标准化,使用U6对miR-302a-3p进行标准化。
1.2.4MTT实验测定细胞活力:SW1353细胞(2×103个/孔)接种于96孔板过夜。然后加入20 μL MTT孵育4 h,然后加入200 μL/孔的DMSO孵育10 min。用酶标仪检测490 nm波长下的吸光度。
1.2.5流式细胞术检测细胞凋亡:转染后的SW1353细胞用PBS洗涤并暴露于胰蛋白酶溶液中。2 000 r/min离心8 min后在300 μL结合缓冲液中重悬。将细胞悬液与5 μL Annexin V-FITC在25 ℃避光混合15 min后,用2.5 μL PI孵育约5 min,流式细胞仪观察凋亡细胞。
1.2.6双荧光素酶报告基因检测实验检测miR-302a-3p与XIST或PDK1的靶向关系:ENCORI和Targetscan数据库分别预测miR-302a-3p与XIST或PDK1的假设结合位点。通过分子克隆将XIST和PDK1 3’ UTR的cDNA序列及其突变序列分别插入pmirGLO报告载体,生成野生型(WT-XIST和WT-PDK1)和突变型(MUT-XIST和MUT-PDK1)荧光素酶报告质粒。24孔板中IL-1β处理过的SW1353细胞与这些重组质粒和miR-302a-3p mimics或miR-NC mimics共转染。48 h后,使用双荧光素酶报告分析系统评估荧光素酶活性。
1.2.7免疫印迹法检测Bcl-2、Bax及PDK1表达:用SDS-PAGE分离从各组SW1353细胞中提取的蛋白质,转移到PVDF膜上,然后在脱脂牛奶中进行非特异性信号阻断和一抗(anti-Bcl-2、anti-Bax、anti-PDK1和anti-GAPDH)培养。然后将二抗在室温下孵育至膜上1 h,最后用增强的化学发光试剂进行免疫印迹,用Image J软件分析各蛋白条带的灰度。
1.3 统计学处理
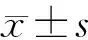
2 结果
2.1 XIST和miR-302a-3p在IL-1β诱导的SW1353细胞中的表达
与Control组[(1.00±0.03)、(1.00±0.03)]比较,IL-1β组SW1353细胞中XIST表达(3.39±0.21)升高,miR-302a-3p表达(0.41±0.01)降低(P<0.05)。
2.2 敲低XIST对IL-1β诱导的SW1353细胞增殖、凋亡的影响
与Control组相比,IL-1β组XIST表达上调,细胞活力、Bcl-2表达下降,凋亡率、Bax表达增加(P<0.05);与IL-1β组和IL-1β+si-NC组相比,IL-1β+si-XIST组XIST表达下调,细胞活力、Bcl-2表达升高,凋亡率、Bax表达下降(P<0.05),见图1、图2和表3。
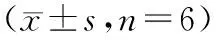
表3 敲低XIST对IL-1β诱导的SW1353细胞增殖、凋亡的影响Table 3 Effects of knockdown of XIST on the proliferation and apoptosis of SW1353 cells induced by IL-1β n=6)

图1 敲低XIST对IL-1β诱导的SW1353细胞凋亡的影响Fig.1 Effects of knockdown of XIST on IL-1β-induced apoptosis in SW1353 cells

注:A:Control组;B:IL-1β组;C:IL-1β+si-NC组,D:IL-1β+si-XIST组。
2.3 敲低XIST或PDK1对IL-1β诱导的SW1353细胞炎症因子的影响
与Control组相比,IL-1β组TNF-α、IL-1β、IL-6水平增加,IL-4、IL-10水平减小(P<0.05);与IL-1β组和IL-1β+si-NC组相比,IL-1β+si-XIST组和IL-1β+si-PDK1组TNF-α、IL-1β、IL-6水平降低,IL-4、IL-10水平升高(P<0.05),见表4。
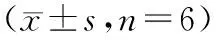
表4 敲低XIST或PDK1对IL-1β诱导的SW1353细胞炎症因子的影响Table 4 Effects of knockdown of XIST or PDK1 on IL-1β-induced inflammatory factors in SW1353 cells n=6)
2.4 XIST负向调控miR-302a-3p
ENCORI预测显示miR-302a-3p与XIST存在作用位点,见图3。miR-302a-3p mimics+WT-XIST组相对荧光素酶活性显著低于miR-NC mimics+WT-XIST组(P<0.05),见表5。pc-XIST组miR-302a-3p表达低于pcDNA组,si-XIST组miR-302a-3p表达高于si-NC组(P<0.05),见表6。
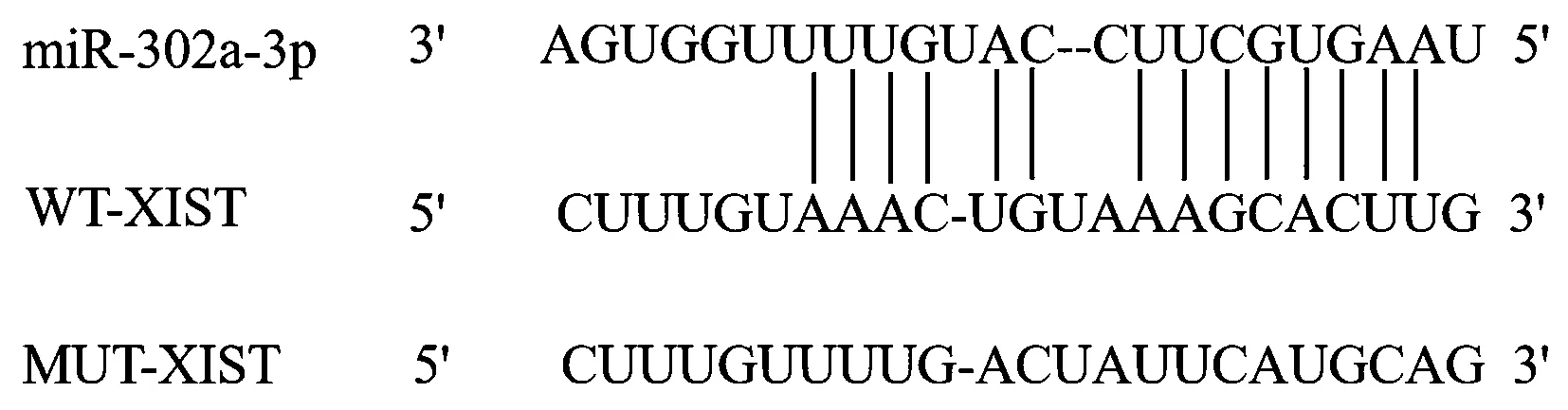
图3 miR-302a-3p与XIST的作用位点Fig.3 Interaction site between miR-302a-3p and XIST
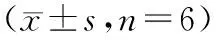
表5 双荧光素酶报告基因检测实验
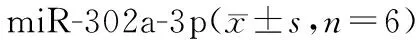
表6 XIST负向调控Table 6 XIST negatively regulates miR-302a-3p n=6)
2.5 miR-302a-3p的下调逆转了si-XIST对IL-1β诱导的SW1353细胞的作用
与IL-1β+si-XIST组和IL-1β+si-XIST+miR-NC inhibitor组比较,IL-1β+si-XIST+miR-302a-3p inhibitor组miR-302a-3p表达下降,细胞活力、Bcl-2表达及IL-4、IL-10水平降低,凋亡率、Bax表达及TNF-α、IL-1β、IL-6水平上升(P<0.05),见图4、图5、表7、表8。
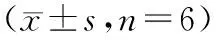
表7 miR-302a-3p的下调逆转了si-XIST对IL-1β诱导的SW1353细胞增殖、凋亡的作用
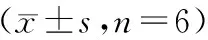
表8 miR-302a-3p的下调逆转了si-XIST对IL-1β诱导的SW1353细胞炎症因子的作用

注:A:IL-1β+si-XIST组;B:IL-1β+si-XIST+miR-NC inhibitor组;C:IL-1β+si-XIST+miR-302a-3p inhibitor组。
2.6 PDK1是miR-302a-3p的靶点
图6显示,Targetscan预测显示miR-302a-3p与PDK1可能存在作用关系。miR-302a-3p mimics+WT-PDK1组相对荧光素酶活性明显低于miR-NC mimics+WT-PDK1组(P<0.05),见表9。miR-302a-3p mimics组PDK1 mRNA和蛋白表达低于miR-NC mimics组,miR-302a-3p inhibitor组PDK1 mRNA和蛋白表达高于miR-NC inhibitor组(P<0.05),见图7和表10。

表1 引物序列Table 1 Primer sequence
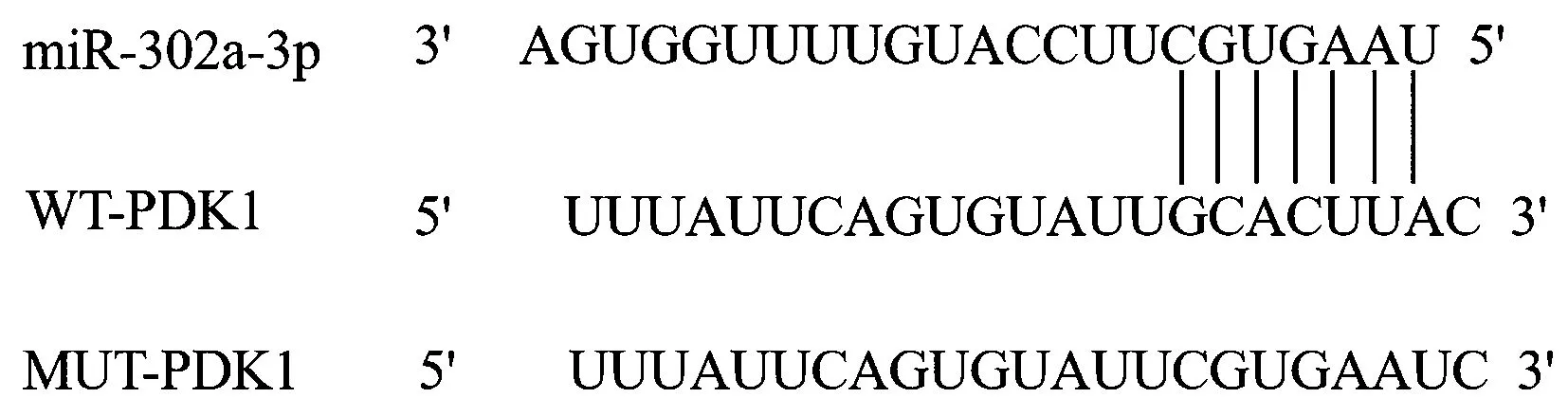
图6 miR-302a-3p与PDK1的作用位点Fig.6 The interaction sites of miR-302a-3p and PDK1

注:A:miR-NC mimics组;B:miR-302a-3p mimics组;C:miR-NC inhibitor组,D:miR-302a-3p inhibitor。
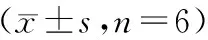
表9 双荧光素酶报告基因检测实验Table 9 Dual-luciferase reporter gene assay n=6)
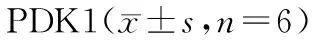
表10 miR-302a-3p靶向调控
2.7 XIST敲低通过促进miR-302a-3p抑制PDK1的表达
IL-1β组PDK1 mRNA和蛋白表达比Control组高(P<0.05);IL-1β+si-XIST组PDK1 mRNA和蛋白表达比IL-1β组和IL-1β+si-NC组低(P<0.05);IL-1β+si-XIST+miR-302a-3p inhibitor组PDK1 mRNA和蛋白表达比IL-1β+si-XIST组和IL-1β+si-XIST+miR-NC inhibitor组高(P<0.05),见图8、表11。

注:A为Control组;B为IL-1β组;C为IL-1β+si-NC组;D为IL-1β+si-XIST组;E为IL-1β+si-XIST+miR-NC inhibitor组;F:IL-1β+si-XIST+miR-302a-3p inhibitor组
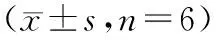
表11 XIST敲低通过促进miR-302a-3p抑制PDK1的表达
3 讨论
lncRNA在OA发病机制中发挥重要作用。例如,PVT1在OA患者血清中高表达,其缺失可减轻脂多糖诱导的骨关节炎进展[10]。Zhang等[11]通过调节miR-150-5p/AKT3促进IL-1β诱导的软骨细胞增殖并抑制细胞凋亡。本研究发现XIST在IL-1β处理的SW1353细胞中表达更高,提示XIST可能与OA的进展有关。敲低XIST后细胞活力增强,凋亡受阻,提示IL-1β诱导的细胞凋亡可以通过下调XIST而得到缓解。过度炎症在IL-1β诱导的软骨细胞中TNF-α、IL-6等促炎因子表达显著升高[12]。结果显示,IL-1β诱导了SW1353细胞的炎症反应,而XIST的敲低使细胞分泌的促炎因子TNF-α、IL-1β、IL-6水平降低,抗炎因子IL-4、IL-10水平升高,提示下调XIST可抑制IL-1β诱导的炎症反应。
研究[13-14]表明,XIST通过与miRNA作用发挥其调控功能。在本研究中,miR-302a-3p被证实为XIST的一个miRNA靶点,且XIST负向调控miR-302a-3p的表达。近期研究表明,miR-302a-3p不仅抑制多种癌症的进展,还在心、脑、肾等相关疾病中发挥作用。Bai等[15]指出,抑制miR-302a-3p可通过靶向抑制FMR1抑制缺氧-复氧诱导的肾小管上皮细胞凋亡。然而并未有报道显示miR-302a-3p在OA中的作用。本研究发现miR-302a-3p在IL-1β诱导的SW1353细胞中下调,而抑制miR-302a-3p可逆转XIST敲除对IL-1β诱导的SW1353细胞凋亡、炎症因子水平的影响,提示XIST敲除对软骨细胞OA损伤的保护作用是通过促进miR-302a-3p实现的。
作为上游的miRNA通过调控下游基因实现其功能。在本研究中,Targetscan显示了miR-302a-3p与PDK1 3’UTR序列的互补结合位点。而双荧光素酶报告基因实验与qRT-PCR、Western blot联合确定了PDK1是miR-302a-3p的下游靶基因。PDK1参与许多细胞系的凋亡,并控制了PI3K或其他途径(如RAS GTPase-MAPK)下游的许多细胞过程[16]。同时,有报道[17]称PDK1上调促进类风湿关节炎的炎症进展。本研究发现,PDK1在IL-1β诱导的SW1353细胞中表达升高,由于既往研究[8]显示了沉默PDK1可抑制体外模拟OA样软骨细胞凋亡,故本研究仅检测了其对炎症因子的影响,结果发现沉默PDK1可降低促炎因子的分泌而增加抑炎因子的表达,说明PDK1能促进OA进展。此外,抑制miR-302a-3p可使XIST敲低对PDK1的抑制作用得到缓解,提示XIST在OA中的作用是通过miR-302a-3p/PDK1轴实现的。然而,PDK1能否挽救miR-302a-3p对OA的影响尚不清楚,这将是本研究接下来的重点。
综上所述,抑制XIST通过靶向上调miR-302a-3p进而抑制PDK1表达的作用促进了IL-1β处理的软骨细胞的细胞活力,但抑制了凋亡和炎症反应的发生,这为XIST/miR-302a-3p/PDK1调控轴在OA进展中的存在提供了证据,也在lncRNA领域中XIST作为一种有前途的分子生物标志物为OA治疗提供了新的方向。

