MLK3基因敲除抑制骨骼肌损伤后再生*
高诗娟,张燕红,方光明,杜 杰
(首都医科大学附属北京安贞医院,北京市心肺血管疾病研究所,北京 100029)
人体约80%的蛋白由骨骼肌储存。骨骼肌萎缩不仅直接导致骨骼肌功能下降,还会导致全身营养不良,严重影响生活质量。骨骼肌在正常及病理状况下处于损伤和再生的动态过程。损伤和再生失衡会导致骨骼肌萎缩。骨骼肌再生由一群位于肌纤维基底膜和肌膜之间的肌卫星细胞来完成。这群长期处于相对静息状态的细胞在骨骼肌受到损伤刺激时被激活,继而经过增殖、分化、融合形成新的肌纤维,从而完成骨骼肌再生过程[1-2]。肌卫星细胞的增殖和分化受多个信号通路调控。Notch信号通路的活化促进肌卫星细胞自我更新,抑制分化[3]。丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路的激活则促进肌卫星细胞增殖和分化[4-5]。阐明肌卫星细胞增殖和分化的调控机制,对于认识如何维持骨骼肌稳态,阻止骨骼肌萎缩具有重要意义。
混合谱系激酶3(mixed lineage kinase 3,MLK3)是MAPK级联反应中重要的丝氨酸/苏氨酸蛋白激酶,广泛表达于骨骼肌、肺、肝及心脏等组织。MLK3通过激活MAPK下游成员c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)、细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)及p38 MAPK等,调控细胞增殖、分化和凋亡[6]。MLK3基因敲除(MLK3gene knockout,MLK3KO)小鼠心脏功能下降,心脏纤维化加重[7-8]。但MLK3在骨骼肌损伤再生中的作用未见报道。本研究在MLK3KO小鼠及野生型(wild-type,WT)小鼠中建立骨骼肌损伤再生模型,探讨MLK3在骨骼肌再生中的作用及其机制。
材料和方法
1 动物
10~12周龄SPF级雄性C57BL6/J小鼠购自北京唯尚立德公司,以C57BL6/J为背景的MLK3KO小鼠由上海邦耀公司协助构建,均饲养于首都医科大学附属北京安贞医院SPF级动物房,动物实验均遵守本医院实验动物管理委员会的相关规定。
2 主要试剂
蛇毒心脏毒素(cardiotoxin,CTX)购自Merck;MLK3抗体(#4370S)、p-ERK1/2抗体(#4370)、ERK1/2抗体(#4695)、p-JNK抗体(#4668)、JNK抗体(#9252)、p-p38抗体(#4511)及p38抗体(#9212)均购自Cell Signaling Technology;配对盒蛋白7(paired box protein 7,PAX7)抗体(AB_528428)购自Developmental Studies Hybridoma Bank;麦胚凝集素(wheat germ agglutinin,WGA)抗体购自Sigma;Alexa Fluor 555和Alexa Fluor 488荧光Ⅱ抗购自Jackson ImmunoResearch;总RNA提取试剂TRIzol购自Invitrogen;RevertAid First Strand cDNA Synthesis Kit(K1622)和T-PER组织蛋白提取液均购自Thermo Fisher Scientific;SYBR Green Real-Time PCR试剂购自TaKaRa;Masson染色液购自北京索莱宝科技有限公司。
3 主要方法
3.1 骨骼肌损伤模型构建10~12周龄的雄性WT及MLK3KO小鼠麻醉后,胫骨前肌注射CTX(10 μmol/L,30 μL)制备骨骼肌损伤模型[9]。
3.2 RNA提取及RT-qPCR使用TRIzol法提取成纤维细胞或小鼠胫骨前肌总RNA。使用RevertAid First Strand cDNA Synthesis Kit将2 μg总RNA逆转录成cDNA,步骤如下:RNA与Oligo dT混合后,65℃孵育5 min,加入逆转录酶及缓冲液,42℃60 min进行逆转录反应,70℃5 min灭活逆转录酶。得到的cDNA在iQ5系统(Bio-Rad)中使用SYBR试剂进行实时荧光定量PCR。以GAPDH为内参照,目标基因表达水平以2-ΔΔCt法进行计算。MLK3的上游引物序列为5′-CCCTTTGCACAACTCATGGC-3′,下 游 引物 序列为5′-GAATGGAAGGAGTCCCGTGG-3′;Myog的上游引物序列为5′-CAGCCCAGCGAGGGAATTTA-3′,下游引物序列为5′-AGAAGCTCCTGAGTTTGCCC-3′;Myod的上游引物序列为5′-AGCATAGTGGAGCGCATCTC-3′,下游引物序列为5′-GGTCTGGGTTCCCTGTTCTG-3′;GAPDH的上游引物序列为5′-AATGCATCCTGCACCACC-3′,下游引物序列为5′-ATGCCAGTGAGCTTCCCG-3′。
3.3 Western blot实 验分离CTX处 理 的WT及MLK3KO小鼠胫骨前肌,T-PER组织裂解液(补充0.5 mol/L EDTA、蛋白酶抑制剂和磷酸酶抑制剂)提取总蛋白后,用BCA蛋白浓度测定试剂盒进行蛋白浓度测定。将总量为80 μg的蛋白经过聚丙烯酰胺凝胶电泳分离,然后电转至硝酸纤维素膜。5%脱脂奶粉室温封闭1 h,分别加入MLK3、p-ERK1/2、ERK1/2、p-JNK、JNK、p-p38、p38及GAPDH等抗体,4℃孵育过夜。加入Ⅱ抗室温孵育2 h,使用Odyssey红外荧光扫描成像仪捕获目的条带。目的条带定量分析采用ImageJ软件。
3.4 免疫荧光染色收集CTX处理的WT及MLK3KO小鼠胫骨前肌制备冰冻切片,用预冷的冰丙酮固定20 min,室温晾干20 min后PBS洗,0.3%Triton X-100透化10 min,2次。3% BSA室温封闭1 h,加入PAX7抗体,4℃过夜,PBS洗3次,加入Alexa Fluor 555荧光二抗,室温孵育40 min,PBS洗后,DAPI封片。使用Leica ST5激光扫描共聚焦显微镜观察PAX7的荧光强度。
3.5 WGA染色收集CTX处理的WT及MLK3KO小鼠胫骨前肌制备石蜡切片(4 μm),经二甲苯和梯度乙醇脱蜡至水后,抗原热修复,羊血清工作液室温封闭30 min,滴加1∶100稀释的WGA抗体,37℃避光孵育1 h,PBS洗后,DAPI封片液封片。倒置荧光电子显微镜(Nikon)采集图像,NIS Br 3.0软件计算肌纤维横截面积,每张切片统计200个肌纤维。
3.6 Masson胶原纤维染色将WT及MLK3KO小鼠胫骨前肌石蜡切片脱蜡至水。使用Masson染色液染色,基本步骤如下:铁苏木素染色5~10 min,酸性乙醇分化5~15 s;Masson蓝化液返蓝3~5 min;丽春红品红染色5~10 min;磷钼酸溶液洗1~2 min;苯胺蓝染色1~2 min;乙醇脱水、中性树胶封片。倒置电子显微镜(Nikon)采集图像,胶原纤维呈蓝色,骨骼肌细胞呈红色。NIS Br 3.0软件计算纤维化面积。
4 统计学分析
用GraphPad Prism 7.0软件进行统计分析。结果以均数±标准差(mean±SD)表示。两组间比较用t检验,多组间比较用单因素方差分析。以P<0.05为差异有统计学意义。
结 果
1 骨骼肌损伤后早期MLK3表达水平显著升高
为探讨MLK3是否参与骨骼肌损伤后修复,收集CTX处理0、1、3和5 d的小鼠胫骨前肌,RT-qPCR检测MLK3的表达变化,发现CTX处理后3 d骨骼肌中MLK3的mRNA表达显著升高(P<0.01),见图1A;Western blot结果显示,CTX处理后3 d的骨骼肌中MLK3蛋白表达升高,见图1B。这提示MLK3可能在骨骼肌损伤后再生过程中发挥作用。
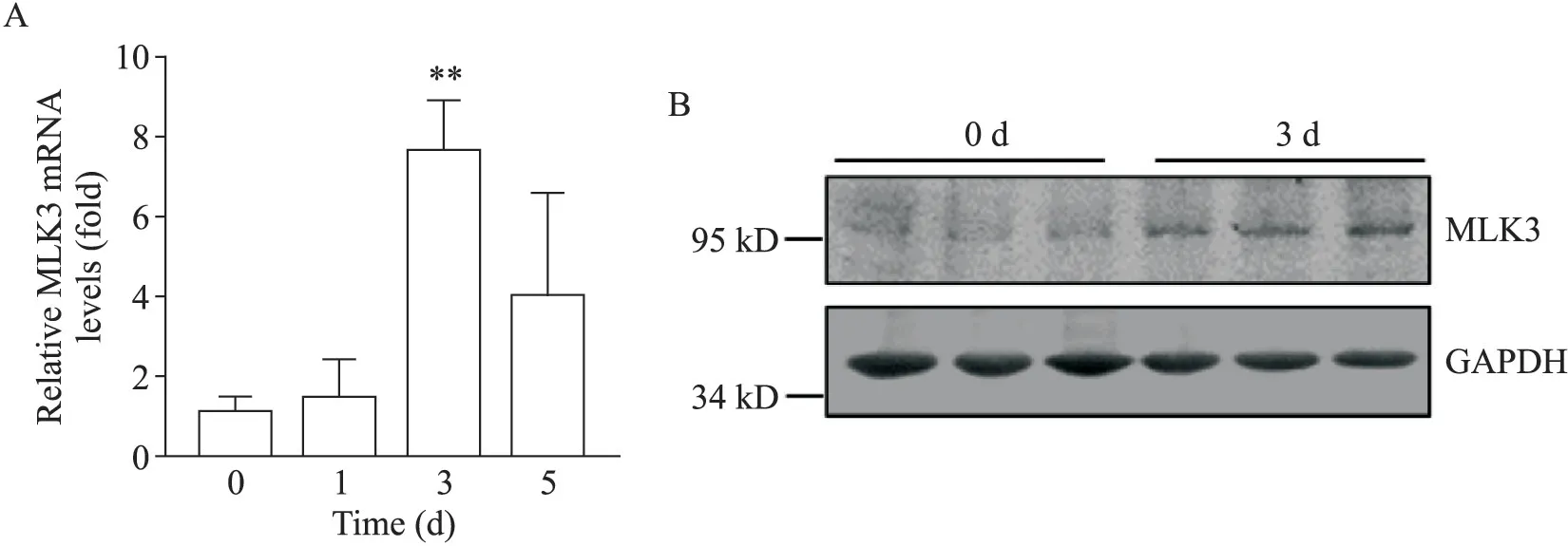
Figure 1.Mixed lineage kinase 3(MLK3)was up-regulated in regenerating tibial anterior(TA)muscles at early stage after cardiotoxin(CTX)-induced injury.A:MLK3 mRNA levels in TA muscles from wild-type mice at indicated time points after CTX injury(n=6);B:MLK3 protein expression in regenerating TA muscles at 3 d after injury(n=3).Mean±SD.**P<0.01 vs 0 d.图1 MLK3在骨骼肌损伤修复早期表达升高
2 MLK3缺失导致骨骼肌损伤后再生能力下降
为探讨MLK3是否在骨骼肌再生过程发挥作用,我 们 构 建 了MLK3KO小鼠,Western blot验证MLK3KO小鼠骨骼肌纤维中无MLK3蛋白表达(图2A)。进而,WT及MLK3KO小鼠给予CTX处理诱导损伤。损伤后7 d,收集WT及MLK3KO小鼠骨骼肌,WGA染色观察新生肌纤维大小及排列。未受损的WT及MLK3KO小鼠骨骼肌纤维排列紧密,肌纤维横截面面积无差别;CTX诱导损伤7 d,MLK3KO小鼠骨骼肌纤维排列较对照组紊乱,新生的骨骼肌肌纤维横截面面积显著小于WT小鼠(P<0.01),见图2B。这表明MLK3KO小鼠骨骼肌再生能力下降。
3 MLK3基因缺失加重骨骼肌损伤后纤维化
WT及MLK3KO小鼠胫骨前肌给予CTX处理后7 d,受损部位骨骼肌Masson染色评价胶原沉积情况。未损伤时MLK3KO和WT小鼠胶原纤维阳性面积无显著差异。损伤后7 d,MLK3KO和WT小鼠蓝色胶原纤维阳性面积均增加,但MLK3KO小鼠胶原纤维阳性面积显著高于WT小鼠(P<0.01),见图3。这提示MLK3基因缺失加重骨骼肌损伤部位的纤维化。
4 MLK3基因缺失抑制肌卫星细胞的增殖和分化
免疫荧光检测WT及MLK3KO小鼠损伤后3 d骨骼肌中PAX7阳性细胞数,结果显示MLK3KO小鼠骨骼肌中PAX7阳性细胞比例显著低于WT小鼠(P<0.01),见图4A。RT-qPCR检测肌卫星细胞分化关键基因Myod和Myog的mRNA水平,结果显示损伤后3 d的WT小鼠骨骼肌中Myod和Myog的表达较未损伤组显著升高,但MLK3KO小鼠损伤后3 d的骨骼肌中Myod和Myog表达与WT小鼠相比均显著降低(P<0.01),见图4B。上述结果表明MLK3基因缺失抑制肌卫星细胞的增殖和分化。
5 MLK3基因缺失抑制ERK1/2活化
Western blot检 测CTX损 伤 后3 d的WT及MLK3KO小鼠骨骼肌中ERK1/2、JNK及p38磷酸化水平,结果显示MLK3KO小鼠骨骼肌中磷酸化ERK1/2的水平与WT小鼠相比显著下降(P<0.01),但磷酸化JNK及磷酸化p38的水平没有显著差异,见图5。上述结果表明再生的骨骼肌中MLK3基因缺失抑制ERK1/2信号通路的激活。

Figure 2.MLK3 deficiency resulted in impaired regeneration in injured muscle.A:Western blot analysis of MLK3 protein levels in muscles isolated from WT and MLK3KO mice;B:the WT and MLK3KO muscles were immunostained with WGA(green)at 0 and 7 d after CTX-induced injury(scale bar=20 μm),and the myofiber mean cross-sectional area(CSA)was analyzed(n=6).Mean±SD.**P<0.01 vs WT.图2 MLK3基因缺失鼠骨骼肌损伤后再生能力下降

Figure 3.MLK3 deficiency resulted in increased muscle fibrosis in injured muscle.Masson staining was performed to detect collagen deposition(blue)in TA muscles isolated from WT and MLK3KO mice(scale bar=20 μm),and the ratio of fibrosis area per filed was calculated.Mean±SD.n=6.**P<0.01 vs WT.图3 MLK3基因缺失加重骨骼肌损伤后纤维化
讨 论
骨骼肌损伤后,肌卫星细胞的活化、增殖和分化对于骨骼肌再生、促进损伤后修复,维持骨骼肌功能,阻止骨骼肌萎缩至关重要。本研究发现,蛋白激酶MLK3基因缺失抑制肌卫星细胞的增殖和分化,导致骨骼肌损伤后再生能力下降,间质纤维化加重,表明MLK3在骨骼肌再生过程中发挥重要作用。
骨骼肌损伤后修复过程大致分为三个阶段:炎症期(数小时~7 d);再生期(2~7 d),肌卫星细胞激活、增殖、分化、融合形成新的肌纤维;重塑期(5~30 d),细胞外基质产生、新生肌纤维变大重塑等。其中,骨骼肌损伤后早期肌卫星细胞增殖、分化对整个修复至关重要[10]。本研究发现CTX诱导损伤后早期(3 d)MLK3表达显著升高,提示MLK3可能参与骨骼肌损伤后再生的早期细胞事件。

Figure 4.MLK3 deficiency impaired the proliferation and differentiation of muscle satellite cells.A:At 3 days after injury,PAX7 positive cells in WT and MLK3KO muscles were detected by immunofluorescence staining for PAX7(scale bar=20 μm),and percentages of PAX7 positive cells per field were analyzed(n=4);B:the mRNA levels of Myod and Myog in WT and MLK3KO muscles at 0 and 3 d after injury were assessed by RT-qPCR(n=6).Mean±SD.**P<0.01 vs WT.图4 MLK3基因缺失抑制肌卫星细胞增殖和分化
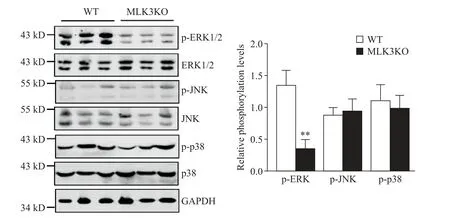
Figure 5.MLK3 deficiency inhibited phosphorylation of ERK1/2.Western blot analysis of the phosphorylation levels of ERK1/2,JNK and p38 in WT and MLK3KO muscles at 3 d after injury.Mean±SD.n=5.**P<0.01 vs WT.图5 MLK3基因缺失抑制ERK1/2磷酸化
骨骼肌再生期肌卫星细胞的激活、增殖、分化、融合受到生肌调节因子(myogenic regulatory factors,MRFs;包括PAX7、MyoD、MyoG等)的序贯表达所严格调控。骨骼肌损伤后,静息的PAX7阳性肌卫星细胞活化,转化为PAX7阳性、MyoD阳性的肌母细胞,继而分化成MyoG阳性的肌细胞。单个核的肌细胞融合成多个核肌细胞,并与残留受损的肌纤维融合,形成新的肌纤维,从而完成骨骼肌再生过程[11]。该过程受到细胞内多种信号通路的调控。比如Notch信号激活通过抑制MyoD的表达而抑制分化[3]。MAPK信号通路在骨骼肌再生过程中发挥重要作用:血管紧张素1结合Tie-2受体,激活下游ERK1/2,促进肌卫星细胞的增殖分化[4]。胰岛素样生长因子激活p38,活化的p38介导再生关键因子MyoD的表达,促进骨骼肌再生[5]。MLK3作为MAPK级联通路中ERK1/2及p38上游的关键激酶,其对ERK1/2及p38的激活是否在骨骼肌再生过程中发挥作用既往未见研究报道。
骨骼肌损伤后,位于肌纤维基底膜和肌膜之间的肌卫星细胞增殖、分化,形成新的肌纤维,从而完成骨骼肌再生。PAX7是肌卫星细胞的标志物,并且在肌卫星细胞的增殖中发挥重要作用[12]。本研究在损伤后3 d的WT及MLK3KO小鼠骨骼肌中通过免疫荧光观察肌卫星细胞PAX7阳性细胞比例,发现MLK3KO小鼠PAX7阳性细胞比例下降。PAX7表达于静息的肌卫星细胞及由肌卫星细胞分化而来的肌母细胞,PAX7阳性细胞比例下降,提示肌卫星细胞增殖及分化能力下降。损伤后3 d,MLK3KO小鼠骨骼肌中分化关键基因Myod和Myog的表达下降,进一步证实了MLK3基因缺失导致肌卫星细胞增殖及分化能力减弱。基于既往研究ERK1/2及p38活化促进肌卫星细胞增殖和分化及MLK3对ERK1/2和p38的激活作用,我们推测MLK3可能通过活化ERK1/2或p38促进肌卫星细胞的增殖、分化。Western blot检测CTX损伤后3 d的WT及MLK3KO小鼠骨骼肌中磷酸化ERK1/2和p38水平,显示MLK3KO小鼠中磷酸化ERK1/2水平下降,而p38磷酸水平没有变化,提示MLK3通过激活ERK1/2促进肌卫星细胞的增殖和分化。MLK3可以激酶依赖和激酶非依赖的方式激活ERK1/2[6,13]。在肌卫星细胞的增殖和分化过程中,MLK3通过何种方式激活ERK1/2还有待探讨。另外,骨骼肌损伤再生过程中,何种机制介导了MLK3的表达升高也不清楚,后续需要深入探讨。
综上所述,本研究结果显示蛋白激酶MLK3基因缺失通过抑制ERK1/2活化降低骨骼肌损伤后肌卫星细胞的增殖和分化,并导致骨骼肌损伤后再生能力受损,表明MLK3通过ERK1/2信号通路在骨骼肌再生中发挥重要作用,调控该信号通路可能有望成为骨骼肌萎缩的治疗新方向。

