TGF-β1 对炎症状态下人牙周膜成纤维细胞的调控作用
朱嘉皓, 芦婷, 钟良军,2
1. 杭州师范大学口腔医学院,浙江 杭州(310000); 2. 杭州师范大学附属医院口腔医学中心,浙江 杭州(310000)
牙周炎是以细菌感染引起的牙周组织破坏为特征的疾病,患病率高达45% ~50%,作为最严重的一种疾病影响着世界11.2%的人口,是第六大最常见的人类疾病[1]。已有研究显示牙周局部免疫反应在牙周炎的进展过程中起到重要的作用[2]。目前研究发现细胞免疫中,辅助性T 淋巴细胞17和调节性T 淋巴细胞之间的不平衡与牙槽骨吸收以及牙周炎的进展相关[3]。由转录因子叉头盒p3(Forkhead/winged helix transcriptional factor p3,Foxp3)介导产生的调节性T 细胞在维持免疫、抑制对宿主的过度免疫反应中具有不可或缺的作用[4]。
转化生长因子-β1(transforming growth factor β1,TGF-β1)是一种动态平衡的生长因子,是组织感染后维持免疫系统平衡及协调组织修复的细胞因子[5]。白细胞介素35(interleukin-35,IL-35)作为一种新型抗炎因子,由EB 病毒诱导基因3(Epstein-Barrvirus-induced gene 3,EBI3)和白细胞介素12p35亚基(interleukin-12p35,IL-12p35)的异源二聚体构成,具有抑制辅助性T 淋巴细胞17 细胞活化作用[6-7]。IL-35 亚基EBI3 能促进调节性T 细胞的分化,同时能促进脂多糖诱导的B 细胞活化,在炎症性疾病中发挥重要作用[8]。研究发现白细胞介素6(interleukin-6,IL-6)能激活成熟的破骨细胞,在炎症发生过程中具有重要的作用[9],Foxp3 在细胞中的表达受TGF-β1 调节[10],TGF-β1 与EBI3 在调节性T 细胞免疫炎症抑制中相关[11],但在人牙周膜成纤维细胞(human periodontal ligament fibroblasts,hPDLFs)中的研究尚属空白。牙周炎所带来的局部免疫反应可对全身健康产生影响,故Foxp3 和EBI3可能是对牙周炎症控制的重要靶点[12]。本实验利用牙龈卟啉单胞菌来源脂多糖(lipopolysaccharide fromPorphyromonas gingivalis,Pg-LPS)模拟炎症环境,探索TGF-β1 对于牙周炎症抑制作用机制,从细胞水平探究TGF-β1 对LPS 诱导的hPDLFs 增殖、迁移、细胞周期及IL-6、IL-35 亚基EBI3、Foxp3 的表达。
1 材料和方法
1.1 主要试剂和仪器
hPDLFs 细胞株(武汉普诺赛生命科技有限公司,中国);DMEM 高糖型培养基(Gibco,美国);胎牛血清(Gibco,美国);青霉素-链霉素双抗液(Gibco,美国);实时定量PCR 引物(上海生工生物工程有限公司,中国);CCK-8 试剂盒(碧云天,中国);IL-6 一抗、EBI3 一抗、Foxp3 一抗、辣根过氧化物酶标记兔二抗以及Vinculin 一抗(爱博泰克,中国);小鼠波形蛋白抗体(碧云天,中国);小鼠广谱细胞角蛋白抗体(碧云天,中国);DAB 显色试剂盒、细胞周期检测试剂盒(碧云天,中国);逆转录试剂盒(Thermo,美国);Transwell 小室(Corning,美国);牙龈卟啉单胞菌来源脂多糖(Invitrogen,美国);重组人TGF-β1 蛋白(MCE,美国);恒温细胞培养箱(Thermo Forma 311,Thermo,美国);倒置显微镜(CKX53,Olympus,日本);高速台式离心机(Megafuge 1.0R,Heraeus,德国);实时定量PCR 仪(StepOne PlusTM,ABI,美国);Bio-RAD 凝胶成像系统(GelDoc MP,Bio-Rad,美国);流式细胞分析仪(CytoFLEX Beckman Coulter,美国);多功能酶标仪(Multiskan MK3,Thermo,美国)。
1.2 方法
1.2.1 hPDLFs 的鉴定与培养 购买商品化人牙周膜成纤维细胞系,获得细胞后传代培养,利用免疫组化法对牙周膜成纤维细胞进行鉴定。将第四代细胞消化离心,细胞计数为3.0 × 104个/mL,将细胞均匀铺至6 孔板内,标为抗波形丝蛋白组、抗角蛋白组及阴性对照组,待细胞爬至60% ~70%时,取出细胞爬片,以4%多聚甲醛固定30 min,用0.1%Tritonx-100 处理爬片10 min,经PBS 冲洗,室温下封闭过氧化氢酶,10%正常山羊血清封闭15 min,孵育一抗为鼠抗人波形丝蛋白与鼠抗人角蛋白抗体4 ℃过夜,孵育二抗HRP 标记的山羊抗鼠IgG,DAB 显色,复染,封片观察镜下爬片情况并拍照记录。
将hPDLFs 培养于含10%胎牛血清和1%双抗的DMEM 培养基中,放置5% CO2的37 ℃细胞培养箱中。当细胞数量生长至占培养皿面积90%时,使用0.25%胰酶以1∶3 比例进行传代培养,选择生长状态良好的4 ~6 代细胞进行实验。
1.2.2 qRT-PCR 与CCK-8 法筛选Pg-LPS 炎症刺激浓度 取生长状态良好的4 ~6 代hPDLFs 培养于T25 培养瓶中,生长至占培养皿面积90%后分别接种于6 孔板和96 孔板中。将Pg-LPS 冻干粉在超净工作台中用含胎牛血清的DMEM 培养基倍比稀释成1、10、100 μg/mL 的Pg-LPS 完全培养基,只含胎牛血清的DMEM 培养基作为空白对照组。加入含Pg-LPS 的培养基后诱导3 d,收集细胞,Trizol 法抽提总RNA,去除DNA 污染,根据逆转录试剂盒说明书,获得cDNA,按照BeyoFastTM SYBR GreenqPCR Mix(2X)说明书进行实时定量,检测IL-6 mRNA 表达量确定Pg-LPS 浓度。设置无TGF-β1 的单纯Pg-LPS 组,取生长状态良好的4 ~6 代hPDLFs,将其在T25 瓶中培养至占培养皿面积90%,细胞计数后以2 × 103个/孔细胞密度接种于96 孔板中,待细胞贴壁后更换含1、10、100 μg/mL 的Pg-LPS 完全培养基,将96 孔板中各组细胞置于37 ℃、5% CO2培养箱中培养,在0、24、48、72 h 对各组细胞每孔加入CCK-8试剂10 μL,细胞培养箱放置2 h后检测450 nm处吸光度OD 值。
1.2.3 实验分组 根据1.2.2 实验结果以100 μg/mL浓度的Pg-LPS 作为模拟炎症刺激因素,将实验分成4 组:①对照组,单纯100 μg/mLPg-LPS;②低浓度组,1 ng/mL TGF-β1+100 μg/mLPg-LPS;③中浓度组,10 ng/mL TGF-β1+100 μg/mLPg-LPS;④高浓度组100 ng/mL TGF-β1+100 μg/mLPg-LPS。
1.2.4 CCK-8 法检测细胞增殖情况 取生长状态良好的4 ~6 代hPDLFs,在T25 瓶中培养至占培养皿面积90%,细胞计数后以2 × 103个/孔细胞密度接种于96 孔板中,待细胞贴壁后更换含100 μg/mL的Pg-LPS 完全培养基,并调整至1.2.3 分组浓度,各组细胞置于37 ℃、5% CO2培养箱中培养,在0、24、48、72 h对各组细胞每孔加入CCK-8试剂10 μL,细胞培养箱放置2 h 后检测450 nm 处吸光度OD 值。
1.2.5 细胞迁移能力实验 划痕实验:取生长良好的hPDLFs,在T25 瓶中培养至占培养皿面积90%,细胞计数后以2 × 105个/孔的密度接种于6 孔板,待细胞生长至90%以上时,更换无血清培养基,并调整至1.2.3 分组浓度。用100 μL 的加样枪头划出无细胞区,在划痕后0、6、12、24 h 拍照,使用Image J 软件测量划痕面积,同时计算细胞愈合面积。
Transwell 小室实验:取生长良好的hPDLFs,以5 × 104个/孔接种到Transwell 小室的上室,下室加入含各组相应浓度的培养基,孵育箱中培养24 h后,弃原培养液,无菌PBS 冲洗3 遍后,用棉签拭去未迁移的细胞。甲醛固定20 min 后结晶紫染色30 min,显微镜下观察并随机选取3 个视野拍照计数,观察各组之间的差别,并计算迁移细胞数。1.2.6 流式细胞术检测细胞周期 取生长良好的4 ~6 代hPDLFs 培养于T25 培养瓶中,生长至占培养皿面积90%进行铺板,细胞计数后以2×105个/孔的密度接种于6 孔板,待24 h 细胞贴壁后,更换含100 μg/mL 的Pg-LPS 完全培养基,并调整至1.2.3分组浓度。刺激72 h 后收集各组细胞,70%乙醇固定细胞,-20 ℃过夜,根据细胞周期试剂盒说明书,对细胞孵育染色,使用流式细胞仪检测各组细胞G0-G1 期、S 期、G2-M 期比例。
1.2.7 qRT-PCR 检测hPDLFs 中IL-6、EBI3 及Foxp3的表达 取生长良好的4 ~6 代hPDLFs 培养于T25培养瓶中,生长至占培养皿面积90%进行铺板,细胞计数后以2 × 105个/孔的密度接种于6 孔板中,待24 h 细胞贴壁后,更换含100 μg/mL 的Pg-LPS完全培养基,并调整至1.2.3 分组浓度。刺激72 h后收集各组细胞,Trizol 法抽取各组细胞总RNA,去除DNA 污染,根据逆转录试剂盒说明书,获得cDNA,按照BeyoFastTMSYBR GreenqPCR Mix(2X)说明书进行实时定量。PCR 反应程序为:95 ℃(10 min)预变性后,95 ℃(5 s)→60 ℃(20 s)→72 ℃(10 s)共40 个循环。PCR 引物序列见表1,18sRNA 作为内参基因进行标化,采用2-ΔΔCt方法分析相关mRNA 的表达量。
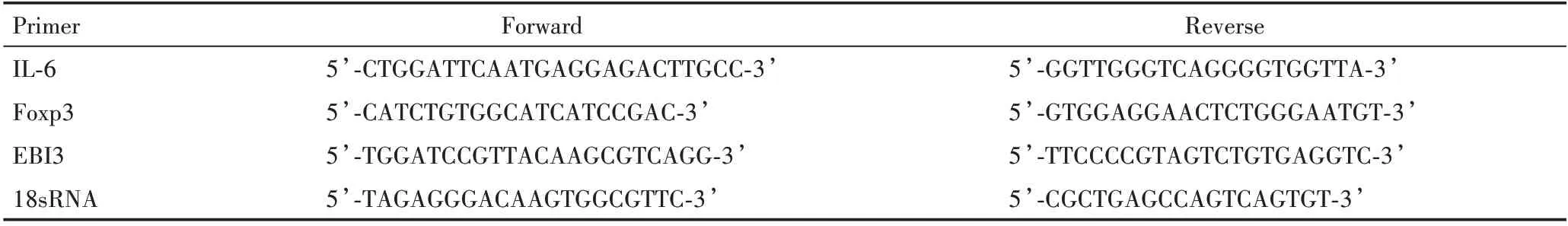
表1 PCR 引物序列Table 1 PCR primer sequences
1.2.8 Western blot 检 测hPDLFs 中IL-6、EBI3 及Foxp3 蛋白的表达 取生长良好的4 ~6 代hPDLFs培养于T25 培养瓶中,生长至占培养皿面积90%进行铺板,细胞计数后以2 × 105个/孔的密度接种于6 孔板中,待24 h 细胞贴壁后,更换含100 μg/mL 的Pg-LPS 完全培养基,并调整至1.2.3 分组浓度。刺激72 h 后收集各组细胞,将收集的细胞用PBS 冲洗3 次,加RIPA 裂解液提取细胞蛋白,离心后取上清加入PMSF 与Loading Buffer,金属浴95 ℃10 min 变性处理,进行SDS-PAGE 电泳,恒压40 V 至指示剂进入分离胶后,转150 V 电泳至结束,在低温恒流300 mA 环境下湿转2 h 将蛋白转移至PVDF 膜上,5%脱脂奶粉封闭1 h,IL-6、EBI3、Foxp3、Vinculin 一抗1∶1 000 稀释,4 ℃下摇床孵育过夜,以TBST 溶液清洗3 次,20 min/次,以辣根酶标记的二抗(1∶5 000)稀释液室温孵育1 h,TBST 溶液清洗3 次,15 min/次,将ECL 显色液均匀地滴在PVDF 膜上,再将PVDF 膜放置于BIO-RAD 仪中曝光显影。将目的蛋白灰度值与内参(Vinculin)灰度值用Image J软件分析成像结果,进行IL-6、EBI3 和Foxp3 蛋白定量分析。
1.3 统计学分析
采用Graphpad Prism8.0 软件进行统计分析,所有数据以均值± 标准差表示,组间差异使用单因素方差分析(one-way ANOVA),组间比较采用SNK-q法。P<0.05 为差异具有统计学意义。
2 结 果
2.1 hPDLFs 免疫组化鉴定
光学显微镜下见抗波形丝蛋白组细胞质内均匀分布棕黄色阳性颗粒,细胞核呈蓝色;抗角蛋白组可见细胞梭形轮廓外形,但胞质内未见颜色改变,仅细胞核染呈蓝色(图1),说明细胞来源中胚层。
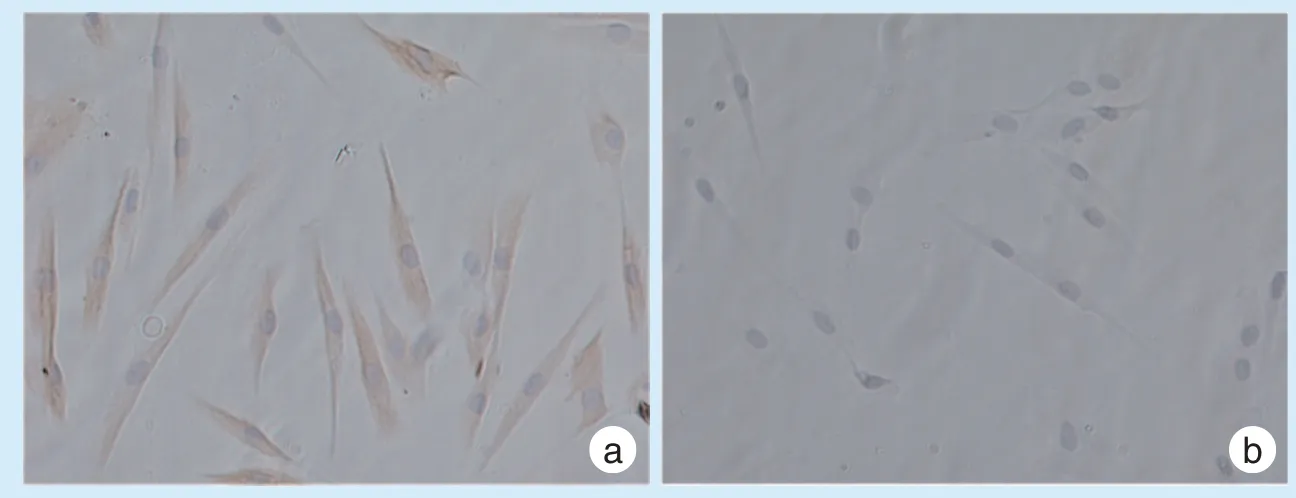
图1 hPDLFs 免疫组化鉴定Figure 1 Immunohistochemical identification of hPDLFs
2.2 不同浓度Pg-LPS 对hPDLFs 的细胞增殖以及IL-6 mRNA 表达的影响
在细胞铺板48 h 后,1、10、100 μg/mLPg-LPS组抑制hPDLFs 的增殖(图2,F= 5.091,P<0.05;q1-0= 4.477,q10-0= 4.740,q100-0= 4.273,P<0.05);在72 h,1、10、100 μg/mLPg-LPS 组进一步抑制hPDLFs 的增殖(F= 23.72,P<0.0001;q1-0= 9.628,q10-0= 9.272,q100-0= 10.23,P<0.0001)。
与空白对照组相比,随Pg-LPS 浓度的递增,炎症因子IL-6 的mRNA 的表达量逐渐上升(图2),其中当Pg-LPS 浓度为100 μg/mL 时,IL-6 mRNA 表达量与对照组相比显著上升(F= 122.9,P<0.001;q100-0= 26.57,P<0.000 1),故选择100 μg/mLPg-LPS 作为后续实验使用浓度,用于模拟炎症状态。
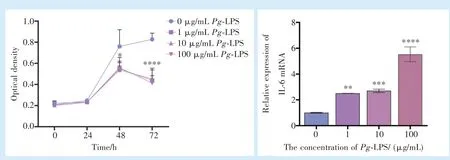
图2 不同浓度Pg-LPS 对hPDLFs 的细胞增殖以及IL-6 mRNA 表达的影响Figure 2 Effects of different concentrations of Pg-LPS on IL-6 mRNA expression and cell proliferation in hPDLFs
2.3 TGF-β1 对100 μg/mL Pg-LPS 刺激下hPDLFs增殖的影响
与空白对照组相比,1、10、100 ng/mL 的TGF-β1在24、48 h 时对含Pg-LPS 的hPDLFs 的增殖结果无明显改变;在72 h 时,10、100 ng/mL TGF-β1 对hPDLFs 的增殖效果相对于空白对照组上升,差异有统计学意义(图3,F= 34.38,P<0.000 1;q10-0=11.70,q100-0= 11.49,P<0.05),表明10、100 ng/mL TGF-β1 在炎症状态下可提高细胞增殖情况。
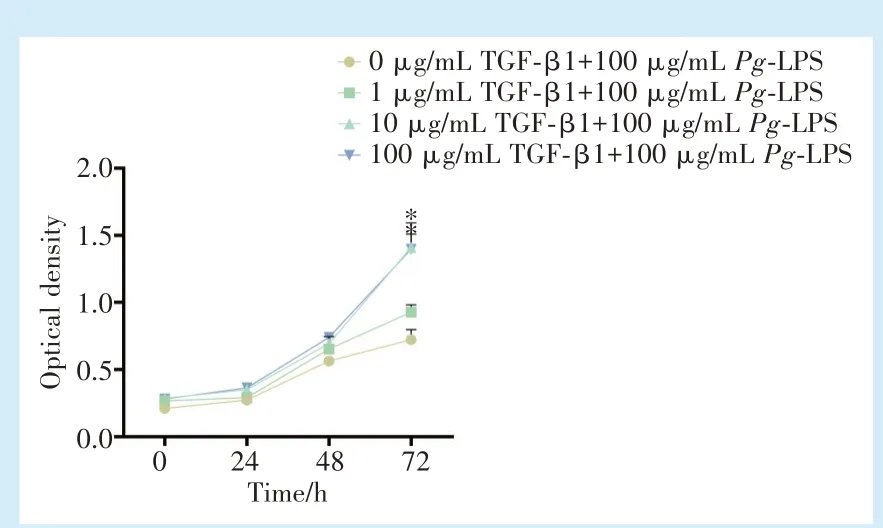
图3 不同浓度TGF-β1 对100 μg /mL Pg-LPS 刺激下hPDLFs 增殖的影响Figure 3 Effects of different concentrations of TGF-β1 on the proliferation of hPDLFs stimulated with 100 μg/mL Pg-LPS
2.4 TGF-β1 对100 μg/mL Pg-LPS 刺激下hPDLFs迁移能力的影响
2.4.1 细胞划痕实验 通过显微镜对4 组各时间点细胞迁移能力的观察,计算4 组各个时间点的愈合面积比例(图4)。在6 h 时,与空白对照组相比,1、10、100 ng/mL TGF-β1 组的细胞划痕愈合面积均无明显差异;而在12 h,1、10、100 ng/mL TGF-β1 组相对于空白对照组划痕愈合面积升高,差异有统计学意义(F=93.38,P<0.000 1;q1-0=13.05,q10-0=13.38,P<0.005;q100-0= 23.37,P<0.000 1)。
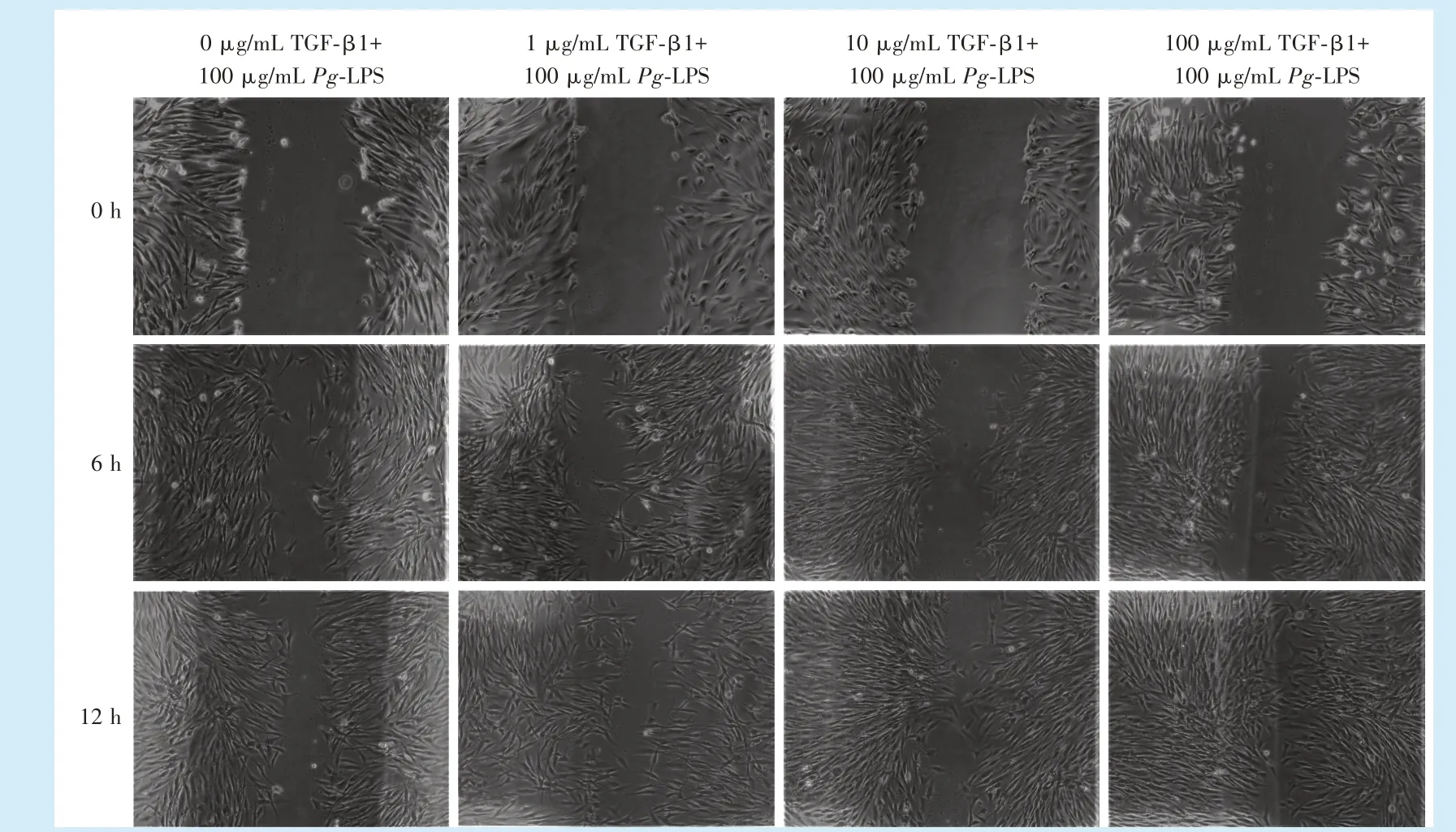
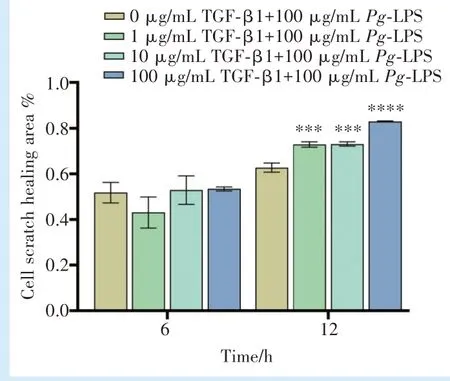
图4 不同浓度TGF-β1 对100 μg/mL Pg-LPS 刺激下hPDLFs 划痕实验愈合面积的比较Figure 4 Comparison of the experimental scratch assay area of hPDLFs stimulated with 100 μg/mL Pg-LPS and different concentrations of TGFβ1
2.4.2 Transwell 小室实验 显微镜下观察下室中4 组迁移的细胞(图5),结果显示在细胞铺板24 h后,与空白对照组相比,1、10、100 ng/mL TGF-β1 组的迁移细胞数增多,差异有统计学意义(F= 138.5,P<0.000 1;q1-0= 5.212,P<0.05;q10-0= 18.49,q100-0=25.56,P<0.000 1),随TGF-β1 的浓度增高,hPDLFs的迁移能力逐渐增强。
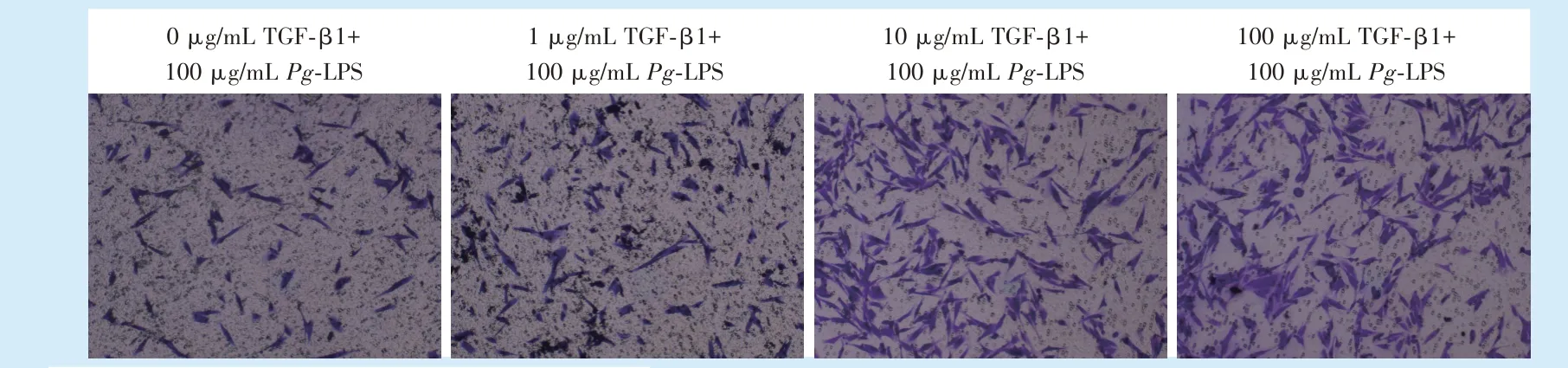

图5 不同浓度TGF-β1 对100 μg /mL Pg-LPS 刺激下hPDLFs 迁移细胞数的比较Figure 5 Comparison of migrating cell numbers of hPDLFs stimulated by 100 μg/mL Pg-LPS with different concentrations of TGF-β1
2.5 TGF-β1 对100 μg/mL Pg-LPS 刺激下hPDLFs细胞周期的影响
1、10、100 ng/mL TGF-β1 组可加快炎症状态下的hPDLFs 细胞进程(图6),与空白对照组相比,1、10、100 ng/mL TGF-β1 组G0-G1 期细胞百分率明显减少(F= 214.7,P<0.000 1;q1-0= 26.65,q10-0=29.02,q100-0= 31.45,P<0.000 1),S 期细胞百分率明显增加(F= 432.4,P<0.000 1;q1-0= 35.26,q10-0=37.05,q100-0= 47.89,P<0.000 1);100 ng/mL TGF-β1组的G2-M 期细胞百分率降低(F= 9.319,P<0.05;q100-0= 5.997,P<0.05)。
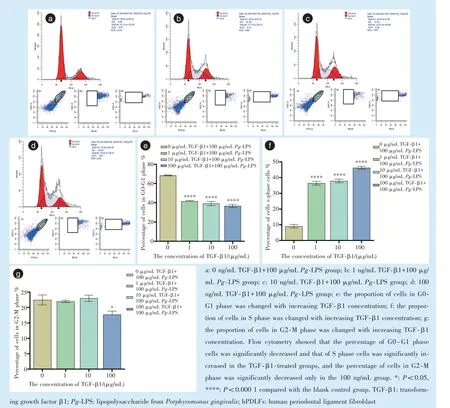
图6 不同浓度TGF-β1 对100 μg /mL Pg-LPS 刺激下hPDLFs 细胞周期进程的比较Figure 6 Comparison of cell cycle progression of hPDLFs stimulated with 100 μg/mL Pg-LPS and different concentrations of TGF-β1
2.6 TGF-β1 对100 μg/mL Pg-LPS 刺激下hPDLFs 目的基因表达的影响
qRT-PCR 结果显示(图7):与空白对照组相比,1、10、100 ng/mL TGF-β1 组IL-6 mRNA 的表达量降低(F= 101.4,P<0.000 1;q1-0= 17.28,q10-0=22.10,q100-0= 19.86,P<0.000 1);在TGF-β1 浓度为1 ng/mL 和10 ng/mL 时,EBI3 mRNA 较 空 白 对 照 组明显升高(F= 216.6,P<0.000 1;q1-0= 28.81,q10-0=24.99,P<0.000 1);Foxp3 mRNA 同样在TGF-β1 浓度为1 ng/mL 和10 ng/mL 时相对于空白对照组升高(F= 11.97,P<0.05;q1-0= 5.952,q10-0= 4.875,P<0.05)。
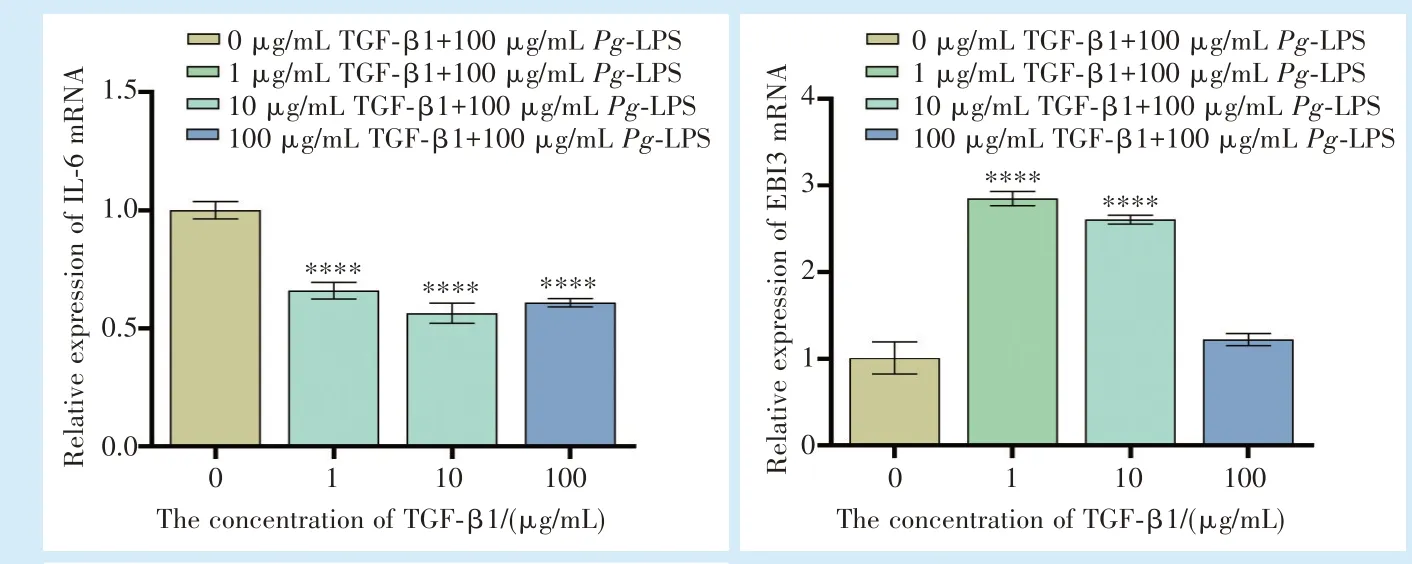
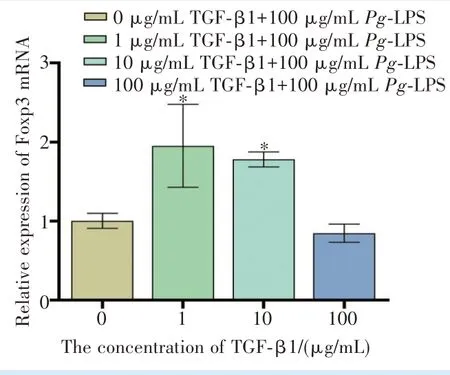
图7 不同浓度TGF-β1 对100 μg /mL Pg-LPS 刺激下hPDLFs 目的基因表达的比较Figure 7 Comparison of target gene expression in hPDLFs stimulated with 100 μg/mL Pg-LPS and different concentrations of TGF-β1
2.7 TGF-β1 对100 μg/mL Pg-LPS 刺激下hPDLFs目的蛋白表达的影响
Western blot 结果显示(图8):与空白对照组相比,1、10、100 ng/mL TGF-β1 组IL-6 蛋白的表达量降低(F= 809.0,P<0.000 1;q1-0= 53.00,q10-0=58.16,q100-0= 58.79,P<0.000 1);在TGF-β1 浓度为1 ng/mL 和10 ng/mL 时,EBI3 蛋白相比较空白对照组升高(F= 70.61,P<0.000 1;q1-0= 9.351,P<0.001;q10-0= 17.54,P<0.000 1);Foxp3 蛋白表达在TGF-β1 浓度为10 ng/mL 时相对于空白对照组提高(F= 21.22,P<0.005;q10-0= 7.207,P<0.05)。
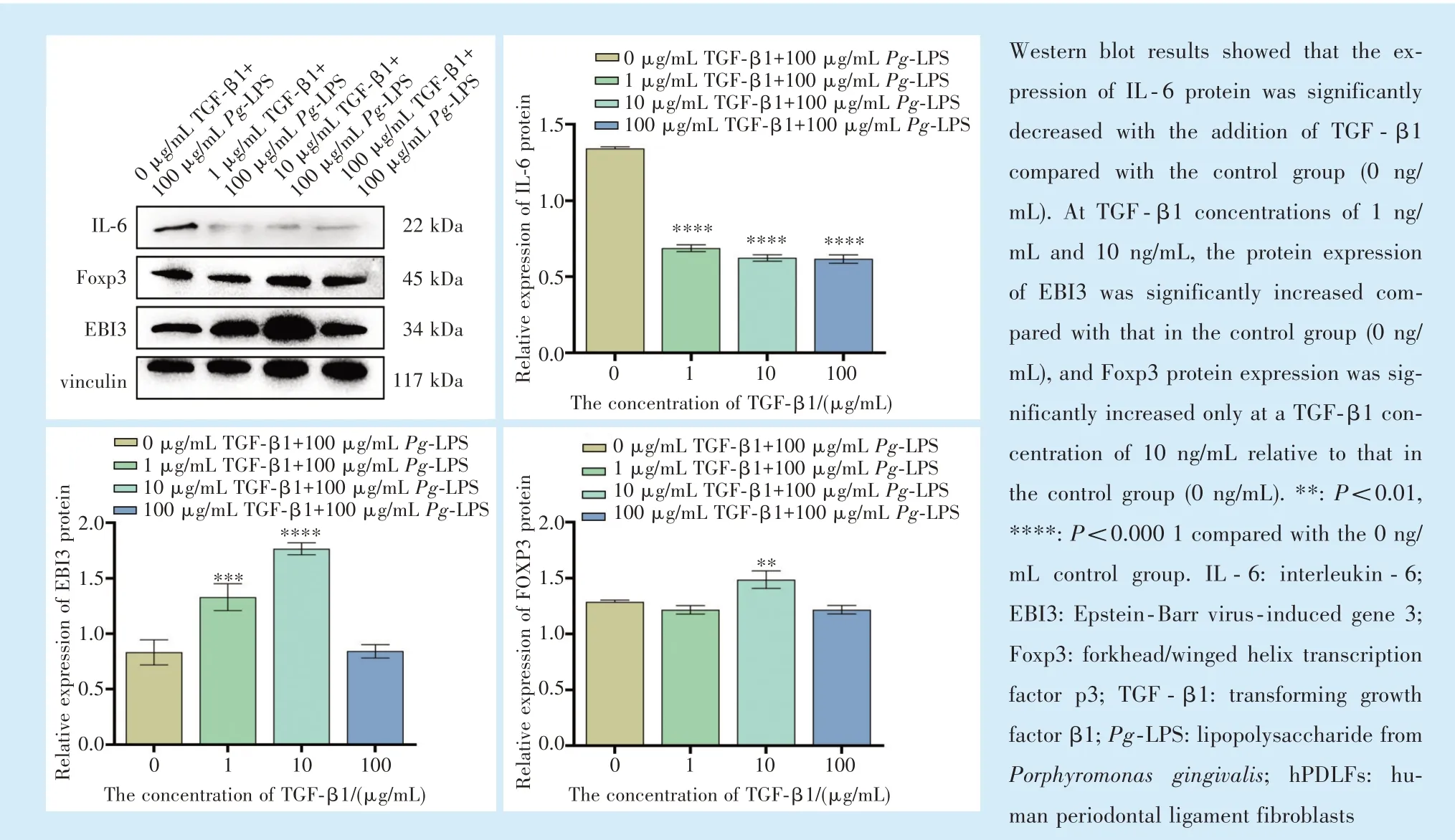
图8 不同浓度TGF-β1 对100 μg /mL Pg-LPS 刺激下hPDLFs 目的蛋白表达的比较Figure 8 Comparison of the expression of target proteins in hPDLFs stimulated with 100 μg/mL Pg-LPS and different concentrations of TGF-β1
3 讨 论
牙周炎是一种慢性免疫炎症性疾病,宿主免疫调节在牙周炎发病过程中有重要作用,EBI3 作为IL-35 亚基的一种分泌型糖蛋白,由调节性T 细胞表达,通过gp130/STAT3 信号通路以自分泌方式促进调节性T 细胞分化,同时与IL-12p35 结合构成IL-35 提高炎症抑制的作用[8]。EBI3 缺失可致炎症加重,其通过上调组蛋白乙酰化的表观遗传机制改善炎症[13]。EBI3 与目标蛋白以及伴侣蛋白Calnexin 结合,促进目标蛋白正确折叠,提高目标蛋白的表达,EBI3 与Calnexin 协同作用可提高抑制性炎症因子IL-35 的表达[14]。
Williams 等[15]发现炎症发展和免疫调节共存于念珠菌病患者的口腔黏膜,EBI3 与Foxp3 在免疫细胞中高表达,这种炎症发展和免疫耐受之间的平衡是决定感染发展的关键,特别是辅助性T 细胞17 和调节性T 细胞的失衡可影响牙周炎的发生发展,调控调节性T 细胞是牙周炎免疫治疗的重要方向,然而在炎症环境下局部调控调节性T 细胞的功能具有不稳定性[16]。过往研究显示EBI3 与Foxp3仅在调节性T 细胞中表达[17],hPDLFs 主要特征是产生胶原纤维且具有一定的分化潜能[18],但在本课题组实验中首次发现hPDLFs 中存在EBI3 与Foxp3 的表达,提示hPDLFs 可能与调节性T 细胞性质相似,具有参与免疫反应、抑制炎症的能力,目前该结果在国内外研究中未曾报道。TGF-β1 是免疫系统中调控调节性T 细胞的细胞因子[11],因此本实验进一步探索TGF-β1 对hPDLFs 是否具有调控作用,结果表明在炎症状态下,TGF-β1 提高hPDLFs胞内EBI3 和Foxp3 的表达:TGF-β1 浓度为1 ng/mL和10 ng/mL 时,EBI3 与Foxp3 的mRNA 表 达均 明显上升,两者具有同步性;EBI3 的蛋白表达在TGF-β 1 浓 度 为1 ng/mL 和10 ng/mL 时上升,Foxp3 的蛋白表达仅在TGF-β1 浓度10ng/mL 时表达上升。因为Foxp3 的蛋白在内毒素刺激下易降解[19],且Foxp3的蛋白稳定性依赖于Foxp3 乙酰化程度,IL-6 的存在一定程度能抑制Foxp3 的乙酰化[20]。IL-6 为炎症细胞因子,在生理状态下在血液和组织中浓度较低,但炎症反应过程中浓度升高,可协同集落刺激因子促进原始骨髓细胞分化和增殖[9],IL-6 在血液及组织细胞中的水平越高代表炎症程度越重。本研究表明hPDLFs 在炎症状态下,加入TGF-β1 后IL-6 的mRNA 和蛋白表达与无TGF-β1 相比均下降,表明TGF-β1 有抑制hPDLFs 炎症因子表达的作用,TGF-β1 调控hPDLFs 中EBI3 与Foxp3 的表达从而降低炎症是一种全新的抑炎机制,可作为牙周炎免疫治疗新的研究体系。
Koidou 等[21]研究表明牙周炎治疗后,龈沟液中TGF-β1 的表达上调可促进组织愈合。龙晏等[22]发现无炎症的情况下10 ng/mL TGF-β1 具有促进人牙周膜细胞增殖和迁移的能力,且该作用存在剂量效应关系[23]。因此本实验以10 ng/mL 为参考,设置浓度梯度探索在炎症状态下TGF-β1 是否仍具有促进细胞增殖和迁移的能力,结果表明炎症状态下hPDLFs 的增殖随TGF-β1 的浓度增高而增加,迁移能力随TGF-β1 的浓度增高而增加,Pg-LPS 抑制hPDLFs 向S 期、G2-M 期进展,将细胞周期阻滞于G0-G1 期,而TGF-β1 可以改善这一过程。
本实验证明TGF-β1 可促进炎症状态下hPDLFs的增殖及迁移能力,且能显著降低IL-6 的表达;浓度为1 ng/mL 和10 ng/mL 时,EBI3 上调,抑制炎症进程,此过程可能与转录因子Foxp3 表达上调有关。
【Author contributions】Zhu JH and Lu T peformed the experiments, analyzed the data, and wrote the article. Zhu JH and Zhong LJ designed the study and revised the article. All authors read and approved the final manuscript as submitted.

