直接靶板微滴法快速检测肺炎克雷伯菌替加环素和多黏菌素的敏感性
夏兆新,杨文苏,朱 毅,胡心益,林春晖,蒋 童,沈继录
肺炎克雷伯菌是重要的院内感染病原体,其耐药性在全球范围内不断增加,且治疗药物愈发受限,是重大的公共卫生问题之一[1]。替加环素和多黏菌素是治疗这些致病菌感染的重要药物[2-3]。然而随着其在临床抗感染治疗中的逐渐使用,近年来也不断有对其耐药的菌株被分离出来[4-5]。CHINET数据[6]显示,2021年肺炎克雷伯菌的替加环素耐药率为4.2%,中介率为7.0%,而多黏菌素在克雷伯菌属中的耐药率也达到3.9%。目前临床上常用纸片扩散法,或基于微量肉汤稀释法来检测替加环素和多黏菌素的敏感性,然而其操作繁琐,耗时长,可能会延误治疗。为了优化替加环素和多黏菌素的使用,该研究基于基质辅助激光解吸/电离飞行时间质谱(matrix-assisted laser desorption/ionization time of flight mass spectrometry,MALDI-TOF MS)技术[7-8]进行直接靶板微滴生长法(direct-on-target micro-droplet growth assay,DOT-MGA),预测替加环素和多黏菌素的敏感性,评估数小时内快速检测肺炎克雷伯菌耐药表型的可行性和准确性。
1 材料与方法
1.1 菌株来源共收集安徽医科大学第一附属医院临床分离的肺炎克雷伯菌67株,其中27株对替加环素耐药菌,13株对多黏菌素耐药,27株对两种抗生素敏感。所有菌株均经过MALDI-TOF MS(德国Bruker公司)鉴定,确定菌种。
1.2 材料与试剂MALDI-TOF MS质谱仪,质谱样品处理基质液及MALDI-TOF MS靶板均购自德国Bruker公司;替加环素、多黏菌素和CAMHB肉汤粉末(阳离子调节肉汤)购自北京索莱宝科技有限公司;哥伦比亚血琼脂平板购自上海科玛嘉微生物技术有限公司;ATCC27853和ATCC25922作为微量肉汤稀释法和MALDI-TOF MS鉴定所用的标准菌株,为安徽医科大学第一附属医院微生物实验室所保存。
1.3 微量肉汤稀释法测定最低抑菌浓度(minimal inhibitory concentration,MIC)通过微量肉汤稀释法测定替加环素的MIC。根据美国食品药品管理局临床折点,解释替加环素敏感性(MIC≥8 mg/L为耐药,MIC=4 mg/L为中介,MIC≤2 mg/L为敏感),ATCC25922作为参考菌株;根据欧洲抗菌药敏感性试验委员会临床折点,解释多黏菌素敏感性(MIC≥4 mg/L为耐药,MIC≤2 mg/L为敏感),ATCC27853和ATCC25922作为参考菌株。
1.4 DOT-MGA在96孔微量滴定板孔中先加入100 μl菌液,后加入100 μl的MH肉汤(含或不含抗生素,其终浓度为2 μg/ml),不含抗生素的孔用作该样品的生长对照孔。然后取6 μl混合液微滴转移到MALDI-TOF MS靶板孔上,一式三份进行,3个孔含有抗生素,另外3个孔不含抗生素。将接种好的靶板放入塑料运输盒中,在盒底部加入4 ml去离子水,用作湿盒。置于温箱中于(35±1)℃分别孵育3、4、6、8 h后,使用无尘纸将肉汤从靶板上移除。待靶板上剩余菌液完全干燥后,加入1 μl基质液覆盖靶点,手动收集MALDI-TOF质谱光谱,并由MALDI Biotyper 3软件(Bruker Daltonik)评估。
预实验中随机选取13株敏感和13株耐药的细菌,分别设置了3、4、6和8 h的孵育时间后,对所有菌株进行DOT-MGA进行检测。
在生长对照鉴定得分≥1.7分的情况下,该组测试判定为有效。含有替加环素或多黏菌素的样本,成功鉴定(得分≥1.7分)被解释为非敏感(中介或耐药)结果NS (no susceptible),而鉴定失败(得分<1.7分)定义为敏感S (susceptible)。
1.5 数据处理DOT-MGA的最终结果分别与微量肉汤稀释法的结果进行比较,按照如下公式计算有效率、敏感度、特异度、阴性预测值、阳性预测值及分类一致率(categorical agreement,CA)。CA即被评估方法的结果与微量肉汤稀释法药敏结果一致的菌株所占百分比。见表1。

表1 DOT-MGA数据处理
灵敏度=a/(a+c);特异度=d/(b+d);阳性预测值=a/(a+b);阴性预测值=d/(c+d)
2 结果
研究[7,9]报道中显示,DOT-MGA试验以6 μl液滴培养可以获得最佳检测性能。在本研究前期实验中以4、6、8 μl作为比较,发现液滴体积过小,小于4 μl细菌生长状态不佳,超过6 μl则容易溢出靶板孔,造成交叉污染,6 μl可以很好的固定在孔内,获得最佳的生长状态,于是后续实验均采用6 μl的体积来摸索最佳孵育时间。
2.1 替加环素的DOT-MGA结果替加环素DOT-MGA预实验结果显示,培养3 h后,细菌生长的有效率为88.46%,CA为73.91%,细菌生长状态不好,不能被正确检测。而4 h后,细菌生长的有效率为100.00%,CA为96.15%,其灵敏度、特异度、阳性预测值和阴性预测值分别为92.31%、100.00%、100.00%、92.86%,已达到最佳状态,随着时间延长到6 h和8 h,检测性能未能得到明显的提高。扩大菌株量,对所收集到的54株菌株,以6 μl液滴,孵育4 h后,经过MALDI-TOF质谱仪检测,与微量肉汤稀释法对比后,只有1株菌存在中介判断为敏感,存在微小误差,其他结果均一致。DOT-MGA的有效率、CA、灵敏度、特异度、阳性预测值和阴性预测值分别为100.00%、98.15%、96.30%、100.00%、100.00%、96.45%,与微量肉汤稀释法的结果具有良好的一致性。见表2。

表2 DOT-MG对替加环素非敏感菌株的鉴定性能
2.2 多黏菌素的DOT-MGA结果本研究共收集到13株多黏菌素不敏感的菌株,又随机选取了13株多黏菌素敏感的菌株进行DOT-MGA实验,在3 h孵育时间下生长有效率为92.15%,而4、6、8 h孵育时间下,生长对照孔均能有效鉴定出,生长有效率为100.00%,而在孵育4 h后,DOT-MGA的鉴定性能达到最佳,其CA、灵敏度、特异度、阳性预测值和阴性预测值分别为96.15%、92.31%、100.00%、100.00%、92.86%,孵育时间延长到6 h和8 h,检测性能与4 h的结果一致。见表3。
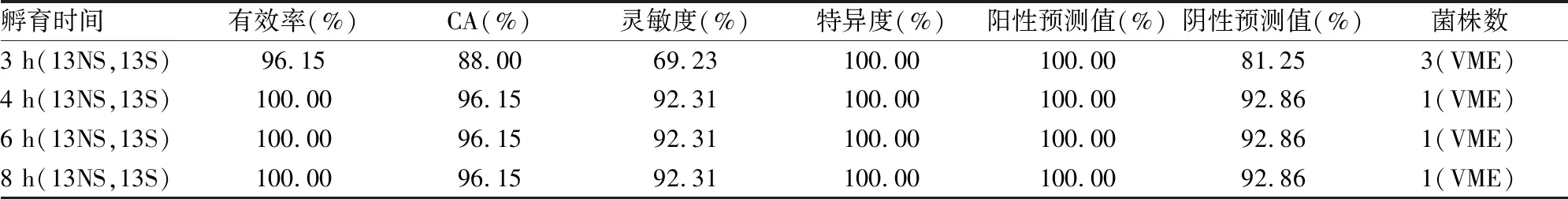
表3 靶板微滴生长法对多黏菌素非敏感菌株的鉴定性能
3 讨论
目前,微量肉汤稀释法是抗菌药物敏感性实验的金标准[10]。临床常用的VITEK 2 Compact全自动微生物分析系统是基于该方法进行药物MIC值的检测,但其结果通常不能在同一天内获得,从而可能延误有效的治疗,微生物的快速药敏检测仍然是急需解决的问题。DOT-MGA是基于微量肉汤稀释法原理,利用MALDI-TOF MS仪器具有更高的检测性能,缩短常规肉汤稀释法的孵育时间,从而达到快速检测的效果,且与肉眼观察结果比较,既可以排除主观因素的干扰,也可以提高其准确性和灵敏度,这一方法受到了人们的广泛关注[11-14]。有学者将美罗培南与肺炎克雷伯菌和肠杆菌共同孵育,利用DOT-MGA在4 h内实现快速检出该菌对碳青霉烯酶的非敏感性和碳青霉烯酶的分型[15-16]。本研究收集了临床分离的27株替加环素不敏感的菌株和13株多黏菌素不敏感的菌株,探究DOT-MGA对替加环素和多黏菌素耐药的肺炎克雷伯菌的表型检测性能。结果显示,在与替加环素、多黏菌素共同孵育4 h后,大部分肺炎克雷伯菌便可以被MALDI-TOF MS仪检测出,其抗生素敏感性的结果与肉汤稀释法相比具有较高的一致性,替加环素和多黏菌素的生长有效率均为100.00%,CA分别为98.15%和96.15%。在替加环素DOT-MGA实验中,54株菌中有1株菌(MIC=4 μg/ml,I)由中介误判为敏感,存在微小误差,多黏菌素DOT-MGA实验中,26株菌有1株菌(MIC=4 μg/ml,R)由耐药误判为敏感,存在非常重大误差,这可能是因为该菌MIC值与选取的折点药物浓度相近(2 μg/ml),而配置过程中存在认为误差引起。
DOT-MGA也同样可以推广到许多不同的微生物和抗生素检测中,Idelevich et al[17]评估了DOT-MGA检测头孢呋辛、厄他培南、环丙沙星、左氧氟沙星、庆大霉素等多种抗生素的性能。但DOT-MGA检测需要优化抗生素-生物体组合条件,摸索最适孵育时间以获得最佳检测性能。在本研究中,孵育时间为3 h时,部分细菌生长控制无法检测出,这可能是孵育时间过短,细菌含量低,细菌黏液性高,从而光谱较差,仪器无法检测出。而无抗生素孵育组,尽管生长控制孔已达到了仪器的检测限,但加药后偶尔也有几个替加环素或多黏菌素耐药的菌株生长仍未达到检测要求,这主要与微生物自身的生长状况有关,生长缓慢的细菌需要更长的时间来与抗生素竞争,而过长的孵育时间也会导致细菌过度生长,并可能产生其他杂菌,从而无法做出准确的判断。适当的孵育时间应允许可以成功检测的细菌生长控制,同时可以准确表征细菌对抗生素的易感性。本研究中替加环素DOT-MGA组,有一株菌在两次4 h孵育鉴定中,一次未检出,一次可以正确预测,这个误差可能受操作过程中吸水纸吸取液滴不当或靶板清洁程度等多种因素的影响。因此,在摸索多种抗生素-细菌组合的最佳检测条件后,开发出一种含有固定含量抗生素的一次性靶板,改进弃去液滴的方式,规范操作流程,从而减小实验中的误差,更好用于临床药物敏感性的检测。
本研究仅对替加环素和多黏菌素这两种药物进行评估,研究表明DOT-MGA法可以在4 h孵育后检测对替加环素、多黏菌素敏感和不敏感的菌株,未对其他抗生素进行评估,但其他抗生素尤其是碳青霉烯类药物的检测先前已有报道,Idelevich et al验证了多种抗生素在孵育4 h后便可获得最佳检测性能[17]。替加环素、多黏菌素耐药的菌株难以收集,实验中的菌株量有限,仍需扩大样本量和细菌种类进一步验证。其中Horseman et al[11]的研究也表明DOT-MGA法在金黄色葡萄球菌、肠球菌、大肠杆菌和肺炎克雷伯菌四种常见病原菌的药敏鉴定中同样具有很高的准确性。DOT-MGA方法在其他不同菌种的药物敏感性检测中可能也具有很大的潜能。
综上所述,DOT-MGA方法可以快速鉴别替加环素和多黏菌素的敏感性,并可能用于不同菌种、不同抗生素敏感性的鉴别,这为临床微生物抗生素快速检测提供新的思路,对临床多重耐药菌的抗感染治疗具有重大意义。

