整合素αvβ6 在头颈部鳞状细胞癌中的作用研究
赵瑞 华清泉
整合素是细胞外基质配体的异二聚体跨膜受体[1],由α 和β 亚基结合而成[1],其与配体结合后不仅具有粘附功能,还能启动跨细胞膜的双向信号传递[2],介导细胞-细胞和细胞-细胞外基质(extracellular matrix, ECM)的相互作用[3]。其中最为特殊的是上皮限制性整合素αvβ6[4],其仅在上皮细胞上表达,在健康成人组织中缺失或低表达,而在需要组织重构的发育、伤口愈合、癌症和纤维化等过程中表达上调[5,6]。
1 整合素αvβ6 的结构和功能
整合素αvβ6 是由αv 和β6 亚单位组成的,分为胞外、跨膜和胞质结构域[7]。编码αv 亚基的基因(CD51)定位于2q31-q32 染色体,编码β6 亚基的基因(ITGB6)则在2q24-q31 染色体上[8,9]。αv 亚基主要负责配体的识别,而β6 亚基主要负责信号转导[9]。β6 亚基只能与αv 亚基结合,是整合素αvβ6 的限速亚基,其控制着整合素αvβ6 的表达和有效性[5]。整合素αvβ6 的独特性可能正是因为β6 亚基的结构特异性[9]。
整合素αvβ6 能特异性识别结合包括纤维连接蛋白、骨桥蛋白、玻璃体连接蛋白、肌键蛋白-c 和转化生长因子-β(transforming growth factor-β, TGFβ)前肽在内的含有RGD 基序(精氨酸-甘氨酸-酪氨酸)的蛋白[1,5]。整合素通过将信号分子和连接蛋白募集到β 亚基的胞浆尾[10],从而参与调节增殖、迁移、存活、分化、肿瘤侵袭和转移等多种过程。在多达三分之一的实体肿瘤中发现整合素αvβ6 的表达升高,并与患者较差的预后和肿瘤侵袭性增加相关。因此,整合素αvβ6 是检测和治疗这类癌症的一种极好的细胞表面差异表达分子[5,11]。
2 整合素αvβ6 促进HNSCC 的侵袭与转移
多项研究发现整合素αvβ6 在HNSCC 中过表达,有研究称整合素αvβ6 表达在95%的HNSCC 肿瘤细胞上[12]。有实验证实在41%的口腔黏膜白斑标本中也检测出整合素αvβ6 高表达,并证实整合素αvβ6 在口腔鳞癌及口腔黏膜白斑中高表达与疾病的恶性进展相关[13]。整合素αvβ6 通过介导多种经典致癌途径促进HNSCC 肿瘤细胞的侵袭和转移(见图1、图2)。
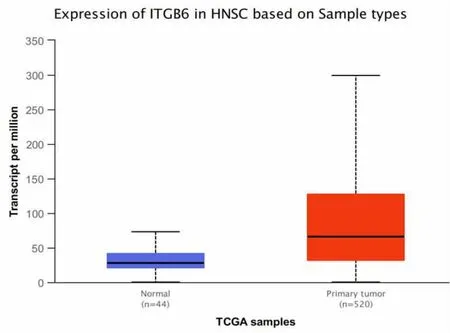
图1 TCGA 数据库显示ITGB6 在HNSCC 癌组织中表达明显高于癌旁组织且差异有统计学意义(t=-7.7384,P<0.05)
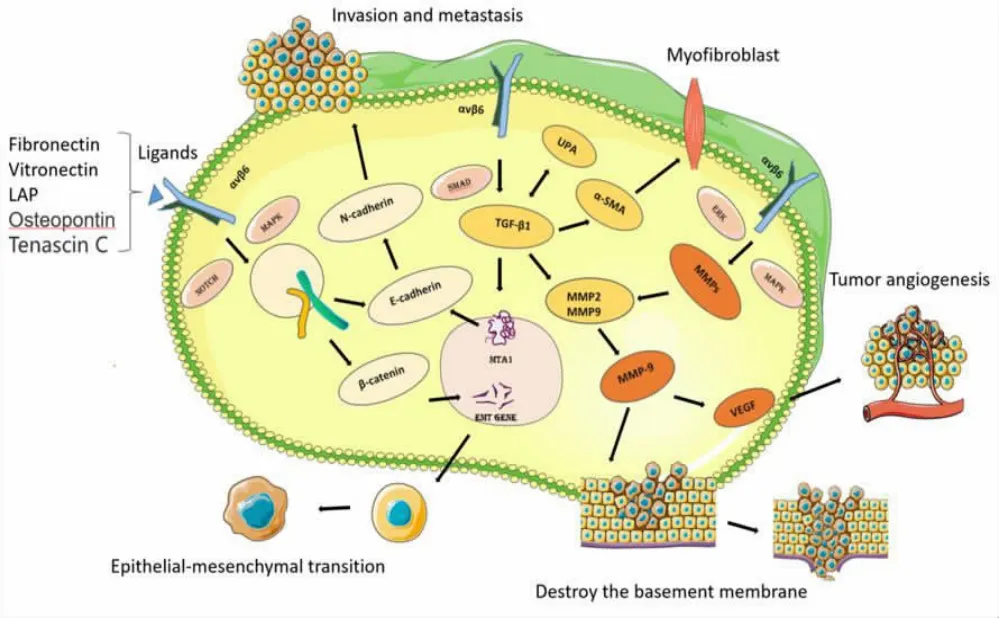
图2 整合素αvβ6 通过介导多种致癌途径促进HNSCC肿瘤细胞的侵袭和转移
2.1 整合素αvβ6 促进HNSCC 癌细胞的上皮-间质转化(epithelial-mesenchymal transition, EMT)
EMT 是细胞由上皮状态向间质状态转变,并使其获得迁移和侵袭性行为的生物学过程[14,15]。EMT在胚胎发育和伤口愈合等重要生理过程中发挥着重要作用,其特点是细胞粘附性的丧失和运动性的增加。EMT 最主要的标志是上皮标志物E-钙黏蛋白表达下调[16]。钙依赖的细胞表面蛋白E-钙黏蛋白是促进上皮细胞之间粘附的主要蛋白,细胞表面E-钙黏蛋白通过β-连接素将细胞连接到细胞骨架以维持细胞间连接和上皮功能。HNSCC 肿瘤细胞侵袭时E-钙黏蛋白被内吞而β-连接素被释放易位到细胞核,诱导EMT 基因的转录。在HNSCC 肿瘤细胞中,E-钙黏蛋白缺失导致细胞间粘附被破坏,从而使肿瘤细胞侵袭转移能力增加[14-16]。
研究证明在HNSCC 中,EMT 促进HNSCC 侵袭,并且EMT 过程导致的基底膜破坏以及基因和表型改变的细胞侵袭底层间质是上皮发育不良(癌前)向HNSCC 发展的重要原因[17]。此外,实验证实EMT与HNSCC 患者预后相关。还有研究证实在HNSCC中存在E-钙黏蛋白到N-钙黏蛋白的转换,高表达的N-钙黏蛋白与肿瘤的恶性程度密切相关。因此,EMT 促进HNSCC 进展可能是通过钙黏蛋白转换发生的。在喉鳞状细胞癌组织中检测到E-钙黏蛋白呈低表达,这提示EMT 激活并在喉癌发生发展过程中发挥重要作用[16]。
EMT 过程可能是由Notch 信号通路及MAPK磷酸化来调控。在口腔癌中,我们认为Notch 可以作为肿瘤启动子。此前研究证实,当β6 亚基被阻断时,Notch 通路被抑制了75%,而MAPK 的激活也显著降低。这表明整合素αvβ6 与配体结合是产生EMT 周围初始信号事件的必要条件[4]。
2.2 整合素αvβ6 激活HNSCC 癌细胞内的TGF-β1
整合素αvβ6 是TGF-β1 的激活剂[9],当整合素αvβ6 与LAP1 中包含的RGD 基序结合时,会引发构象改变导致TGF-β1 激活。整合素αvβ6 通过激活TGF-β1 以及该细胞因子对细胞的抗增殖作用,在正常上皮细胞中作为肿瘤抑制因子。敲除ITGB6基因的动物易于自发发生良性和恶性肿瘤的研究结果证明了这一点。在癌症发展过程中,整合素αvβ6-TGF-β1 相互作用的复杂平衡被打破,TGF-β 信号通路严重失调,导致TGF-β1 通过经典的Smad 信号通路以及非Smad 信号通路从肿瘤抑制因子转变为肿瘤促进因子。此外,TGF-β1 在癌细胞中上调尿激酶型纤溶酶原激活物(urokinase-type plasminogen activator, uPA) 的表达,而uPA 通过纤溶酶原的激活,可能激活潜伏的TGF-β1,从而提供一个正反馈回路来放大TGF-β1 在癌细胞中的活性[18,19]。
TGF-β1 激活后通过多种机制增加HNSCC 细胞的迁移侵袭以及转移能力,包括通过TGFβ1/ALK/Smad 信号通路诱导HNSCC 血管生成、调节肿瘤微环境、促进EMT、免疫抑制作用[20]。体内及体外实验均发现过表达的ITGB6 可以通过上调和活化TGFβ1,促进口腔鳞癌细胞侵袭转移[21]。同时用外源性TGF-β1 刺激口腔癌细胞株后发现细胞株的迁移和侵袭能力明显增强[22]。在HNSCC 发生过程中,TGFβ1 激活后还可导致参与核小体重塑等过程的转移相关蛋白1(metastasis associated protein 1, MTA1)表达上调,从而使HNSCC 肿瘤细胞增殖及侵袭能力增加,促进肿瘤转移。侵袭实验也证实TGF-β1 能够促进舌癌细胞的侵袭能力增强[23]。整合素αvβ6 依赖的TGF-β1 激活也可诱导附近基质细胞分化成肌成纤维细胞。肌成纤维细胞是高度收缩的细胞,可以结合其他αv 整合素,如αvβ1,进一步激活肿瘤细胞周围的TGF-β 前体。同时,肌成纤维细胞又可促进HNSCC 侵袭。既往实验证实肌成纤维细胞在体内外促进口腔鳞癌细胞的侵袭,并有研究称肿瘤间质中肌成纤维细胞的存在与舌癌的局部复发和转移有关。TGF-β1 是驱动肌成纤维细胞转分化最有效的细胞因子[24-28]。
2.3 整合素αvβ6 促进HNSCC 癌细胞的基质金属蛋白酶(matrix metalloproteinase, MMPs)分泌MMPs是一类锌结合内肽酶[29],负责重塑细胞外基质结构。在癌症进展中它们的主要作用是消化细胞外基质和血管基底膜的成分,促进肿瘤生长、细胞迁移、肿瘤侵袭。在所有MMPs 中,IV 型胶原酶(MMP-2 和MMP-9)在癌症进展中起关键作用,因其可降解基底膜的主要成分IV 型胶原。与正常细胞相比,MMP-2 及MMP-9 在HNSCC 中均有高表达。MMP-9 mRNA 的过表达与口腔癌前病变发展为鳞癌相关。此外,据报道MMP-9 的高表达与HNSCC 患者的生存率有关,与肿瘤侵袭程度、淋巴转移、静脉肿瘤血栓形成及病理分期有关[30-34]。
整合素αvβ6 过表达可诱导MMP-9 的分泌增加,并且其分泌量与β6 的表达量呈正相关。实验证实MMP-9 过表达导致的IV 型胶原蛋白降解在舌癌侵袭转移中起重要作用[35]。应用蛋白酶抑制剂抑制MMP-9 的功能发现细胞的生长和迁徙也受到抑制[36]。另有学者发现在侵袭性差的口腔鳞癌细胞株中诱导表达β6 亚基,可通过诱导MMPs 增加,促进细胞对基底膜的侵袭,并在体内体外促进细胞增殖[12]。除此之外,MMP-9 能调节血管生长因子(vascular endothelial growth factor, VEGF)的释放,同时能裂解VEGF 的肝素结构域导致其溶解度增加,促进肿瘤早期新生血管生成。研究证实,在喉癌和舌癌等多种HNSCC 中均发现MMP-9 及VEGF 过表达,尤其在肿瘤侵袭前沿,并且其表达还与血管密度呈正相关。说明在HNSCC 中,MMP-9 通过破坏细胞外基质和促进肿瘤新生血管生成等机制促进其侵袭转移[35,37,38]。
肿瘤细胞可以通过整合素αvβ6-MAPK/ERK信号通路调控基质金属蛋白酶MMP-9 的分泌;整合素αvβ6 高表达使MAPK 活性增加,MMP-9 分泌增多,ECM 降解加速,促进肿瘤细胞的侵袭转移;通过基因突变技术删除β6 细胞内段ERK 结合位点,可以抑制肿瘤细胞的生长[39]。
3 整合素αvβ6 在HNSCC 的诊断与治疗中的应用
由于整合素αvβ6 在健康组织中表达水平难以检测,但已被证明在HNSCC 中高表达,并且它的高表达通常与肿瘤侵袭和转移以及患者中位生存时间的显著缩短有关[40]。因此整合素αvβ6 可以作为HNSCC 肿瘤成像和临床治疗的潜在靶点。它还可作为一种预后预测指标,用于跟踪肿瘤进展和监测治疗。
3.1 整合素αvβ6 在HNSCC 诊断中的应用
细胞外基质中含有RGD 序列的配体结合整合素αvβ6 后将其激活,从而参与细胞增殖、分化、凋亡、肿瘤细胞粘附和迁移等过程[12]。在成像中,利用整合素αvβ6 高亲和力RGD 多肽进行细胞成像,为区分整合素αvβ6 阳性的浸润性癌细胞提供了一种新的方法。
3.1.1 靶向RGD 多肽用于HNSCC 的定位与肿瘤转移的追踪
考虑到整合素αvβ6 在头颈部骨浸润性鳞状细胞癌中高表达,Nieberler 等[1]使用整合素αvβ6靶向RGD 多肽对头颈部骨浸润性鳞状细胞癌进行荧光细胞学成像,结果显示可以明显改善术中对切缘的控制。Hanadi 等[12]将18f-半乳糖-RGD 作为PET 显像剂用于检测HNSCC 肿瘤的试验显示肿瘤摄取高于背景,并且可以检测到大多数(10/12)原发肿瘤和部分(2/6)淋巴结转移。另有学者将标记的RGD 四聚体结合近红外发射量子点,以促进原位头颈部鳞癌小鼠模型中残余肿瘤组织的消除。近红外引导下的手术使无复发生存率提高了50%。Hausner 等[41]成功设计了一种重铅肽,模拟含RGD 序列多肽。该肽与整合素αvβ6 结合,可以帮助特异性识别高表达整合素αvβ6 的小鼠肿瘤。这些肽被成功地用于口腔鳞癌的手术、诊断或化疗中的成像及治疗,可帮助确定肿瘤区域。Roesch 等[42]设计了含有RGD 序列的多肽SFLAP3,其在人血清中表现出超过24h 的显著稳定性。体内外实验观察到SFLAP3 对多种高表达整合素αvβ6 的HNSCC 肿瘤细胞系具有较高的亲和力和特异性。将68ga-dota 标记的肽成功地作为放射示踪剂用于PET/CT 扫描,显示SFLAP3 在HNSCC 异种移植物和患者原发肿瘤病灶中有特异性积聚,从而发现组织学证实的头颈部鳞癌和相应的淋巴结转移。上述结果表明在HNSCC 中高表达的整合素αvβ6 对于其特异性成像及诊断具有较高应用价值。
3.1.2 靶向环非肽Tyr2 用于HNSCC 肿瘤的可视化
Quigley 等[43]将优化的整合素αvβ6 选择性环非肽Tyr2 在TRAP 螯合物核心上进行三聚化合成,然后用Ga-68 自动标记形成Ga-68 Trivehexin。该探针显示出对整合素αvβ6 特有的高亲和力,可从血清中快速清除。在人体PET 成像中,Ga-68-Trivehexin在HNSCC 的原发灶和转移灶中均显示出高且持续的摄取。除了肾脏和泌尿道中的排泄物,其他器官未见相关摄取。且排泄物在研究环境中不会影响肿瘤的可视化。这在肝脏和肺等高表达整合素αvβ6的癌的典型原发和转移器官中效果最为显著,因为受非特异性摄取的影响显著减小。与以往的靶向探针相比,Ga-68-Trivehexin 对HNSCC 的形态描述更加准确,并且在受放射影响的周围组织中摄取不会明显增加,对肿瘤的精准可视化程度更高。此探针还可以用于对放射治疗的早期反应的评估。因此Ga-68-Trivehexin 对于整合素αvβ6 表达升高的头颈部鳞状细胞癌的PET 成像具有很高的临床价值。
3.2 整合素αvβ6 在HNSCC 光热疗法(photothermic therapy, PTT)中的应用
HNSCC 每年在全世界有近70 万例新发病例和38 万例死亡病例,传统的治疗方法包括手术、化疗及放疗等综合治疗[44]。然而这些治疗治疗方法仍存在较多缺点。手术切除的局限性在于这种方法会切除至关重要功能性组织如部分舌头,这可能影响患者讲话和吞咽功能。放化疗对恶性肿瘤组织的特异性较差,容易产生耐药性和全身副作用。因此,需要开发新的治疗方法,使其可以消除癌细胞,同时不会对正常细胞造成损伤和副作用。
PTT 作为传统癌症治疗方法的替代或补充,其具有创伤小、并发症少、恢复快的优点,PTT 通过光热试剂在近红外光的照射下,不断吸收热量,使局部温度升高,选择性破坏异常细胞,从而达到治疗癌症的目的[45]。目前PTT 在临床上主要用于较表浅部位如皮肤病治疗。PTT 具有相对选择性,不毁损容貌和功能,且不良反应少或轻微,治疗头颈部显露表浅部位的恶性肿瘤有明显的有利条件。整合素αvβ6 在HNSCC 的发生、发展、转移和侵袭中起重要的调控作用。所以,对于HNSCC 的治疗来说,整合素αvβ6 是一个理想的药理学靶点。将光热剂装载于生物相容性更好的纳米颗粒中,并在上面连接靶向整合素αvβ6 的多肽,以HNSCC 中高表达的整合素αvβ6 作为光热治疗的靶点,可显著提高纳米材料的肿瘤靶向能力,更有利于肿瘤的消除。
方少斌等[21]通过实验证明,使用含有RGD 序列的拮抗剂抑制整合素αvβ6,可以抑制人口腔鳞癌细胞的迁移和生长,并抑制体内肿瘤的生长。这提示整合素αvβ6 可作为HNSCC 成像和治疗中的靶点。在PTT 中Legge 等[46]将磁性氧化铁纳米颗粒附上生物相容性二氧化硅涂层,并与靶向整合素αvβ6 的抗体结合,使纳米颗粒直接进入过表达整合素αvβ6的HNSCC 肿瘤细胞,利用磁性纳米颗粒的加热特性,将其暴露在交变磁场中,对整合素αvβ6 过表达的肿瘤细胞进行热消融。通过整合素αvβ6 抗体的靶向作用,磁性纳米粒子产生的热疗可以定位于肿瘤生长区域,具有显著降低副作用和最大限度地减少对健康组织损伤的潜力。在体外实验中,磁性纳米粒子连接抗整合素αvβ6 抗体后,仅在交变磁场中暴露10min,就导致85%的VB6 细胞死亡。相比之下,整合素αvβ6 阴性细胞暴露于相同环境时,细胞活力仅降低20%。这项体外研究表明,通过精心配对抗原、抗体和纳米颗粒,磁高热对高表达整合素αvβ6 的HNSCC 肿瘤细胞的杀伤潜力可以显著增强。这证明将用于细胞加热和破坏的磁热疗新兴领域与新开发的HNSCC 生物标志物整合素αvβ6 结合在一起,有望形成一种新的靶向治疗方法。
4 结局和展望
HNSCC 是一种包括不同解剖区域的异质性肿瘤,即使在多模式治疗之后[12],HNSCC 患者的5 年生存率仅为40%~50%[47]。为了改善晚期转移性疾病的治疗结果和总生存率,发现HNSCC 疾病进展的生物标志物以及进行分子靶向治疗都是必要且有重要意义的[48]。
整合素αvβ6 在HNSCC 中表达显著上调,且与患者生存期相关。大量的研究证明,整合素αvβ6 通过多种致癌信号通路促进HNSCC 肿瘤细胞的侵袭转移。整合素αvβ6 在HNSCC 发生和发展过程中的表达和重要作用为以整合素αvβ6 为靶点的肿瘤成像和治疗提供了可靠依据,整合素αvβ6 成为未来遗传学和临床研究的有前途的靶点,以及合适的治疗选择[49,50]。近年来开发了多种靶向整合素αvβ6 的PET 放射性药物。其中一些已经在人体中进行了测试,甚至已用于临床试验,因此强调了靶向整合素αvβ6 的成像在人类癌症中的临床潜力[51-54]。
综上所述,在HNSCC 中表达显著升高的整合素αvβ6 与肿瘤的侵袭转移及恶性进展密切相关,并与HNSCC 患者的预后相关,在预判HNSCC 的发展和恶化中具有一定的价值,可作为独立预后不良指标。且由于整合素αvβ6 在HNSCC 中高表达的独特性,利用其作为治疗靶点,将能选择性结合整合素αvβ6 的多肽与不同的抗肿瘤药物结合,提高抗癌药靶向性和生物利用度。由于其对靶点的准确识别性及非癌细胞不受影响性,能够极大地提高药效并削弱不良反应。将能选择性结合整合素αvβ6 的多肽与光热剂结合合成纳米探针,此探针兼具成像与治疗功能,具有肿瘤靶向、药物缓释、放射增敏、多药联合、无创定位等优势,有望增强药物治疗效果、减少药物的不良反应、抑制肿瘤耐药。同时,由于独特的肿瘤靶向、光热效应等物理特性,有望在今后为HNSCC 患者带来无创定位、基因治疗、光热治疗在内的新型诊断和治疗方式。

