酿酒酵母中高效积累β-胡萝卜素的代谢途径构建
王思懿, 张 悦, 王燕燕, 于 放
(大连工业大学 生物工程学院,辽宁 大连 116034)
β-胡萝卜素(C40H56)是由4个异戊二烯双键结构和2个β-紫罗酮环结构组成的含有40个碳原子的四萜类化合物,是自然界中最普遍存在也是最稳定的天然色素[1-2]。β-胡萝卜素是维生素A的重要来源,是目前较安全的补充维生素A的产品[3-4],具有抗氧化、抗炎、抗肿瘤、增强免疫、预防心血管疾病等多种生物功能[5-6],因其无毒、安全、有营养等特点可作为食品添加剂、营养强化剂和医药制剂等使用[7]。经济的快速发展使人类的生活水平不断提高,人们更加注重营养保健,对类胡萝卜素的需求显著增加,由于天然β-胡萝卜素生理活性丰富,在众多类胡萝卜素中所占市场份额比重很大,市场需求量很高[8]。相比于其他类胡萝卜素,人们对β-胡萝卜素更加青睐,尤其是天然β-胡萝卜素,目前天然的β-胡萝卜素在市场上一直都处于供不应求的状态,因此寻找一条绿色经济高效的天然β-胡萝卜素生产途径将会推动产业的发展。β-胡萝卜素不能在人体内合成,只能从食物中摄取[9]。根据来源不同,β-胡萝卜素分为天然提取、化学合成和微生物发酵。天然的β-胡萝卜素可通过从陆地高等植物(如胡萝卜、玉米、万寿菊等)、藻类(如杜氏盐藻[10]、螺旋藻等)以及微生物,如成团泛菌(Pantoeaagglomerans)、三孢布拉氏霉菌(Blakesleatrispora)、红酵母(Rhodotorulasp.)[11]、红法夫酵母(Xanthophyllomyces)等中获得[12]。化学合成分为以维生素A为原料或以β-紫罗兰酮为原料构造多聚烯链合成全反式β-胡萝卜素[13-14]。利用微生物发酵法生产天然β-胡萝卜素比植物、藻类效率更高,比化学合成法生物学功能更丰富,从品质、技术、资源和成本等因素考虑均优于其他方法[15]。随着代谢工程的快速发展,构建能够异源合成β-胡萝卜素的高产工程菌株已成为当前热点[16]。如Verwaal等[17]利用红法夫酵母的β-胡萝卜素合成途径相关酶基因,在酿酒酵母中构建出β-胡萝卜素产量为5.9 mg/g DCW的工程菌。Li 等[18]在酿酒酵母中通过对红法夫酵母β-胡萝卜素合成途径中相关酶基因相关密码子优化及过表达获得产量为0.39 mg/g DCW的工程菌。Xie等[19]由分散的装配策略构建可控β-胡萝卜素生物合成途径,通过控制途径的开关时间,在摇瓶培养中实现了7.41 mg/g DCW的β-胡萝卜素。王贝贝等[20]将来源于红法夫酵母的β-胡萝卜素合成途径相关酶基因导入酿酒酵母,获得能生产1.56 mg/g DCW的β-胡萝卜素工程菌BW02。酿酒酵母(Saccharomycescerevisiae)为安全的模式微生物,具有遗传背景清楚,生长周期短,发酵密度大,发酵条件成熟,生物安全性好等优良的特性[21]。此外,与酿酒酵母相关的基因操作手段和载体工具也比较丰富,常被作为一种埋想的宿主[22],酿酒酵母中存在内源的MVA途径,能够为萜类化合物的合成提供前体异戊二烯焦磷酸(IPP)和二甲基烯丙基焦磷酸(DMAPP)[23],因此在本研究中选择酿酒酵母进行β-胡萝卜素的异源生产[24]。为了能够获得具有较高β-胡萝卜素生产能力的酿酒酵母基因工程菌株,利用组成型表达载体pYES2-Kan上的三个不同位点分别插入了酿酒酵母来源的BTS1基因及红法夫酵母来源的CrtI基因、CrtYB基因,并转化至酿酒酵母MKP-o中,使其进行β-胡萝卜素的生产。如图1所示为在酿酒酵母中β-胡萝卜素的生物合成途径。本研究中质粒的应用相比于将β-胡萝卜素合成基因整合到酵母基因组上进行β-胡萝卜素的生产,可极大增加酵母细胞中转入基因的拷贝数,进而提高酿酒酵母的生产效率;而相比于常用的利用诱导型表达载体来实现β-胡萝卜素的合成,组成型启动子的应用无需对基因进行诱导表达,在酵母生长的过程中可连续实现β-胡萝卜素的积累。研究结果显示,该工程菌经多次传代后质粒依旧较为稳定。因此,该工程菌株的构建为后续高效、低成本合成β-胡萝卜素奠定了基础。
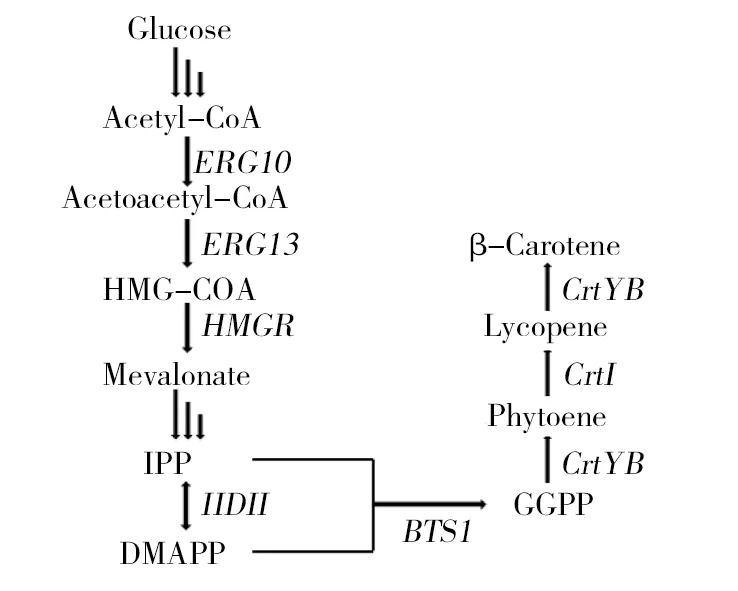
图1 酿酒酵母中β-胡萝卜素的合成途径[25]Fig.1 Synthetic pathway of β-carotene in Saccharomyces cerevisiae[25]
1 材料与方法
1.1 材料
1.1.1 菌株、质粒和引物 酿酒酵母菌株MKP-o、红法夫酵母菌株、质粒pYES2-Kan由实验室保存。克隆基因所用引物如表1所示。

表1 PCR所用引物Table 1 Primers for PCR
1.1.2 培养基 ①TD培养基: 土豆20%,无水葡萄糖2%;②LB培养基: 蛋白胨1%, 酵母浸粉0.5%, 氯化钠1%,氨苄青霉素100 mg/L;③YPD完全培养基:胰蛋白胨2%, 酵母浸粉1%,无水葡萄糖2%;④SD-URA筛选培养基: 酵母选择培养基0.67%(六缺,Ade-Ura-His-Lys-Trp-Leu),葡萄糖2%,Ade 0.004%,His 0.002%,Lys 0.003%,Trp 0.004%,Leu 0.006%(上述培养基各成份占比均为质量分数)。上述液体培养基加2% 的琼脂粉配制成对应固体培养基。
1.1.3 主要试剂与仪器设备 PrimeSTAR HS DNA聚合酶和RNA反转录酶(宝生物工程有限公司,大连);限制性内切酶SacI、BamH I、SalI(宝生物工程有限公司,大连);重组酶2×MultiF Seamless Assembly Mix(爱博泰克生物科技有限公司,武汉);氨苄青霉素(索莱宝科技有限公司,北京);β-胡萝卜素标准品(索莱宝科技有限公司,北京)。高通量组织研磨仪(HF-48,上海贺帆仪器有限公司);PCR扩增仪(BioSafer 9702,赛飞有限公司);台式高速离心机(H1650-W,湖南湘仪实验室仪器开发有限公司);紫外可见分光光度计(UV2400,上海舜宇恒平科学仪器有限公司);高速冷冻离心机(TGL-16,湖南湘仪实验室仪器开发有限公司);高效液相色谱(MD-2015 JASCO Corporation,日本分光株式会社)。
1.2 方法
1.2.1 克隆β-胡萝卜素合成途径基因 红法夫酵母(Xanthophyllomycesdendrorhous)在TD液体培养基中20 ℃,180 r/min振荡培养,10 000×g 离心收集菌体,加入与菌体等量酸洗玻璃珠,细胞经破碎机振荡破碎50 HZ 10 min,用Trizol法提取总RNA。酿酒酵母MKP-o在YPD液体培养基中28 ℃,180 r/min振荡培养后破碎细胞提取总RNA。将其反转录获得红法夫酵母与酿酒酵母cDNA模板。分别用TY:BTS1-F-SalI/TY:BTS1-R-SalI,TY:CrtYB-F-BamHI/TY:CrtYB-R-BamH I,TY:CrtI-F-SacI/TY:CrtI-R-SacI扩增获得BTS1、CrtYB、CrtI基因。以上基因序列均由华大基因测序验证。
1.2.2 表达载体构建 用SacI酶切pYES2-Kan质粒,切胶回收SacI切割后的线性表达载体pYES2-Kan和目的基因CrtI,用重组酶50 ℃,30 min将其连接得到重组质粒pYES2-Kan-CrtI。用BamH I酶切pYES2-Kan-CrtI质粒,切胶回收BamH I切割后的线性表达载体pYES2-Kan-CrtI和目的基因CrtYB,用重组酶50 ℃, 30 min连接得到重组质粒pYES2-Kan-CrtI-CrtYB。用SalI酶切pYES2-Kan-CrtI-CrtYB质粒,回收用SalI切割后的线性表达载体pYES2-Kan-CrtI-CrtYB和目的基因BTS1,用重组酶50 ℃,30 min将其连接得到重组质粒pYES2-Kan-CrtI-CrtYB-BTS1。
1.2.3 酵母转化方法 将菌液收集于50 mL离心管中4 ℃,5 000 r/min离心5 min。弃上清,加入10 mL超纯水吹打混匀4 ℃,5 000 r/min离心5 min。弃上清,加入5 mL Buffer A吹打混匀,冰上静置10 min,4 ℃,5 000 r/min离心5 min。弃上清,加入250 μL Buffer A (成分为1 mL醋酸锂,1 mL TE,8 mL超纯水)吹打混匀后吸取50 μL加入到2 mL离心管中,加入2 μL质粒、6 μL DMSO及300 μL Buffer B(成分为100 μL醋酸锂,100 μL TE,800 μL 50% PEG)快速混匀,于28 ℃培养箱放置30 min后,42 ℃水浴15 min,快速拿出于冰上静置10 min。4 000 r/min低速离心2 min,剩少量上清与菌体吹打混匀涂板,28 ℃培养箱倒置培养3 d。
1.2.4 产β-胡萝卜素酿酒酵母工程菌的构建 β-胡萝卜素重组质粒的构建是基于多片段同源重组的方法。将构建的重组质粒pYES2-Kan-CrtI-CrtYB-BTS1BTS1-F-SalI/TY:BTS1-R-SalI,TY:CrtYB-F-BamH I/TY:CrtYB-R-BamH I,TY:CrtI-F-SacI/TY:CrtI-R-SacI),筛选获得酿酒酵母基因工程菌TD。
1.2.5 摇瓶发酵方法 从SD-URA固体筛选培养基上挑取验证正确的阳性单克隆菌株,于相应的液体筛选培养基中制备发酵种子液(28 ℃,180 r/min,24 h)。转移至含50 mL YPD液体培养基的100 mL三角瓶中,28 ℃,180 r/min振荡培养3 d,按照5%(体积分数) 接种量取10 mL种子液接种到含200 mL YPD液体培养基的500 mL三角瓶中28 ℃,180 r/min振荡培养。根据不同发酵时间取样,检测OD600、生物量及β-胡萝卜素含量。
1.2.6 β-胡萝卜素产量的检测方法 称量2 mL EP管重,取0.5 mL培养的发酵液12 000 r/min离心3 min,弃上清,无菌水清洗后,烘干至恒重,称量EP管和菌体总重量后用无菌水溶解12 000 r/min离心3 min,弃上清并用1 mL 3 mol/L HCl重悬细胞,放入沸水浴破胞3 min后,立即放到冰上3 min,12 000 r/min离心3 min弃上清。无菌水洗涤2次后加入1 mL丙酮,超声10 min至菌体变为白色后12 000 r/min离心5 min,取待测样品(提取2~3次合并样品)。待测样品过0.22 μm有机膜后用高效液相色谱分析β-胡萝卜素产量。检测条件:MD-2015检测器,Unitary C18色谱柱(4.6 mm×250 mm,5 μm),流动相为V乙腈∶V异丙醇=1∶1,流速1.0 mL/min,柱温30 ℃,检测波长450 nm。每个待测样品进行3个生物学重复试验,β-胡萝卜素标准品用于定量分析。利用峰面积进行β-胡萝卜素含量的计算。
1.2.7 工程菌株遗传稳定性检测 将单菌落挑到5 mL YPD培养基中,每12 h传代一次,每次转接50 μL进行传代培养,共转接20次,将第5代、第10代、第15代、第20代培养物稀释10-3倍后分别涂SD-URA平板和YPD平板,28 ℃倒置培养3 d。通过观察菌株颜色平及板计数来考察该工程菌株的质粒遗传稳定性。
2 结果与分析
2.1 β-胡萝卜素合成途径基因的克隆
提取酿酒酵母及红法夫酵母总RNA,将其反转录后以酿酒酵母及红法夫酵母的cDNA为模板克隆BTS1、CrtYB、CrtI基因。如图2所示:a为克隆BTS1基因电泳图,泳道1~6成功克隆出牻牛儿基牻牛儿基焦磷酸合成酶基因(BTS1)1 008 bp;b为克隆CrtI基因电泳图,泳道1成功克隆出八氢番茄红素脱氢酶基因(CrtI)1 749 bp;c为克隆CrtYB基因电泳图,泳道1~4成功克隆出具有八氢番茄红素合成酶和番茄红素环化酶的双功能酶基因(CrtYB)2 022 bp。

图2 β-胡萝卜素合成相关基因电泳图Fig.2 Electrophoretic diagram of genes related to β-carotene synthesis 图a中M为Marker,1~6泳道为BTS1基因1 008 bp;图b中M为Marker,1泳道为CrtI基因1 749 bp;图c中M为Marker,1~4泳道为CrtYB基因2 022 bpM in figure a is Marker, and 1 008 bp of BTS1 gene is in lane 1-6; M in figure b is Marker, 1 749 bp of CrtI gene is in lane 1; M in figure c is Marker, and 2 022 bp of CrtYB gene is in lane 1-4
2.2 生产β-胡萝卜素的底盘酿酒酵母细胞构建
酿酒酵母MKP-o菌株含有形成萜类化合物的MVA途径,其萜类生物合成途径中存在合成萜类的通用前体GGPP。酿酒酵母含有一种GGPP合成酶,由BTS1编码,能够将FPP转化为GGPP。编码GGPS的BTS1基因是酿酒酵母合成萜类产物的一个关键酶基因,在工程菌中一般过表达BTS1基因能提高萜类合成分支的代谢通量。为进一步提高BTS1基因,选择首先过表达来源于酿酒酵母的香叶基香叶基焦磷酸合成酶基因(BTS1),而后同时引入红法夫酵母β-胡萝卜素生物合成途径所必需的八氢番茄红素脱氢酶基因(CrtI),以及同时具有八氢番茄红素合成酶和番茄红素环化酶的双功能酶基因(CrtYB),进行β-胡萝卜素的异源生产。
将BTS1、CrtI、CrtYB基因分别插入组成型载体pYES2-Kan中,由PGK1、CCW12、TDH3启动子分别驱动表达,得到合成β-胡萝卜素的重组质粒pYES2-Kan-BTS1-CrtI-CrtYB。将重组质粒导入酿酒酵母MKP-o获得工程菌TD,酿酒酵母工程菌株经破碎后,PCR验证出该菌株含有BTS1、CrtI、CrtYB基因,证实重组质粒导入成功(图3)。如图3所示,泳道1成功扩增出条带大小1 008 bp的BTS1;泳道2成功克隆出条带大小1 749 bp的CrtI;泳道3成功扩增出条带大小2 022 bp的CrtYB。如图4所示,酿酒酵母MKP-o本身为白色菌落(图4a),而工程菌株TD菌体颜色相比于原始菌株显现出明亮的橘红色,说明能够生产β-胡萝卜素(图4b、c)。
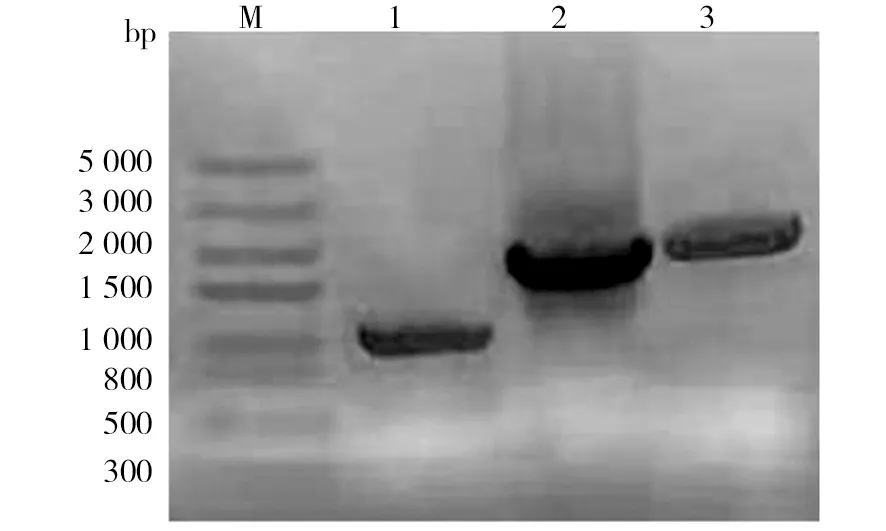
图3 工程酵母菌落PCR电泳图Fig.3 PCR electrophoresis of engineered yeast coloniesM:Marker;1:BTS1基因1 008 bp;2:CrtI基因1 749 bp;3:CrtYB基因2 022 bpM:The Marker;1:BTS1 gene 1 008 bp;2:CrtI gene 1 749 bp;3:CrtYB gene 2 022 bp

图4 酵母菌株培养物颜色比较Fig.4 Comparison of the color of yeast strain cultures
2.3 工程菌TD摇瓶发酵生长曲线测定
酿酒酵母工程菌TD摇瓶生长曲线如图5所示。菌株0~12 h处于迟滞期;12~48 h处于对数生长期,进入大量繁殖阶段,繁殖速度旺盛;48~180 h处于平稳期,是次级代谢产物合成的有利时期,β-胡萝卜素作为一种异源合成的次级代谢产物主要在细胞生长的后期积累。因此,菌体越快达到生长后期,β-胡萝卜素的合成越早,积累也就越多。该工程菌株TD摇瓶发酵180 h,OD600达到了11.97,且该工程菌株在第二天(约48 h)左右即趋于稳定,达到最大生物量,OD600接近12。

图5 酿酒酵母(TD菌株)生长曲线Fig.5 Growth curve of S. cerevisiae (TD strain)
由此可见,本研究构建的酿酒酵母工程菌株生长较快,两天左右即可进入平稳期并能够积累较多的目标产物β-胡萝卜素。
2.4 工程菌株β-胡萝卜素的定量分析
利用高效液相色谱法对工程菌株β-胡萝卜素进行定量分析,经高效液相色谱检测,如图6所示,在初始葡萄糖添加量为20 g/L的发酵条件下,将工程菌株TD发酵72 h,能生产14.53 mg/g DCW的β-胡萝卜素。利用组成型表达载体进行β-胡萝卜素生产,不但能够节省生产成本,不用额外向发酵液中添加诱导剂对基因的表达去进行诱导,而且能够缩短发酵周期,节约生产时间。

图6 TD菌株β-胡萝卜素产量Fig.6 β-carotene production of TD strain
2.5 工程菌株遗传稳定性分析
将基因整合到基因组上虽然遗传稳定,不易突变,但基因的拷贝数少,对基因功能的应用有一定的影响,而转入质粒可有效解决转入的外源基因拷贝数过低的问题。在利用质粒进行β-胡萝卜素异源生产的研究中,前期研究人员多采用诱导型启动子构建质粒,转入酵母后,通过诱导剂驱动代谢途径酶基因的表达,实现目的产物的生产。但诱导型表达载体的弊端是细胞生长和产物合成分两个阶段进行,周期过长,尤其是后期酵母停止生长后,β-胡萝卜素合成的前体化合物提供不充分,会对β-胡萝卜素的合成效率带来影响。因此,若能通过组成型启动子驱动代谢途径酶基因的表达,并构建相应表达载体,有望解决拷贝数不足以及使用诱导型启动子所遇到的问题。由于生产过程中采用的生产培养基营养丰富,因此质粒在如YPD等营养丰富的培养基中能否保持稳定,是该方法能否进一步应用生产β-胡萝卜素的前提和基础。
为检测质粒的稳定性,在YPD液体培养基中将工程菌株TD进行了传代培养,取第20代培养物涂板,以验证β-胡萝卜素生产菌株的稳定性。如图7所示,20次传代后的菌株呈现橘红色,具备合成β-胡萝卜素的能力。浙江大学谢文平[26]将酿酒酵母工程菌在YPD培养基中传至20代,在第20代的平板上,大约出现了1/800的白色菌落突变,其余菌落均能合成β-胡萝卜素。与其研究结果一致,本研究构建的工程菌TD遗传稳定性较好,具备连续工业生产的潜力。

图7 TD菌株第20次传代平皿培养物 Fig.7 TD strain 20th generation plate culture
将工程菌传至20代,记录营养缺陷型培养基和完全培养基筛选平板中的菌落数,进一步计算出质粒保有率,如图8所示,第20代工程菌株质粒稳定性达到95%以上。夏诏杰[27]构建的酿酒酵母基因工程菌在无选择性压力的YPD培养基中培养40 h后(约3代)质粒保有率最高可达到80%,培养130 h后(约10代)质粒几乎完全丢失,而在具有选择性压力的SSM培养基中培养,重组酵母的质粒稳定性在整个培养过程中保持90%以上。Ro等[28]构建的利用pESC-Leu2d表达紫穗槐二烯合酶 (ADS)的工程酵母菌株在无选择性压力的YPG培养基中培养144 h(约12代)的质粒稳定性达到84%。与上述研究相比,本研究构建的工程菌遗传稳定性更高。

图8 TD菌株质粒传代稳定性Fig.8 Stability of plasmid passage of TD strain
通常情况下,工业用菌需要验证质粒遗传的稳定性,质粒保有率不低于90%,经过10代以上稳定筛选之后才用于小试、中试和工业生产的。如陆文渊等[29]构建的基因工程菌在无抗生素压力下连续传代20代,质粒保有率为100%,显示此工程菌可满足扩大生产的需要。郝丹等[30]研究表明在无抗生素选择压力下,工程菌连续传代20代保持100%的分裂稳定性,可以满足扩大生产的需要。康小燕等[31]研究发现质粒pACYC184虽表现出一定的分离不稳定性,但仍然能够在无抗生素选择压力条件下每4 h传一代,培养200 h内保持质粒的基本稳定遗传,稳定性已足够满足工业生产的需要。李晓丹等[32]构建的重组CCT酶基因的工程菌在无抗生素选择压力的培养条件下,传代20代后开始出现质粒丢失的细胞,连续传代50次后仍保留重组质粒,保有率为90%,表明此工程菌适合于工业化生产。本研究构建的酿酒酵母工程菌每12 h传一代,共计培养240 h连续传代20代,第10代酵母菌株质粒保有率为100%,第20代酵母菌株质粒保有率也能达到95%以上,具备大规模生产的潜力。证实该菌株能够稳定高效生产β-胡萝卜素,有望将其应用于工业化对β-胡萝卜素进行大规模生产。
3 讨 论
本研究利用酿酒酵母表达真核生物红法夫酵母来源的β-胡萝卜素合成基因,将BTS1、CrtI、CrtYB基因分别插入组成型载体pYES2-Kan中,由PGK1、CCW12、TDH3组成型启动子分别驱动表达,得到合成β-胡萝卜素的组成型重组质粒pYES2-Kan-BTS1-CrtI-CrtYB,从而在酿酒酵母中构建β-胡萝卜素的生物合成途径。酿酒酵母基因工程菌株TD摇瓶发酵72 h,能生产14.53 mg/g DCW的β-胡萝卜素。而刘洁等[33]克隆来自锁掷酵母的类胡萝卜素相关酶基因整合到巴斯德毕赤酵母基因组中能生产3.7 mg/g DCW的β-胡萝卜素。相比之下,本研究通过重组质粒的高拷贝提高基因表达,进而提高酵母的生产效率具有优越性。王瑞钊等[34]在酿酒酵母δ位点整合红法夫酵母来源的β-胡萝卜素合成基因(CrtE、CrtI、CrtYB)并通过增加前体供应得到产β-胡萝卜素的酿酒酵母工程菌,利用40 g/L葡萄糖作为碳源,将其摇瓶发酵120 h后能生产21.6 mg/g DCW的β-胡萝卜素;Zhao等[35]向酿酒酵母基因组中引入红法夫酵母β-胡萝卜素合成基因构建了一株组成型生产β-胡萝卜素的酿酒酵母工程菌株,摇瓶发酵72 h生产出8.98 mg/g DCW的β-胡萝卜素;Bu等[36]构建的酿酒酵母基因工程菌株摇瓶发酵72 h能生产11.4 mg/g DCW的β-胡萝卜素。本研究构建的酿酒酵母工程菌TD仅利用20 g/L的葡萄糖作为碳源,摇瓶发酵72 h即可得到14.53 mg/g DCW的β-胡萝卜素。工程菌TD的优势在于用更短的发酵时间以及更少量的碳源即可获得较高的β-胡萝卜素含量,为后续通过培养条件的优化进而提高目的产物含量创造了提升空间。
综上所述,在酿酒酵母中利用组成型重组质粒pYES2-Kan-BTS1-CrtI-CrtYB进行β-胡萝卜素的异源生产具有独特优势,不仅能够节省工业生产成本,还能够缩短发酵周期。该组成型重组质粒遗传稳定,不易丢失,与整合基因组相比,基因的拷贝数更多,与诱导型载体相比,无需菌体生长与产物合成分段进行,且无需额外诱导即可稳定高效生产β-胡萝卜素。该工程菌在2 d左右即可达到较高的菌体浓度,并能够完成目的产物的合成从而达到较高的β-胡萝卜素产量。本研究构建的菌株为后续通过发酵条件的优化、上游代谢通路编辑等手段,高效、低成本生产β-胡萝卜素提供参考。

