耐高温沼渣降解菌的筛选及复合菌剂降解效果研究
顾 欣, 黄凯悦, 田彦梅, 马群飞, 杨 娜
(宁夏大学 农学院,宁夏 银川 750021)
沼气发酵是秸秆和畜禽粪污资源化利用的主要方式之一,能有效处理有机废弃物,减少污染源,保护环境,具有经济效益、环境效益和能源效益[1-2]。截止2020年,我国大中小型沼气工程已建成13万余处[3],每年产生多达1.3 亿t的沼渣和沼液[4]。沼渣通常含有大量未腐熟的有机质和含氮化合物,具有较高的化学需氧量,对植物具有高毒性,易造成烧苗或其他植物病害[5]。因此,必须对沼渣进行降毒处理才能将环境风险降至最低[5]。基于沼渣中丰富的有机碳和植物养分,利用微生物作用进行好氧堆肥,将其转化为优质肥料是当前主要的资源化利用方式[6]。沼渣成分主要有纤维素、木质素、果胶质等非矿物质和矿物质等,其中纤维素含量占64%[7]。这些物质在好氧堆肥过程中会释放大量热量,使高温期的堆温超过60 ℃。此阶段正是纤维素和木质素等大分子物质降解的重要阶段[8]。因此,分离筛选并应用耐高温的纤维降解菌,将促进好氧堆肥的生物进程,对沼渣肥料化生产具有重要意义。环境中不同微生物之间的关系较为复杂。一种微生物可以利用其它微生物的代谢产物作为底物进行生长、繁殖,或者不同微生物分别利用环境中的不同物质[9-10]。因此,两种或两种以上相容的微生物能实现很多单一菌株难以实现的功能[11]。这说明微生物以群体形式存在能够为个体生存提供更好的保障,有利于群体对环境变化的适应[12]。为了促进好氧堆肥发酵,缩短生产时间,针对纤维素和木质素降解功能构建复合菌剂成为研究热点[13]。用于菌剂复配的有多种真菌、细菌和放线菌,其中真菌资源开发较早,研究较多[14]。近年来,具有纤维降解功能的细菌越来越受到重视。傅冰等[15]从白蚁肠道中分离出3株纤维素降解细菌,经复配试验明确了蜡样芽胞杆菌(Bacilluscereus)和链球菌(Streptococcussp.)的组合产酶能力高于单一菌株或其他组合,纤维素酶活性达3 670 U/L。单德鑫等[16]从农村自然堆肥还田土中筛选出耐15 ℃低温的纤维素降解细菌。何宙阳等[17]以秸秆和猪粪为堆肥原料,以米黑根毛霉(Rhizomucormiehei)NJAU-F4-5、芽胞杆菌NJAU-N20和芽胞杆菌NJAU-N30制备复合菌剂,发现添加复合菌剂的堆体升温速率最快,高温期温度最高,后熟期降温更快且物料腐熟度最好,表明接种复合菌剂能有效驱动堆肥发酵进程。以上纤维降解菌均具有较好的促发酵作用,但是并未对菌株的耐高温性能进行探讨。考虑到堆肥物料的成分差异,有必要针对沼渣开展耐高温纤维降解菌的筛选和复配进行研究。本研究以纤维素酶活性为核心指标,分离筛选耐高温的纤维降解细菌,构建复合菌剂并通过场地试验进一步探明复合菌剂对沼渣堆肥物理、化学和生物学性质的影响,重点测定不同发酵阶段物料的滤纸酶活性(Filter paper activity,FPA)、漆酶活性(Laccase activity,LAA)、木质素过氧化物酶活性(Lignin peroxidase activity,LPA)和锰过氧化物酶活性(Manganese peroxidase activity,MPA),以评价该复合菌剂对沼渣堆肥的促发酵效果,为沼渣快速肥料化提供菌种支撑和参考。
1 材料与方法
1.1 材料
1.1.1 样品来源 从宁夏中卫市采集自然堆肥样品4份、稻秸腐烂物样品3份和新鲜牛羊粪便样品5份。
1.1.2 培养基(g/L) ①LB培养基用于纤维素降解菌株的富集培养;②牛肉膏蛋白胨培养基用于纤维素降解菌的分离和菌株培养;③羧甲基纤维素钠(CMC-Na)培养基:羧甲基纤维素钠20.0,Na2HPO42.5,KH2PO41.5,蛋白胨2.5,酵母浸膏粉0.5,琼脂20,去离子水定容至1 L,pH调至7.0[19],用于高效纤维素降解菌的筛选;④发酵培养基:麸皮50.0,蛋白胨3.0,NaCl 5.0,(NH4)2SO43.0,KH2PO41.0,MgSO4·7H2O 0.3,去离子水定容至1 L,pH调至7.0,用于测定纤维素和木质素降解酶活性;⑤滤纸条崩解培养基: (NH4)2SO43.0,KH2PO41.0,Mg SO4·7H2O 0.4,酵母浸膏粉0.1,去离子水定容至1 L,调pH 7.0[20],用于滤纸条崩解试验。以上培养基均1×105Pa灭菌30 min。
1.1.3 堆肥材料与场地 堆肥试验地点位于宁夏中卫市镇罗镇,有遮雨设施。发酵物料(新鲜沼渣,由宁夏阜康生物科技股份有限公司提供)pH值7.21,有机质含量811.44 g/kg,全氮含量17.93 g/kg,全磷含量21.71 g/kg,全钾含量15.97 g/kg,含水率66.25%。
1.1.4 主要试剂与仪器设备 ①HAc-NaAc 缓冲液(pH 3.8):0.2 mol/L的NaAc 1.2 mL与0.2 mol/L的HAc 8.8 mL混匀;②1 mmol/L ABTS溶液:称取0.514 6 g ABTS溶于1 L HAc-NaAc 缓冲液(pH 3.8);③10 mmol/L藜芦醇溶液:称取0.168 1 g藜芦醇溶解至1 L去离子水中;④酒石酸缓冲液(50 mmol/L,pH 4.5):将50 mmol/L酒石酸溶液17 mL与483 mL酒石酸钠溶液混合均匀;⑤HAc-NaAc缓冲液(pH 4.8):0.2 mol/L的NaAc 5.9 mL与0.2 mol/L的HAc 4.1 mL混匀。高压蒸汽灭菌锅(LDZX-75KBS,上海申安);紫外分光光度计(UV754,上海奥析);超净工作台(SW-CJ-1FD,苏净安泰);电热恒温培养箱(SPX-250-Z,上海一恒);恒温气浴振荡箱(ZD-85,上海予卓);电热恒温鼓风干燥箱(101-1S,力辰科技);消煮炉(KXL-1010,常州诺基);火焰光度计(6400A,上海精科);可见光分光光度计(752N,中科瑞捷)。
1.2 方法
1.2.1 富集培养与菌种的分离筛选 ①富集培养与细菌分离:将10.0 g样品与90 mL无菌水震荡30 min混匀。取1 mL悬液接入LB液体培养基,60 ℃、180 r/min富集培养24 h。采用稀释平板法对富集培养后的悬液进行细菌分离,60 ℃培养48 h,挑取形态具有差异的菌落转接于新的牛肉膏蛋白胨平板上,经划线法纯化,4 ℃斜面保存。②初筛:将菌落点接于CMC-Na平板,60 ℃倒置培养24 h,滴加刚果红染液,观察有无水解圈,用游标卡尺测量水解圈直径(D,mm)与菌落直径(d,mm),计算D/d比值。根据比值大小初步确定分离菌株的纤维素酶活性,以D/d值较大者进入复筛。③复筛:采用滤纸条崩解试验,将初筛的菌株分别用无菌水制备活菌数为6.9×108cfu/mL的菌悬液,将菌株分别以10%(体积分数,下同)接种量接种于滤纸条崩解培养基,60 ℃、180 r/min振荡培养3 d,以不接菌的培养基为对照,观察滤纸条的崩解情况。用无菌水制备活菌数为6.9×108cfu/mL的菌悬液,将菌株分别以10%接种量接种于液体发酵培养基,60 ℃、180 r/min培养24 h,5 000 r/min离心10 min,取上清液检测纤维素和木质素降解酶活性。以滤纸条崩解程度较严重、酶活性较高的菌株为目标菌株。
1.2.2 菌株的分类鉴定 目标菌株经活化,转接于牛肉膏蛋白胨平板28 ℃培养12 h,观察菌落的生长状况和形态特征。依次开展革兰染色试验、运动性试验、明胶水解试验、甲基红试验、糖醇发酵试验和溶血试验,依据《常见细菌系统鉴定手册》进行细菌生理生化特性鉴定[21]。提取目标菌株DNA,对其16S rDNA基因进行克隆、电泳和回收,委托南京奥维森基因科技有限公司完成测序。测序结果在NCBI数据库是进行BLAST,对菌株进行分子鉴定,同时在库中选取相近种属的基因序列,使用MegaX分析软件构建系统进化树,确定菌株的分类地位。
1.2.3 菌剂的构建 ①拮抗试验:在牛肉膏蛋白胨平板上对目标菌株进行交叉划线培养,菌株之间生长无影响说明两菌株可以进行复配。②菌株配比试验:按1.2.1③制备菌悬液,将W44和X51菌悬液分别以体积比1∶0、0∶1、1∶1、1∶2和2∶1混合制备菌剂,按10%接种量接种于液体发酵培养基,60 ℃、180 r/min培养24 h,5 000 r/min离心10 min,取上清液检测发酵液中纤维素和木质素降解酶活性,以酶活性最高的处理为最优菌剂配方。
1.2.4 堆肥发酵试验 按1.2.1③制备菌悬液,将W44和X51菌悬液以体积比1∶1、1∶2、2∶1混匀制备菌剂,分别添加在400 kg新鲜沼渣中,充分搅拌后,制成1.5 m高的圆锥形发酵堆,分别为T1、T2、T3处理,以不加菌剂为对照(CK)。当堆温达到60 ℃时进行人工翻堆。样品采集时,从堆体上、中、下部距堆体表面10 cm处分别采集约100 g物料,混合均匀作为1个样品,置于无菌密封袋中,迅速带回实验室进行检测。堆制2 h后进行第1次采样,作为0 d样品。以后3 d测1次堆温,采样检测pH值和全盐含量。分别于堆肥的潜育期(Incubation period,IP,第1天)、中温期(Medium temperature period,MP,第3天)、高温期(High temperature period,HP,第9天)、腐熟期(Rotten period,RP,第27天)各取1次样,检测物料的有机质、全氮、全磷、全钾含量、纤维素和木质素降解酶活性和腐熟度。
1.2.5 检测方法 革兰染色试验、运动性试验、明胶水解试验、甲基红试验、糖醇发酵试验和溶血试验,方法参照文献[18]。滤纸酶活性(Filter paper activity,FPA)采用3,5-二硝基水杨酸法[18];漆酶活性(Laocase activity,LAA)采用ABTS法,一个酶活力单位(U)定义为每分钟氧化1 μmol ABTS所需的酶量;木质素过氧化物酶活性(Lignin peroxidase activity,LPA)采用藜芦醇氧化法,一个酶活力单位(U)定义为每分钟氧化藜芦醇产生1 μmol藜芦醛所需的酶量;锰过氧化物酶活性(Manganese peroxidase activity,MPA)采用锰离子氧化法,一个酶活力单位(U)定义为每分钟氧化Mn2+产生1 μmol Mn3+所需的酶量[22]。温度检测:每天15:00时使用电子温度计对堆体中部同一高度(50 cm)随机测量3个点,取平均温度作为堆体的实际温度;pH和全盐检测:采用105 ℃烘干法测定肥料的含水量,每个样品设置3次重复,新鲜样品和去离子水以1∶10(m/V)混合,置于水平摇床振荡2 h,静置30 min过滤后用pH计和电导仪测定,每个样品进行3次重复;全氮检测采用H2SO4-H2O2消煮半微量凯氏定氮法;有机质检测采用灼烧法;全磷检测采用H2SO4-H2O2消煮钒钼酸铵比色法;全钾检测采用H2SO4-H2O2火焰光度法[23];腐熟度检测采用种子发芽指数(Germination index,GI)测定法[24],用小油菜种子做发芽试验。GI(%)=((样品发芽率×样品根长)/(对照发芽率×对照根长))×100%。
1.2.6 数据分析 数据制表与作图采用Excel 2019和Origin 2018,统计分析采用SPSS 22.0(P<0.05,n=3)。
2 结果与分析
2.1 菌株的分离筛选
2.1.1 菌株初筛 分离纯化细菌38株,而在CMC-Na培养基上有透明圈,即具有纤维素降解能力的菌株13株,其中菌株W44、X51、Y2、Td1、T52的D/d值较高(表1)。菌株X51的菌落直径具有显著性且最大,说明生长迅速;菌株W44的D/d最高,为2.79,表明该菌株纤维素降解能力高于其他菌株。
2.1.2 菌株复筛 初筛获得的5株菌株对滤纸的降解情况有差异。菌株W44和X51使滤纸崩解成为糊状,菌株T52和Y2使滤纸结构严重变形且不完整,菌株Td1仅使滤纸发生膨胀并弯曲。因此,菌株W44和X51降解纤维能力较强,作为目标菌株。
2.1.3 菌株酶活性比较 将初筛获得的5株细菌进行复筛,酶活性测定结果如表2所示。结果表明菌株W44的FPA最高,为34 812.69 U/L,只与菌株Td1差异显著,与其他3株细菌差异不显著,菌株X51的FPA也很高。在LAA中,菌株Y2较其他4株菌有显著性差异;在LPA中,菌株W44、T52和X51没有显著性差异,其中菌株X51的酶活性最高,为191.76 U/L;在MPA中,菌株W44有显著性且酶活性最高。其中菌株W44的FPA和MPA在5株菌中既有显著性差异且酶活性较高,其他4株菌中T52和X51的木质素酶活都较好,但是菌株T52的FPA没有菌株X51的好。综合来看,菌株W44和X51的总体酶活性最好。
2.2 菌株鉴定
2.2.1 菌株形态学鉴定 菌株W44的菌落近圆形,边缘不规则,质地软,稍有光泽,呈白色,表面粗糙,培养基颜色无变化(图1A)。菌体呈杆状,大小为(1.0~1.2) μm×(3.0~5.0) μm,革兰染色为阳性(图1B),产芽胞。菌株X51的菌落为圆形,边缘规则,呈白色,扁平,表面粗糙,培养基颜色无变化(图1C)。革兰染色为阳性(图1D),产芽胞。根据形态学特性初步鉴定菌株W44和X51均为芽胞杆菌属(Bacillus)细菌。

图1 菌株W44和X51的菌落形态和革兰染色Fig.1 Colony morphology and gram staining of strain W44 and X51A:W44的菌落形态;B:W44菌体的革兰染色;C:X51的菌落形态;D:X51菌体的革兰染色A: colony morphology of W44; B: gram staining of W44; C: colony morphology of X51; D: gram staining of X51
2.2.2 菌株生理生化特性 菌株W44和X51的生理生化检测结果见表3。
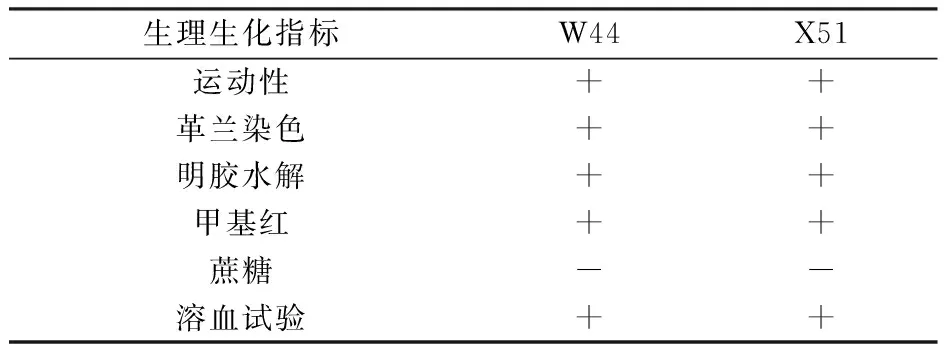
表3 菌株的生理生化特性Table 3 Physiological and biochemical characteristics of strains
2.2.3 菌株分子学鉴定 将菌株W44和X51的基因测序结果登入NCBI,通过BLAST与库中其他细菌的基因序列进行比对,构建系统发育树(图2)。菌株W44和X51分别与芽胞杆菌CLY07(MT775468)和MCCC1A00365(NR157735)的序列相似性达99%和98%。结合形态学和生理生化特征,鉴定菌株W44为蜡样芽胞杆菌(Bacilluscereus),X51为解蛋白芽胞杆菌(Bacillusproteolyticus)。基因编号分别为OM371110和OM371062。

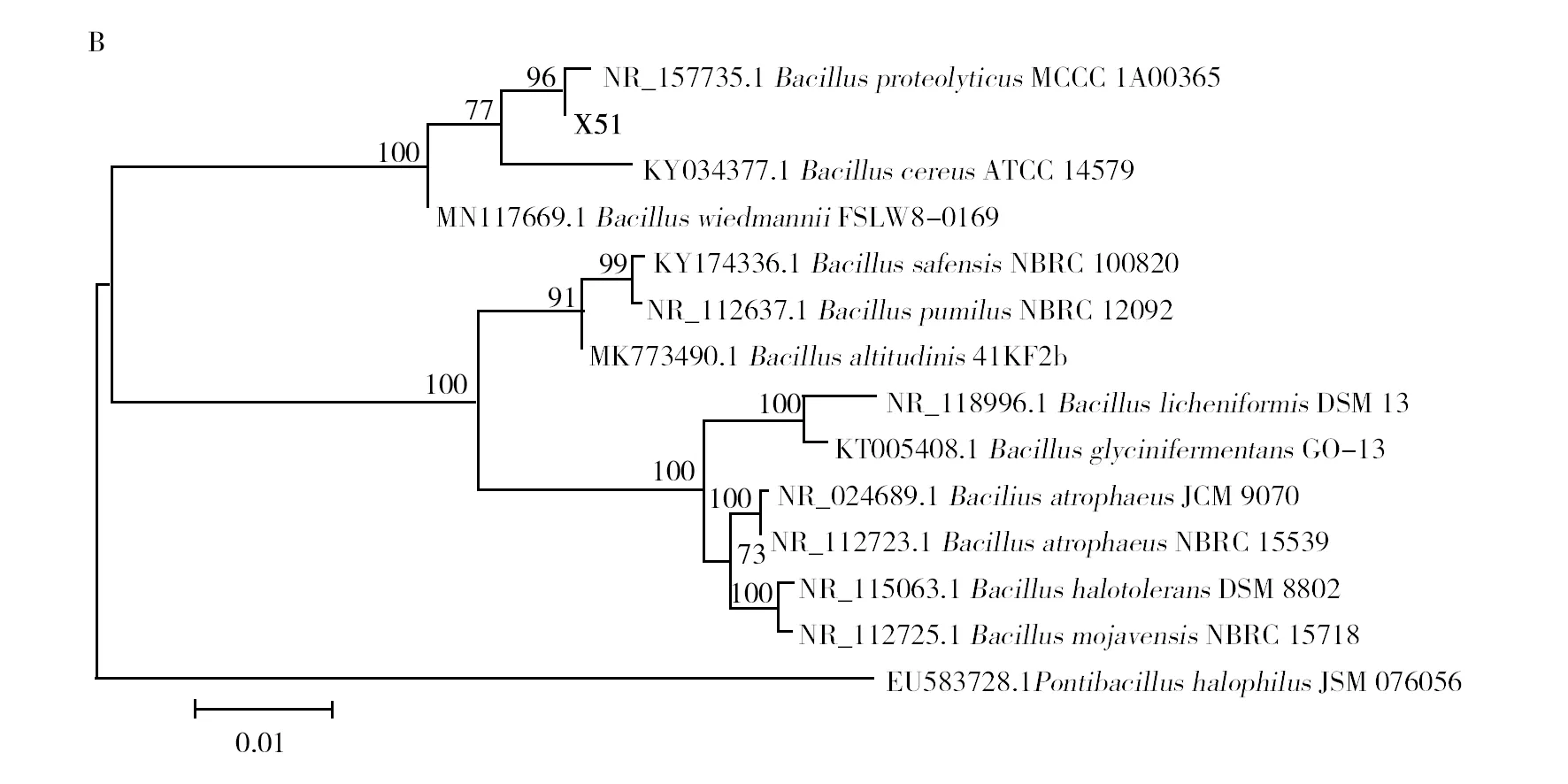
图2 菌株W44(A)和X51(B)的系统发育树Fig.2 Phylogenetic tree of strain W44(A) and X51(B)
2.3 菌剂的复配
2.3.1 拮抗试验 划线培养结果显示,菌株W44和X51划线生长情况良好,交叉处无溶菌现象,说明二者间无拮抗作用,可进行复配。
2.3.2 菌株的复配 菌株W44和X51不同配比的纤维素和木质素降解酶活性不同(表4)。两个菌株复配处理的FPA均显著高于单菌处理,且三个复配处理间无显著差异,菌株W44/X51(1∶2)的FPA最高,为47 725.17 U/L,较菌株W44和X51的单菌酶活性分别增加37.10%和39.71%。不同处理LAA差异较大,菌株W44/X51(1∶2)显著高于其他处理,为266.97 U/L,比单株菌LAA高近一倍。三个复配处理的LPA均显著高于单株菌,且三者间无显著差异,其中菌株W44/X51(1∶2)为675.62 U/L,较菌株W44和X51的单菌处理分别增加371.24%和252.33%。在MPA指标上,菌株W44/X51(1∶2)和(2∶1)为586.71 U/L和576.52 U/L,比单株菌高。因此,菌株W44/X51(1∶2)组合表现的酶活性最高,菌株W44/X51(2∶1)稍逊,菌株W44/X51(1∶1)次之。

表4 纤维素降解酶和木质素降解酶活性(U/L)Table 4 Degradation enzyme activity of cellulose and lignin(U/L)
2.4 堆肥发酵试验
2.4.1 复合菌剂对沼渣堆肥温度、pH值和全盐含量的影响 沼渣堆肥温度整体变化趋势均为先快速上升,然后保持一定水平,随后逐渐下降至环境温度。各处理对堆温的影响具有差异(图3A)。堆肥时间为夏季,环境气温32.3 ℃,堆肥第0天,CK、T1、T2和T3的堆温分别为32.7、33.6、33.4和32.9 ℃。堆肥第6天,T1、T2和T3处理均达到50 ℃以上,而CK只有47.8 ℃,说明添加菌剂处理的堆肥升温快,先到达HP。到第15天,各处理的堆温达到最高,T2的最高温度为65.7 ℃,比同时期的CK高10.42%。至第30天堆温趋于稳定,接近环境温度。其中,加菌剂的处理比对照处理先进入HP,最高堆温比对照处理高,且比对照处理先进入降温期。沼渣堆肥的pH值呈现先上升后降低的规律(图3B)。初始物料pH值为7.21。随着堆肥进程,CK、T1、T2和T3的pH值随之增加,最高值分别为8.07、8.16、7.97、7.67,其中T1高于CK,T2和T3低于CK,表明不同菌剂配施对堆肥物料pH值的影响具有差异。至堆肥结束,物料pH值在7.37~7.52之间。由图3C可知,物料的全盐质量分数随堆肥进程呈现波动,最终升高的变化趋势。堆肥初期的全盐质量分数为2.17~2.22 g/kg。随着堆温升高,该指标随之增加。至HP时,CK、T1、T2和T3的全盐质量分数较初始值分别增加了38.29%、39.82%、36.87%和31.92%。至堆肥结束,各处理的全盐质量分数分别增加至2.41、2.52、2.37 g/kg和2.42 g/kg,分别较初始值增加了8.56%、11.50%、9.22%和10.50%。
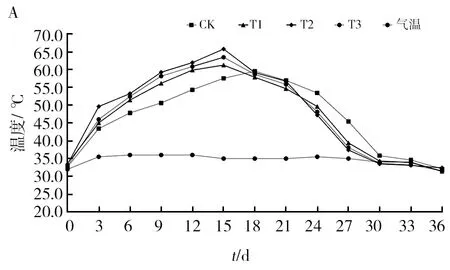
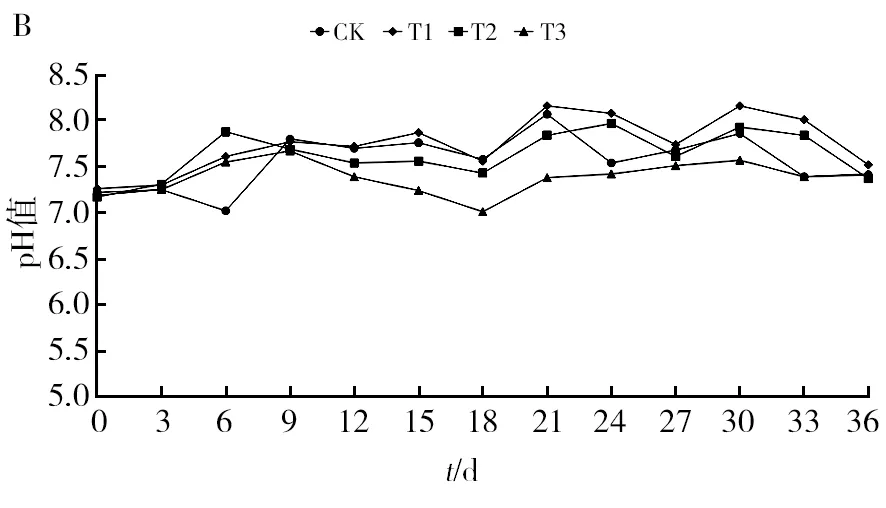

图3 不同处理对沼渣堆肥温度、pH值和全盐质量分数的影响Fig.3 ffects of different treatments on temperature, pH and mass fraction of total saltA:温度;B:pH值;C:全盐质量分数A: Temperature; B: pH level; C: Mass fraction of total salt
2.4.2 复合菌剂对沼渣堆肥有机质、全氮、全磷、全钾质量分数的影响 ①有机质:有机质是堆肥中微生物生命活动的能量来源,或被氧化分解为CO2和H2O,或转化为微生物组织,或形成腐殖质。由图4A可知,在堆肥过程中,沼渣中的有机质质量分数随着堆肥进程逐渐下降。初始物料有机质质量分数为811.44 g/kg。至堆肥结束,CK、T1、T2和T3的有机质质量分数较堆肥初期减少30.23%、34.95%、42.85%、39.59%,可以看出T2的有机质消耗最多,CK消耗的有机质最少。说明施用菌剂有利于加快堆肥中有机质的分解转化,其中T2有机质降解速率最快。②全氮:图4B表明,沼渣堆肥中添加复合菌剂对物料全氮质量分数有影响。各处理全氮质量分数均随发酵进程呈下降趋势,不同处理的降幅具有显著差异(P<0.05)。堆肥初期的物料全氮质量分数为17.93 g/kg,至堆肥结束,CK、T1、T2和T3处理较初期分别降低了68.77%、37.53%、26.60%和34.41%。T2的氮损失率最低,较CK的氮损失率降低42.17%,T1和T3次之,较CK氮损失率分别降低了31.42%和34.36%。这表明添加复合菌剂能显著降低堆肥的全氮损失,其中T2处理的降低效果尤为显著。③全磷:由图4C可知,物料全磷质量分数随堆肥进程呈上升趋势。物料初始全磷质量分数为21.71 g/kg。RP均有上升,CK、T1、T2和T3处理较初始值分别提高18.33%、23.26%、25.70%和23.68%。其中,T2的质量分数最高,较CK增加了7.37%。
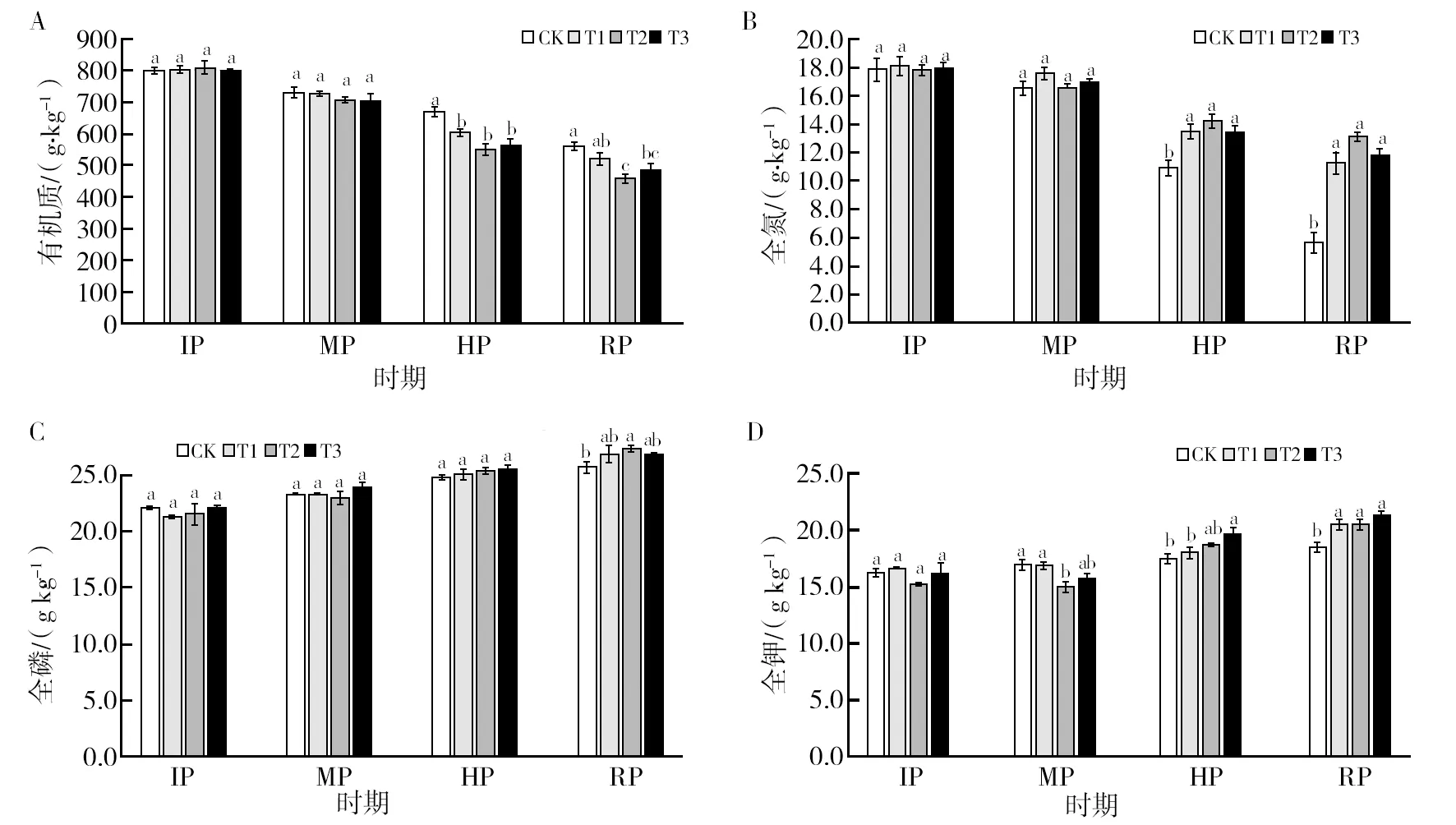
图4 不同处理对沼渣堆肥有机质、全氮、全磷和全钾质量分数的影响Fig.4 Effects of different treatments on mass fraction of organic matter, total nitrogen, total phosphorus and total potassium in biogas residue compostA:有机质;B:全氮;C:全磷;D:全钾;IP:潜育期;MP:中温期;HP:高温期;RP:腐熟期。图中不同小写字母代表各处理在P<0.05水平上差异显著,下同A:Organic matter; B: Total nitrogen; C: Total phosphorus; D: Total potassium; IP: Incubation period; MP: Medium temperature period; HP: High temperature period; RP: Rotten period. Different lowercase letters in the figure indicate significant differences at the P<0.05 level. The same below
表明添加复合菌剂可以显著提高堆肥物料中的全磷质量分数,其中T2增幅最高。④全钾:图4D表明,在堆肥过程中,全钾质量分数呈上升趋势。初始物料的该指标为15.97 g/kg。到RP时,CK、T1、T2和T3处理较初始值分别增加15.15%、27.93%、27.99%和33.50%。增幅最大的是T3,较CK增加了18.35%。表明添加复合菌剂可以有效提升堆肥物料中全钾的质量分数,其中T3增幅最高。
2.4.3 复合菌剂对沼渣堆肥纤维素酶和木质素酶活性的影响 由图5可知,堆肥物料的FPA、LAA、LPA和MPA随着堆肥进程均呈先增加后降低的趋势,均在HP达到最高水平,但是不同的酶其活性及变化幅度有差异。FPA是4种酶中酶活水平较高的酶。由图5A可知,在IP时,各处理的FPA已经产生差异,CK、T1、T2和T3分别为1 846.01、2 324.25、2 711.11、2 451.78 U/L。所有处理的FPA均在HP达到最高水平,较IP的增幅分别达到54.40%、237.31%、240.33%、128.09%。其中,T2处理的FPA增幅更大,较同阶段CK提高185.93%。RP各处理的FPA都低于对应的HP酶活性。表明复合菌剂能有效提高堆肥物料中的纤维素酶活性。图5B表明,IP时,CK、T1、T2和T3的LAA均处于较低水平,分别为555.56、725.31、611.11、469.14 U/L。发酵进入MP时,LAA显著提高。至HP时,各处理的LAA达到最高水平,其中T2的LAA水平最高,较CK、T1、T3分别提高了11 528.56%、688.28%和100.73%。RP时,各处理LAA较HP均显著下降,但仍高于IP。如图5C,IP时CK、T1、T2和T3的LPA分别为58.68、106.33、116.49、125.45 U/L。HP时,各处理的LPA达到最高值,较IP分别增加132.11%、224.95%、504.60%、144.28%。其中T2的LPA增幅最大,较同期CK提高了372.49%。RP的各处理酶活性较HP下降。MPA在4种酶中处于最低水平。由图5D可知,IP时,CK、T1、T2和T3处理的MPA范围为30.20~93.47 U/L。HP较IP分别增加了185.70%、233.35%、563.09%、712.09%。其中T3处理的MPA增幅最大,较同期CK提高了526.39%。RP的MPA较HP显著下降,但是仍然较IP高。总之,沼渣堆肥中添加复合菌剂能显著提高FPA、LAA、LPA和MPA,其中,T2处理的前三种酶活性增幅最高,T3处理的MPA增幅最高。
2.4.4 复合菌剂对沼渣堆肥种子发芽指数的影响 通常以种子发芽指数表征堆肥物料的腐熟度。由图6可知,堆肥过程中GI呈上升趋势,对种子发芽的抑制作用逐渐减弱,但是不同处理的腐熟进程有差异。以GI大于50%和大于80%分别作为物料基本腐熟和完全腐熟的判断依据[25]。发酵初期,各处理的GI均值为38.26%,均未达到50%。至MP时,只有T2处理为53.55%,达到基本腐熟。堆肥至HP(第9天),T2处理的GI增至80.74%,已充分腐熟,而T1、T3和CK都于27 d才达到充分腐熟。说明添加复合菌剂能显著促进沼渣堆肥的腐熟,缩短堆肥时间。其中T2处理促腐熟效果最好,比CK提前了18 d。
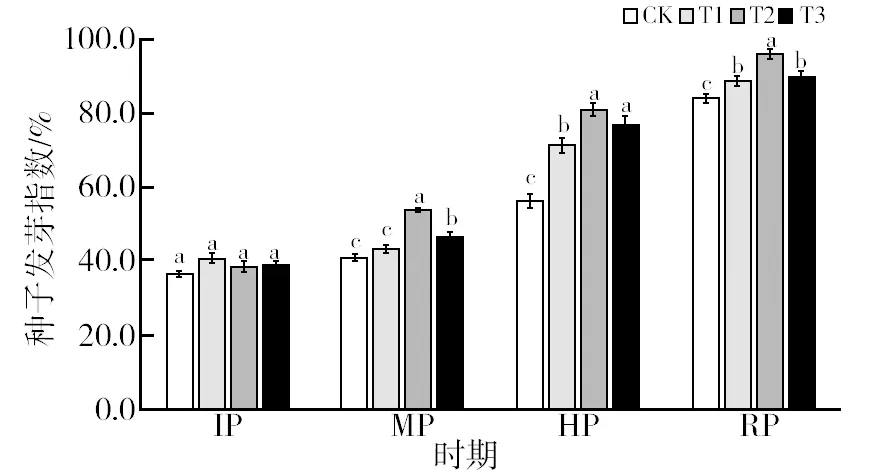
图6 不同处理对沼渣堆肥种子发芽指数的影响Fig.6 Effect of different treatments on seed germination index of biogas residue compost
3 讨 论
理论研究和生产应用均表明,耐高温的纤维降解菌对促进好氧堆肥很重要[26]。目前已筛选到多种纤维素降解真菌并开展了较为系统的研究,但是对耐高温的纤维降解细菌研究相对较薄弱[27]。本研究筛选获得的纤维素降解细菌W44和X51可以耐60 ℃高温,同时具有较好的纤维降解酶活性,其纤维素酶活性分别为34 812.69 U/L和34 159.10 U/L,木质素酶活性分别为733.42 U/L和670.85 U/L,显示出较好的堆肥应用潜力,为沼渣好氧堆肥提供了菌种资源。
芽胞杆菌是堆肥中一类重要的微生物。刘心吾等[28]和周望平等[29]均发现芽胞杆菌分别是秸秆物料和畜禽粪便堆肥发酵过程中的优势菌群。芽胞杆菌的芽胞具有极强的抗逆性,包括抗热、抗盐、抗酸、抗碱、抗辐射、抗静水压等[30]。田伟等[31]从牛粪中分离筛选到蜡样芽胞杆菌和枯草芽胞杆菌(B.subtilis),菌体耐受50 ℃高温。黄翠等[32]在研究农业固废堆肥时获得具有纤维素降解能力且耐受55 ℃高温的芽胞杆菌、类芽胞杆菌(Paenibacillussp.)、地衣芽胞杆菌(B.licheniformis)、枯草芽胞杆菌、凝结芽胞杆菌(B.coagulans)和短芽胞杆菌(Brevibacillusborstelensis)等。以上细菌产生的芽胞是菌体细胞的休眠体, 形成于生长发育后期,具有含水量低、含大量吡啶二羧酸钙的厚壁,可逆性好且具有较强的抗热性[33]。本研究以堆肥高温期的翻堆温度60 ℃为条件进行筛选,经分类鉴定,明确2个菌株分别为蜡样芽胞杆菌(B.cereus)菌株W44和解蛋白芽胞杆菌(B.proteolyticus)菌株X51。2个菌株对高温的耐受有助于其在堆肥发酵中的生存及代谢。根据农业部NY/T1109-2017《微生物肥料生物安全通用技术准则》[34],蜡样芽胞杆菌属于第三级,即需做致病性试验的菌种。该菌株的致病性将被进一步检测,以保证农业使用的安全性。
堆肥发酵的生物学本质是微生物对有机质的转化作用,涉及大量生物化学反应,且几乎均为酶促反应[35]。因此,针对堆肥物料的组成性质,筛选具有高降解酶活性的微生物是重要的功能菌筛选策略。沼渣富含纤维素,其次是木质素[36],因此,沼渣降解菌的筛选通常以纤维素降解酶和木质素降解酶活性为核心指标,并依据酶活性高低进行复合菌剂的研究[37]。迟畅等[38]在秸秆降解菌的筛选时,以羧甲基纤维素钠酶活性为主要筛选指标。康跃等[39]开展园林废弃物木质素降解菌的筛选,以LAA、LPA和MPA等木质素降解酶活性作为核心筛选指标。聂文翰等[40]进行秸秆降解复合菌剂的构建,发现复合接种剂JFB-1较单菌株处理和其他组合具有更高的酶活性。因此,结合底物组分特征开展降解菌的筛选,同时综合考虑各菌株的相容性和组合的酶活性,有助于快速实现研发目标。本研究以高温下的纤维素降解酶为主要筛选指标,以木质素降解酶作为次要指标,并依据核心酶活性评价不同菌株组合的产酶效果,从而快速筛选获得目标菌株和具有潜力的复配组合。
为缩短堆肥腐熟时间,提高生产效率和堆肥品质,在物料中添加促腐熟菌剂已成为公认可行的方法[41]。张晓倩等[42]在牛粪便和稻草堆肥中添加黄孢原毛平革菌(Phanerochaetechrysosporium)和变色栓菌(Thametesversicolor)组成的复合菌剂,发现堆肥中的β-葡萄糖苷水解酶活性、羧甲基纤维素钠酶活性、LAA和MPA均比CK有显著提高,加快了纤维素和木质素的降解与转化,提升了最高堆温,将腐熟时间缩短了5 d,提高了堆肥品质。研究表明,植物类废弃物堆肥中添加促腐熟菌剂,既增加了物料中的微生物丰度,又能利用活跃的微生物代谢促进物料的酶解和矿化进程,能显著提高物料腐熟度,同时使腐熟时间更短。本研究在沼渣堆肥中添加菌株W44/X51(1∶2)复合菌剂,其FPA、LAA和LPA均显著高于其他处理,MPA也具有较高水平,说明该复合菌剂提高了堆肥中沼渣降解的酶活性,减少了堆肥物料的碳氮损失,促进了养分转化,显著缩短了腐熟时间。该研究既能获得品质较高的腐熟物,又减少了生产的时间成本。因此,该复合菌剂具有较好的应用前景,有关菌剂的生产工艺条件和堆肥生产流程优化有待进一步探索。

