真菌鞘糖脂的生物学功能及应用研究进展
卓少恩, 林瀛栩, 胡 琪, 曾 斌, 蒋春苗
(江西科技师范大学生命科学学院 江西省生物加工过程重点实验室,江西 南昌 330013)
真菌是地球上分布最广泛的生物之一,具有重要的环境和医学意义,其中酵母菌和丝状真菌在工业生产中有着广泛的应用。目前已知的具有生物活性的微生物次级代谢产物中,近一半都是由丝状真菌所产生[1],如临床上使用的青霉素型和头孢菌素型β-内酰胺类抗感染药物也是来源于丝状真菌。另外,有些丝状真菌如黑曲霉(Aspergillusniger)、里氏木霉(Trichodermareesei)和黄曲霉(Aspergillusflavus)在发酵工业中,主要用于开发工业酶制剂和有机酸的生产[2-3]。除此之外,米曲霉(Aspergillusoryzae)、酱油曲霉(Aspergillussojae)和构巢曲霉(Aspergillusnidulans)等丝状真菌的特殊代谢产物,如鞘糖脂,在功能性医药用品、保健食品、化妆品及抗真菌药物开发等相关领域有着广泛应用[4-5]。 糖脂(Glygolipids)是糖还原末端以糖苷键的形式与脂类结合在一起形成的化合物的总称,广泛分布于动物、高等植物和真菌中。糖脂的种类很多,其中研究得较为深入和广泛的是鞘糖脂(Glycosphingolipids)。鞘糖脂是细胞内重要的生物活性物质,不仅参与细胞分化、增殖、免疫、凋亡及衰老等重要生理活动[6-7],中性鞘糖脂还可作为功能性医药用品、化妆品、保健食品等的重要活性组分。近年来,随着生物化学和分子生物学的发展,以及新型分离分析技术的涌现,鞘糖脂的结构、功能及应用研究取得了很大的进步。本文主要对真菌鞘糖脂的结构、生物合成代谢、生物学功能及其作为生物活性分子在保健食品和护肤品中的潜在应用等研究进展进行详细的总结。
1 真菌鞘糖脂的结构及种类
真菌鞘糖脂属鞘脂的一类糖脂。目前,人类致病性菌白色念珠菌(Candidaalbicans)[8]、植物病原体禾谷镰刀菌(Fusariumgraminearum)[9]、模式真菌粗糙脉孢菌(Neurosporacrassa)[10]等真菌的鞘糖脂均已成功分离和鉴定。真菌鞘糖脂主要由鞘氨醇长链、C16-26脂肪酸链和特殊的极性基团三个部分组成,根据极性基团的不同,可分为中性鞘糖脂和酸性鞘糖脂两大类。
在真菌中,Δ4-Δ8-9-甲基-鞘氨醇作为鞘氨醇长链,与C16-18脂肪酸链连接形成神经酰胺,再与葡萄糖或半乳糖残基形成中性鞘糖脂—葡萄糖神经酰胺(Glucosylceramide, GlcCer)或半乳糖神经酰胺 (Galactosylceramide, GalCer)(图1A)。迄今为止,所有研究过的丝状真菌均含有GlcCer或GalCer,其中大多数曲霉属,如烟曲霉(Aspergillusfumigatus)[11-13]、A.niger[14-15]、A.oryzae,A.sojae和泡盛曲霉(Aspergillusawamori)[16]等真菌均能合成GlcCer和GalCer。有趣的是,菌丝形态的申克孢子丝菌(Sporothrixschenckii)仅能合成GlcCer,但其酵母态可同时合成GlcCer和GalCer[17-18]。在真菌中,GlcCer和GalCer是中性鞘糖脂代谢通路的最后一步产物;在高等动物中,GlcCer进一步加上各种糖基形成分布于全身的复杂鞘糖脂,GalCer或其被修饰形成的硫苷脂仅分布于中枢神经组织;目前发现在植物中只有中性鞘糖脂GlcCer,没有GalCer。
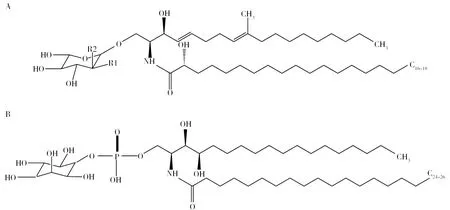
图1 中性鞘糖脂基本结构和肌醇磷脂酰神经酰胺结构[26]Fig.1 Basic structure of neutral glycosphingolipids and Inositol phosphatidylceramide structures[26]A: 中性鞘糖脂基本结构,当R1为-OH,R2为-H时,则为GlcCer;当R1为-H,R2为-OH,则为GalCer;B: 肌醇磷脂酰神经酰胺结构A: Basic structure of neutral glycosphingolipids,When R1 is -OH and R2 is -H, it is GlcCer; When R1 is -H and R2 is -OH, it is GalCer; B: Inositol phosphatidylceramide structures
真菌酸性鞘糖脂又称为糖基肌醇磷酸神经酰胺(Glycosyl inositol phosphoceramide, GIPC),包括甘露糖基肌醇磷脂酰神经酰胺(Metabolic inositol phosphoceramide, MIPC)和甘露糖-(肌醇磷脂酰)2-神经酰胺(Metabolic (inositol phosphoceramide)2, M(IP)2C)。在真菌中,酸性鞘糖脂以植物神经酰胺鞘氨醇作为骨架,与C18-26的脂肪酸链和多种复杂糖基连接形成肌醇磷脂酰神经酰胺(Inositolphosphoryl-ceramides,IPC),IPC可作为合成更复杂酸性鞘糖脂的前导物质,通过添加甘露糖和第二个肌醇磷酸基进一步修饰,生成具有甘露糖单元的MIPC和具有甘露糖单元以及两个肌醇基的M(IP)2C[19]。MIPC和M(IP)2C的聚糖部分表现出很大的多样性和复杂性,在不同的真菌种类之间存在差异。
真菌中性和酸性鞘糖脂的神经酰胺骨架结构上有特殊的差异,如中性鞘糖脂的鞘氨醇在C4-5和C8-9处有不饱和双键,在C9上有一个甲基化(-CH3)基团[20-23],这种Δ4-Δ8-9-甲基-鞘氨醇结构是真菌中性鞘糖脂特有的结构(图1A)。而在植物中,Δ4-Δ8-鞘氨醇结构(C4-5和C8-9不饱和双键)在中性鞘糖脂中也有发现[20,22,24], 但在哺乳动物中主要以Δ4-鞘氨醇结构(C4-5不饱和双键)形式存在[22]。相反,与中性鞘糖脂不同,真菌酸性鞘糖脂在鞘氨醇的C4处有一个羟基(-OH),且酸性鞘糖脂的鞘氨醇的C4-5和C8-9没有不饱和双健及C9的甲基化结构(图1B)。此外,中性和酸性鞘糖脂的脂肪酸链长度也不同,如真菌中性鞘糖脂脂肪酸链多为C16-18,而酸性鞘糖脂以C18-26脂肪酸链为主[25],且一些真菌鞘糖脂的脂肪酸链在C3-4有1个不饱和双键,这种双键仅存在于子囊真菌的GlcCer和GalCer中,如A.fumigatus[11-12]和A.niger[14-15]。植物鞘糖脂脂肪酸链的长度范围在C14~C26[24],而哺乳动物中性鞘糖脂的脂肪酸链主要为 C16或C18[22]。
2 真菌鞘糖脂生物合成涉及的关键基因和重要产物
目前,酿酒酵母(Saccharomycescerevisiae)、C.albicans、N.crassa[10]、A.nidulans[27-28]和F.graminearum[9,29-31]等真菌的鞘糖脂生物合成途径已比较清楚。鞘糖脂的原料神经酰胺可来自3条途径,denovo合成(或称从头合成途径)、鞘磷脂的降解和鞘糖脂再循环利用途径,本文主要讨论真菌鞘糖脂的denovo合成途径。鞘糖脂的denovo合成途径起始于内质网上的膜结合酶催化反应[32-33],为了更好地理解真菌鞘糖脂的生物合成,将整个鞘糖脂生物合成过程分为三个模块(图2),即二氢鞘氨醇的合成、中性鞘糖脂的合成和酸性鞘糖脂的合成。

图2 真菌鞘糖脂的生物合成途径Fig.2 Biosynthetic pathway of fungal glycosphingolipidsA:de novo合成途径中二氢鞘氨醇的合成途径; B:中性鞘糖脂的合成途径; C:酸性鞘糖脂的合成途径.1:丝氨酸软脂酰辅酶A转移酶;2:3-酮基二氢神经酰胺鞘氨醇还原酶;3:神经酰胺合成酶;4: 鞘脂C4羟化酶;5:鞘脂Δ4-去饱和酶;6:鞘脂Δ8-去饱和酶和鞘脂C9-甲基转移酶;7:葡萄糖神酰神经酰胺合成酶;8:半乳糖神酰神经酰胺合成酶;9:神经酰胺合成酶;10:肌醇磷脂酰神经酰胺合成酶;11:GDP-甘露糖-肌醇-磷酸神经酰胺转移酶;12:肌醇磷脂酰神经酰胺合成酶A: Synthesis pathway of dihydrosphinganol in de novo synthesis pathway; B: Synthesis pathway of neutral glycosphingolipids; C: Synthesis pathway of acid glycosphingolipids. 1:Serine palmitoyl transferase; 2: 3-ketodihydroceramide sphingosine reductase; 3: Ceramide synthetase; 4: Sphingolipid C4 hydroxylase; 5: Sphingolipids Δ 4-desaturase; 6: Sphingolipids Δ 8-desaturase and sphingolipid C9 methyltransferase; 7: Glucosylceramide synthase; 8: Galactosylceramide synthetase; 9: Ceramide synthase; 10: Inositol phosphatidyl ceramide synthetase; 11: GDP mannose inositolphosphate ceramidase; 12: Inositol phosphatidyl ceramide synthetase
2.1 二氢鞘氨醇的生物合成
二氢鞘氨醇的合成是中性和酸性鞘糖脂生物合成的共同起点,主要涉及两步酶催化反应(图2)。丝氨酸和棕榈酰辅酶A在丝氨酸软脂酰辅酶A转移酶的催化下缩合成3-酮基二氢鞘氨醇,然后经3-酮基二氢鞘氨醇还原酶还原为二氢鞘氨醇(图2A)。丝氨酸软脂酰辅酶A转移酶作为鞘糖脂合成的第一个限速酶,在所有生物中都相当保守。在酵母和丝状真菌中,丝氨酸软脂酰辅酶A转移酶由LCB1、LCB2和TSC3基因编码,LCB1和LCB2是该酶活性所必需的两个基因,敲除LCB1或/和LCB2基因的S.cerevisiae突变菌株均不能合成鞘糖脂[34-36]。在A.nidulans中,编码丝氨酸软脂酰辅酶A转移酶的基因与S.cerevisiaeLCB1为同源基因,并命名为lcbA,是A.nidulans菌丝极性生长必需基因。TSC3属于TSC基因家族,TSC3基因编码一种新的80-氨基酸蛋白,具有亲水性的氨基末端和膜相关的疏水羧基末端。该蛋白可与LCB1或/和LCB2结合形成酶复合体,可调控丝氨酸软脂酰辅酶A转移酶的最佳活性,并且是维持真菌在高温下生长所不可缺少的[37]。3-酮基二氢鞘氨醇还原酶在丝状真菌中的研究较少,在A.fumigatus中,该酶由ksrA基因编码,但ksrA在曲霉中的生物学作用还有待阐明;C.albicans缺失ksr1会损害菌丝的生长,表明ksr1的表达对菌丝的极性生长具有重要作用[38]。在真菌中,二氢鞘氨醇合成后可分别用于生成二氢神经酰胺和植物神经酰胺,是中性鞘糖脂和酸性鞘糖脂生物合成的起点和共同途径[13,39-41]。
2.2 中性鞘糖脂的生物合成
在合成中性鞘糖脂过程中,二氢鞘氨醇首先在神经酰胺合成酶的催化作用下与C16或C18的脂肪酸链发生酰化作用生成二氢神经酰胺,随后在脂肪酸链的C2位插入羟基(-OH)基团,生成OH-二氢神经酰胺,真菌OH-二氢神经酰胺可以由不同长度和饱和度的脂肪酸链组成。参与该步骤的神经酰胺合酶编码基因BarA(或Cer1或Bar1)已在A.nidulans、新型隐球菌(Cryptococcusneoformans)中鉴定且证明其在菌丝极性生长中起着重要作用[39-41]。BarA(或Cer1或Bar1)基因在合成中性鞘糖脂中起到重要作用,敲除该基因的突变菌株不能直接合成中性鞘糖脂[41,43-44]。
随后,OH-二氢神经酰胺由鞘脂Δ4-去饱和酶还原为Δ4-OH-神经酰胺。鞘脂Δ4-不饱和酶基因在S.cerevisiae和C.albicans中已被鉴定和研究,敲除该基因的C.albicans突变菌株与野生型相比,菌丝生长速率降低。然后Δ4-OH-神经酰胺通过鞘脂Δ8-去饱和酶及鞘脂C9甲基转移酶分别在C8-9处和C9处引入一个双键和一个甲基(-CH3)基团,生成OH-Δ4-Δ8-9-甲基神经酰胺。这种Δ8-不饱和和C9-甲基化的神经酰胺鞘氨醇特征是真菌中性鞘糖脂特有的,是真菌生长、分化和致病所必需的[42]。在A.nidulans、C.neoformans和F.graminearum中,敲除鞘脂Δ8-脱氢酶基因(sdeA)和鞘脂C9-甲基转移酶基因(SmtA/SmtB)会导致饱和(未甲基化)GlcCer的积累,抑制真菌菌丝生成,严重影响真菌生长。因此Δ8-不饱和及甲基化的鞘氨醇修饰是真菌正常生长和菌丝分化所必需的[28,43]。
最后,合成的Δ4-Δ8-9-甲基神经酰胺从内质网转移到高尔基体,在葡萄糖神经酰胺合成酶或半乳糖神经酰胺转移酶的作用下,将UDP-葡萄糖或UDP-半乳糖转移到OH-Δ4-Δ8-9-甲基神经酰胺骨架上,合成中性鞘糖脂GlcCer或GalCer[26,44-46]。目前研究表明大多数真菌葡萄糖神经酰胺合成酶编码基因GCSA或GCS1的表达在真菌的菌丝生成过程中极为重要,敲除GCSA或GCS1基因的真菌不能合成GlcCer,直接影响菌体的生长和丝状化[28]。与葡萄糖神经酰胺合成酶不同,在真菌中编码神经酰胺半乳糖基转移酶的基因只在N.crassa和稻瘟病菌(Magnaporthegrisea)中被发现[47-48],关于真菌神经酰胺半乳糖基转移酶及GalCer功能的研究报道极其有限。在哺乳动物中,GlcCer和GalCer是中性复杂鞘糖脂形成的前导物质,进一步可形成脑苷脂、神经节苷脂、红细胞糖苷脂,而在真菌中,GlcCer和GalCer是鞘糖脂代谢通路的最后一步产物。
2.3 酸性鞘糖脂的生物合成
二氢鞘氨醇通过羟基化先形成植物鞘氨醇,并作为脱饱和神经酰胺的前体,在C.albicans、毕赤酵母(Pichiapastoris)、粟酒裂殖酵母(Schizosaccharomycespombe)、乳酸克鲁维酵母(Kluyveromyceslactis)和S.cerevisiae中发现[44,49-51]。二氢鞘氨醇的羟基化由鞘脂C4-羟化酶催化,在S.cerevisiae中,Sur2基因对鞘脂C4羟基化活性是必需的,但对正常生长不是必需的。但是Sur2同源基因A.nidulansBasA对植物鞘氨醇的生物合成是必需的,对真菌生存也是必需的[52],敲除BasA基因的A.nidulans突变体将会导致真菌异常细胞壁增厚,研究表明,产生这种表型的原因是二氢鞘氨醇的积累[52]。
生成的植物鞘氨醇通过神经酰胺合成酶催化形成植物神经酰胺。编码神经酰胺合成酶的LagA基因在酵母和丝状真菌中广泛存在,是真菌生长和菌丝极性生长必需基因。研究表明,抑制A.nidulansLagA基因表达的突变菌株生长缓慢,菌丝发生扭曲[39]。在C.albicans中,缺乏Lag1基因严重影响该菌的生长和菌丝形态的构建。此外,在酵母型真菌中,过表达Lag1可诱导该生物体的假菌丝生长,这表明Lag1对于传递信号以诱导菌丝特异性基因表达是必需的[41]。
以上的反应都在内质网进行,植物神经酰胺必须从内质网转移到高尔基体中才能加入极性基团形成复杂的酸性鞘糖脂,植物神经酰胺的囊泡转运和非囊泡转运都不需要ATP,但需要内质网和高尔基膜之间的直接接触[53]。在真菌中,IPC合成酶将肌醇-1-磷酸基团从磷脂酰肌醇上转移到植物神经酰胺C1-OH上形成IPC。IPC合成酶在曲霉属种[54]中由aurA基因编码,也称IPC1基因,在真菌中是必不可少的,对真菌的存活至关重要。抑制A.nidulansaurA的菌株孢子丧失萌发能力,引起终端表型[55]。IPC作为合成更复杂的酸性鞘糖脂的前导物质,进一步形成MIPC和M(IP)2C等复杂酸性鞘糖脂。例如,在GDP-甘露糖-肌醇-磷酸神经酰胺转移酶作用下将GDP-甘露糖基转移到IPC的肌醇2-OH上,从而形成MIPC。该反应需要Csg1 (Sur1)、Csg2[56]和Csh1[57-58]三种蛋白,这些蛋白可以形成两个不同的肌醇磷酸神经酰胺甘露糖基转移酶复合物Csg1-Csg2和Csh1-Csg2,Csg1和Csh1亚基起催化作用,Csg2起调节作用[57]。MIPC还可以进一步在IPC合成酶的作用下将另一个肌醇磷脂酰基加入到MIPC形成M(IP)2C[59]。酵母也可通过将第二个肌醇磷酸从磷脂酰肌醇转移到MIPC产生M(IP)2C,这一反应需要Ipt1基因[60]。另外,Skn1基因也已被证明是M(IP)2C合成的必需基因[61]。Skn1通过调节Ipt1的活性发挥作用或者在营养不良的生长条件下,Skn1可以作为Ipt1的功能同源物,酵母在马铃薯葡萄糖培养基中生长时,Ipt1缺失的细胞会产生低水平的M(IP)2C[62]。
3 真菌鞘糖脂的生物学功能
3.1 鞘糖脂在真菌生长中的作用
鞘糖脂是真菌细胞膜的主要成分,在膜微区中与胆固醇、甾醇聚集形成脂筏,参与真菌细胞极化和菌丝的极性生长[63]。鞘糖脂的生物学功能在丝状真菌中已通过基因缺失或抑制途径进行了研究[8,28,31,64-66]。研究表明,GlcCer生物合成途径中任何步骤的打断都会抑制真菌菌丝生长和菌丝延伸,并导致脂筏定位错误。例如,敲除barA或通过抑制剂打断GlcCer合成途径,都极大地减少了菌丝极性生长或菌丝延伸[39,67]。同样,通过敲除GlcCer合成最后一步的葡萄糖神经酰胺合成酶基因或添加该酶抑制剂,也会损害A.nidulans菌丝的延伸,或抑制A.fumigatus出芽、芽管形成等[27-28,30]。这些研究结果表明,GlcCer对丝状真菌极性轴的建立和维持、真菌的生长和分化至关重要。
与GlcCer相比,GalCer的大部分功能研究主要在哺乳动物中进行,其在真菌中的生物学功能尚不清楚。现有研究发现菌丝形态的S.schenckii只合成GlcCer,但其酵母形态同时含有GlcCer和GalCer,表明在S.schenckii菌丝体形态-酵母形态转换过程中,神经酰胺半乳糖基转移酶可能被激活,或者在酵母形态-菌丝形态转化过程中被抑制[17-18]。A.fumigatus和S.schenckii菌丝中性鞘糖脂的结构分析发现,GalCer和GlcCer具有相同的神经酰胺骨架,但GalCer含有较高比例的Δ3-不饱和脂肪酸[12,18]。这些结果表明,GalCer的产生和脂肪酸链的Δ3-不饱和度可能是鞘糖脂通过激活/失活信号转导通路调控真菌形态发生的分子机制。
在真菌中,不仅中性鞘糖脂的合成受损时影响真菌的生长和菌丝分化,酸性鞘糖脂合成在真菌生长中也具有重要作用。如抑制IPC合成酶后,植物鞘氨醇和植物神经酰胺代谢物的积累会导致真菌细胞周期阻滞和凋亡[55]。IPC合成途径的完整性与真菌的生存能力有关,不仅是因为IPC在真菌分化中的作用,还与二氢鞘氨醇、植物鞘氨醇和植物神经酰胺含量水平的高度调控有关,因为二氢鞘氨醇和植物鞘氨醇的积累对真菌细胞具有极大的毒性作用,两者的高水平积累会导致真菌细胞死亡。所以,植物神经酰胺合成酶和IPC合成酶可以成为开发新型抗真菌药物的潜在靶点,因为抑制这些酶活性将导致植物鞘氨醇和植物神经酰胺的积累,最终导致真菌细胞死亡,从而达到抑菌效果。
3.2 非生物胁迫
在真菌的维持正常生理功能中,适宜的细胞膜流动性是必要条件,膜流动性降低或提高是细胞感受温度信号的关键早期反应之一。当细胞处于寒冷、高温或极端环境情况下,降低质膜的渗透性,有利于保护质膜的稳定性[26,68-69]。真菌鞘糖脂含量的多少直接影响细胞膜的完整性和离子通透性。在中性鞘糖脂合成途径中,当GlcCer合成通路被阻断或外源施加鞘糖脂后,其对环境温度胁迫的耐受能力都受到明显的影响。有研究表明酵母ΔLCB突变体因缺少鞘氨醇而不能在温度较高或过高(大于37 ℃)的环境下生存,而施加外源鞘糖脂后重新获得抵抗热敏感的能力[70]。不同温度胁迫会直接影响酵母鞘糖脂类型、含量和鞘氨醇碳链长度[71]。此外,敲除鞘糖脂生物合成途径中的关键基因CSG2或IPT,会抑制酵母突变菌株在12 ℃时的菌丝生长,而在28 ℃时没有影响[72],但这些基因的过表达又改善了酵母的菌丝在低温下的生长和发酵活性,表明鞘糖脂在冷胁迫下参与发酵活性细胞的过程中也发挥了重要作用[73]。
嗜热微生物在高温胁迫下可以通过改变细胞中鞘糖脂类物质的含量响应高温胁迫。嗜热微生物中酸性鞘糖脂IPC的相对含量会随着温度的升高而增加,但MIPC或M(IP)2C的相对含量却降低[71]。N.crassa在应答热胁迫中合成C18和C24脂肪酸链的植物神经酰胺,作为信号分子介导真菌的细胞凋亡[74]。GlcCer合成在真菌响应酸碱环境胁迫中也具有重要作用。例如C.neoformans的Cer1突变体因不能合成GlcCer而不能在酸/碱性环境中生存;S.cerevisiae自身不能合成GlcCer,但在外源施加GlcCer后,可以提高其对碱性环境和乙醇的耐受性[75]。除此之外,细胞中只能合成饱和GlcCer的C.neoformans突变体对膜应激物的敏感性增强,抗逆能力减弱[43]。这些研究结果表明,鞘糖脂含量和种类在微生物应答逆境胁迫中起着重要的作用。
3.3 细胞凋亡
鞘糖脂代谢在细胞凋亡中起重要作用。在细胞增殖、分化、衰老到凋亡过程中,鞘糖脂被认为是细胞凋亡外部通路的关键因子[76],许多鞘糖脂在细胞生长分化过程中都有抑制细胞凋亡的作用。研究发现,二氢鞘氨醇和植物鞘氨醇对A.nidulans具有非常高的结构和立体化学特异性,具有很强的杀菌活性。在细胞的凋亡过程中,二氢鞘氨醇和植物鞘氨醇能快速诱导DNA凝聚,而不依赖于有丝分裂、大规模DNA断裂,这些都是细胞凋亡的共同形态学特征,表明二氢鞘氨醇和植物鞘氨醇能诱导A.nidulans细胞凋亡[77]。在中性鞘糖脂合成途径中,C.albicans的细胞壁含有GlcCer,可与从萝卜中分离的抗真菌植物防御素RsAFP2相互作用,由于RsAFP2耐受基因涉及细胞壁完整性和菌丝生长/分隔环形成,从而阻断了C.albicans酵母形态-菌丝形态的转化,最终导致C.albicans的细胞凋亡[78]。
4 真菌鞘糖脂的应用
4.1 真菌GlcCer和GalCer的潜在开发应用
鞘糖脂是细胞内重要的生物活性物质,作为信号分子不仅参与细胞分化、凋亡及衰老等重要生理活动,中性鞘糖脂还可作为功能性医药用品、化妆品、保健食品的重要活性组分。目前,作为保湿成分被广泛添加在化妆品中或作为功能成分添加到保健食品的中性鞘糖脂GlcCer主要来源于植物[79-80]。研究表明,在表皮细胞分化过程中,GlcCer在角质形成细胞中可被β-葡萄糖神经酰胺水解酶水解为神经酰胺并储存在角质层,神经酰胺是维持和形成表皮通透性屏障的关键分子,是皮肤保水的重要成分[81]。表皮中β-葡萄糖神经酰胺水解酶的缺乏或抑制可改变神经酰胺和GlcCer的分布,导致表皮通透性屏障功能下降[79]。而GalCer可激活角质细胞中β-葡萄糖神经酰胺水解酶,促进GlcCer水解释放出神经酰胺[79],增加角质细胞中神经酰胺的含量以改善皮肤干燥和过敏性皮肤炎等。纯化的GlcCer通常作为功能补充添加到保健食品中,多项动物模型和人体试验结果表明,口服植物GlcCer可减少皮肤表皮水分流失、皮肤过敏和UVA 诱导的皮肤皱纹[82-84]。除了改善皮肤屏障功能和预防特应性皮炎外,植物 GlcCer 作为膳食补充剂还具有预防肠道损伤的功能。口服GlcCer 能保护结肠表面免受各种药物的有害影响,并可通过调节肠道微生物群来改善肠道微环境[85-87]。有趣的是,GlcCer必须在β-葡萄糖神经酰胺水解酶的作用下释放出神经酰胺才能在皮肤屏障和预防肠道损伤中发挥作用。目前应用到化妆品和保健食品中的GlcCer主要从小麦、稻米、大豆等植物中进行提取,但来自植物的中性鞘糖脂没有GalCer。在发现疯牛病之前,GalCer主要来源于牛等动物神经组织,但由于存在病毒疾病风险,从动物神经组织提取的GalCer不能直接用于化妆品或其他人类用途[88]。因此,寻求新的合成 GlcCer 和 GalCer 的生物资源并利用基因工程技术定向改造,以此来提高生物体内 GlcCer 和 GalCer 含量具有非常广阔的应用前景。
在真菌中,有多种食品级安全真菌可以合成GlcCer和GalCer,由GalCer(30.3%)和GlcCer(69.7%)组成的糖基神经酰胺(中性鞘糖脂)是曲霉菌中丰富的鞘糖脂之一,如Koji类曲霉中1 g菌丝体大约含有240 μg中性鞘糖脂[89]。早在1977年,学者们陆续从A.oryzae、A.fumigatus、A.niger中提取纯化并鉴定到了GlcCer,直到2014年,日本学者首次从A.oryzae、A.sojae和A.awamori等曲霉中提取纯化鉴定到GalCer,证实了A.oryzae、A.sojae和A.awamori可同时生成GlcCer和GalCer[16,23,89-90]。
目前有研究表明真菌糖基神经酰胺在预防肠道损伤和提高皮肤水分含量中发挥重要的作用[91]。来源于圆酵母(Torulayeast)的GlcCer可以增加真皮成纤维细胞增殖和胶原蛋白的生成,有助于保持皮肤弹性[4]。Miyagawa等[92]研究表明,糖基神经酰胺还会影响正常人表皮角化细胞基因的表达,如Koji、琉球曲霉(Ryukyuaspergillus)和A.oryzae的糖基神经酰胺可增强OCLN蛋白(一种表皮紧密连接蛋白)基因和ABCA12蛋白基因(ATP结合亚家族成员12)的表达水平来增加角质形成细胞中神经酰胺的含量。此外,Hamajima等[93]证实,A.oryzae糖基神经酰胺可作为益生元被肠道微生物菌群消化,增加了肠道中有益物种球形白球菌(Blautiacoccoides)的比例。Hamajima等报道,向肥胖小鼠喂食A.oryzae糖基神经酰胺可改变小鼠胆固醇代谢,并能明显降低肝脏胆固醇含量[94]。综上所述,来自曲霉的 GlcCer 和 GalCer 既可作为化妆品的保湿成分,又可作为“功能成分”添加到保健食品中,且来源于曲霉的中性鞘糖脂因同时含有 GlcCer 和 GalCer,弥补了植物仅含有 GlcCer 的缺陷,尤其被认定为食品级安全菌株的A.oryzae,将是开发中性鞘糖脂的理想生物资源。
4.2 中性鞘糖脂作为抗菌肽的靶点
由于真菌鞘糖脂的结构与哺乳动物不同,真菌中性鞘糖脂可以作为抗菌肽的靶点来阻断它们的功能。先前研究已经确定了几种天然产物可直接靶向真菌GlcCer并调节其生长。研究表明,RsAFP2和海利霉素(Heliomycin)对产生GlcCer的C.albicans和P.pastoris具有活性,而缺乏GlcCer的菌株对RsAFP2和Heliomycin具有抗药性。RsAFP2结合GlcCer将会改变真菌细胞壁的形状,最终影响C.albicans的酵母形态—菌丝形态的转化。有趣的是,RsAFP2和Heliomycin不与人类GlcCer相互作用[95]。近些年,由于GlcCer具有高度免疫原性,针对真菌GlcCer的单克隆抗体已被开发出来。如被C.neoformans感染的患者会产生抗体,经过用GlcCer抗体处理后,C.neoformans所合成的GlcCer含量减少,细胞出芽和体外生长受到抑制,再向其他患者注射这些人类血清的抗体时[96],将会抑制C.neoformans细胞的出芽。单克隆抗体最终产生了抗真菌GlcCer的抗体,表明被动给药是一种可以避免受C.neoformans感染的治疗方法[97]。此外,用GlcCer抗体处理裴氏着色霉(Fonsecaeapedrosoi)[98]和胶孢炭疽菌(Colletotrichumgloeosporioides)[99]后会直接抑制真菌生长和降低分生孢子萌发率。中性鞘糖脂作为抗菌肽的靶点显然还需要进一步的研究,但目前获得的研究结果清楚地表明,使用特异性单克隆抗体阻断鞘糖脂功能可能是一种很有希望的治疗侵袭性真菌感染的选择。
4.3 酸性鞘糖脂在开发抗真菌药物中的应用
IPC是真菌生长所必需的,抑制IPC合成途径会导致真菌细胞死亡。因此通过合成IPC合成抑制剂,直接抑制酸性鞘糖脂代谢酶的酶活性来开发抗真菌药物,可以有效抑制真菌的生长。其中IPC合成酶就是一个理想的抗真菌药开发靶点。目前已经合成的IPC合成抑制剂有金担子素A(Aureobasidin A,AbA)[100]、罗他霉素(Rotamycin)[101]、Khafrefungin[102]、锈霉素(Rustmicin)。AbA是最先被开发出来的IPC合成酶的抑制剂,对C.albicans、C.neoformans、A.oryzae等病原真菌都有很强的杀菌作用[103]。AbA是结合在IPC合成酶的疏水部位从而抑制真菌IPC合成酶的活性使酸性鞘糖脂IPC合成量减少[104],IPC合成酶实际上被称为Aur1,因为它是对AbA[105]产生抗性的基因,但是AbA只会杀死正在生长的细胞,而对处于休眠期的细胞却无任何影响,这表明AbA不抑制遗传物质的合成。而Rotamycin抑制剂对C.albicans具有良好的抗真菌活性。此外,Khafrefungin是由内生真菌产生的一种杀真菌化合物,在体外较低的浓度就可抑制IPC合成酶活性并导致植物鞘氨醇和植物神经酰胺的积累从而抑制真菌生长。同样,Rustmicin在体外较低的浓度也会抑制IPC合成酶且对真菌的抑制作用具有选择性,对C.albicans和S.cerevisiae的抑制作用基本相似,抑制效果相对于C.neoformans较不明显。
以上抗菌药物已经开发出来,可是霉菌中的IPC合成酶不易受AbA的影响,新的AbA衍生物已被合成,对IPC合成酶的抑制能力有所提高,可较好地抑制A.fumigatus[106]。但这些化合物对真菌的选择性是否与哺乳动物细胞相似,还有待进一步研究。除此之外,Pleofunins是最近被鉴定的IPC合成酶新抑制剂,该抑制剂从根霉属(Rhizopus)的菌丝提取物中分离出来,属于一类对酵母和霉菌均有效的IPC合酶抑制剂[107],抑制效果比先前的IPC合成酶抑制剂都要好。Pleofunins虽然预期对哺乳动物细胞没有毒性,但这些化合物的选择性指数在很大程度上是未知的。
5 展 望
鞘糖脂是一类化学性质复杂的糖脂物质,广泛存在于真菌、植物和动物中。我们总结了真菌鞘糖脂的种类和结构,讨论了鞘糖脂在真菌中的生物合成途径和生物学功能,并特别关注了中性鞘糖脂作为保湿成分和功能成分在化妆品和保健食品中的重要作用,也阐述了鞘糖脂在抗真菌药开发中的应用。
关于鞘糖脂抗真菌药的开发研究中,目前已经研制出了多种抗真菌药物,如Aureobasidin A(AbA)、Hough cephalosporins、Rotamycin、Khafrefungin、Rustmicin以及相应的衍生物等,这些药物都对IPC合成酶有着一定的抑制效果,从而抑制了真菌的生长。但是抗真菌化合物的护理标准有限,真菌耐药性正在迅速上升,抗真菌化合物的抑制水平明显下降,目前迫切需要具有新作用机制的抗真菌化合物。由于真菌鞘糖脂在结构上不同于哺乳动物,或者完全不存在于哺乳动物系统中,关键的真菌鞘糖脂代谢酶在哺乳动物细胞中不存在或存在显著差异,并且已被证明在实验室环境中具有针对性。唯一一个限制是这些化合物是否只会杀死真菌而对哺乳动物细胞没有影响?毒性研究和选择性指数分析将能够解决这一限制,随着药物设计和药物筛选新技术的发展,真菌鞘糖脂途径为开发具有生物活性的抗真菌化合物提供了更广阔的前景。同时,真菌鞘糖脂代谢途径中所特有的其他相关酶类也会受到广大学者的关注,这对研究新型的具有口服活性、半衰期长、低毒、广谱并具有一定体内和体外活性的抗真菌药物有着十分重要的理论指导意义。
另外,还探讨了真菌中性鞘糖脂作为保湿成分添加到化妆品或作为功能成分的膳食补充剂添加在保健食品中的重要作用。同时也注意到动植物中性鞘糖脂在应用上的局限性及真菌中性鞘糖脂的化妆品和保健食品中应用的优势。中性鞘糖脂GlcCer在预防肠道损伤和提高皮肤水分含量中发挥重要作用,但不管是在角质形成层细胞还是在小肠或结肠黏膜细胞中,GlcCer必须被β-葡萄糖神经酰胺酶水解成神经酰胺才能发挥作用,而GalCer可以激活β-葡萄糖神经酰胺酶促进GlcCer水解释放出神经酰胺。但目前应用到化妆品和保健食品中的植物中性鞘糖脂只有GlcCer,没有GalCer。而来自动物脑组织的GalCer有病毒感染的风险,且来源于动物脑组织的GalCer在化妆品或保健食品中的应用是不被接受的。因此,那些能同时合成GlcCer和GalCer的食品发酵工业的真菌,可以作为生产中性鞘糖脂的直接来源,尤其被美国食品与药物管理局(FDA)和世界卫生组织(WHO)认定为安全生产菌株(GRAS)的A.oryzae,将被认为是可用于生产GlcCer和GalCer的潜在重要生物资源。因为A.oryzae不仅可以快速生长并积累大量脂质,合成GlcCer和GalCer并将它们储存在细胞中,而且也可用于食品和保健品的商业规模栽培。此外,与植物或动物相比,利用A.oryzae生产鞘糖脂还具有以下优点:①A.oryzae生长迅速,其生长速度可达到许多陆地植物的100倍以上;②A.oryzae的生长和收获受季节条件的影响较小;③在中性鞘糖脂提取后,A.oryzae残留物可用作动物饲料;④来源于A.oryzae的中性鞘糖脂因同时含有GlcCer和GalCer,弥补了植物仅含有GlcCer的缺陷,添加到护肤品或保健食品中对增强皮肤屏障功能或维护肠道健康更加有效。因此,A.oryzae等可作为一种全新且安全的中性鞘糖脂来源的生物资源。但由于真菌鞘糖脂生物合成及分解代谢途径的复杂性和动态变化,这些活性分子的产生规律和调控机制尚不清楚,很大程度上限制了A.oryzae中性鞘糖脂的开发和应用。因此,研究A.oryzae中性鞘糖脂的合成调控通路,并通过基因工程技术提高中性鞘糖脂的产量将具有非常重要的意义和广阔的应用前景。

