放线菌次级代谢产物研究进展
夏焕章, 翟 航
(沈阳药科大学 生命科学与生物制药学院,辽宁 沈阳 110016)
微生物可以产生结构多样、种类丰富的次级代谢产物,是天然药物研发的宝库,临床上应用的微生物天然药物主要来源于放线菌,这些物质大多具有抗细菌、抗真菌、抗肿瘤、免疫抑制、杀虫等活性,广泛用于医药、农业和食品行业。随着超级耐药细菌的出现和肿瘤发生率的持续升高,深入挖掘微生物次级代谢产物,开发新作用机制和新结构母核的药物前体变得越来越迫切。除此而外,为了降低药物成本,高产菌株的构建是关键。本文从放线菌新结构挖掘和高产菌株构建两个方面对近年来的研究进展进行介绍(图1),为开发放线菌来源的新型药物提供参考。
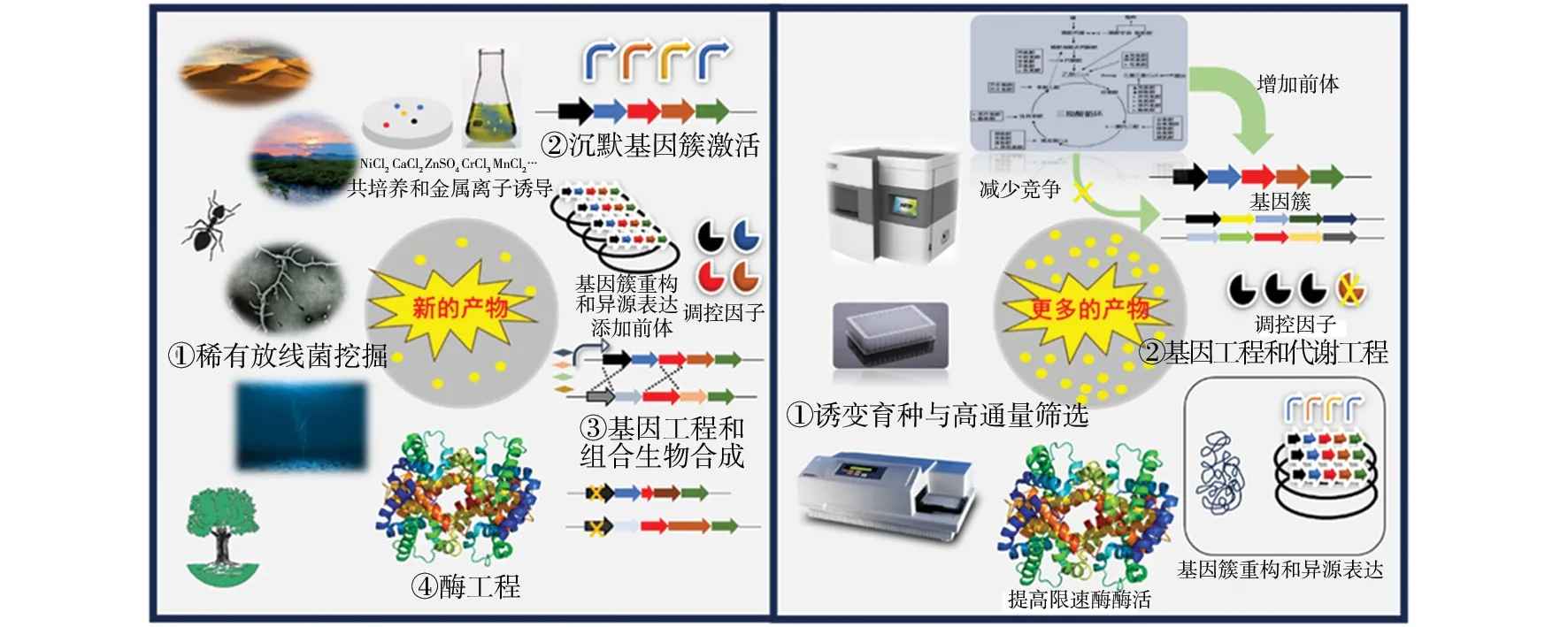
图1 放线菌新结构挖掘和高产菌株构建的策略Fig.1 Strategies for new structure mining and high-yield strain construction of actinomycetes
1 从放线菌中挖掘新结构
放线菌是天然药物的重要来源,有一半的抗菌药物是放线菌来源的,在抗生素发现的黄金时代之后,主要以化学修饰的方式对已发现抗生素的毒性、耐药性、物理化学特性等方面进行优化,出现不断迭代的现象,而从放线菌中分离有价值的新结构分子变得越来越难,因为按照传统的筛菌模式分离得到的多是已发现的结构。拓展放线菌研究范围,深入挖掘陆地和海洋来源的稀有放线菌,进一步优化筛选方式对于先导化合物开发具有指导意义[1]。随着放线菌基因组测序、基因组挖掘和基因编辑技术的成熟,激活大量未表达的沉默基因簇、异源表达实验室条件下不生长微生物的基因簇、组合生物合成策略扩大非天然化合物库、蛋白质工程对关键酶改造等策略[2],对于从放线菌中挖掘新型结构具有重要意义。
1.1 挖掘稀有放线菌和优化筛菌方式
自抗生素发现的黄金时代以来,陆生放线菌一直是抗生素发现的主要阵地。近年来从海洋中分离的稀有放线菌可以产生结构多样的次级代谢产物,具有独特的生物活性,成为抗生素发现的新资源。Subramani等[3]总结了海洋稀有放线菌产生的167种新的生物活性化合物,具有抗菌、抗肿瘤、抗虫、抗疟疾活性,其中小单孢菌属是化学多样性和独特生物活性的最丰富来源。Chen等[4]总结了海洋放线菌分离得到的536个化合物,其中生物碱(37%)、多酮类(33%)和肽类(15%)占比最大,链霉菌属(68%)、小单孢菌属(6%)和诺卡菌属(3%)是次级代谢物的主要生产者。除海洋来源的稀有放线菌,Zhang等[5]对陆生来源和海洋来源的稀有放线菌产生的新天然产物进行了总结,2006~2018年共报道515个新化合物,主要涉及大环内酯类、聚酮类、蒽醌类、联吡啶类、多烯类,这进一步证明稀有放线菌是新结构挖掘的宝贵资源,具有成药潜力的新结构作为先导化合物被进一步研究,Gao等[6]从65 000株放线菌中筛选到一株稀有放线菌Nonomuraeasp. MJM5123,可以产生环肽类抗生素Ecumicin(图2),它对结核分枝杆菌MIC为0.26 μg/mL,并且对利福平、链霉素、环丝氨酸耐受的结核分枝杆菌具有同等的抑菌效力,通过与ClpC1(Caseinolytic protein C1)作用发挥抑菌效果[7]。
传统的筛菌方式是基于抗菌活性的筛选,并不是靶点导向的,这使其在后续研究中面临以下问题:①候选分子渗透性太差或者被细胞外排;②该化合物作用的靶点在哺乳动物中也存在,可能具有毒副作用。为了优化传统的筛选方式,基于靶点的全细胞筛选策略(Target-based Whole Cell Strategy)被用于放线菌新结构的挖掘,其原理是减弱靶点的蛋白表达量会提高该受试菌对抗菌分子的敏感度,如果干扰组(降低表达量)抑菌圈大于不干扰组(不降低表达量),那么该抗菌分子则为该靶点的候选抑制剂。脂肪酸的合成对于细菌生长至关重要,并且脂肪酸合成过程中的酶功能和酶结构在细菌和哺乳动物中不同,这使得脂肪酸合成过程中的酶如FabI、FabF/B、FabH成为重要的抗菌靶点。默克公司建立了基于靶点的全细胞筛选平台,以FabH、FabF、FabB为靶点,从250 000个放线菌或真菌提取液中筛选到抗菌剂Phomallenic acids C[8]、Platensimycin[9]、Platencin[10]对耐甲氧西林金黄色葡萄球菌、耐万古霉素肠球菌均有优异的抑制能力。沈奔团队对Platensimycin和Platencin(图2)的生物合成过程进行研究,二萜合酶PtmT3负责醚环的起源[11],PtmO5负责醚键的形成[12],PtmO1/3/6/8负责羟化、还原和氧化[13],为该类化合物结构优化和产量提高奠定基础。含有噻唑的肽类抗生素早在1954年已经被发现具有良好的抑菌活性,如微球菌素(Micrococcin)、硫链丝菌素(Thiostrepton)等,由于水溶性较差,所以这类化合物并未走向临床,但是其独特的作用模式和较强的抑制耐药菌活性使其再次成为研究热点,Zhang等[14]基于抗性的全细胞筛选设计了一种对噻唑霉素(Thiazomycin)敏感-耐药株的双板活性筛选方案用于筛选噻唑霉素类似物,该方案表现为敏感株抑菌圈大于耐药株抑菌圈,并且非此作用机制的抗生素无这一差异,最后在ActinoplanesphilippinensisMA7347中筛选到新的噻唑骨架Philipimycin,结构鉴定发现含有糖基修饰,作为噻唑霉素衍生物被进一步研究。
1.2 激活沉默基因簇
随着对放线菌基因组数据的深入分析后发现,一个基因组中有大约30~50个基因簇,而90%的基因簇在实验室条件下处于沉默状态。因此,激活放线菌中沉默基因簇是挖掘新结构的有效手段。目前激活沉默基因簇主要分为两个方面,发酵过程方面和基因簇方面。在发酵过程方面包括改变培养基组成、优化培养条件、共培养、添加化学激发子等;在基因簇方面包括敲除或过表达全局性调控子、激活途径特异性调控因子、替换目标基因簇的启动子、异源表达整个基因簇等策略[15]。
金属离子作为化学激发子常常被用于激活沉默基因簇,Shi等[16]从深海热泉喷口处分离到Streptomycessp.WU20,在发酵培养基中添加金属离子后产生了新化合物,具有抑制枯草芽胞杆菌的活性。Akhter等[17]以Streptomycespratensisstrain NA-ZhouS1为研究对象,在100 μmol/L氯化镍激活下可以产生两个新的芳香聚酮类抗生素Stremycin A/B,对铜绿假单胞菌、耐甲氧西林金黄色葡萄球菌(MRSA)、肺炎克雷伯菌的最小抑菌浓度小于16 μg/mL。自然条件下放线菌产生抗生素是为了抑制周围的微生物来争夺更多的生存营养,可以看成是其他微生物的诱导作用激发了放线菌的产抗能力,于是共培养其他微生物来模拟自然界的微生物相互作用也被用于激活沉默基因簇。Carlson等[18]考察了不同类型细菌激活链霉菌沉默基因簇Resistomycin的潜力,变形杆菌的产生率(65%)明显高于厚壁菌门(5.9%)和放线菌门(9.1%)的菌株。Shin等[19]将芽胞杆菌与海洋链霉菌共培养后,分离得到一个新的环肽类化合物Dentigerumycin E,具有抑制肿瘤细胞增殖和迁移的活性。
全局性调控因子在时机适宜时会调控多个基因簇的表达,对菌体生长发育、形态结构、次级代谢产物的形成均有影响,改变全局性调控因子的表达量是激活沉默基因簇的常用策略。目前报道的全局性调控因子包括bld、nsdA、farR1、abrC、ScbR、adpA、crp等。Yushchuk等[20]以StreptomycescyanogenusS136为研究宿主,过表达adpA后激活了Lucensomycin基因簇的表达。Xu等[21]敲除Streptomycesansochromogenes中的adpA后发现,Nikkomycin的合成被抑制,而Oviedomycin基因簇被激活。Ameruoso等[22]使用CRISPRi和CRISPRa技术对委内瑞拉链霉菌内源性调控网络进行干扰,使用CRISPRi敲低jadR2并且使用CRISPRa激活结构基因,成功激活Jadomycin B的产生,通过可编程的工具包对调控网络进行干扰可以有效地激活沉默基因簇。然而,通过全局性调控因子来激活沉默基因并不总是成功的,因为菌体内调控是非常复杂的网络式调节,其细节需要进一步研究。如果将基因簇表达和基因簇调控分开,避开复杂的调控网络,将结构基因置于强启动子下重构基因簇,或者直接在背景较为清晰的模式宿主中表达将是一种有效的手段,但大片段基因的克隆和操纵是技术瓶颈。转化相关重组技术(Transformation-associated recombination,TAR)是利用酿酒酵母体内高效的同源重组作用获得大片段基因簇,这使得异源表达基因簇成为可能。Shao等[23]报道了一种即插即用的沉默簇表达工具,包括启动子模块、辅助模块和结构基因模块,在强启动子作用下高效表达每个结构基因从而重构基因簇,在变铅青链霉菌中成功激活了Spectinabilin的生产。Yamanaka等[24]对Saccharomonosporasp. CNQ-490基因组信息分析时发现一个和达托霉素合成基因高度相似的沉默的NRPS基因簇,利用TAR技术进行大片段克隆并删除推测的负调控基因和非必须基因,然后在天蓝色链霉菌中异源表达,成功获得一个新的脂肽类化合物Taromycin A。由于细菌中的基因表达是成串的,所以激活沉默基因簇中多个结构基因可以看成激活沉默基因簇的多个操纵子,为了将强启动子更容易地嵌入多个操纵子中,Montiel等[25]使用酵母同源重组、基于营养缺陷的酵母选择系统和序列正交启动子盒,开发了一个启动子工程平台,以四环素基因簇验证该方法和天然活性簇效率相当,然后在异源宿主中激活了沉默簇Lzr的表达。Zhang等[26]使用CRISPR-Cas9敲入技术同时在5个链霉菌属中敲入强启动子,激活了S.viridochromogenes基因组中一个Ⅱ型PKS基因簇。
1.3 基因工程和组合生物合成
次级代谢产物的中间体因为含量低而难以分离得到,作为次级代谢产物的类似物可能具有更优良的特性,在生物合成途径解析的基础上,利用基因工程策略可以大量积累次级代谢产物的中间体。Qi等[27]将匹马霉素合成过程中的P450单加氧酶scnG失活后产生了3个匹马霉素类似物:12-脱羧-12-甲基匹马霉素(1)、4,5-脱氧-12-脱羧-12-甲基匹马霉素(2)、3-羟基-4,5-脱氧-12-脱羧-12-甲基匹马霉素(3)。化合物1具有更强的抗真菌活性且毒性降低了4.5倍。制霉菌素类似物NPP A1(Nystatin-likePseudonocardiapolyene A1)被鉴定为一种独特的含有双糖的四烯类抗真菌大环内酯,由假诺卡氏菌(Pseudonocardiaautotrophica)产生[28],其水溶性显著增加,溶血活性降低。Kim等[29]通过定点突变失活了PKS模块5中的烯基还原酶,产生了NPP B1,体外和体内抗真菌活性和毒性研究表明,其对白色念珠菌表现出相当的抗真菌活性,但毒性低于两性霉素B,这表明NPP B1可能是一种很有前途的候选药物。Su等[30]将Ecumicins生物合成基因簇中的ecuN敲除,生成C3位置未羟基化的EcuH16,该化合物具有更好的抗结核杆菌活性。
除了基因工程可以获得新结构,组合生物合成策略也常用于扩展次级代谢产物多样性,这与同源酶的底物宽泛性关系密切。聚酮类化合物的生物合成过程具有“装配线”特征,利用组合生物合成策略将聚酮合成簇中的模块或者结构域进行替换重组,有望合成新型的聚酮类化合物。Ruan等[31]将红霉素基因簇Module 1中的AT domain用特异性识别丙二酰辅酶A的Hyg-AT2(rapamycin cluster)、Ven-AT(pikromycin cluster)、RAPS-AT14(rapamycin cluster)替换,得到C12丢失甲基的12-desmethyl-12-deoxyerythromycin A,将Module 2中的AT domain用特异性识别丙二酰辅酶A的AT替换,得到C10位丢失甲基的10-desmethylerythromycin A和10-desmethyl-12-deoxyerythromycin A。阿维菌素和米贝尔霉素作为杀虫剂被广泛用于农业,但仍然面临耐药问题和毒性问题,伊维菌素B1a是将阿维菌素B1a的C22,23位双键还原得到,保持抗虫活性的同时大大降低毒性。Zhang等[32]将阿维菌素合成簇中的aveDH2-KR2用米贝尔霉素合成簇中的milDH2-ER2-KR2替换,直接在阿维菌素产生菌中发酵生产伊维菌素,产量达(3 450±65) μg/mL。为了进一步获得新的伊维菌素类似物,在上述菌株基础上将加载模块aveLAT-ACP替换为milLAT-ACP,获得了两个新的伊维菌素类似物,它们在C25位保持和米贝尔霉素一致的甲基取代,这两个新化合物按照一定比例混合对抗秀丽隐杆线虫活性比伊维菌素高4.5倍,比米贝尔霉素高2.5倍。糖基化修饰对于活性和物理化学特性至关重要,Malmierca等[33]将6种不同的脱氧糖合成基因导入Sipanmycins产生菌中,形成了6种新型Sipanmycins类似物,在失活L-谷氨酸合成酶后补加不同类型的 β-氨基酸期望定向替换天然的起始单元,添加3-氨基戊酸时获得两个新化合物,活性研究时发现有4个新化合物抗金黄色葡萄球菌活性提高,抗肿瘤活性相当或降低。
1.4 拓展关键酶的底物谱
聚酮类化合物具有类似的碳骨架合成过程,酰基转移酶(Acyltransferase,AT)、酮合酶(Ketosynthase,KS)、酰基载体蛋白(Acyl carrier protein,ACP)负责在聚酮链合成中添加延伸单元,组合的酮还原酶(Ketoreductase,KR)、脱氢酶(Dehydratase,DH)、烯还原酶(Enoylreductase,ER)、甲基转移酶(Methyltransferase,MT)负责改变酮基氧化态,硫酯酶(Thioesterase,TE)负责释放和环化聚酮骨架,经过糖基修饰后得到结构多样的聚酮类化合物,所以聚酮结构多样性与AT识别底物多样性、β -酮基氧化态、聚酮链长度、后修饰过程等因素关系密切[34]。一般情况下AT只识别丙二酰辅酶A和甲基丙二酰辅酶A,如果可以扩展酰基转移酶的底物谱将有望合成新型的聚酮骨架,但是AT蛋白质工程仍然面临机制不清楚的问题,Li等[35]解析SpnD-AT晶体结构,通过点突变对底物识别残基Q150/Y278/S280进行研究,并且对红霉素合成过程中的Ery-AT6进行改造,得到突变体Y278G/S280G对戊炔基丙二酰辅酶A、庚烯基丙二酰辅酶A和苄基丙二酰辅酶A识别能力增强,这为拓展聚酮骨架获得新型聚酮化合物提供参考。TE负责聚酮链的释放和骨架环化,而对非天然底物不进行环化,Koch等[36]对Pikromycin PKS中的硫酯酶进行结构分析,获得突变体TES148C可以识别天然底物的异构体C11-OH(S),产生苦霉素异构体,这为拓展硫酯酶底物谱获得新聚酮结构提供参考。
2 提高放线菌的产抗能力
从自然界分离得到的菌株生产活性物质的能力一般不高,这不仅无法满足工业需求,而且会增加分离纯化的成本,所以,在新结构挖掘的基础上提高该宿主菌产抗能力成为首要任务。传统的诱变-筛选育种过程费时费力,若结合新技术对诱变过程和筛选过程进行优化则可大大提高效率,再对其发酵培养基和发酵过程进行优化可以显著提高产抗水平。在分子层面,使用基因工程和代谢工程策略对菌株的初级代谢和次级代谢过程进行改造成为构建高产菌株的有效手段,这主要包括改变调控因子的表达量,增加前体供应,减少竞争途径的分流,提高限速酶的酶量和酶活、基因簇重构和异源表达,进一步将上述策略组合最大限度地激发宿主的产量能力。
2.1 诱变育种和发酵优化策略
通过诱变育种筛选高产菌株虽然面临工作量大、耗时耗力等问题,但仍然是提高放线菌产抗能力的有效策略。除了传统的物理诱变(紫外线、X射线)和化学诱变(亚硝基胍、甲基磺酸乙酯)外,常压室温等离子体技术(atmospheric and room temperature plasma,ARTP)在微生物诱变育种中的应用越来越广泛。依据产物的物理化学性质(紫外吸收、易反应基团)或生物性质(抗菌活性)建立高通量筛选方法是优化筛选过程的关键,培养基优化和发酵过程优化被用于进一步提高目标化合物产量。Streptomyceshygroscopicus可以生产大环内酯类化合物FK520,具有良好免疫抑制活性,Yu等[37]以S.hygroscopicusATCC 14891为出发菌株,通过ARTP诱变筛选到高产菌株SFK-36,结合响应面法优化培养基使FK520产量从373 mg/L提高到1 588 mg/L。随后,以SFK-36为出发菌株,将紫外线诱变与链霉素抗性筛选相结合[38],筛选到菌株SFK-6-33,使FK520产量从1 588 mg/L提高到2 432 mg/L。Yu等[39]开发了一种利用链霉素抗性预筛选(8 g/mL)和24孔板微孔板读数器(台盼蓝分光光度法)重筛选策略的高通量筛选方法,通过六轮ARTP诱变,筛选到一株高产新霉素的突变株Sf6-2,效价为(7 780±110) U/mL,优化发酵培养基后效价增加到(10 849±141) U/mL。
2.2 基因工程和代谢工程策略
2.2.1 调控因子 Smanski等[40]鉴定了Platensimycin和Platencin的生物合成基因簇,敲除负调控子ptmR1后产量提高100倍,二者产量分别为(323±29) mg/L和(255±30) mg/L。StreptomycesrimosusM527可以生产多烯大环内酯抗生素龟裂霉素(Rimocidin),可有效防治多种植物真菌病害。Liao等[41]敲除该菌中的全局性调控因子nsdA,龟裂霉素产量提高46%,结构基因的转录水平均上调,并且菌丝分化速度加快。米贝尔霉素因具有良好的杀虫活性被用于农业,Streptomyceshygroscopicus发酵产生Milbemycin A3/A4和5-oxo-Milbemycin A3/A4,后者是米贝尔霉素化学修饰的重要前体,Wei等[42]发现milR2是5-oxo-Milbemycin A3/A4生产的正调控因子,敲除milR2后5-oxo-Milbemycin A3/A4的生成减少了39%,过表达milR2后5-oxo-Milbemycin A3/A4的生成增加了34%。Streptomycesavermitilis产生的阿维菌素也是一种重要的杀虫剂,Liu等[43]发现TerR家族的aveT是阿维菌素生物合成的正调控因子,通过激活簇内的avrR、抑制转膜外排蛋白aveM来促进阿维菌素的生成,进一步在阿维菌素工业菌株A-178中过表达aveT,产量提高22%;敲除aveM,产量提高42%(11 400 mg/L)。
2.2.2 前体供应和竞争路径 宿主积累前体物质的能力影响宿主产抗能力,前体物质主要是从单糖、脂肪酸、氨基酸等营养物质转化而来,通过前体喂养、操纵前体合成中的限速酶、改变前体竞争途径的流向是增加前体供应的常用手段。乙酰辅酶A、丙二酰辅酶A、甲基丙二酰辅酶A是聚酮类化合物的重要前体,Yu等[38]在StreptomyceshygroscopicusSFK-6-33基础上过表达内源性巴豆酰辅酶A羧化酶FkbS增加乙基丙二酰辅酶A,过表达乙酰辅酶A羧化酶ACCase来增加丙二酰辅酶A,使FK520产量从2 432 mg/L进一步提高到3 511 mg/L。支链脂肪酸降解后可以产生大量乙酰辅酶A前体,支链α-酮酸脱氢酶(Branched chain α-keto acid dehydrogenase,BCDH)和乙酰辅酶A脱氢酶(acyl-CoA dehydrogenase,ACDH)可以将亮氨酸、异亮氨酸和缬氨酸转化为乙酰辅酶A前体,并在聚酮合成过程中受到脂肪酸合成路径(FAS)的竞争,为了降低FAS竞争路径的关键酶KASIII的表达量,Yi等[44]将KASIII启动子替换为弱启动子PSCO1214,过表达BCDH和ACDH,Pikromycin产量提高1.3倍,三羧酸循环中的琥珀酸辅酶A在甲基丙二酰辅酶A变位酶(Methylmalonyl-CoA mutase, MCM)转化下生成甲基丙二酰辅酶A,将BCDH和MCM同时过表达,Pikromycin产量提高2.3倍。
2.2.3 限速酶的酶量和酶活 在多步的生物合成过程中,某一步生化反应可能受到终产物或中间产物抑制、簇内簇外调控等因素而成为次级代谢产物合成中的限速步骤,有目的地增加限速酶的含量或者提高限速酶的活性有望提高发酵产物的发酵水平。在红霉素A合成的两条途径中,若Eryk先对C12位羟基化,然后EryG在C3″-OH进行甲基化会产生中间体红霉素C,若先进行甲基化再进行羟基化会产生中间体红霉素B,二者生物活性低且副作用大,是红霉素A分离纯化中的主要杂质,Chen等[45]通过调节羟化酶EryK和甲基转移酶EryG的酶量,几乎完全消除了红霉素B和C的生成,并将红霉素A的产量提高了25%。糖肽类抗生素(Chloroeremomycin)A82846是半合成抗生素奥利万星的关键前体,主要由AmycolatopsisorientalisSIPI18099发酵生产,而A82846A(63.6%)和A82846C(12%)是发酵过程中的主要杂质,3个化合物的差异在于含有氯原子的数目不同,A82846的氯原子含量最多,卤化酶活性不足可能是杂质积累的主要原因,过表达卤化酶chal并增加其拷贝数[46],杂质A82846A(22.5%)和A82846C(1%)均大幅减少,A82846B成为主成分(831 mg/L),含量提高23%。Li等[47]在构建多杀菌素异源表达菌株时,产生了一半的多杀菌素B(N端单甲基)杂质,过表达甲基转移酶SpnS后杂质几乎不再产生,进一步过表达限速酶SpnP来加强SpnS的产物消耗,使多杀菌素A产量提高5.3倍(5 800 μg/L),杂质减少90%。Zhang等[48]将甲基转移酶EgtD、裂解酶EgtE和亚砜合酶TncEgt1在大肠埃希菌中表达,可以产生70 mg/L的麦角硫因。基于麦角硫酶分解麦角硫因产生有紫外吸收的羧酸衍生物原理建立了高通量筛选方法,对TNcEgt1和EgtD进行定向进化以提高酶活,最优突变体MD4产生290 mg/L的麦角硫因,在5 L发酵罐中进行发酵过程优化后产量可达到5.4 g/L。
2.2.4 异源表达和基因簇重构 除了用上述策略对天然宿主改造外,将感兴趣的基因簇在遗传背景清晰、基因操作成熟的模式宿主中表达是挖掘新结构、研究生物合成途径、生成更多次级代谢产物的常用策略,而大片段克隆技术是实现上述过程的基础。从BAC衍生的pStreptoBAC载体被用于克隆达托霉素基因簇[49],使用已表征的基因探针在玫瑰孢链霉菌基因组文库中钓取到128 kb的达托霉素基因簇,鉴定了3个关键的合成基因,并在变铅青链霉菌中成功表达。通过限制性酶切位点将大片段连接到含有穿梭和表达元件的载体上效率较低,体内同源重组被用于大片段质粒的构建,如在大肠埃希菌中RecET介导的线-环同源重组(Linear and Circular Homologous Recombination,LCHR),Jones等[50]利用该技术将链霉菌穿梭和表达元件pIB139AF2通过融合和重组两步安装到含有FK506完整基因簇的pBAC-FK506骨架上,并在S.albusJ1074宿主中成功整合。Song等[51]重构了多杀菌素合成基因簇,将23个结构基因分为7个操纵子,分别置于组成型强启动子下,将其在白色链霉菌中异源表达,相比于异源表达原始基因簇,重构多杀菌素基因簇后产量提高了328倍,达到1 116 μg/L。
2.2.5 多策略的组合 将上述提及的多种策略进行组合搭配可以最大限度地激发放线菌产抗能力。Li等[52]以转录组数据为依据,过表达正调控因子TetR1、过表达簇中的限速酶、减弱糖原合成路径、增强糖原磷酸化路径来提供更多的前体物质G-1-P,使阿卡波糖产量从1.74 g/L提高到2.92 g/L,在发酵罐中分批补加葡萄糖和麦芽糖,阿卡波糖产量可以达到8.04 g/L。米卡芬净作为棘白菌素类抗真菌剂被广泛用于治疗侵袭性真菌感染,FR901379是米卡芬净化学合成的原料,Men等[53]表达限速酶McfF和McfH来优化FR901379的生物合成途径,消除不需要的副产物,过表达转录激活因子McfJ,FR901379的产量从0.3 g/L提高到1.3 g/L,共表达mcfJ、mcfF和mcfH后进一步在5 L发酵罐中优化分批补料条件,FR901379的产量达到4.0 g/L。为了提高FK506的发酵水平,Wu等[54]基于基因组测序和分析,删除了假定的竞争途径、重构FK506生物合成基因簇、增加前体供应,使FK506产量从140.3 mg/L增加到603 mg/L,对其发酵过程进一步优化后,在15 L发酵罐中FK506产量可达830.3 mg/L。
3 展 望
放线菌次级代谢产物在医疗、农业、食品等领域具有广阔的应用价值,从批准上市的抗菌药物来看,放线菌仍然是产生结构新颖、效果显著的药物分子的主力军。在耐药菌广泛存在,新型细菌、新型病毒不断出现的大背景下,开发新药和提高产量是放线菌药物资源开发的两大主要目标。深入挖掘稀有放线菌资源、优化传统的筛菌模式是放线菌新药资源开发的方面之一,在分子水平对次级代谢产物合成的基因簇进行研究具有重要意义。在提高放线菌产抗能力策略中,在传统诱变育种的基础上取长补短,建立灵敏高效的筛选方法并结合抗性筛选是提高产量的有效策略。在阐明生物合成途径的基础上通过基因工程和代谢工程来组合多种高产策略,如增加或降低调控子的表达、增加前体供应、减少竞争途径、增加限速酶的酶量和酶活是构建高产菌株的一般策略,但这仍然是基于次级代谢产物生物合成过程有限的知识之上。近年来,DNA测序和合成成本的下降,基因组学、转录组学、蛋白质组学的出现,生物信息学的快速发展,基因编辑技术的不断更新为我们更深入地了解菌体复杂的代谢网络奠定了基础,这对于放线菌新药开发和产量提高具有重要的意义。

