响应面法优化杀鱼假交替单胞菌2515发酵培养基
王枫林, 王秀华, 2*, 朱 娜, 张红芳
(1.中国水产科学研究院黄海水产研究所 农业农村部海水养殖病害防治重点实验室青岛市海水养殖流行病学与生物安保重点实验室, 山东 青岛 266071;2.青岛海洋科学与技术试点国家实验室 海洋渔业科学与食物产出过程功能实验室,山东 青岛 266071)
近年来,随着海水养殖业的快速发展,病害问题越来越严重[1]。弧菌病是最常见的细菌性疾病,给全球海水养殖业带来了巨大经济损失[2-5]。虽然抗生素等药物对弧菌病具有一定的防控效果,但也会带来细菌耐药性、药物残留、养殖环境污染等问题[6]。益生菌作为一种微生态制剂,具有促进养殖动物的消化吸收、抑制病原菌生长、改善养殖水质、增强机体免疫力等功能[7-8]。假交替单胞菌(Pseudoalteromonassp.)是一种广泛存在海洋中的细菌,能够产生多种胞内外活性物质,包括胞外酶、胞外毒素、抗生素、胞外多糖及小分子化合物等,具有抑菌、溶藻、杀菌、降解琼脂及防污等功能,是一种潜在的益生菌[9-11]。为了提高假交替单胞菌的发酵生物量,增加其功能化合物的产生,已有学者对该属菌株进行了发酵培养基优化的研究[12-14]。有关培养条件对微生物生物量及抑菌活性影响的研究已有大量报道[15-18],但是培养条件对假交替单胞菌抑菌活性的影响研究较少。孙星等[19]优化了假交替单胞菌SW-1的培养条件,确定了该培养条件能够提升其生物量和抑制弧菌效果。詹萍年等[20]优化了假交替单胞菌JIV-49的发酵条件,提高了其抗真菌活性物质的活性。中国水产科学研究院黄海水产研究所海水养殖流行病学与生物安保重点实验室从对虾养殖池中分离筛选出1株拮抗菌杀鱼假交替单胞菌(Pseudoalteromonaspiscicida)2515,其分泌的胞内外物质具有广谱的抗弧菌效果,并且该菌培养物添加到养殖水体和饲料中能够减少养殖对虾肠道内的弧菌数量,提高对虾感染副溶血弧菌(Vibrioparahaemolyticus)的成活率[21-22], 在水产养殖弧菌病防控方面具有较大的应用价值与开发潜能。但是有关杀鱼假交替单胞菌2515的发酵培养基的最佳配方尚不明确,从而限制了该菌株的后续开发。因此,本研究对菌株2515进行碳源、氮源、无机盐筛选并通过响应面法优化了其最佳发酵条件,并以鳗弧菌(Vibrioanguillarum)为指示菌,探究其抑菌活性的变化,为后续新型水产饲料添加剂开发提供参考。
1 材料与方法
1.1 材料
1.1.1 供试菌株 杀鱼假交替单胞菌(Pseudoalteromonaspiscicida)2515菌株(简称菌株2515)由中国水产科学研究院黄海水产研究所病研室分离鉴定,保藏于中国典型培养物保藏中心保藏(CCTCC NO. M2020731);鳗弧菌(Vibrioanguillarum)MN保藏于中国微生物菌种保藏管理委员会普通微生物中心(CGMCC NO. 7198)。
1.1.2 培养基(g/L) ①活化培养基(2216E):蛋白胨5,酵母膏1,FePO4·4H2O 0.01,陈海水(洁净的天然海水黑暗静置数周得到的海水,其化学元素与海水相同,使用时取上层水体)定容至1 L,调节pH 7.6~7.8。②基础发酵培养基(液体LB):蛋白胨10,酵母膏5,NaCl 10,蒸馏水定容至1 L。
1.1.3 主要试剂与仪器设备 胰蛋白胨、酵母膏(OXOID,Thermo Scientific有限公司);NaCl、葡萄糖、蔗糖、乳糖、麦芽糖、可溶性淀粉、尿素、(NH4)2SO4、大豆蛋白胨、牛肉膏、MgSO4、FeSO4、FeCl3·6H2O、MnCl2、CaCl2、KH2PO4和ZnCl2(国药集团化学试剂有限公司)。恒温震荡培养箱(智诚ZHWY-2102,上海智城分析仪器制造有限公司);超净工作台(SW-CJ-2FD,苏州安泰空气技术有限公司);高压灭菌锅(SX-500,TOMY KOGYO CO., LTO);生化培养箱(SHP-080,上海精宏实验设备有限公司)。
1.2 方法
1.2.1 菌株活化 将保藏的菌株2515从-80 ℃超低温冰箱冰盒取出,用无菌接种环蘸取菌液接种到2216E平板中,28 ℃培养 24 h。
1.2.2 种子液的制备 挑取固体平板上经活化的单菌落,接种至装液量为 200 mL 种子培养基的 500 mL 锥形瓶中,28 ℃、150 r/min 振荡培养16 h。
1.2.3 细菌生物量测定 取200 μL发酵24 h的菌株2515发酵液到96孔细胞培养板中,用酶标仪测量OD600值,表示细菌生物量。
1.2.4 单因素实验 ①盐度的筛选:通过调整LB液体培养基中NaCl的浓度,配置盐度梯度为0、1%、2%、3%、4%、5%、6%、7%(体积分数,下同)的培养基,每个梯度3个重复,将种子液以1%的接种量接入200 mL发酵培养基中, 28 ℃、150 r/min培养24 h后,测定OD600值,确定最佳盐度。②碳源的筛选:LB液体培养基中分别添加葡萄糖、蔗糖、乳糖、麦芽糖、可溶性淀粉5种碳源,每种碳源分别设置 5、10、15、20 g/L 4个浓度,以不添加碳源的液体LB培养基做对照,每个浓度 3 个重复,将种子液以1%的接种量接入200 mL发酵培养基中,28 ℃、150 r/min培养24 h后测定OD600值,确定最佳碳源。③氮源的筛选:LB液体培养基中分别添加胰蛋白胨、尿素、(NH4)2SO4、大豆蛋白胨、牛肉膏4种氮源,分别设置 5、10、15、20 g/L 4个浓度,每个浓度 3 个重复,将种子液以1%的接种量接入200 mL发酵培养基中,28 ℃、150 r/min培养24 h后测定OD600值,确定最佳氮源。④无机盐的筛选:LB液体培养基中分别添加MgSO4、FeSO4、FeCl3·6H2O、MnCl2、CaCl2、KH2PO4和ZnCl27种无机盐,分别设置 0.25、0.5、0.75、1 g/L 4个浓度,以不添加无机盐的LB液体培养基做对照,每个浓度3个重复, 将种子液以1%的接种量接入200 mL发酵培养基中,28 ℃、150 r/min培养24 h后测定OD600值,确定最佳无机盐。⑤酵母膏的筛选:将LB基础培养基中酵母膏的添加量设为0、2.5、5、7.5、10、12.5、15 g/L 7个浓度,每个浓度3个重复,将种子液以1%的接种量接入200 mL发酵培养基中,28 ℃、150 r/min培养24 h后测定OD600值,确定最佳酵母膏浓度。
1.2.5 Plackett-Burman(PB) 试验设计 在单因素优化试验结果的基础上,对影响菌株2515发酵培养基的主要因素蔗糖(A)、可溶性淀粉(B)、麦芽糖(C)、胰蛋白胨(D)、CaCl2(E)、MnCl2(F)、盐度(G)、酵母膏(H),采用Factors=8和 Runs=12 的 Plackett-Burman(PB)设计,对这8个因素进行研究,另外3个因素为虚拟变量,用于估计误差。每个因素取高低2 个水平,根据单因素实验确定各因素水平的值,每组设3个重复,按照表1进行发酵实验,结果用OD600表示。采用Design-Expert 11软件进行试验设计和数据分析。

表1 Plackett-Burman 试验设计Table 1 Experimental design of Plackett-Burman
1.2.6 最陡爬坡实验 在单因素优化试验和 PB 试验的基础上,筛选出对发酵水平影响显著的 4个因素,确定基础发酵条件,根据 PB 试验中效应值选定爬坡方向,设定步长,进行最陡爬坡试验。吸光值最大的取值作为下一步实验的中心点。
1.2.7 响应面 Box-Behnken 实验设计 根据PB 试验和最陡爬坡实验结果,确定具有显著性的 4 因素为变量,以生物量大小为响应值,运用 Design-Expert设计 4因素 3 水平共 29个试验点的Box-Behnken 响应面分析试验。响应面法采用多元二次方程拟合因素和响应值之间的函数关系,通过对回归方程的分析寻求最优实验因素,并对模型进行验证,以得到菌株2515的最优发酵培养基。
1.2.8 抑菌活性的测定 抑菌活性的测定参照文献[22] ,具体步骤:取50 mL发酵液于无菌离心管中,6 000 r/min离心10 min,离心后获得的菌体,用PBS缓冲液洗涤2次后,加10 mL PBS缓冲液重悬,用超声波细胞破碎仪破碎10 min (150 W),使菌液澄清。澄清菌液经 0.22 μm 孔径的细菌过滤器过滤除菌,即获得细胞内容物。取浓度为107cfu/mL的鳗弧菌菌悬液100 μL 均匀涂布于2216E平板上,在牛津杯孔里加入100 μL发酵上清液和细胞内容物,再以普通LB培养基上清液和细胞内容物为对照,设置3个平行,28 ℃培养24 h,采用十字交叉法测量抑菌圈直径。
2 结果与分析
2.1 单因素优化结果
2.1.1 盐度的筛选 盐度的筛选结果见图1,当盐度为0时,菌株2515不生长,当盐度从1%递增到7%时,菌株2515的OD600值呈现递减趋势,在盐度为1%时有最大OD600值1.17,确定发酵盐度为1%。

图1 盐度对菌株2515发酵产量的影响Fig.1 Effect of salinity on the growth of strain 2515
2.1.2 碳源的筛选 碳源的筛选结果见图2,添加不同浓度乳糖和葡萄糖发酵液的OD600值低于对照组,说明对菌株2515具有抑制作用。添加不同浓度的蔗糖和可溶性淀粉的OD600值高于对照组,其中5 g/L的蔗糖和10 g/L的可溶性淀粉OD600最大值分别为1.17和1.20。添加麦芽糖组中,浓度为20 g/L的OD600低于对照组,其他组高于对照组,10 g/L组有最大值1.23。故发酵碳源可选择5 g/L的蔗糖、10 g/L的可溶性淀粉和10 g/L麦芽糖。

图2 碳源对菌株2515发酵产量的影响Fig.2 Effect of carbon source on the growth of strain 2515
2.1.3 氮源的筛选 氮源的筛选结果见图3,添加各浓度胰蛋白胨的发酵液OD600值最大,大豆蛋白胨和牛肉膏次之,尿素和硫酸铵最低,在尿素中菌株2515不生长。其中,胰蛋白胨组OD600值随着浓度的增加先增加后减少,胰蛋白胨为10 g/L时,有最大值1.20。所以发酵氮源选择10 g/L胰蛋白胨。

图3 氮源对菌株2515 发酵产量的影响Fig.3 Effect of nitrogen source on the growth of strain 2515
2.1.4 无机盐的筛选 无机盐的筛选结果见图4,在培养基中添加Ca2+、Mn2+时,菌株2515的OD600值高于对照组,且表现出随着离子浓度的升高,OD600变小的趋势,Ca2+和Mn2+均在0.25 g/L时,分别有最大值1.30和1.15。添加K+时,OD600值和对照组数值基本一致,对菌株2515的生长无影响。Mg2+、Fe2+、Fe3+和Zn2+的OD600值均低于对照组,表明这些离子对菌株2515的生长具有抑制作用。所以发酵无机盐选择0.25 g/L CaCl2和0.25 g/L MnCl2。

图4 无机盐对菌株2515发酵产量的影响Fig.5 Effect of metal ion on the growth of strain 2515
2.1.5 酵母膏最适浓度的筛选 酵母膏最适浓度的筛选结果见图5,不添加酵母膏的对照组OD600值明显低于添加的组别,并且各组OD600随着添加酵母膏浓度的增加呈先升高后下降,在浓度为12.5 g/L时,OD600最大为1.25,故在发酵培养时选择12.5 g/L的酵母膏。

图5 酵母膏浓度对菌株2515 发酵产量的影响 Fig.5 Effect of yeast extract on the growth of strain 2515
2.2 Plackett-Burman 实验设计结果分析
Plackett-Burman实验设计见表2,分析结果见表3。由表3的P值可知,对菌株2515发酵OD600有显著影响的因素依次是C>F>H>E,即麦芽糖>MnCl2>酵母膏>CaCl2,确定这四个因素作为下一步的关键因素。

表2 Plackett-Burman实验设计Table 2 Design of Plackett-Burman
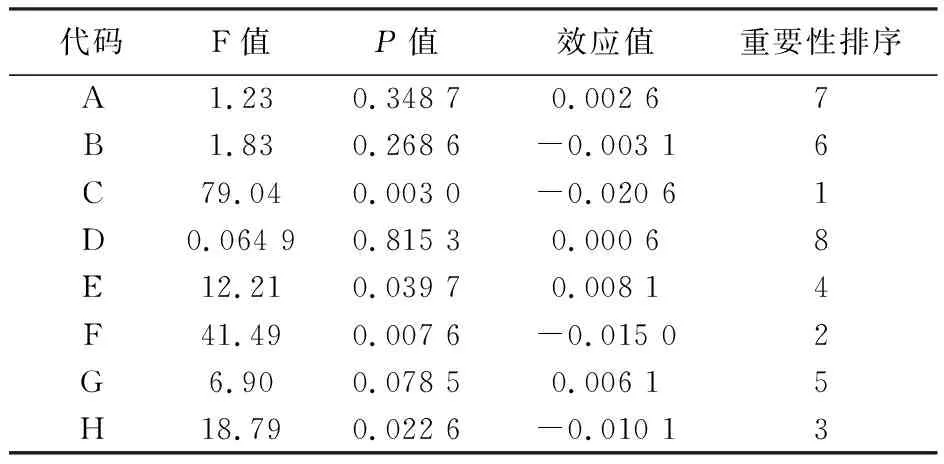
表3 Plackett-Burman实验分析结果Table 3 Results of Plackett-Burman experiment
2.3 最陡爬坡实验
根据表3中C、F、H和E四个因素的效应值,确定麦芽糖、MnCl2和酵母膏具有负效应,应依次减小;CaCl2具有正效应,应依次增大。爬坡实验结果见表4,表4结果表明随着麦芽糖、MnCl2和酵母膏浓度依次减小,CaCl2浓度依次增大,菌株2515的生物量呈现先增大后减小的变化。当麦芽糖含量为3 g/L、CaCl2含量为0.65 g/L、MnCl2含量为0.15 g/L、酵母膏含量为4 g/L时,菌株2515的OD600达到最大值1.293,为4因素的最大响应值区域。因此以表4中实验号5各因素水平为中心值设计后续响应面实验。
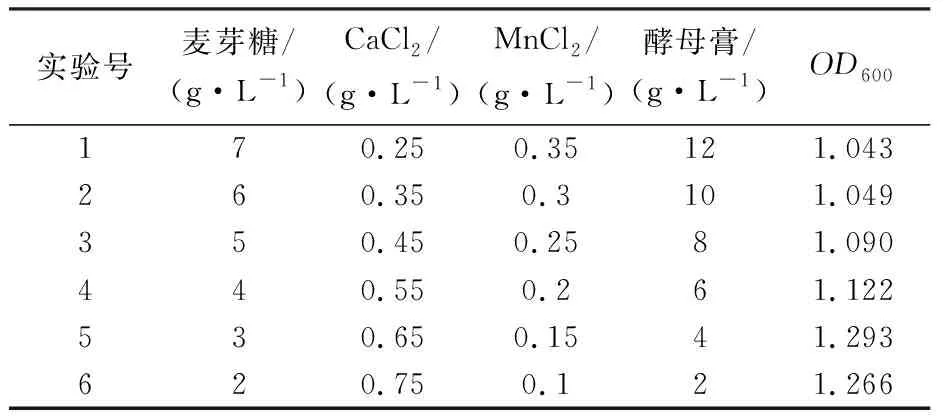
表4 爬坡实验结果Table 4 Results of climbing test
2.4 响应面设计结果与分析
四个重要因子的最适浓度范围确定后,以麦芽糖3 g/L、CaCl20.65 g/L、MnCl20.15 g/L、酵母膏4 g/L为中心点进行响应面分析。各自变量水平见表5,Box-Behnken设计及结果分析见表6和表7。该二次模型多元相关性系数R2=0.985 2,表明98.52%的菌株2515生物量变化可以用此模型解释,回归模型P<0.000 1,表明模型是极显著的,失拟项P值为0.400 4,表明失拟不显著,因而该模型拟合程度好,实验误差小,可用于预测最优发酵条件参数。一次项C、F、H影响达到极显著水平(P<0.01),E影响显著(P<0.05);交互项CE、CH、EH、FH影响达到极显著水平(P<0.01),CF和EF不显著(P>0.05);二次项C2、E2、H2影响达到极显著水平(P<0.01),F2影响显著(P<0.05)。表明各因素对菌株2515生物量的影响不是简单的线性关系。经回归拟合后,得到二次多项式方程:R=1.400 894-0.037 61C-0.010 339E-0.036 537F+0.030 258 875H+0.079 288 75CE-0.009 056 625CF+0.028 287 625CH-0.000 792 5EF-0.043 037 5EH+0.057 817 5FH-0.078 832 625C2-0.088 135 125E2-0.013 304 187 5F2-0.104 561 812 5H2。

表6 Box-Behnken 设计及结果Table 6 Design and results of Box-Behnken

表7 Box-Behnken 设计回归分析Table 7 Regression analysis of Box-Behnken design
根据上述回归方程作出响应面分析图和相应的等高线图(图6~11),因素交互作用的响应面图均为开口向下的凸型曲面,有极大值点。图6为麦芽糖和CaCl2对菌株2515OD600的等高线和响应图,等高线图形状为椭圆,表明麦芽糖和CaCl2两个变量之间的交互效应较强。图7为麦芽糖和MnCl2对菌株2515OD600的等高线和响应图,等高线图形状近圆形,表明麦芽糖和MnCl2两个变量之间的交互效应较弱。图8为麦芽糖和酵母膏对菌株2515OD600的等高线和响应图,等高线图形状为椭圆,表明麦芽糖和酵母膏两个变量之间的交互效应较强。图9为CaCl2和MnCl2对菌株2515OD600的等高线和响应图,等高线图形状近圆形,表明CaCl2和MnCl2两个变量之间的交互效应较弱。图10为CaCl2和酵母膏对菌株2515OD600的等高线和响应图,等高线图形状为椭圆,表明CaCl2和酵母膏两个变量之间的交互效应较强。图11为MnCl2和酵母膏对菌株2515OD600的等高线和响应图,等高线图形状为椭圆,表明MnCl2和酵母膏两个变量之间的交互效应较强。

图6 麦芽糖和CaCl2的等高线和响应图Fig.6 Contour line and response surface of maltose and CaCl2

图7 麦芽糖和MnCl2的等高线和响应图Fig.7 Contour line and response surface of maltose and MnCl2
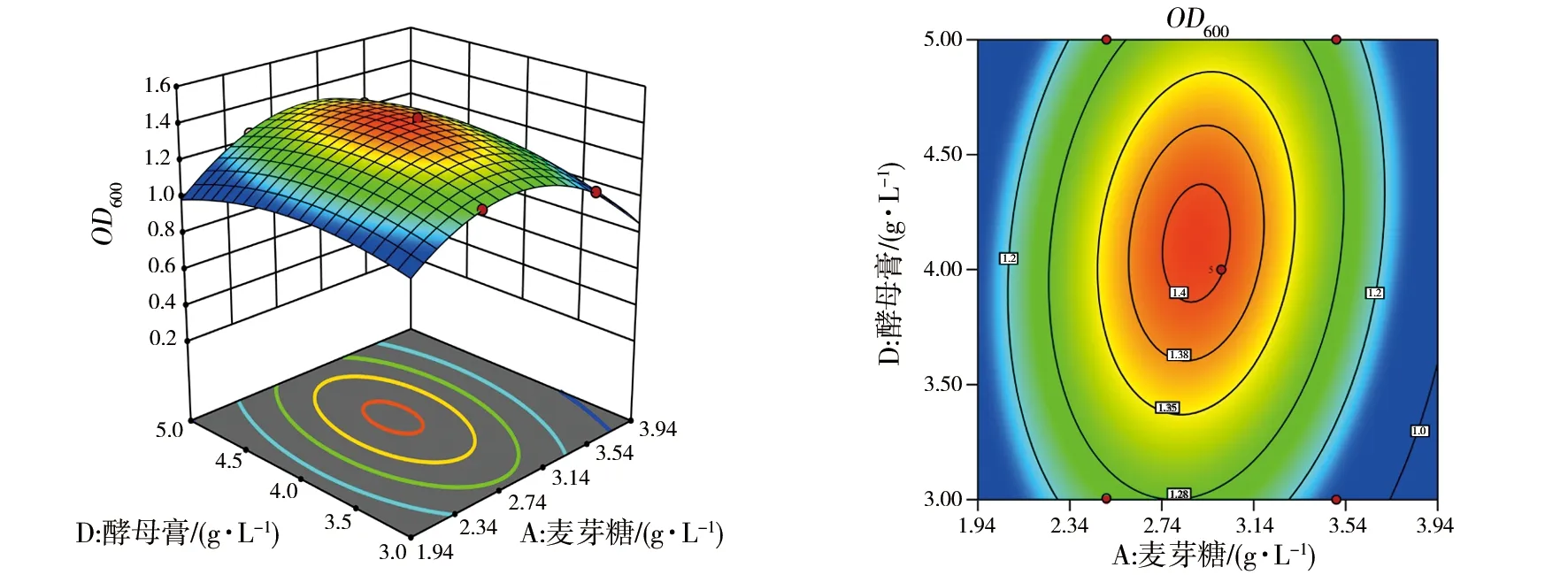
图8 麦芽糖和酵母膏的等高线和响应图Fig.8 Contour line and response surface of maltose and yeast extract

图9 CaCl2和MnCl2的等高线和响应图Fig.9 Contour line and response surface of CaCl2 and MnCl2
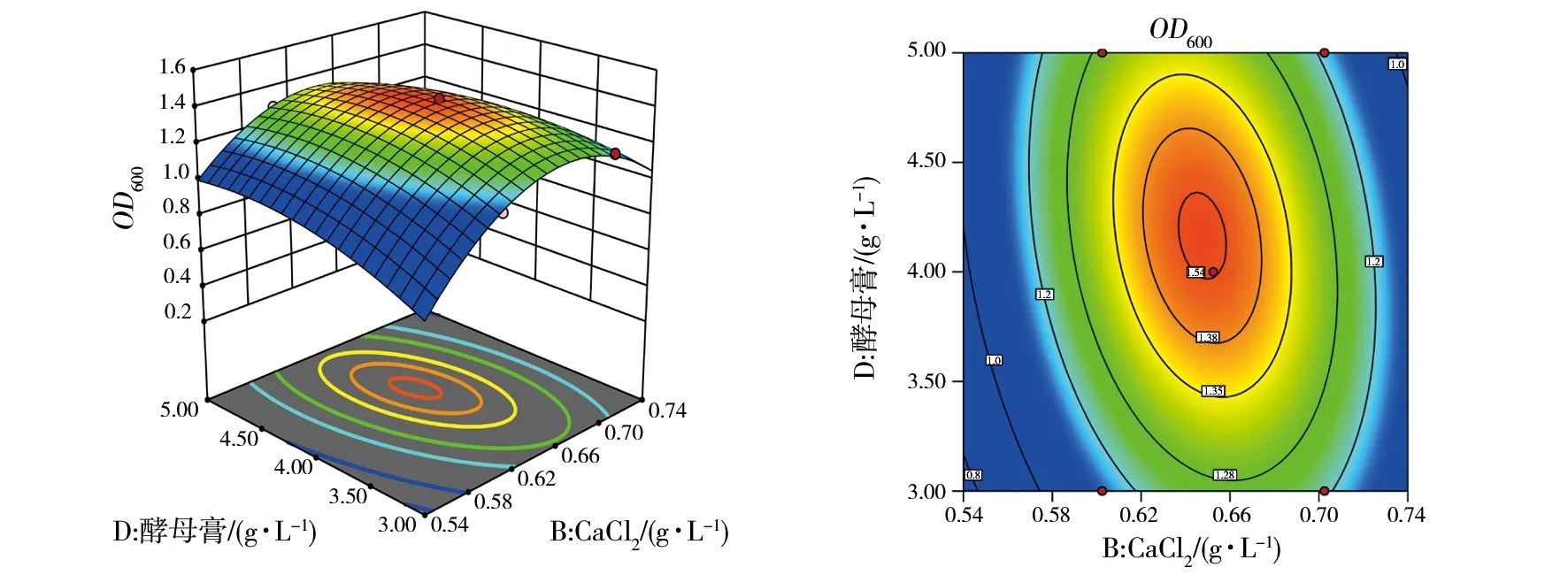
图10 CaCl2和酵母膏的等高线和响应图Fig.10 Contour line and response surface of CaCl2 and yeast extract
2.5 验证实验
由模型可得最佳培养基组合:麦芽糖2.860 g/L、CaCl20.643 g/L、MnCl20.100 g/L、酵母膏3.860 g/L,菌株2515OD600预测值为1.431。为了保证试验的方便可行,对各个条件做少许修正进行验证实验,麦芽糖2.85 g/L、CaCl20.65 g/L、MnCl20.10 g/L、酵母膏3.85 g/L进行验证试验,实验重复3次,结果菌株2515在锥形瓶中发酵的OD600值为1.416,发酵生物量提高了36.4%;菌株2515在5 L发酵罐发酵的OD600值为1.866,发酵生物量提高了40.4%,表明该模型能够准确地预测菌株2515的发酵生物量。
2.6 抑菌活性的测定
菌株2515在优化后的培养基中进行发酵,其发酵上清液和细胞内容物抑菌活性结果见图12,优化后培养基培养的菌株2515上清液抑菌圈直径为14.1 mm,细胞内容物抑菌圈为14.5 mm,显著高于对照组LB培养基的该菌株上清液抑菌圈(11.0 mm)和细胞内容物抑菌圈(11.4 mm)(P<0.05),抑菌活性分别提高了28.2%和27.2%。

图12 优化后培养基与LB培养基的菌株2515抑菌圈对比Fig.12 Comparison of bacteriostatic circle of strain 2515 between optimized medium and LB medium不同小写英文字母代表不同组间存在显著差异,P<0.05The diferent letters indicate significant difference,P<0.05
3 讨 论
微生物的增殖与其培养环境密切相关[23]。发酵培养基中的营养成分、盐度、pH、培养温度及接种量等都可以影响细菌的生物量[24-25],因此培养基的优化是提高微生物发酵产量的重要方法之一。优化发酵培养基的主要方法有单因素法、正交法和响应面法等。单因素法只是对一种因素进行优化,没有将各因素之间的交互作用综合考虑,所得的培养基多为非最优结果;正交法虽然考虑了因素之间的交互作用,但是会大大增加实验的次数,对于不是显著的因素只能凭经验和相关文献去判断[26]。响应面法能够体现各因素之间的交互作用,而且需要的实验次数少、周期短,是优化培养基的有效方法[14]。
本研究通过单因素结合响应面的方法,优化了菌株2515的发酵培养基,确定了麦芽糖、MnCl2、酵母膏和CaCl2为菌株2515的发酵的关键影响因子,并且确定了低盐的条件下更有利于菌株的增殖。碳源是培养基中重要的组成成分,是微生物增殖和产生代谢物的最基本能量来源[27]。本研究通过在LB基础培养基中添加麦芽糖作碳源,促进了菌株2515的生长和抗菌物质的产生,研究结果对菌株2515的后续开发提供了重要的技术支撑。
假交替单胞菌可以产生多种活性物质,具有不同的生物学功能。微生物产生的次级代谢产物不仅与菌株的代谢分泌系统有关,还与其培养的环境有密切关系[28]。杨运楷等[29]通过正交法优化了假交替单胞菌CDM8的培养基,通过优化碳源、氮源、无机盐等的配方参数,发酵的生物量提高了48.23%。窦旖君等[30]优化了产黑色素假交替单胞菌XH2的培养条件,获得了最佳发酵温度、pH、盐度及钙离子浓度,应用优化的配方使其黑色素的产量提高了2.6倍。Lyu等[31]对假交替单胞菌SP48的培养条件进行了优化,确定了最佳的氮源、碳源以及微量元素的种类及浓度,应用优化后的配方,其发酵的生物量提高了79.2%。本研究通过响应面法优化了菌株2515的发酵培养基,生物量最佳的培养基为麦芽糖2.85 g/L、CaCl20.65 g/L、MnCl20.10 g/L、酵母膏3.85 g/L,胰蛋白胨 10 g/L,NaCl 10 g/L,在锥形瓶和发酵罐中发酵生物量分别提高了36.4%和40.4%,同时刺激了菌株分泌更多的活性物质,胞外和胞内抑菌活性分别提高了28.2%和27.2%。结果表明发酵条件可以改变菌株的正常生理代谢功能,不同的菌株及不同的活性物质需要的最佳培养条件是不同的。优化后的培养基配方对于菌株2515的发酵是可行的,对于水产养殖弧菌病的防控,推动水产养殖的绿色可持续发展具有重要意义。

