伊犁河流域春季可培养细菌多样性及其胞外酶检测
程 刚, 程 艳, 胡海洋, 邢 月, 别尔德别克·库布加沙
(1.新疆环境保护科学研究院 新疆环境污染监控与风险预警重点实验室,新疆 乌鲁木齐 830011;2.新疆环境保护科学研究院,新疆 乌鲁木齐 830011;3.上饶师范学院 生命科学学院,江西 上饶 334001;4.新疆农业大学 水利与土木工程学院,新疆 乌鲁木齐 830052;5.新疆农业大学 化学化工学院,新疆 乌鲁木齐 830052)
伊犁河位于新疆西北部中亚的伊犁-巴尔喀什湖盆地,是新疆降水量最多的地区,具有亚湿润的大陆性温带气候特征。伊犁河是典型的干旱半干旱区内陆河流,其流向从东向西,南支特克斯河与东支巩乃斯河汇合后称为伊犁河,北支喀什河在雅马渡汇入,形成伊犁河干流,最终流入哈萨克斯坦境内的巴尔喀什湖[1]。已有研究表明,伊犁河流域整体综合水质较好,但随着经济开发,人为活动加剧,伊犁河流域部分河流面临水质退化风险[2-4]。当前,伊犁河流域水环境风险防控主要针对水源地、地下水和河流健康风险评价,污染物因子分析和有机污染物溯源等方面[3,5-6],而对该流域微生物群落结构特征的研究较少。水生生物群落结构可作为流域生态质量评价中的重要指标,被广泛运用在河流生态系统水环境风险评估中[7]。近年来,伊犁河流域已通过鱼类、大型底栖动物和浮游动植物的群落结构完整性来评价伊犁河流域河流的健康状况[8-11]。细菌作为水生生物中数量最大和功能最多的类群之一,相较其他大型水生生物,水生细菌群落结构组成会随环境因子及人类活动影响发生改变,但其多样性损失并不明显[12-13]。此外,西北高海拔地区河流有着与中东部地区河流显著差异的外在环境条件,细菌等微生物群落结构以及多样性有明显的地域特征,其中蕴含着许多“土著”菌种,功能菌株以及潜在新菌种资源亟待开发[14-15]。运用可培养法对伊犁河流域细菌进行分离鉴定以及系统发育分析,可了解伊犁河流域可培养细菌群落结构信息,获得该流域珍稀菌种资源。目前,针对伊犁河流域细菌群落结构和菌种资源的研究尚未见相关报道。本研究以伊犁河流域水体和沉积物为研究对象,通过传统可培养法获得该流域的可培养细菌群落结构信息,并对分离菌株进行胞外酶活性筛选,以期为伊犁河流域微生物资源的利用、发掘和深入研究提供参考。
1 材料与方法
1.1 材料
1.1.1 样品采集 供试样品采自新疆伊犁河流域境内河段,于2021年4月在伊犁河流域特克斯河支流(4个样点)、巩乃斯河支流(3个样点)、喀什河支流(4个样点)以及伊犁河干流(4个样点),每隔直线距离约45~50 km设置采样点,沿河采集表层水样(水下50 cm左右)和水底沉积物(表层0~5 cm)样品,将样品装入50 mL无菌离心管于4 ℃低温保藏,送至实验室进行细菌菌株的分离鉴定。
1.1.2 培养基 细菌分离纯化培养基[16](g/L):① 溶菌肉汤(LB)培养基:蛋白胨10,酵母浸粉5,NaCl 10,琼脂15,蒸馏水1 L,pH 7.0,121 ℃高压灭菌15 min;② 胰酪大豆胨(TSA)培养基:胰酪胨15,大豆木瓜蛋白酶消化物5,NaCl 5,琼脂15,蒸馏水 1 L,pH 7.5,121 ℃高压灭菌15 min;③营养琼脂(NA)培养基:牛肉膏3,蛋白胨10,NaCl 5,琼脂15,蒸馏水1 L,pH 7.4,121 ℃高压灭菌15 min;④ R2A培养基:酸水解酪蛋白 0.5,蛋白胨0.5,葡萄糖0.5,酵母浸粉0.5,可溶性淀粉0.5,丙酮酸钠0.3,K2HPO40.3,MgSO4·7H2O 0.024,琼脂15,蒸馏水 1 L,pH 7.4,121 ℃高压灭菌15 min;⑤ 高氏1号培养基:可溶性淀粉20,KNO31,K2HPO40.5,MgSO4·7H2O 0.5,NaCl 0.5,FeSO4·7H2O 0.01,琼脂15,蒸馏水1 L,pH 7.5,121 ℃高压灭菌15 min。⑥细菌胞外酶活性检测培养基:分别选取分离纯化培养基为基础培养基,在其中添加0.5%(质量分数)可溶性淀粉作为淀粉酶检测培养基;添加1%(体积分数)的吐温-60作为酯酶检测培养基;添加0.5%(质量分数,下同)羧甲基纤维素钠作为纤维素酶检测培养基;添加1%木聚糖作为木聚糖酶检测培养基;添加1.5%明胶作为明胶检测培养基。
1.1.3 主要试剂与仪器设备 Ezup柱式细菌基因组DNA抽提试剂盒(B518255,上海生工生物工程股份有限公司);TaqDNA聚合酶(R001B,宝生物工程(大连)有限公司)。超净工作台(SW-CJ-2D,江苏通净净化设备有限公司);微生物培养箱(MJX-160B-Z,上海博迅医疗生物仪器股份有限公司);高压灭菌锅(BXM-50VE,上海博迅医疗生物仪器股份有限公司);医用低温保存箱(BDF-86H118,济南鑫贝西生物技术有限公司);高速冷冻离心机(H1850R,湖南湘仪实验室仪器开发有限公司);PCR仪(WD-9402D,北京六一生物科技有限公司);凝胶成像分析系统(WD-9413B,北京六一生物科技有限公司)。
1.2 方法
1.2.1 可培养细菌的分离纯化及培养基优势度指数计算 将每条河流不同样点采集到的水体和沉积物样品分别等量混合,水样取1 mL用0.85%的生理盐水按照100、10-1、10-2进行梯度稀释,沉积物称取约1 g,用2 mL 0.85%(质量分数)的生理盐水混匀,按照10-2、10-3、10-4进行梯度稀释,分别涂布于LB、NA、TSA、R2A和高氏1号5种固体培养基上,每个梯度下的样品涂布3个平板作为平行对照。考虑采样点春季平均水温约10 ℃左右,水体pH值约8.0,设置培养温度32 ℃,涂布平板倒置培养3~7 d。挑取不同的单菌落,划线纯化2~3次,纯化后的细菌菌株用含40%甘油的分离纯化培养基于-80 ℃保藏。培养基优势度通过下列公式计算:D=N/NT,其中N为各种培养基分离的细菌种类数量,NT为分离到细菌的全部种类数量[16]。
1.2.2 细菌DNA提取及16S rRNA基因扩增 纯培养菌株的DNA提取使用Ezup柱式细菌基因组DNA抽提试剂盒并参照说明书进行。采用细菌通用引物[17]27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R(5′-GGTTACCTTGTTACGACTT-3′)对纯化菌株的16S rRNA序列进行扩增。PCR反应体系(25 μL):DNA模板2 μL,10×PCR缓冲液2.5 μL,10 mmol/L的P1和P2各1 μL,dNTP(10 mmoL/L)2 μL,TaqDNA聚合酶(2.5 U/μL)0.5 μL,补齐灭菌双蒸水至25 μL。PCR反应条件:94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,30个循环;72 ℃延伸8 min。PCR产物用1%琼脂糖凝胶电泳进行检测。回收纯化后的16S rRNA基因PCR样品送至上海生工生物工程股份有限公司进行测序。
1.2.3 分离细菌的系统发育和可培养细菌分布状况分析 测序结果在BLAST(http://www. ncbi. nlm. nib.gov/ blast/ blast.cgi)上进行比对分析,获得最相近菌株的16S rRNA基因序列。并用MEGA7.0(Molecular Evolutionary Genetics Analysis)软件进行序列分析,用Clustal W进行多序列比对,系统进化矩阵根据Kimura-2模型估算,采用邻近相连法(Neighbor-Joining method)构建出系统进化树[18]。将所分离的细菌菌株的序列比对结果进行筛选,利用Venny 2.1(https://bioinfogp.cnb.csic.es/tools/venny/index.html)软件进行细菌群落结构分析。
1.2.4 分离细菌的胞外酶检测分析 淀粉酶、酯酶、纤维素酶、木聚糖酶和明胶酶检测及验证方法参照文献[19-20]进行。活化菌株用灭菌牙签分别点接于添加酶作用底物的细菌胞外酶活性检测固体培养基上,32 ℃培养3~7 d。待菌落形成后,观察菌落周围是否出现透明圈(水解圈),以此作为分离菌株胞外酶产生标准。测量菌落直径(d)和透明圈(水解圈)(D)直径,以D/d的数值大小评价菌株产胞外酶活性的强弱[21]。淀粉酶是用新鲜配置的Lugol′s碘液将菌落染色后,观察菌落周围是否出现透明圈(水解圈)进行筛选;明胶酶是用50%(质量分数)的三氯乙酸处理菌落后,观察菌落周围是否出现透明圈(水解圈)进行筛选;纤维素酶和木聚糖酶是用1 mg/mL的刚果红溶液将菌落染色后,观察菌落周围是否出现透明圈(水解圈)进行筛选;酯酶可直接观察菌落周围是否出现透明圈(水解圈)进行筛选。
2 结果与分析
2.1 培养基优势度指数分析
本研究选取的LB、TSA、NA、R2A和高氏1号培养基对伊犁河流域细菌的筛选分离结果有明显差异(表1)。利用可培养法从伊犁河流域共分离得到225株细菌,通过菌落特征和细胞形态学观察,发现高氏1号和R2A培养基分离到的菌落数最多,菌落形态丰富,其他3种培养基分离到的菌落数较少,菌落形态较单一。从5种培养基分离效果来看,R2A培养基分离得到46株细菌,分属于19个属,23个物种,分离效果最好;LB培养基分离得到41株细菌,分属于10个属,20个物种,分离效果最差。从5种培养基的优势度指数计算结果可知,TSA培养基的优势度指数最高,为0.393,LB培养基的优势度指数最低,为0.238。
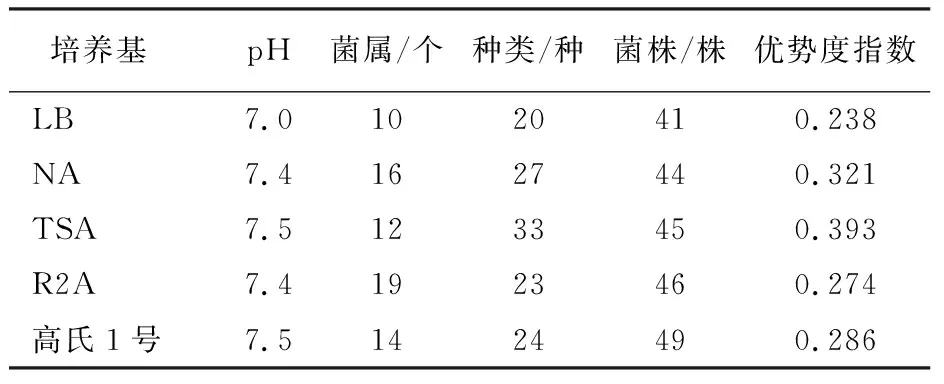
表1 LB、TSA、NA、R2A和高氏1号5种培养基分离细菌的多样性及优势度指数Table 1 The diversity and dominant index of isolated bateria on 5 types of different medium (LB, NA, TSA, R2A and Gauze′s No.1 medium)
2.2 可培养细菌的16S rRNA基因序列的系统发育分析
通过可培养法共获得225株细菌(水样139株,沉积物86株),其中特克斯河54株,巩乃斯河62株,喀什河60株,伊犁河干流49株,并分别编号。对纯化菌株的16S rRNA基因扩增片段进行序列测定,在BLAST上进行序列同源性比对(表2)。同源比对结果表明,225株细菌分属于变形菌门γ亚群(Gamma-pseudomonadota,56.44%)、放线菌门(Actinomycetota,18.22%)、厚壁菌门(Bacillota,14.22%)、变形菌门α亚群(Alpha-pseudomonadota,4.89%)、变形菌门β亚群(Beta-pseudomonadota,4%)、拟杆菌门(Bacteroidota,0.44%)和异常球菌-栖热菌门(Deinococcota,0.44%)等7个大的系统发育类群。其中假单胞菌属(Pseudomonas,42.22%)作为优势属分离频率最高,共分离得到95株该属菌株,分属于26个种。其次是芽胞杆菌属(Bacillus,9.33%),共分离得到21株该属菌株,分属于11个种。不动杆菌属(Acinetobacter,9.33%)第三,共分离得到21株该属菌株,分属于6个种。红球菌属(Rhodococcus,4.89%)第四,共分离得到11株该属菌株,分属于3个种。除上述检出的高频细菌外,还分离得到37个属的细菌,包括节杆菌属(Arthrobacter)(8株,3种)、微小杆菌属(Exiguobacterium)(7株,3种)、拉思氏菌属(Rahnella)(7株,1种)、短波单胞菌属(Brevundimonas)(4株,2种)、氢噬胞菌属(Hydrogenophaga)(4株,1种)、假节杆菌属(Pseudarthrobacter)(4株,2种)、微杆菌属(Microbacterium)(3株,2种)、链霉菌属(Streptomyces)(3株,2种)、食酸菌属(Acidovorax)(2株,1种)、纤维单胞菌属(Cellulomonas)(2株,1种)、考克氏菌属(Kocuria)(2株,2种)、分枝杆菌属(Mycobacterium)(2株)、血杆菌属(Sanguibacter)(2株,2种)、鞘脂菌属(Sphingobium)(2株,1种)、气单胞菌属(Aeromonas)(1株,1种)、土壤杆菌属(Agrobacterium)(1株,1种)、包西氏菌属(Bosea)(1株)、Cereibacter(1株,1种)、金黄杆菌属(Chryseobacterium(1株,1种)、金黄微杆菌属(Chryseomicrobium)(1株,1种)、棒状杆菌属(Corynebacterium)(1株,1种)、短小杆菌属(Curtobacterium)(1株)、奇异球菌属(Deinococcus)(1株,1种)、杜擀氏菌属(Duganella)(1株)、Microcella(1株,1种)、Pararheinheimera(1株,1种)、泥单胞菌属(Pelomonas)(1株)、游球菌属(Planococcus)(1株)、游动微菌属(Planomicrobium)(1株,1种)、植物杆菌属(Plantibacter)(1株,1种)、Proteobacterium(1株)、嗜冷杆菌属(Psychrobacter)(1株)、皱纹单胞菌属(Rugamonas)(1株,1种)、鞘氨醇单胞菌属(Sphingomonas)(1株)、鞘脂单胞菌属(Sphingopyxis)(1株,1种)、寡养单胞菌属(Stenotrophomonas)(1株,1种)、束毛球菌属(Trichococcus)(1株,1种)。
对分离纯化的225株细菌16S rRNA基因扩增片段进行序列测定,在BLAST上进行同源比对,根据菌株的系统发育地位构建系统发育树,分析其进化关系(图1)。结果表明,可培养细菌菌株聚类于7个大的分支,变形菌门为最大优势类群,分属于变形菌门α亚群(4.89%)、β亚群(4%)和γ亚群(56.44%),三者聚类在进化树上部的大分枝上,其中变形菌门γ亚群占分离细菌多样性的主要位置。放线菌门(18.22%)为第二大优势类群,其次是厚壁菌门(14.22%)。而拟杆菌门(0.44%)和异常球菌-栖热菌门(0.44%)各自独占一个分类单元,分散于进化树的不同分支上。从分离细菌菌株分布状况来看,特克斯河共分离得到54株细菌,分属于变形菌门γ亚群(46.30%)、放线菌门(24.07%)、厚壁菌门(12.96%)、变形菌门α亚群(7.41%)、变形菌门β亚群(5.56%)5个大的系统发育类群,22个属28个种。其中假单胞菌属作为优势属,占特克斯河总分离菌株的40.74%,次之为芽胞杆菌属占7.41%。巩乃斯河共分离到62株细菌,分属于变形菌门γ亚群(51.62%)、放线菌门(19.35%)、厚壁菌门(14.52%)、变形菌门β亚群(8.06%)、变形菌门α亚群(3.23%)和异常球菌-栖热菌门(1.61%)6个大的系统发育类群,16个属30个种。其中假单胞菌属作为优势属,占巩乃斯河总分离菌株的50%,次之为红球菌属和芽胞杆菌属,两者均占8.06%。喀什河共分离到60株细菌,分属于变形菌门γ亚群(70%)、放线菌门(21.66%)、厚壁菌门(5%)、变形菌门α亚群(1.67%)和变形菌门β亚群(1.67%)5个大的系统发育类群,12个属25个种。其中假单胞菌属作为优势属,占喀什河总分离菌株的38.33%,次之是不动杆菌属,占18.33%。伊犁河干流共分离得到49株细菌,分属于变形菌门γ亚群(57.14%)、厚壁菌门(26.53%)、变形菌门α亚群(8.16%)、放线菌门(6.12%)和拟杆菌门(2.05%)5个大的系统发育类群,11个属28个种。其中假单胞菌属作为优势属,占伊犁河干流总分离菌株的38.78%,次之是不动杆菌属,占16.33%。

图1 16S rRNA基因部分序列构建的伊犁河流域可培养细菌的系统发育树Fig.1 Phylogenetic relationships among cultivable bacterial isolates from Ili River Basin based on the 16S rRNA gene sequences
2.3 伊犁河流域可培养细菌分布状况分析
通过比较分离菌株的门水平分布(图2),可见巩乃斯河样品中细菌所占优势类群以及分离菌株数量最多,细菌门水平占比与伊犁河全流域细菌分类基本保持一致,依次为变形菌门γ亚群、放线菌门和厚壁菌门,并且从巩乃斯河样品中分离得到了1株异常球菌-栖热菌门的细菌。特克斯河和喀什河样品中优势细菌类群基本保持一致,依次为变形菌门γ亚群、放线菌门和厚壁菌门。样品中优势类群比例有一定差异,如变形菌门γ亚群占比升高,其在特克斯河样品中占46.30%,巩乃斯河样品中占51.62%,而喀什河样品中达到70%。喀什河中放线菌门占比为21.66%,与特克斯河样品相比有所降低,与巩乃斯河和伊犁河全流域样品相比有所增加。除此之外,喀什河样品中厚壁菌门占比最低,仅占5%,而在特克斯河样品中占12.96%,巩乃斯河样品中占14.52%,伊犁河全流域样品中占14.22%。
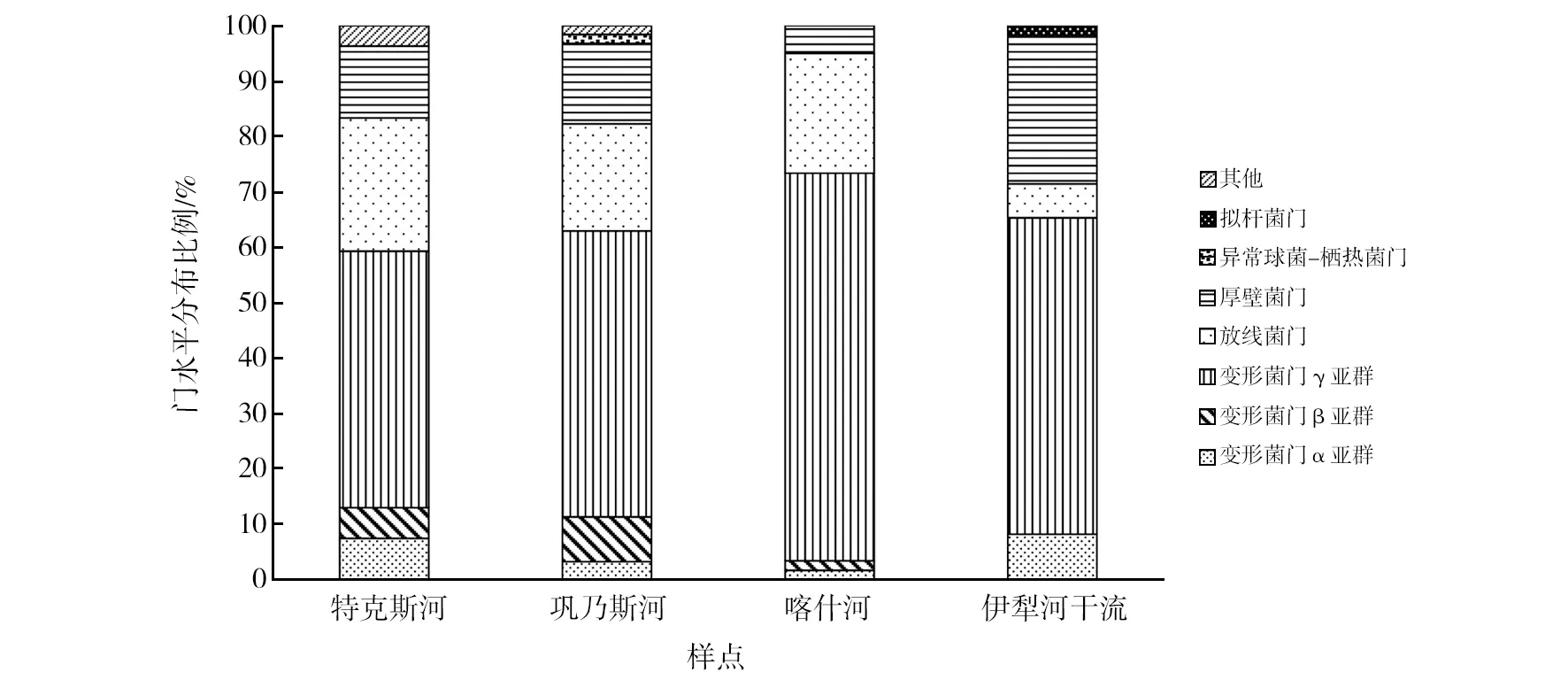
图2 伊犁河流域可培养细菌的门水平分布示意图Fig.2 Phylum horizontal distribution of cultivable bacteria in Ili River Basin
从伊犁河干流样品中分离得到的细菌数量最少,仅为49株,分别归属5大细菌类群,依次为变形菌门γ亚群、厚壁菌门、变形菌门α亚群、放线菌门和拟杆菌门,其细菌类群分布与特克斯河、巩乃斯河、喀什河以及伊犁河全流域相比有明显差异,其中变形菌门γ亚群所占的比例最高,为57.14%,与其他河流样品基本保持一致。厚壁菌门和变形菌门α亚群所占比例最高,例如厚壁菌门在特克斯河样品中占12.96%,在巩乃斯河样品中占14.52%,在喀什河样品中占5%,在伊犁河全流域中占14.22%,而在伊犁河干流样品中占26.53%。变形菌门α亚群在特克斯河样品中占7.41%,在巩乃斯河样品中占1.61%,在喀什河样品中占1.67%,在伊犁河全流域中占4%,而在伊犁河干流样品中占8.16%。放线菌门所占比例最低,例如放线菌门在特克斯河样品中占24.07%,在巩乃斯河样品中占19.35%,在喀什河样品中占21.67%,在伊犁河全流域中占18.22%,而在伊犁河干流样品中仅占6.12%。除此之外,从伊犁河干流样品中分离得到1株拟杆菌门细菌。与特克斯河、巩乃斯河和喀什河样品分离结果不同,本研究在伊犁河干流未分离到变形菌门β亚群细菌。
根据已纯化菌株的测序结果,最终将伊犁河全流域分离到的225株细菌划分为84个物种,其中特克斯河28种,巩乃斯河30种,喀什河25种,伊犁河干流28种(图3)。由于伊犁河流域三大支流和伊犁河干流地理位置、环境条件的不同,导致4条河流细菌群落结构分布上差异明显,仅有Pseudomonaslinyingensis在4条河流样品中均分离到,多数菌种为各河流样品所特有。特克斯河分布的28种细菌中,与伊犁河干流共有的6种,与巩乃斯河和喀什河均共有的4种,特克斯河独有的菌种19种,占分离细菌菌种的22.6%。巩乃斯河分布的30种细菌中,与特克斯河共有的4种,与喀什河和伊犁河干流均共有的6种,特克斯河独有的菌种18种,占分离细菌菌种的21.4%。喀什河分布的25种细菌中,与特克斯河共有的4种,与巩乃斯河共有的6种,与伊犁河干流共有的9种,喀什河独有菌种13种,占分离细菌菌种的15.5%。伊犁河干流分布的28种细菌中,与喀什河共有的9种外,与特克斯河和巩乃斯河均共有的6种,伊犁河干流独有菌种14种,占分离细菌菌种的16.7%。上述结果表明,虽然伊犁河流域三大支流最终汇集成伊犁河干流,但各支流和干流中可培养细菌地域分布性强,不同河流区域具有独特的细菌菌种分布。

图3 伊犁河流域可培养细菌菌种分布示意图Fig.3 Venn diagram of cultivable bacterial species distribution in Ili River Basin
2.4 可培养细菌胞外酶活性测定
从伊犁河全流域的特克斯河、巩乃斯河、喀什河和伊犁河干流共分离得到225株细菌,隶属于七大细菌发育类群,41个属84个种。为深入挖掘伊犁河流域潜在的菌种资源,对已测序菌株进行了胞外酶活性检测(表3),结果发现具有淀粉酶活性的细菌共有89株,占比39.56%;能够降解吐温-60的细菌共有130株,占比57.78%;具有明胶酶活性的细菌共有91株,占比40.44%;具有纤维素酶活性的细菌共有54株,占比24%;具有木聚糖酶活性的细菌共有9株,占比4%。其次,225株细菌中具有2种及以上酶活性的菌株共113株,占总分离菌株的50.22%,其中假单胞菌属作为优势属,共56株,占比49.56%,芽胞杆菌属15株,占比13.27%。优势种为Pseudomonaskunmingensis,该菌种有8株具有2种及以上酶活性。初步表明伊犁河流域河流微生物具有较广泛降解大分子物质的能力。
从上述潜在功能菌株的筛选培养基来源分析(表4)的结果发现,TSA培养基和NA培养基获得潜在功能菌株的数量最多,含有2种及以上酶活性的菌株在TSA培养基中占比高达68.89%,其次是NA培养基,占比68.18%。而R2A培养基和高氏1号培养基获得潜在功能菌株数量最低,其中R2A培养基中含有2种及以上酶活性的菌株占比仅30.43%。除此之外,从上述潜在功能菌株的空间分布来看,特克斯河含有2种及以上酶活性的菌株数量最高,占比61.11%。喀什河含有2种及以上酶活性的菌株数量最低,占比43.33%。伊犁河干流相较其他三条河流,水样中具有2种及以上酶活性的菌株占比最低,为28.57%,而沉积物中具有2种及以上酶活性的菌株占比最高,为67.86%。

表4 不同样点和培养基中具有胞外酶活性菌株的分布Table 4 Distribution of strains with extracellular enzyme activity in different sample points and medium
3 讨 论
对比高通量测序技术(High throughput sequencing,HTS),梯度稀释加平板涂布的可培养法仍然是分离和获取环境样品中微生物菌种资源最简单有效的方法之一。基于细菌16S rRNA基因分析的HTS技术虽然可以进行特殊基因和生态功能层面的深入研究,但并不能获取细菌菌种资源,以及分辨特殊近源菌种的毒性强弱[22-24]。本研究利用5种培养基对伊犁河流域水体和沉积物中可培养细菌进行了分离纯化。结果表明,不同培养基分离纯化伊犁河可培养细菌类群差异明显,其中R2A培养基分离得到19个属的细菌,分离效果最好。而TSA培养基分离得到33个种的细菌,培养基优势度指数最高。除此之外,结合胞外酶活性筛选实验结果,发现含有2种及以上酶活性的菌株在TSA培养基中占比最高,而R2A培养基占比最低。可培养法虽然不能完整体现环境样本中真实微生物菌群结构,但运用多种不同类型培养基能部分弥补菌群结构的偏差,为进一步研究该流域细菌生理和生态功能提供菌种资源。
伊犁河流域可培养细菌多样性较为丰富,分离菌株经16S rRNA基因序列比对及系统进化分析发现,225株细菌归属于变形菌门γ亚群(Gamma-pseudomonadota,56.44%)、放线菌门(18.22%)和厚壁菌门(Firmicutes,14.22%)等七大细菌发育类群,共41个属84个种。其中变形菌门γ亚群和放线菌门为伊犁河流域中的优势类群,优势属为假单胞菌属(Pseudomonas)、不动杆菌属(Acinetobacter)和芽胞杆菌属(Bacillus)。比较特克斯河、巩乃斯河、喀什河和伊犁河干流细菌群落结构发现,三大支流细菌群落结构大致相同,优势类群依次为变形菌门γ亚群、放线菌门和厚壁菌门,与伊犁河全流域中优势类群一致。其中巩乃斯河分离到的细菌数量和种类最多,并且分离到了1株异常球菌-栖热菌门(Deinococcota)的细菌。而伊犁河干流分离到的细菌数量和种类较少,其优势类群中厚壁菌门和变形菌门α亚群(Alpha-pseudomonadota)比例上升明显。已有研究报道,厚壁菌门在长期工业污染的城市河流的细菌群落中为优势类群[25-26]。对比同处新疆高海拔地区的开都河细菌群落结构分布,变形菌门α亚群也是其优势类群,并随地理距离的增加而增加[14]。其次,从分离细菌菌种的分布情况来看,特克斯河、巩乃斯河、喀什河三条支流与伊犁河干流菌落构成差异明显,4条河流共有菌种只有Pseudomonaslinyingensis。4条河流彼此间共有菌种最多为9种,为喀什河和伊犁河干流所共有。喀什河支流与特克斯河和巩乃斯河形成的伊犁河汇合形成伊犁河干流,两者属于流域环境过渡区,细菌菌种构成有部分重叠。但4条河流共有菌种数远低于每条河流独有菌种数,表明伊犁河流域细菌菌种的地域分布性强,不同河流具有各自不同的细菌菌种分布。
细菌胞外酶在大分子量聚合物降解过程中发挥重要作用,异养细菌通过胞外酶将水环境中的高聚有机物降解,作为菌株主要碳源和能量来源加以利用[27-28]。本研究选取五种胞外酶检测培养基检测分离菌株的胞外酶活性,结果表明,伊犁河流域细菌降解吐温-60的酯酶、明胶酶和淀粉酶活性较好,木聚糖酶活性较差。胞外酶活性优势属为假单胞菌属和芽胞杆菌属,其中由于其营养需求简单,适应力强等特征在自然界中普遍存在,并且经常发现具有降解复杂有机物能力的菌株[29-31]。其中,菌株YL-215(OK147810)含有5种胞外酶活性;菌株YL-89(OK135823)与菌株YL-4(OK136188)的标准菌株相似性<98%,为潜在新种,且含有多种胞外酶活性,值得进一步深入研究。由伊犁河流域水体和沉积物分离的菌株一半以上(50.22%)具备至少2种胞外水解酶活性,表明该流域细菌的生态营养多功能性较高,部分菌株可作为潜在可用种质资源在河流水质净化及水质检测方面发挥作用。
本研究通过可培养法对伊犁河流域细菌群落进行了分析,伊犁河全流域的可培养细菌多样性较丰富,分离得到的225株细菌归属于七大细菌类群,41个属84个种。可培养细菌菌种具有地域分布性强的特点。分离细菌的产胞外酶活性比例较高,具备2种及以上胞外水解酶活性菌株占比达50.22%。运用5种通用培养基获得了伊犁河流域部分易培养细菌多样性信息,后续研究可运用高通量测序等技术全面分析该流域微生物群落结构,设置不同培养条件和培养方式,进一步挖掘该流域珍稀菌种资源,为伊犁河流域微生物资源的开发和利用提供前期参考。

