陕西省猕猴桃溃疡病病原菌分离鉴定及分型研究
朱海云, 马 瑜*, 柯 杨, 李 勃
(1. 陕西省微生物研究所,陕西 西安 710043;2. 陕西省生物农业研究所,陕西 西安 710043)
猕猴桃溃疡病于20世纪80年代首次在日本静冈县出现,是一种由丁香假单胞菌猕猴桃致病变种(Pseudomonassyringaepv.actinidiae,Psa)引起的猕猴桃细菌性病害[1]。该病传染性强,传播速度快,在日本首次发病之后,迅速传播到中国、韩国和意大利[2-4]。猕猴桃溃疡病在意大利发病之初危害并不严重,但是自2007年起该病发病严重,并在世界范围内流行[5]。如在葡萄牙、西班牙、法国、新西兰、土耳其等各大猕猴桃产区蔓延,给猕猴桃产业带来了巨大的经济损失[6-10]。从1985年起,猕猴桃溃疡病在中国湖南、四川、安徽省[11-13]等地相继发生。1991年陕西长安县太乙宫猕猴桃园发现此病[14],现已扩展到周至、杨凌、户县等各大猕猴桃产区,给当地的猕猴桃产业造成极大的经济损失。Psa易变异,具有遗传多样性,大量研究表明不同地区、不同时期所分离到的Psa在遗传结构上存在一定的差异,而且引发溃疡病的严重程度也有一定的差异[15]。例如2007年之前在意大利爆发的溃疡病未造成严重损失,而2007年之后在意大利爆发的溃疡病则症状严重,造成了巨大的损失[16-17]。目前已确定在世界范围内存在5个Psa的变型,分别为Psa1、Psa2、Psa3、Psa5和Psa6[18-19]。Psa1于20世纪80年代首次在日本被发现,在日本广泛分布,另外在意大利和韩国的猕猴桃中也检测到少量Psa1。Psa1毒力相对较高,与Psa3无显著性差异,此外,Psa1产生菜豆毒素[20-21]。Psa2主要在韩国的猕猴桃园中被检测到,能够产生冠毒素[22-23]。Psa3是导致猕猴桃溃疡病流行最广泛、危害最为严重的一个类群,在世界各大猕猴桃产区均被检测到[24]。Psa5和Psa6仅在日本的部分猕猴桃园中被检测到,其中Psa6能产生菜豆毒素和冠状毒素两种毒素[25-26]。值得注意的是Pseudomonassyringaepv.actinidifoliorum是一种能够导致猕猴桃叶片出现斑点但不会降低猕猴桃产量的另一种猕猴桃病原菌,其最初被归类为Psa的一个低毒类群即Psa4[27-28],但是后来其被鉴定为Pseudomonassyringaepv.actinidifoliorum[29]。综上所述,不同Psa变型在毒力以及致病性方面也有较大差异,不同变型应采取不同的防治措施,以提高防治效率。因此,了解猕猴桃产区Psa的变型情况有助于制定针对性的防治策略,提高防治效果。病原微生物分型的方法有多位点序列分析(Multilocus sequence analysis,MLSA)分型、脉冲场凝胶电泳(Pulsed-field gelelectrophoresis,PFGE)分型、聚合酶链反应(Polymerase chain reaction,PCR)分型及限制性片段长度多态性(Restriction fragment length polymorphism,RFLP)分型。但是PFGE分型耗时长、成本高,电泳图谱不利于不同实验室间进行比较;PCR分型分辨力弱,重复性差,结果解析困难;RFLP分型分辨力弱,且操作比较复杂。而MLSA具有快速简便、重复性好、区分力高的特点。同时,开发共享的多位点序列分析互联网数据库和高速发展的 PCR 测序技术优势使该方法逐步被广泛的应用于病原菌的鉴定分型研究中。研究人员通常使用4~7个管家基因的序列对Psa进行MLSA分型,构建系统发育树。如Chapman等[27]最初使用7个管家基因对Psa进行了MLSA分型,将全球Psa分为四个类群即Psa1、Psa2、Psa3和Psa4(Psa4后被鉴定为Pseudomonassyringaepv.actinidifoliorum);Sawada等[19-30]使用7个管家基因发现了两个新类群:Psa5和Psa6。Sawada等[18]为了进一步验证MLSA的分型模式,基于平均核苷酸一致性(average nucleotide identity,ANI)对Psa各分型进行了系统基因组分析,并确认其分型模式与之前获得的MLSA分型模式相匹配[18],这说明MLSA分型是有效的分型方法。陕西是世界上最大的猕猴桃生产基地,也是猕猴桃溃疡病的重灾区。陕西猕猴桃种植区域大多在秦岭北麓、渭河南岸,主要的种植区域包括周至、眉县、灞桥区、长安区、鄠邑区及渭南地区,其中周至和眉县是两个最大的猕猴桃产区,其猕猴桃总产量约占全省的2/3。自猕猴桃溃疡病首次在长安太乙宫发病至今已三十一年,且猕猴桃溃疡病已在陕西各猕猴桃主产区蔓延,那么其病原菌Psa是否随时间变化以及区域变化而发生变异?是否存在多个变型? 目前仅有部分研究提及Psa多样性分析及分型,但并未做专门的研究。高小宁等[31]利用Rep-PCR(Enterobacterial repetitive inter-genic consensus)和BOX-PCR多态性分析技术将陕西省72个Psa分别聚类为6个和8个类群,但未进行分型分析。赵志博等[32]应用5个管家基因对分离到的Psa进行MLSA分型,结果显示这些Psa均为Psa3,但是这些Psa都分离自同一时期,不具有时间跨度。He等[33]应用5个管家基因对全国的Psa进行MLST分型,被聚类为Psa3的菌株中仅有一株Psa为陕西的菌株。为了明确Psa在陕西省内不同时间不同区域的变型情况,本研究将分离自不同年份不同区域内的Psa进行筛选鉴定,并应用7个管家基因对Psa进行MLSA分型,相较于5个管家基因的MLSA分型可以进一步提高精度,全面准确地监测陕西Psa的变型情况,从而为有针对性地制定猕猴桃溃疡病防治策略提供参考。
1 材料与方法
1.1 材料
1.1.1 病原菌分离材料 2013年2月至2019年4月于陕西周至、眉县、灞桥、鄠邑、长安及渭南猕猴桃园采集感染猕猴桃溃疡病的枝干及叶片用于病原菌的分离鉴定。
1.1.2 培养基 高蔗糖培养基:蛋白胨10 g,NaCl 5 g,蔗糖50 g,琼脂15 g,去离子水补足至1 000 mL,pH 7.0~7.2,121 ℃灭菌20 min。高葡萄糖培养基:蛋白胨10 g,NaCl 5 g,葡萄糖50 g,琼脂15 g,去离子水补足至1 000 mL,pH 7.0~7.2,121 ℃灭菌20 min。金氏培养基:蛋白胨20 g,K2HPO41.5 g,MgSO41.5 g,琼脂15 g,去离子水补足至1 000 mL,pH 7.0~7.2,121 ℃灭菌20 min。
1.1.3 主要试剂与仪器设备 Lysis Buffer for Microorganism to Direct PCR(TaKaRa,中国大连)购自宝生物工程(大连)有限公司;Premix Taq Version 2.0(TaKaRa,中国大连)购自宝生物工程(大连)有限公司;GoldView核酸料(赛百盛,中国北京)购自北京赛百盛基因技术有限公司;琼脂糖(Biowest,西班牙)购自上海联硕宝为生物科技有限公司。光学显微镜(BX-4型,奥林巴斯株式会社);电泳仪(DDY-6D,北京市六一仪器厂);PCR仪(TProfessional Gradient型,德国Analytica Jena公司);凝胶成像系统(Gel Doc XR型,美国伯乐公司)。
1.2 方法
1.2.1 病原菌的分离及初步鉴定 将新鲜的染病组织用自来水冲洗晾干,在无菌操作台上从叶片、叶柄和树干的病斑边缘取出感染组织的碎片,研磨成含有5 mL无菌生理盐水的无菌砂浆,然后将无菌砂浆进行10倍梯度稀释,取0.1 mL各梯度稀释液涂布到高蔗糖培养基,25~27 ℃孵育3 d[34]。挑取隆起的黏稠菌落,再次接种到高蔗糖培养基,同时接种到高葡萄糖培养基作为对照,凡是只在高蔗糖培养基上形成黏稠晶莹菌落而在高葡萄糖培养基上较难生长的菌株即初步确定为Psa。
1.2.2 病原菌特异性分子鉴定 参照Lysis Buffer for Microorganism to Direct PCR试剂说明书提取Psa基因组。以Psa基因组为模板,以特异性引物PsaF1/PsaR2(5′-TTTTGCTTTGCACACCCGAT-TTT-3′,5′-CACGCACCCTTCAATCAGGATG-3′)分别作为正反向引物进行特异序列PCR扩增,若能且仅能扩增出一条约280 bp的片段,则鉴定为Psa[35]。PCR反应体系:DNA模板为Lysis Buffer for Microorganism to Direct PCR裂解上清液 2 μL,浓度为10 μmol/L的正向和反向引物各0.5 μL,Premix Taq (Ex Taq Version 2.0) 10 μL,用灭菌双蒸水补足到20 μL。PCR反应条件:94 ℃预变性10 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,共35个循环;72 ℃延伸5 min;4 ℃保温10 min。
1.2.3 管家基因序列的扩增及测序 参考Sarkar等[36]设计的7对管家基因(acn、cts、gapA、gyrB、pfk、pgi和ropD)引物,以Psa基因组为模板进行管家基因序列扩增(扩增及测序引物序列如表1所示)。PCR反应体系:DNA模板为Lysis Buffer for Microorganism to Direct PCR裂解上清液 2 μL,浓度为10 μmol/L的正向和反向引物各0.5 μL, Premix Taq (Ex Taq Version 2.0)10 μL,用灭菌双蒸水补足至20 μL。PCR反应条件:94 ℃预变性10 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸60 s,共35个循环;72 ℃延伸5 min;4 ℃保温10 min。PCR反应产物用1%琼脂糖凝胶电泳鉴定,将反应产物送交北京六合华大基因科技有限公司进行纯化回收并测序。
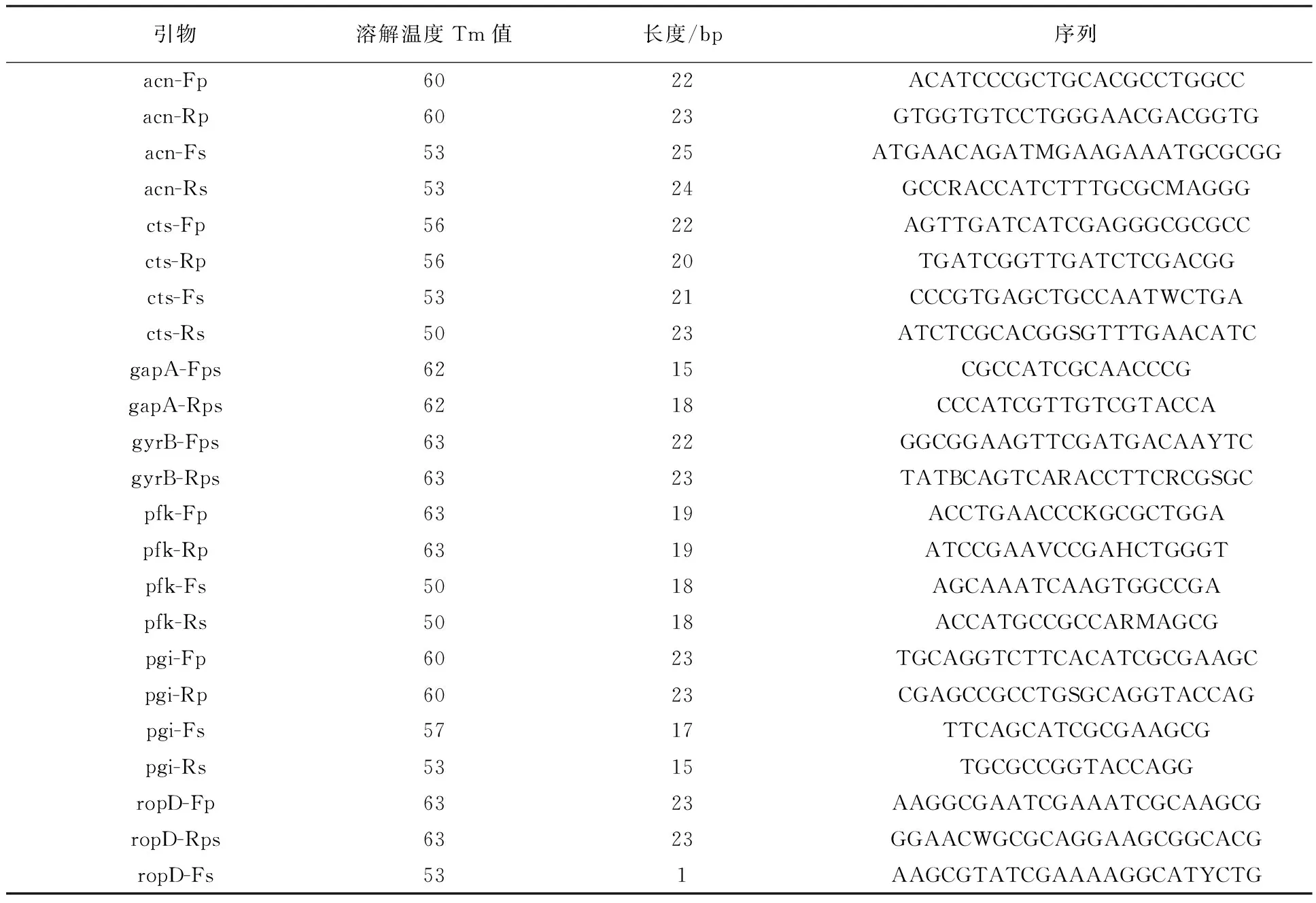
表1 管家基因的扩增引物及测序引物Table 1 Amplification primers and sequencing primers of housekeeping genes
1.2.4 回接实验 用浓度为108cfu/mL的Psa菌悬液针刺接种生有5~7片叶子的盆栽猕猴桃幼苗叶片,接种量为2.5 μL。接种后,将幼苗置于自然环境中,接受自然光照,每天检查发病症状。对照组用无菌水以相同的方式接种。待叶片出现症状,取发病部位分离病原菌Psa,并利用特异性引物PsaR1/R2进行PCR检测。
1.2.5 MLSA分析 选择已知分型的Psa菌株作为参考菌株,并从基因库中下载参考菌株的7对管家基因序列,应用Mega 6.0对各菌株同一管家基因进行序列比对和编辑,应用PhyloSuite软件中的concatenate sequence功能将同一菌株的7个管家基因按照acn-cts-gapA-gyrB-pfk-pgi-ropD顺序进行串联,并应用Mega 6.0软件中的Neighbor-joining方法构建系统发育树,分析所分离Psa菌株和其他参考菌株之间的遗传进化关系。
2 结果与分析
2.1 猕猴桃溃疡病病原菌分离及初步鉴定
自2013年至2019年每年2~3月份采集猕猴桃溃疡病发病枝干和叶片(图1箭头所示)进行病原菌Psa分离。Psa在高蔗糖培养基上可以形成易于辨别的晶莹黏稠的圆形隆起菌落(图2A),挑取这些晶莹单菌落进一步划线纯化。将这些纯化菌株分别接种到高蔗糖培养基和高葡萄糖培养基上,能在高蔗糖培养基上长出晶莹黏稠菌落而在高葡萄糖培养基上难以生长的菌落初步鉴定为Psa(图2B)。对初步鉴定出的Psa进行革兰染色,只保留革兰染色为阴性的菌株。最终通过菌落形态和革兰染色结果初步鉴定出102株Psa。图2C为其中一株初步鉴定为Psa菌株的革兰染色图。部分Psa在金氏培养基上可以产荧光,图2D左边为在金氏培养基上生长的Psa菌株在紫外灯下发出荧光,而右边对照为大肠埃希菌,不发出荧光。

图1 猕猴桃溃疡病发病症状Fig.1 Symptoms of kiwifruit canker
2.2 特异性PCR鉴定
应用特异性引物PsaF1/PsaF2对初步确定为Psa的菌株进行PCR扩增,能且仅能扩增出一条约280 bp大小片段的菌株即鉴定为Psa菌株,无法扩增出条带的则不是Psa菌株(图3)。对初步鉴定为Psa的102株菌株应用特异性引物PsaF1/PsaF2进行PCR扩增,共有86株能够扩增出一条约280 bp的条带,被鉴定为Psa菌株,琼脂糖凝胶电泳图如图4所示。86株Psa菌株的编号、分离地区、分离部位以及分离年份信息如表3所示。
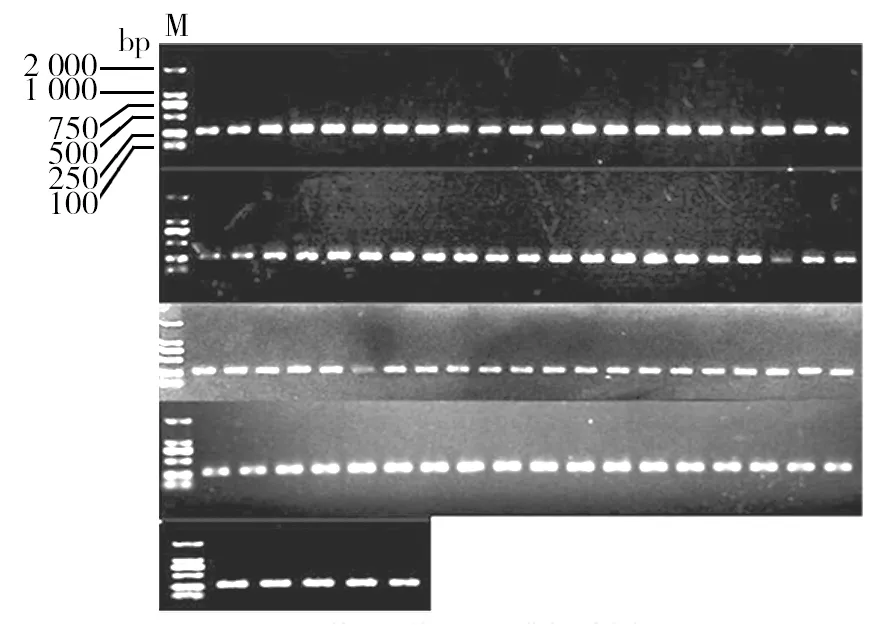
图4 86株Psa的特异性PCR鉴定凝胶电泳图Fig.4 Agarose gel electrophoresis map of the 86 Psa strains identified by specific PCR M:DL2000 DNA Marker
2.3 回接实验
将代表性Psa菌株Z1用针刺法回接盆栽猕猴桃幼苗可致猕猴桃溃疡病,接种7 d后猕猴桃叶片出现褐色病斑,周围有黄色的晕圈(图5A);接种14 d后褐色病斑变大,叶片出现卷曲(图5B);而对照组(图5C、5D)仅有针刺的空隙,并未出现病斑及黄色晕圈,叶面也未出现卷曲,且空隙在第14天时明显缩小,这些症状与自然感染的症状相似。采集发病组织进行分离,并应用特异性引物PsaF1/ PsaF2进行PCR扩增鉴定,能够扩增出一条约280 bp的DNA条带,证明所分离到的病原菌为Psa,且具有致病性。
2.4 MLSA分型
从86株Psa中挑选出16株分离自不同地区不同年份的Psa作为代表性菌株用于MLSA分型,16株菌株信息如表4所示。应用特异性引物PsaF1/PsaF2对这16株菌株进行特异性PCR扩增,其扩增产物凝胶电泳结果如图6所示,16株菌株均扩增出一条长度约为280 bp的片段,为Psa的特异性片段。
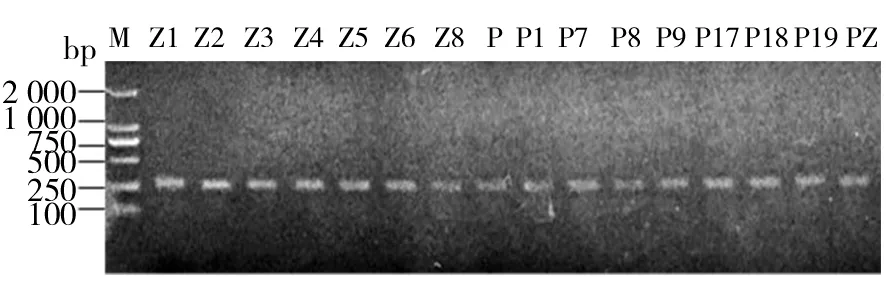
图6 特异性引物PCR扩增产物鉴定Fig.6 Identification of PCR amplification products with specific primers

表4 用于MLSA分析的代表菌株信息Table 4 Representative strain information for MLST analysis
根据Sarkar等描述的管家基因引物,分别扩增16株代表性Psa菌株的7个管家基因序列,其序列长度大约500~900 bp,凝胶电泳检测结果如图7所示。将这些扩增序列进行测序、比对、编辑和串联,应用Mega 6.0构建N-J系统发育树,如图8所示。由图8可以看出,所有菌株聚类为两大分支,一支为丁香假单胞菌猕猴桃致病变种(Pseudomonassyringaepv.actinidiae),另一支为Pseudomonassyringaepv.actinidifoliorum。Pseudomonassyringaepv.actinidiae又可以分为两个分支,其中Psa1、Psa3和Psa6聚为一支。Psa2和Psa5则聚为另一支。16株代表Psa菌株均与ICMP 18801及MAFF212118共同聚为一支,同为Psa3,而且Psa3与Psa6的遗传距离最近。
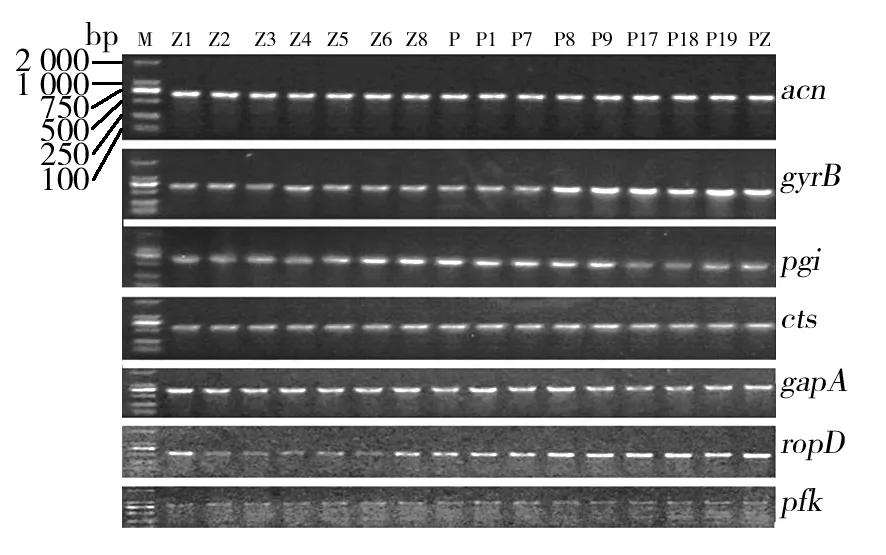
图7 管家基因扩增结果Fig.7 PCR amplication results of housekeeping genes
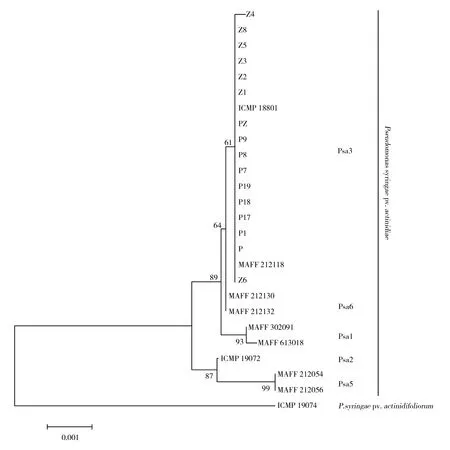
图8 N-J系统发育树Fig.8 N-J phylogenetic tree
3 讨 论
Psa具有高度的遗传多样性和变异性,自首次发现以来,已在世界范围内陆续发现多个变型。随着区域以及时间的变化可能会出现新的Psa变型,如在日本不同时期发现了Psa1、Psa3、Psa5和Psa6四个变型[17-19],在韩国发现了Psa1和Psa2两个变型[3,18],在意大利不同时期发现了Psa1和Psa3两个变型[4,16]。而且不同变型的Psa在毒力及致病性等方面存在一定的差异,因此明确猕猴桃主产区Psa的变型情况对于防治猕猴桃溃疡病病原菌的监测及防治均具有重要的指导意义。为全面分析陕西省各猕猴桃产区所存在的Psa变型情况以及随时间的变化情况,本研究自2013年起在陕西省各猕猴桃主产区采集发病样本分离Psa,尽可能全面地收集各区域各年份的Psa菌株,截止到2019年共分离到86株Psa菌株,并筛选其中具有代表性的16株Psa菌株与各个分型的参考菌株一起进行MLSA分型,结果表明16株代表性菌株均为Psa3。
本研究应用高蔗糖培养基作为筛选培养基分离筛选猕猴桃溃疡病病原菌Psa,通过观察菌落形态即可锁定目标菌株,极大地提高了分离筛选速度,而且准确率高。再结合特异性分子鉴定方法,应用特异性引物进行PCR扩增,通过观察扩增条带即可最终鉴定Psa。这两种方法结合使用可以快速准确分离鉴定Psa。本研究应用7个管家基因进行MLSA分型,首先MLSA分型相较于PFGE分型、PCR分型及RFLP分型更加快速简便,具有更好的重复性和区分力,被广泛应用于病原菌的分型。此外,应用7个管家基因进行MSLA分型相较于5个管家基因进一步提高了其分辨力和准确性。本研究中所用参考菌株的分型结果与Fujikawa[37]和Sawada[18]基于平均核苷酸一致性(average nucleotide identity,ANI)和单核苷酸多态性(single nucleotide polymorphism,SNP)的分型结果一致,证明本研究的MLSA分型结果准确可信。而且,相较于ANI和SNP,MLSA分型更加简单易操作,成本更低。
MLSA分型结果表明16株代表性菌株均为Psa3,说明陕西猕猴桃主产区的Psa为Psa3,Psa未随着时间及区域的变化而出现新的变型。本研究结果与McCann等[38]对全球Psa的遗传多样性分析结果相符合,McCann等利用全基因组测序数据对全球的Psa进行分析,其系统发育分析结果显示相较于韩国和日本的菌株,中国的Psa拥有较低的遗传多样性。此外任雪燕等[39]的研究结果也表明我国不同地域Psa之间的遗传差异和分化程度微弱,整体上我国的Psa遗传多样性处于低水平。陕西省Psa遗传多样性低,仅存在Psa3的原因可能有以下几点:一是进化时间短,物种的进化是漫长的,而Psa在陕西省出现不过31年;二是病原的寄生环境单一,陕西省猕猴桃主产区主要位于秦岭北麓,气候环境及土壤条件相近,且猕猴桃品种单一,主要为中华猕猴桃,因此Psa变异性低。
虽然目前在陕西省内只发现了Psa3,但是Psa是一个具有高度变异性的群体,其基因组上存在许多可移动的遗传元件,如前噬菌体、转座子和质粒等,它们的持续积累插入、缺失和突变将给Psa带来新的特征,如致病性、毒性和耐药性等[40-41],再加上各猕猴桃主产区之间苗木的往来运输,不排除未来在陕西省内会发现新的变型。因此需要不断监测Psa变型,为Psa的检测和防治提供参考。
综上所述,本研究自2013年起即在陕西省各猕猴桃主产区分离鉴定Psa,应用高蔗糖培养基作为选择培养基并结合特异性分子鉴定方法共鉴定出86株Psa。选择不同时间不同地区的16株代表性Psa菌株与参考菌株一起进行MLSA分型,最终确定16株Psa菌株均为Psa3。这说明陕西省猕猴桃主产区猕猴溃疡病病原菌为Psa3,未出现其他变型。本研究为Psa的快速鉴定及猕猴桃溃疡病综合防治措施的制定提供了参考。

