BMSCs通过调控TLR4/MyD88/NF-κB信号通路抑制LPS诱导急性肺损伤小鼠炎症反应
陈茂琼,杨萌婷,蔡 姣,匡梦岚,吴 莎,杨山福,张芷楠,杨小军,樊永霞
急性肺损伤(acute lung injury,ALI)是由各种原因导致的肺泡上皮及间质急性炎症性肺损伤,临床表现为急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS),可导致多器官功能障碍,发病率及病死率高,即使康复也面临长期生活质量低下的风险[1]。尽管经过40余年的不断研究,仍未找到有效的药物治疗方法。采用间充质干细胞(mesenchyml stem cells, MSCs)治疗ALI 是目前研究的热点[2]。MSCs 用于严重肢体缺血患者的一项临床研究[3]显示MSCs可明显改善患者肺功能[4]。多项研究证明[2,5],MSCs治疗ALI能减轻肺损伤严重程度,增强肺组织的修复能力,且安全,但具体机制仍不是十分明确。该文通过LPS诱导小鼠ALI模型,经同源BMSCs移植,探究其作用机制。
1 材料与方法
1.1 药物与试剂脂多糖LPS(美国Sigma,货号:039M4004V),地塞米松磷酸钠注射液(贵州天地药业有限责任公司,货号:H52020477),胎牛血清FBS(美国Gibco公司,货号:10099141)和低糖培养基L-DMEM(美国Gibco公司,货号:12100046);Eagle′s培养基(美国Gibco公司,货号:11835030);ELISA试剂盒(美国NOVUS公司,货号:101808,546999,);吉姆萨染色试剂盒、HE染色试剂盒、蛋白浓度检测试剂盒(北京索莱宝生物公司,货号:G1020,20200629, 20200817);Trizol(美国赛默飞公司,货号:284912);RT-PCR试剂盒(日本宝日医生物技术公司,货号:RR820A);SDS-PAGE凝胶试剂盒(美国Bio-Rad公司,货号:10074554485249);SDS-PAGE凝胶试剂盒(美国Bio-Rad公司,货号:64341430),SDS-PAGE凝胶试剂盒(美国Bio-Rad公司,货号:10074554485249);一抗TLR4、NF-κB、MyD88(美国CST公司,货号:Q9QUK6,Q04206,Q99836);超敏化学发光液(美国Affinity公司,货号:1824a01)。
1.2 动物SPF级KM(昆明种)小鼠,雌雄各半,4周龄,体质量(20±2)g,共32只,购自贵州医科大学实验动物中心,动物生产许可证号:SCXY(黔)2018-0001),饲养条件:温度(25±2)℃,湿度(50%~70%),自由获取食物和水,于带有12 h明/暗循环(7:00—19:00)的房间适应性喂养1周后开始造模。本实验涉及的实验动物经贵州医科大学动物伦理委员会审查并批准,批准号:2101208。
1.3 仪器生物安全柜、CO2细胞恒温培养箱、冰冻切片机、MultiSkan3酶标仪(美国Thermo Fisher),活细胞工作站(日本Olympus),流式细胞仪(FACSCantot Ⅱ),病理组织切片扫描仪(日本Nano Zoomer),全自动血液分析仪(深圳迈瑞),涡旋振荡器(无锡杰瑞安仪器设备有限公司SCILOGEX);电泳仪、凝胶成像仪、RT-PCR仪(美国伯乐);光学显微镜(日本Nikon);超低温高速离心机(德国Eppendorf);超纯水仪(美国Millipore);肺功能检测仪;恒温烘箱(上海善志仪器设备有限公司);电子天平(天津德安特公司)。
1.4 方法
1.4.1BMSCs分离、提取、培养及鉴定 取2只4周龄成年雄性KM小鼠,无菌条件下颈椎脱臼法处死后取双侧股骨,制备BMSCs。密度梯度离心分离有核细胞,贴壁法培养小鼠骨髓中MSCs,将原代细胞接种于75 cm2的培养瓶,经10%胎牛血清和青霉素-链霉素(100 IU/ml) 的低度Dulbecco′s改良Eagle′s培养基培养细胞。3 d后第1次换液,待细胞生长融合至80%~90%,用0.25% EDTA胰蛋白酶消化,进行第1次细胞传代,培养至第4代后经流式细胞仪检测细胞膜表面分子(CD105、 CD90、CD45、CD34)的水平。经胰酶消化、离心、生理盐水洗涤2遍,重悬成细胞悬液备用。本实验采用状态较好的第4代细胞,待其在7 500 mm2培养瓶中融合至约70%,去掉培养上清液,用生理盐水清洗2遍,按浓度为 1010pfu/L的绿色荧光蛋白 (green fluorescent protein,GFP) 标记的腺病毒液,在7 500 mm2培养瓶中加入0.1 ml,37 ℃ 孵育 1.5~2 h后更换为完全培养基继续培养48 h,荧光显微镜下观察GFP发光情况。胰酶消化、离心,PBS液重悬成细胞悬液备用。
1.4.2模型制备、分组及治疗 将体质量 (20±2) g KM小鼠适应性喂养1周后,使用随机数字表法将小鼠分为4组,每组8只,即对照组(Control)、模型组(LPS)、地塞米松治疗组(LPS+DEX)、BMSCs移植组(LPS+BMSCs)。1%戊巴比妥钠(10 ml/kg)腹腔注射,待麻醉生效,仰卧位固定四肢,酒精消毒后切开颈部皮肤并分离皮下各层组织,暴露气管,经气管缓慢推注LPS(5 mg/kg),观察小鼠是否出现呼吸急促、躁动等,判断药物弥散进入肺组织。随后逐层缝合切口放回鼠笼,待小鼠恢复活力后方可离开。对照组以类似方法暴露气管,注射相同剂量生理盐水。造模24 h后,尾静脉一次性注射移植GFP标记的BMSCs细胞悬液,剂量1×108个/kg;DEX治疗组,尾静脉注射DEX 3 mg/kg,每日1次,连续3 d;对照组和模型组尾静脉注射相应体积生理盐水,每日1次,连续3 d。
1.4.3动物样本收集 治疗完毕24 h,统计小鼠存活数目。存活小鼠行1%戊巴比妥钠(10 ml/kg)腹腔注射麻醉,摘眼球收集血液,室温静置30 min,1 000 r/min离心15 min,收集血清于-80 ℃冰箱保存,用于ELISA检测;采血完毕后,切开皮肤以暴露气管,通过气管套管将预冷的0.3 ml PBS注入肺中,并用注射器轻轻推注、反复灌洗,每次间隔1 min,回收3次吸出液体以获得支气管肺泡灌洗液(bronchoalveolar lavage fluid, BALF)。未经肺泡灌洗的各组小鼠剪开胸部,取出肺组织进行肺W/D重量比及病理学检查,其中部分肺组织冻存于液氮中,后续用于基因和蛋白组学检测;部分则放入4%多聚甲醛液固定,用于病理学检查。
1.4.4指标检测
1.4.4.1小鼠肺功能检测 细胞移植后第4天,分别检测小鼠肺功能。戊巴比妥钠(100 mg/kg)腹腔注射麻醉小鼠,待其达深度麻醉、自主呼吸消失,气管插管并连接FlexiVent肺功能检测仪,在含氧21%、呼吸频率150次/min、潮气量10 ml、呼吸末压力达0.2 kPa状态下进行机械通气,待呼吸平稳后,雾化吸入乙酰甲胆碱 (methacholine, Mach) 进行支气管激发试验。Mach浓度依次递增:0、1.5、3、6、12、25、50和100 g/L,间隔时间为2 min,雾化时间20 s,以诱发小鼠支气管平滑肌痉挛。同时检测:气道阻力 (airway resistance, ARs)、气道弹性阻力 (airway elastic resistance, AERs)、动态顺应性 (dynamic compliance,DC)、主气道阻力(main airway resistance, MARs)。
1.4.4.2肺W/D重量比的计算 取各组小鼠左肺上叶,PBS洗净表面血迹并用吸水纸蘸干多余液体,电子天平称量湿重W。置于60 ℃的烘箱中烘烤脱水48 h至恒重,称量记录干重D,通过计算肺W/D重量比评估肺组织水肿程度。
1.4.4.3瑞氏-吉姆萨染色法检测小鼠肺泡灌洗液(BALF)中炎性细胞的表达并计数 取BALF离心(3 000 r/min,5 min)弃上清液,PBS重悬细胞,取0.2 ml细胞悬液进行炎性细胞分类计数,另取0.2 ml悬液甩片,固定后用瑞氏-姬姆萨染液染色5 min,光学显微镜下观察并计数炎性细胞。
1.4.4.4病灶冰冻切片追踪肺组织中标记的BMSCs 取肺标本放置于托盘上,用镊子轻轻拨动组织使其尽量平整铺展,于整个组织块表面加入包埋剂,并置于冷冻速冻台面上(冷冻温度为-20 ℃)使其凝固,待凝固后转移至切片载物架上,设置切片厚度为8 μm,置于活细胞工作站显微镜下观察并拍照统计肺组织中GFP阳性细胞的数量。
1.4.4.5肺组织病理学检测 取经过4%多聚甲醛固定的肺组织,脱水、包埋、切片机切片,脱蜡后行HE染色,光学显微镜观察评估肺组织病理学变化并评估肺损伤程度,采用0~3分评分系统(0:正常;1:轻度;2:中度;3:重度),对肺泡壁厚度、炎性细胞浸润、出血三项进行盲法评估。
1.4.4.6RT-PCR检测肺组织TLR4、MyD88、NF-κBmRNA表达 TRIzol法提取液氮储存的肺组织的总RNA并检测浓度,逆转录cDNA后进行扩增反应,根据NCBI基因库数据,设计小鼠TLR4,MyD88和NF-κB引物(引物由生工生物工程上海股份有限公司合成),进行PCR扩增,并以GAPDH为内参,以2-ΔΔCt值计算各基因mRNA相对表达。引物序列见表1。

表1 引物序列
1.4.4.7酶联免疫吸附法(ELISA)测定分析 取 -80 ℃冰箱冻存的小鼠血清,根据ELISA试剂盒说明书检测IL-1β、IL-6、TNF-α的吸光度值并计算出各炎症细胞因子的表达水平。
1.4.4.8蛋白免疫印迹法(Westren blot)检测TLR4-MyD88-NFκB通路相关蛋白表达 取液氮储存的肺组织提取蛋白,BCA法测浓度后加热。10% SDS-PAGE凝胶电泳,转膜,5%脱脂牛奶室温封闭90 min,相应一抗(1 ∶1 000)4 ℃孵育过夜,二抗(1 ∶10 000)室温孵育2 h,用发光液显影并分析。
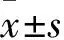
2 结果
2.1 BMSCs提取及鉴定接种3 d可见培养瓶底散在出现部分贴壁细胞;接种7 d细胞数量明显增多,且逐渐融合,接种10~14 d,细胞呈长梭形或多角形、旋涡状或流水样分布。第1代传第2代,3~5 d即可融合至70%~80%,继续往下传代。第4代细胞经过流式细胞仪检测,结果显示:CD105+、 CD90+、CD45-、CD34-,符合MSCs的生物学特征。见图1。

图1 光镜下培养至第4代的小鼠BMSCs ×200
2.2 BMSCs对ALI小鼠生存率的影响从造模开始到治疗结束Control组、LPS+DEX组、LPS+BMSCs组无小鼠死亡,LPS组小鼠死亡2只,死亡率为25%,存活小鼠只数≥6只;LPS+DEX组、LPS+BMSCs组无小鼠死亡,提示BMSCs可降低LPS诱导ALI小鼠的死亡。
2.3 FlexiVent肺功能检测结果LPS诱导ALI小鼠肺功能:MARs、ARs、AERs增加,DC降低,P<0.05。LPS+DEX组、LPS+BMSCs组经过治疗后,MARs、ARs、AERs增加减缓,DC增加接近对照组。见图2。
2.4 BMSCs对ALI小鼠肺组织W/D重量比及肺组织病理学的影响与对照组相比,LPS组小鼠肺W/D重量比明显增高(P<0.01);与LPS组相比,LPS+DEX组、LPS+BMSCs组W/D重量比值下降(P<0.05)。HE染色显示对照组肺组织未见肺泡壁结构改变及炎性细胞浸润;与对照组相比,LPS组小鼠肺脏水肿、淤血明显,肺间质炎性细胞增多、聚集(红色方框处),肺泡壁增厚,肺泡水肿、坏死、毛细血管出血(绿色方框处),组织学评分升高(P<0.01),表明造模成功;与LPS组相比,LPS+DEX组、LPS+BMSCs组小鼠肺水肿、充血程度减轻,炎性细胞浸润减少,组织学评分降低(P<0.05)。见图3。
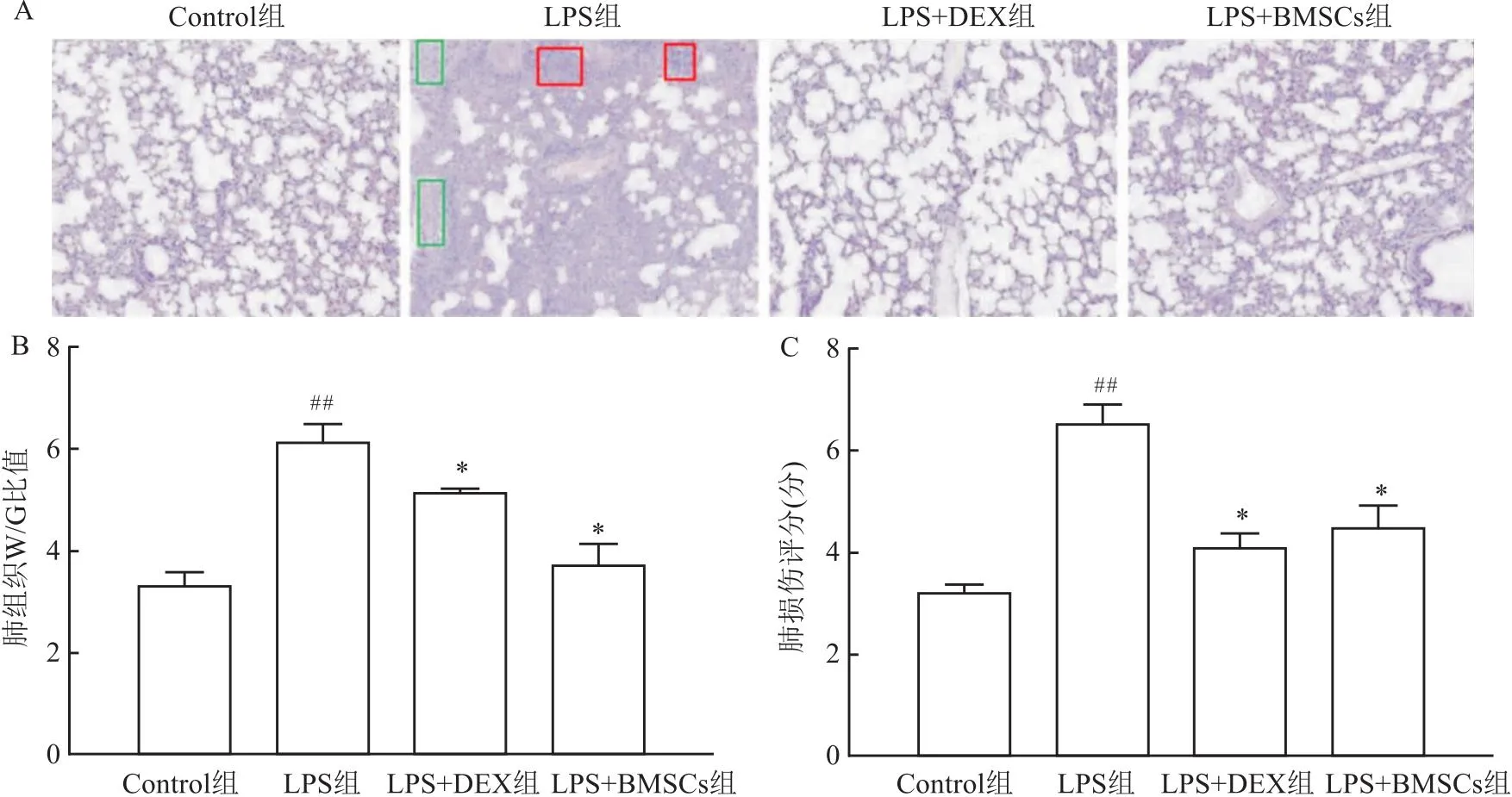
图3 BMSCs对LPS诱导ALI小鼠肺组织病理学、肺W/D重量比及肺损伤的影响
2.5 BMSCs对小鼠BALF中炎性细胞分类及计数的影响对照组仅有少量炎性细胞;与对照组相比,LPS组白细胞、中性粒细胞、单核细胞等明显增加(均P<0.01);与LPS组相比,LPS+DEX组、LPS+BMSCs组白细胞、中性粒细胞及单核细胞数量均减少(均P<0.05)。见图4。

图4 BMSCs对LPS诱导ALI小鼠BALF中炎性细胞的影响 ×50
2.6 冰冻切片追踪BMSCs在肺组织的定植荧光显微镜下可见BMSCs定植于肺部毛细支气管周围,在GFP下见绿色荧光,在Merge下见蓝色荧光,如图5红色箭头所指。

图5 BMSCs在肺组织的定植 HE×100
2.7 BMSCs对ALI小鼠肺组织中TLR4、MyD88和NF-κBmRNA表达的影响与对照组相比,RT-PCR检测结果示LPS组的肺组织中TLR4,MyD88和NF-κB的mRNA表达明显升高(P<0.01)。与LPS组相比,LPS+BMSCs组、LPS+DEX组的肺组织中TLR4,MyD88和NF-κB的mRNA表达明显降低(P<0.01)。见图6。
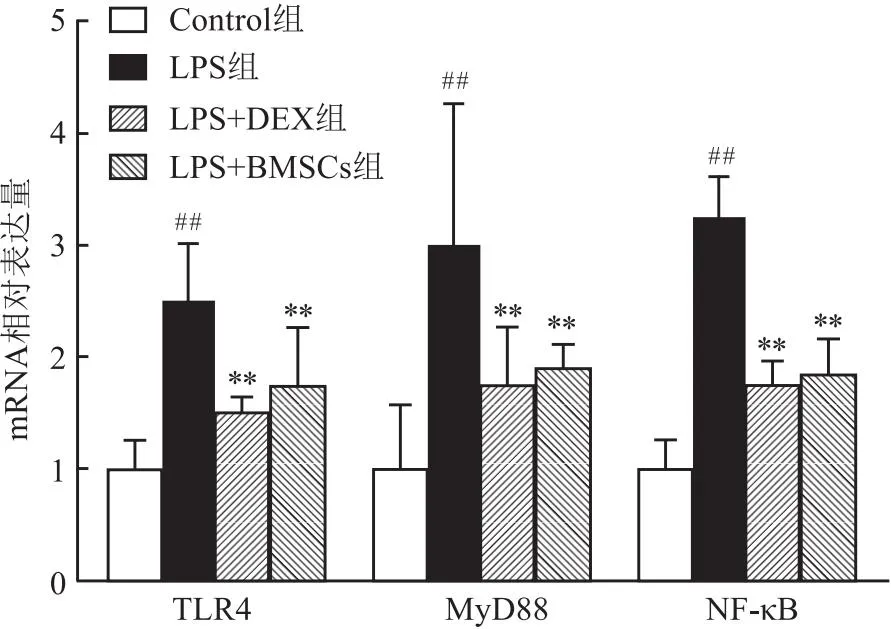
图6 BMSCs对LPS诱导ALI小鼠肺组织TLR4、MyD88和
2.8 BMSCs对ALI小鼠血清IL-1β、IL-6 和TNF-α,水平的影响与对照组相比,LPS组小鼠血清中IL-1β、IL-6和 TNF-α水平上升(均P<0.01);与LPS组相比,LPS+BMSCs组、LPS+DEX组IL-1β、IL-6和 TNF-α水平明显下降(均P<0.05)。见图7。
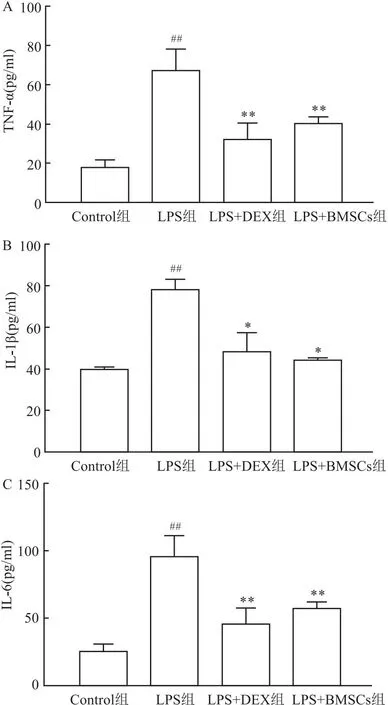
图7 BMSCs对ALI小鼠血清中TNF-α,
2.9 BMSCs对ALI小鼠肺组织TLR4/MyD88/NF-κB信号通路蛋白表达的影响Western blot检测显示,与对照组相比,LPS组TLR4、MyD88及NF-κB蛋白表达上调(均P<0.01),与LPS组相比,LPS+BMSCs组、LPS+DEX组TLR4、MyD88及NF-κB蛋白表达下调(均P<0.01)。见图8。

图8 BMSCs对ALI小鼠肺组织TLR4/MyD88/NF-κB信号通路蛋白表达的影响
3 讨论
ALI是一种以肺泡/毛细血管通透性增高、肺部炎症和肺组织结构损伤为特征的呼吸道疾病。因肺泡上皮细胞和毛细血管内皮细胞损伤,表现为弥漫性肺间质和肺泡水肿,可导致急性呼吸窘迫综合征,是临床上病死率较高的呼吸系统疾病,目前尚无高效且不良反应小的治疗药物[1]。ALI发生后,过度炎症反应导致毛细血管渗透性增加并上调炎症细胞因子数量,因此,治疗ALI的关键在于控制炎症反应[6]。LPS可刺激TLR4和巨噬细胞触发免疫系统活化,促进细胞因子分泌,导致脓毒性休克[7]。研究[8]表明,MyD88依赖性TLR4信号通路是激活NF-κB的重要途径,在NF-κB信号传导调节中至关重要。当细胞受到LPS等刺激时,IκB-α发生磷酸化,从复合物中解离并入核,激活NF-κB信号通路,引起下游释放炎症因子,这些炎症因子又会进一步激活NF-κB信号通路,引发“炎症风暴”,使肺损伤和炎症反应持续发展[8]。下调TLR4/MyD88信号通路或抑制NF-κB激活,可减轻LPS诱导的ALI的“炎症风暴”反应,说明TLR4/MyD88/NF-κB信号通路与ALI密切相关[9]。
在过去的几十年里,以MSCs为基础的细胞治疗学成为研究热点。在MSCs治疗ALI的临床前期研究[10]中显示了良好的修复和促再生作用,但其具体机制仍不明确。体外研究[11]显示:BMSCs可通过TLR4信号通路缓解LPS诱导的肺泡上皮细胞炎症和凋亡,该过程与其降低肺泡上皮细胞中TLR4/MyD88/NF-κB信号通路基因的mRNA水平并抑制相关蛋白表达密切相关。本研究发现,通过静脉移植BMSCs后,即可定植于受损的肺脏组织,通过调控信号通路TLR4/MyD88/NF-κB的基因和蛋白表达,抑制炎症反应,改善肺功能和肺组织病理状况。BMSCs具有以下特点,有望成为ALI细胞治疗的理想种子细胞。首先,BMSCs可以来源患者自体,用于患者自身不会发生排异反应,也不用担心外源性MSCs可能带来的病原微生物及肿瘤细胞污染,也不存在伦理学争议。BMSCs本身免疫原性低,具有广泛的免疫调节功能,影响先天免疫和获得性免疫,有利于自体和同种异体移植[12]。其次,BMSCs对损伤和炎症组织都有很强的内在趋向性。越来越多的临床前和临床研究表明,肝细胞生长因子、转化生长因子-β和血管内皮生长因子可以诱导BMSCs向炎症部位迁移。BMSCs可以释放各种可溶性因子和外泌体,从而减轻炎症,改善损伤部位的微环境,促进组织修复和再生[13]。此外,BMSCs有可能分化为肺组织细胞以替代受损的细胞或组织,尽管这一观点存在争议。最后,BMSCs作为有生命的生物药物,移植进入模型动物体内后可在一定的时间内持续发挥作用,并且不会像地塞米松对机体作用短暂且不良反应较为严重[14]。这些都提示BMSCs对ALI进程有较强的抑制作用。
综上所述,BMSCs移植治疗LPS诱导的ALI的作用机制与调控 TLR4/MyD88/NF-κB 信号通路,抑制炎症因子及介质释放,降低炎症水平有关。BMSCs能有效改善LPS诱导的ALI,通过抑制炎症反应,减轻肺损伤症状,发挥保护作用。本研究阐释了BMSCs治疗LPS诱导ALI的可能潜在机制,为进一步开拓细胞生物治疗ALI、寻找治疗ALI的作用靶点提供了客观的实验依据和理论支持。

