磷转运蛋白StPHO1.2 提高马铃薯耐热性
李 万 李 成 程 敏 吴 芳
1 商洛学院生物医药与食品工程学院, 陕西商洛 726000; 2 西安润壮稼农业科技有限公司, 陕西西安 710003; 3 商洛学院科技处, 陕西商洛 726000; 4 商洛学院国内合作与校友工作处, 陕西商洛 726000
磷元素(Pi)是植物不易获取的、天然土壤中稀有的营养元素之一[1]。研究表明, 植物体内的分解作用、呼吸作用、光合作用、物质运输和信号转导等理化反应都离不开磷元素的参与, 其对植物的生长发育、产量、品质和抗逆性具有重要影响[2]。植物对磷元素的获取主要通过磷转运蛋白(phosphate transporters)实现, 磷转运蛋白能够通过增强植物对磷素营养的吸收和转运, 为植物提供充足磷元素, 从而促进植物的生长发育, 提高产量、品质和抗逆性。
磷转运蛋白包括6 类: PHT1、PHT2、PHT3、PHT4、PHT5 和PHO1[3], PHT1 亚家族是高亲和力转运蛋白。拟南芥PHT1 亚家族PHT1;1、PHT1;2、PHT1;6和PHT1;8等4 个基因的表达量降低会导致植物对磷的摄取和转运能力下降[4-5]; 在磷元素缺乏时, 有5 个基因(PHT1;1、PHT1;4、PHT1;5、PHT1;8和PHT1;9)在根部的表达量上调[6]。缺磷或磷充足条件下, 水稻PHT1 亚家族基因OsPT8的沉默会降低其对磷元素的摄取和转运, 降低结实率[7]。在水稻中过表达番茄PHT1 家族基因LePT1和LePT2, 在缺磷环境下, 水稻根系和叶肉细胞中LePT1和LePT2的表达量上调, 增强水稻对磷元素的吸收, 促进植株生长; 磷过量条件下, 过表达LePT1和LePT2会抑制水稻生长发育, 降低株高, 减少分蘖[8]。这些结果均表明PHT1 亚家族在根系统从土壤获取磷过程中的关键作用。PHT2、PHT3 和PHT4 这3 个亚家族成员都是低亲和力转运蛋白[3]。PHT2 亚家族成员对磷元素在植物体内的分配和光合作用有影响, 例如,在小麦中抑制PHT2 亚家族成员的表达, 能够降低小麦叶片和叶绿体中的磷元素浓度, 且无论磷元素缺乏或充足, 该小麦植株都呈现出矮小、光合能力弱等表型[9]。大豆GmPHT2;1和GmPHT2;2基因具有响应低磷胁迫的能力, 在低磷胁迫下, 大豆GmPHT2;2的表达量显著高于GmPHT2;1; 此外,GmPHT2;1可能还在响应低温胁迫中发挥着一定的功能[10]。线粒体合成的ATP 进入其他细胞器时需要磷元素的协助, PHT3 亚家族则负责介导调控该部分磷元素的转运[11]。过表达拟南芥PHT3 亚家族成员PHT3;3的植株对盐胁迫更为敏感[12]。PHT4 亚家族对酵母中的磷元素转运具有高度特异性, 同时也介导了植物细胞质和叶绿体、异养质体和高尔基体之间的磷元素的转运[2-3]。在马铃薯中, 过表达PHT4亚家族基因StPHT4;2的转基因植株, 其块茎产量更高, 类胡萝卜素含量也更高, 表明StPHT4;2 可能与马铃薯产量和品质相关[13]。PHT5 亚家族能够增加植物耐低磷胁迫的能力[2-3]。在甘蓝型油菜中, 基因BnPHT5;1a和BnPHT5;1b均影响油菜磷稳态, 但BnPHT5;1b适应磷波动能力显著降低,BnPHT5;1a则与耐低磷胁迫能力密切相关[14]。PHO1 亚家族负责磷酸盐的摄取和分配, 参与磷酸盐饥饿状态下的信号传导[15-17]。过表达草莓 PHO1 亚家族基因FaPHO1;H9的拟南芥植株磷含量显著高于野生型植株, 表明FaPHO1;H9在磷转运中起作用[18]。Liu等[19]研究发现, 马铃薯磷转运蛋白PHO1 亚家族的StPHO1.1、StPHO1.2 和StPHO1.3 对磷元素的吸收和转运, 以及马铃薯耐热性具有重要作用。
马铃薯(SolanumtuberosumL.)是小麦、水稻和玉米之后的第四大粮食作物, 高温易使马铃薯减产甚至绝收[20]。本研究以提高马铃薯耐热性为出发点,利用农杆菌介导, 在马铃薯中过表达基因StPHO1.2,比较转基因株系和野生型株系在高温胁迫下的生长差异, 阐明StPHO1.2 对马铃薯生长和耐热性的影响;利用酵母双杂交和双分子荧光互补(BiFC)技术筛选StPHO1.2 的互作蛋白, 为进一步探究StPHO1.2 影响马铃薯耐热性的分子机制奠定基础, 对培育出耐高温、高产、优质的马铃薯新品种提供理论依据和数据支撑。
1 材料与方法
1.1 载体构建
过表达载体pBI121 和荧光表达载体p1300-RFP由本课题组保存, 酵母双杂交相关载体pNubG-Fe65、pTSU2-APP、pPR3N、pOST1-NubI、pBT3-STE、pBT3-SUC、pBT3-N、pBT3-C, BiFC 载体NY、CY, 以及膜系统文库质粒均由西北农林科技大学吴云锋教授提供。
从Phytozome (https://phytozome-next.jgi.doe.gov/)下载基因StPHO1.2序列(PGSC0003DMT400044207),设计特异性引物(表1), 通过PCR 从马铃薯cDNA 中扩增基因StPHO1.2, 根据北京全式金生物技术有限公司的一步法无缝克隆试剂盒(CU201)操作说明书,构建相关载体。
1.2 构建过表达StPHO1.2 的马铃薯转基因株系
1.2.1 农杆菌介导的马铃薯转化 采用农杆菌介导的马铃薯转化技术构建过表达StPHO1.2的马铃薯转基因株系。试验所用马铃薯品种为“Desiree” (野生型, 对照), 用于转化的外植体为马铃薯叶片。愈伤诱导培养基和芽诱导培养基的配制参照张超[21]的方法。
转化重组质粒pBI121-StPHO1.2 至根癌农杆菌感受态细胞GV3101, 筛选阳性克隆并置于含有抗生素(Kan、Rif)的LB 液体培养基中培养(20 mL), 待菌液OD600为0.6~0.8 时, 离心收菌, 使用同体积无抗性LB 液体培养基重悬菌体, 待用。将生长良好的马铃薯叶片置于含有20%蔗糖的MS 液体培养基中(MS2), 用手术刀切除叶柄和叶尖, 在叶片背面划出数道伤口并加入待用菌液, 轻轻摇晃5~10 min 后,暗培养2 d。转移暗培养完成的转化叶片至愈伤诱导培养基培养, 10 d 后转移至芽诱导培养基继续培养(每7~10 d 更换一次), 约4~6 周会形成芽。待芽长至1~3 cm 时剪下置于含有抗生素(Kan amycin)的MS2 培养基中培养。
1.2.2 阳性转基因株系鉴定 待芽组织生长至完整植株时, 采用CTAB 法[22]提取DNA, 设计扩增抗性标记基因(Kan+)的特异性引物(KanF: 5′-GCTATG ACTGGGCACAACAG-3′; KanR: 5′-ATACCGTAA AGCACGAGGAA-3′), 利用PCR 初步鉴定阳性植株。提取初步鉴定的阳性植株的RNA 并反转录得到cDNA, 设计定量引物(DLStPHO1.2F: 5′-GCCAAGT CGATGCAATTCCT-3′; DLStPHO1.2R: 5′-GAGGAA GTAGAAGCGCGTTG-3′), 以ubi3为内参基因[23],对转基因株系和野生型株系中StPHO1.2的基因表达量进行定量分析[24]。
1.3 StPHO1.2 对马铃薯耐热性的影响
利用植物组织培养技术扩繁转基因株系和野生型株系组培苗, 待生长4~6 周后, 选择长势一致的植株分别置于高温(35℃)和常温(22 ℃± 1 ℃)条件下培养, 每种温度下的转基因或野生型植株各9 株。将不同温度下培养的9 株植株, 平均分成3 组, 分别用无磷(0 mmol L–1Pi)、缺磷(0.1 mmol L–1Pi)和富含磷(1.0 mmol L–1Pi)的Hoagland 营养液培养(青岛海博生物技术有限公司, HB8870-3、HB8870-2、HB8870-1), 3 周后观察生长差异。
1.4 StPHO1.2 的互作蛋白筛选
1.4.1 StPHO1.2 的亚细胞定位 种植本氏烟草,待其生长4~6 周后用于亚细胞定位试验。转化重组质粒p1300-RFP-StPHO1.2 至根癌农杆菌感受态细胞GV3101, 筛选阳性克隆并置于10 mL 的LB 液体培养基中培养16 h 左右, 离心收菌。用重悬液(含5%蔗糖和0.02% silwet L-77)重悬菌体并调整OD600值为1.0, 黑暗中放置3 h, 备用。用针头在烟草叶片背面轻触产生创口, 将准备好的菌液通过创口注射进烟草, 覆膜保湿培养2 d, 在激光共聚焦扫描显微镜下(日本Olympus, IX83-FV1200)观察荧光。
1.4.2 酵母双杂交筛选互作蛋白 按照表2 组合共转酵母感受态细胞NMY51, 分别涂布于SD-TL培养基(0.67% YNB, 2%葡萄糖, 0.064% SD-Trp/-Leu,1.5%琼脂粉)和SD-TLHA 培养基(0.67% YNB, 2%葡萄糖, 0.06% SD-Trp/-Leu/-His/-Ade, 1.5%琼脂粉)培养, 根据生长情况筛选出最适合的载体(本试验最适合的载体为pBT3-STE)。
表2 载体筛选Table 2 The selection of vector
YNB (无氨基酵母氮源培养基, Y8040)购买于北京索莱宝科技有限公司, SD-Trp/-Leu (色氨酸和亮氨酸氨基酸缺失混合物, 630417)和 SD-Trp/-Leu/-His/-Ade (色氨酸、亮氨酸、组氨酸和腺嘌呤氨基酸缺失混合物, 630428)购买于宝日医生物技术(北京)有限公司。
转化重组质粒pBT3-STE-StPHO1.2 至酵母感受态细胞NMY51, 筛选阳性克隆后制备含有pBT3-STE-StPHO1.2 的酵母感受态细胞[25], 取10 μL 膜系统文库质粒转化该感受态细胞, 涂布于SD-TLHA培养基, 2~3 d 后, 挑取单克隆菌落转移至SD-TLHA培养基(含X-α-Gal)再培养3 d, 选取显蓝色的菌落,PCR 鉴定并送于西安擎科泽西生物科技有限责任公司测序。
利用NCBI 网站序列比对分析测序结果, 构建该序列与 pPR3N 的重组质粒, 并与 pBT3-STEStPHO1.2 共转酵母感受态细胞NYM51。菌液涂布于SD-TL 和SD-TLHA 培养基上培养3 d, 挑取单克隆菌落移至SD-TLHA 培养基(含X-α-Gal), 观察显色情况。
1.4.3 BiFC 验证蛋白互作 构建互作蛋白的CY 载体, 与NY-StPHO1.2 分别转化至根癌农杆菌感受态细胞 GV3101, 参照陆孙杰的方法[19]进行BiFC 验证。
2 结果与分析
2.1 构建过表达StPHO1.2 的马铃薯转基因株系
提取转化植株和野生型植株(Desiree)的基因组DNA, 利用抗性标记基因(Kan+)的特异性引物进行PCR 扩增(图1)。结果显示, 从pBI121 空载质粒和转化StPHO1.2的植株基因组DNA 均扩增得到600 bp 左右的条带, 但Desiree 基因组DNA 并未扩增出条带, 表明pBI121-StPHO1.2 成功转入了Desiree。
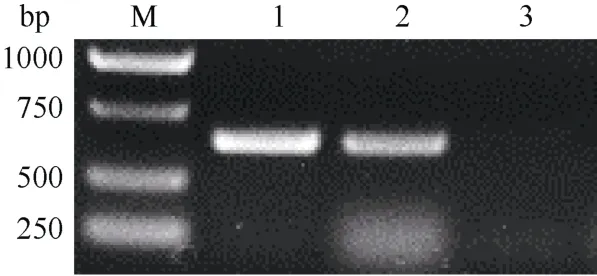
图1 抗性基因PCR 鉴定阳性转基因株系Fig.1 Identification of positive transgenic lines of resistance gene by PCR
提取转化植株和Desiree 的RNA 并反转录得到cDNA, 利用定量引物和ubi3内参基因分析StPHO1.2的基因表达量变化。结果显示, 相比于Desiree, 转化植株中StPHO1.2的基因表达量升高了10 倍以上, 表明StPHO1.2成功在Desiree 中过表达(仅展示StPHO1.2基因表达量最高的阳性转基因植株) (图2)。将过表达StPHO1.2的马铃薯转基因株系命名为StPHO1.2-Desiree。
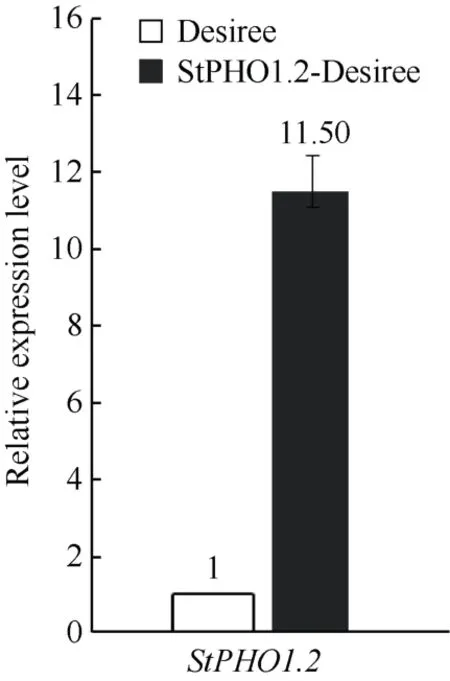
图2 定量PCR 鉴定阳性转基因株系Fig.2 Identification of positive transgenic lines by qPCR
2.2 StPHO1.2 对马铃薯耐热性的影响
无磷(0 mmol L–1Pi)条件下(图3-A), 高温(35 ℃)和常温(22℃±1 ℃)下的StPHO1.2-Desiree 和Desiree的长势无显著差异。缺磷(0.1 mmol L–1Pi)条件下(图3-B)和富含磷(1.0 mmol L–1Pi)条件下(图3-C), 高温和常温下的 StPHO1.2-Desiree 的长势均优于Desiree。此外, 相比于无磷和缺磷条件, 磷元素充足时, StPHO1.2-Desiree 和Desiree 具有更为良好的生长。因此, 过表达StPHO1.2能够增强马铃薯耐热性,且磷元素越充足, 转基因植株生长的越好。
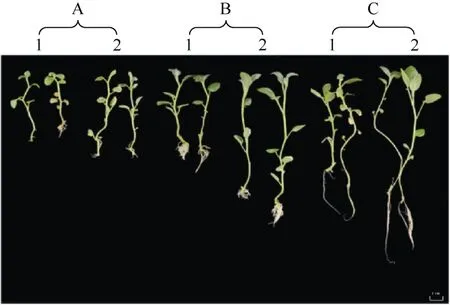
图3 StPHO1.2-Desiree 和Desiree 的表型分析Fig.3 Phenotypic analysis of StPHO1.2-Desiree and Desiree
2.3 StPHO1.2 的互作蛋白筛选
2.3.1StPHO1.2的亚细胞定位及酵母双杂交筛选互作蛋白 将OD600为1.0 的含有重组质粒p1300-RFP-StPHO1.2 的农杆菌菌液注射进本氏烟草叶片中, 保湿培养2 d 后, 在激光共聚焦扫描显微镜下观察荧光。结果显示, 阴性对照组的烟草荧光信号杂乱无规则, 试验组烟草细胞膜上可见荧光信号, 表明StPHO1.2在细胞膜上表达(图4)。
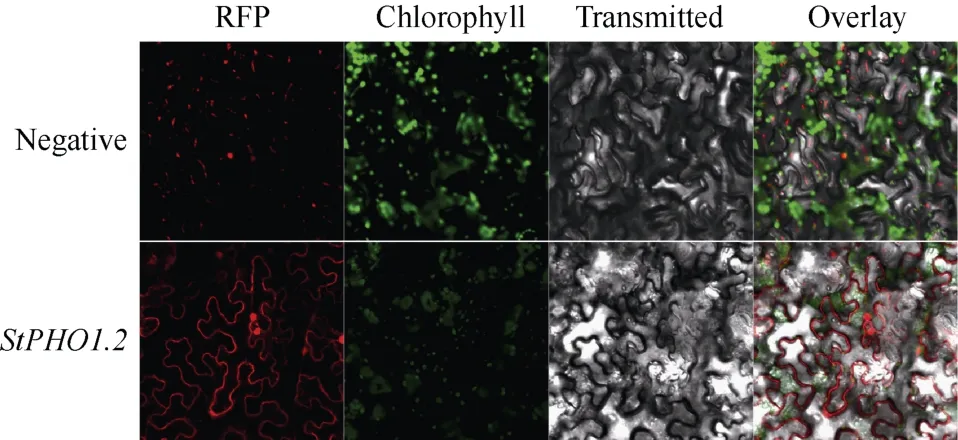
图4 StPHO1.2 的亚细胞定位Fig.4 Subcellular localization of StPHO1.2
由图5 可知, 共转pNubG-Fe65 和pTSU2-APP(阳性对照)的 NMY51 酵母菌株能在 SD-TL 和SD-TLHA 培养基上良好生长。NMY51 (阴性对照)在SD-TL 和SD-TLHA 培养基上均无法生长。共转pPR3N 与重组质粒pBT3-STE-StPHO1.2 (自激活检测)的NMY51 能在SD-TL 培养基上生长, 但无法在SD-TLHA 培养基上生长。共转 pOST1-NubI 和pBT3-STE-StPHO1.2 (功能检测)的NMY51 在SD-TL和SD-TLHA 培养基上均能正常生长。表明重组质粒pBT3-STE-StPHO1.2 功能良好, 且无自激活现象,因此, 选择pBT3-STE-StPHO1.2 进行酵母筛库试验。
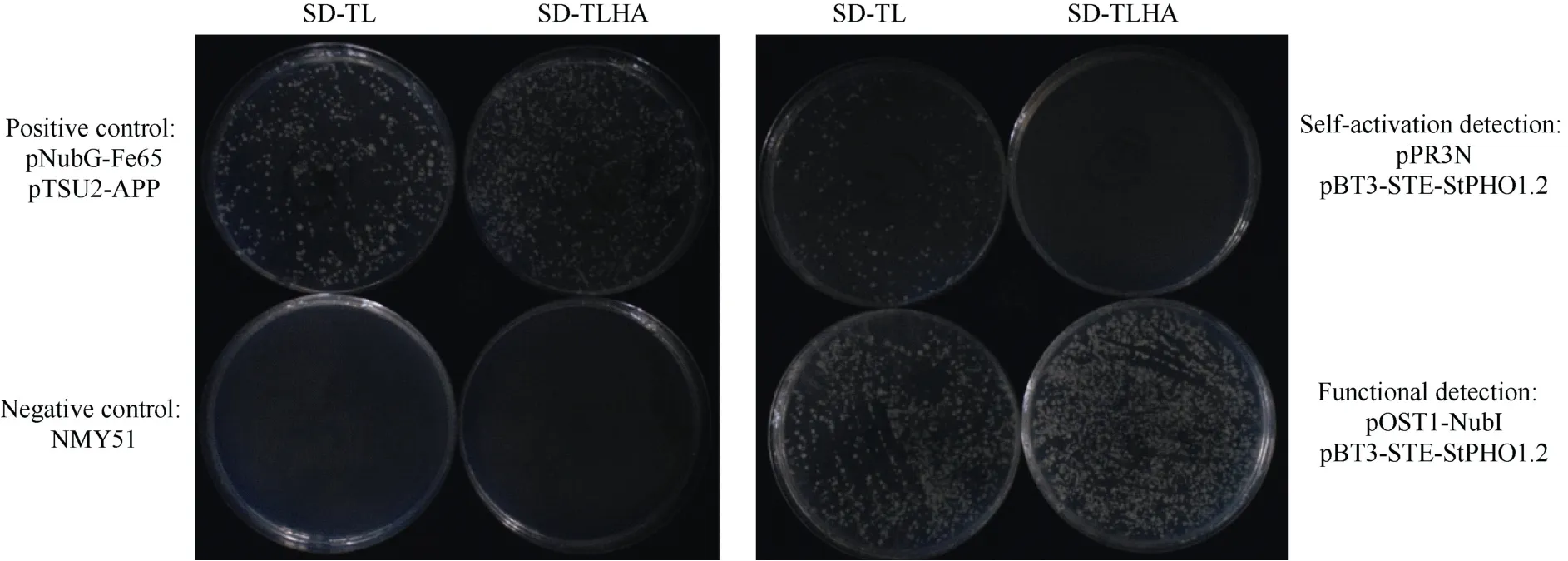
图5 酵母双杂质粒的筛选Fig.5 Screening of vector for yeast double-hybrid experiment
转化pBT3-STE-StPHO1.2至NMY51, 挑取阳性克隆并制备含有重组质粒pBT3-STE-StPHO1.2 的酵母感受态, 然后转化膜系统文库质粒至该感受态中,挑取在SD-TLHA 培养基上生长的单克隆菌落, 移至新鲜的SD-TLHA 培养基(含X-α-Gal)上生长, 结果如图所示(图6)。显蓝色的代表该蛋白与StPHO1.2具有强相互作用。经过PCR、测序、序列比对分析发现, 钙离子转运相关蛋白(StCAX1, PGSC0003 DMT400030772)和光系统 II 蛋白亚基(StPsbR,PGSC0003DMT400057257)与StPHO1.2 互作。
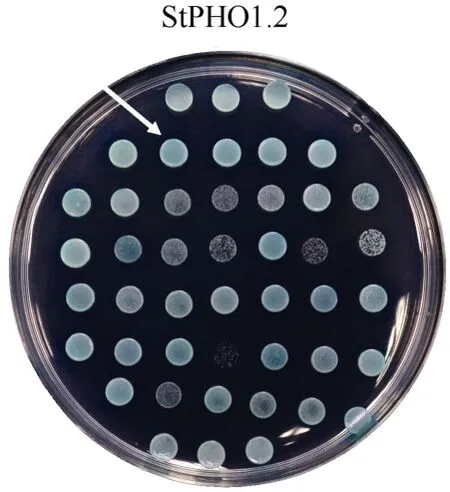
图6 酵母双杂交筛选StPHO1.2 的互作蛋白Fig.6 Screening of interacting proteins of StPHO1.2 by yeast double-hybrid
构建重组质粒 pPR3N-StCAX1 和 pPR3NStPsbR, 分别与pBT3-STE-StPHO1.2 共转NMY51酵母感受态。通过PCR 鉴定共转成功的阳性酵母菌,挑取该菌斑溶于20 μL 无菌生理盐水, 点样3 μL 于SD-TLHA (含X-α-Gal)培养基上生长。结果显示, 转化后的NMY51 酵母菌能在SD-TLHA 培养基上生长,且能与 X-α-Gal 反应显现蓝色, 表明 StCAX1 和StPsbR 均与StPHO1.2 互作(图7)。

图7 StPHO1.2 与互作蛋白的“一对一”验证Fig.7 “One-to-one” verification of StPHO1.2 and interacting proteins
2.3.2 BiFC 验证蛋白互作 构建重组质粒CY-StCAX1 和CY-StPsbR, 分别与NY-StPHO1.2 在本氏烟草叶片中进行BiFC 验证(图8)。阴性对照(NY+CY、CY-StCAX1+NY、CY-StPsbR+NY 和CY+NY-StPHO1.2)无互作, 故荧光信号杂乱且不规则;StCAX1 和StPHO1.2、StPsbR 和StPHO1.2 均互作,因此, CY-StCAX1+NY-StPHO1.2 和CY-StPsbR+NYStPHO1.2 共注射烟草叶片后, 在显微镜下能够观察到荧光信号。结果显示, 细胞膜和细胞质中都有荧光信号出现, 表明StCAX1 和StPsbR 均与StPHO1.2互作。
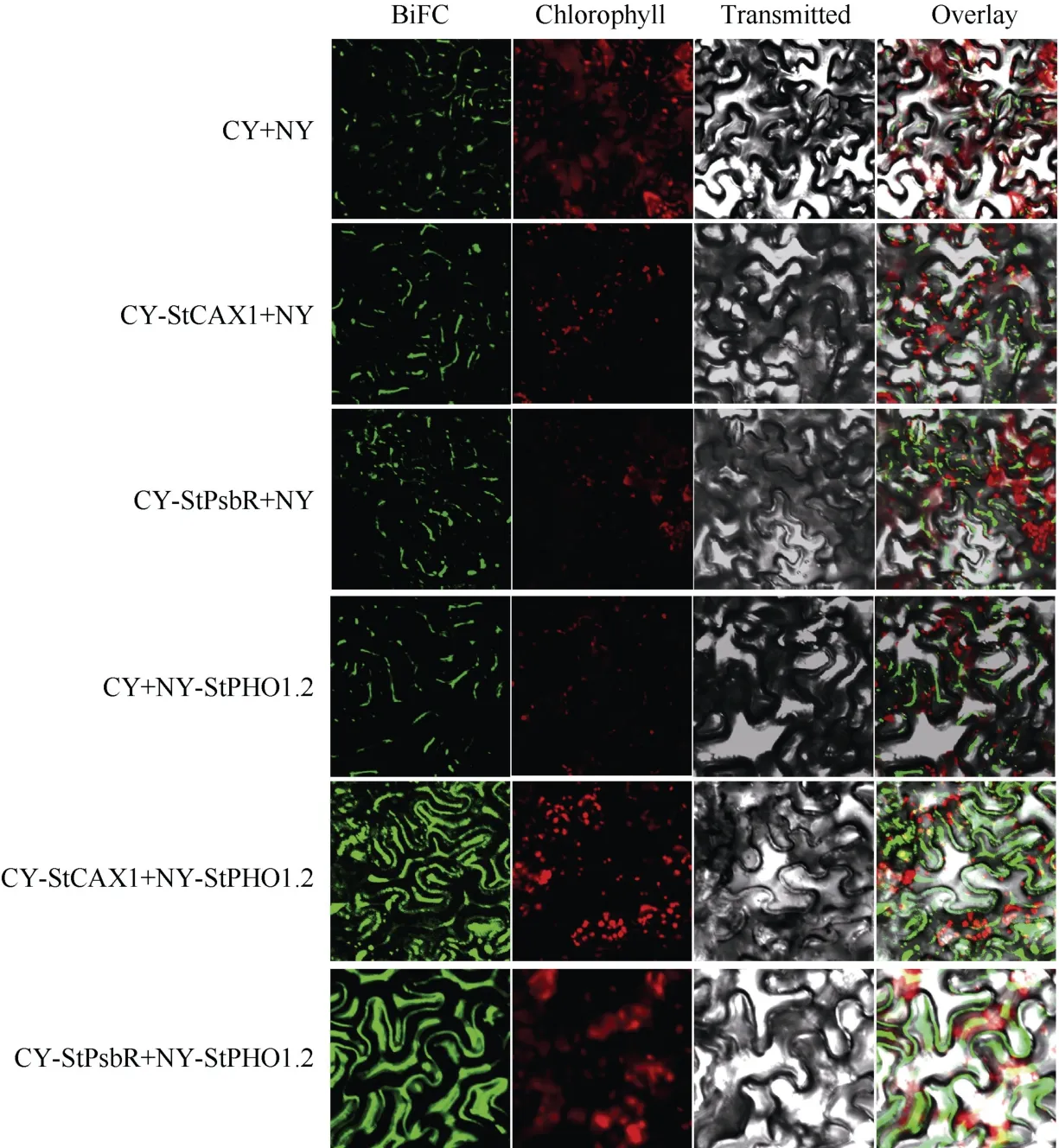
图8 StPHO1.2 与互作蛋白的BiFC 验证Fig.8 BiFC identification of StPHO1.2 and interacting proteins
3 讨论
植物在磷元素缺乏环境下, 其多个理化指标会发生变化, 从而影响到生长发育。磷元素是光合作用中不可缺少的底物或调节物, 缺磷则会严重影响植物的光合作用[26], 导致光合速率下降, 从而减少生长量、根系结构等[27]。水稻在磷元素缺乏时, 碳水化合物更多地运输至根部, 从而增加根冠比[28],加剧膜脂过氧化程度加剧[29]。大豆在缺磷条件下,通过光合作用固定的碳更多的转化成为了淀粉, 运输至茎和根部的可溶性糖含量则急剧减少[30], 同时抗逆性明显受到影响, 比如细胞膜透性增加, MDA含量升高, 保护酶活性下降等[31]。
拟南芥 PHO1 亚家族包含 11 个成员(PHO1,PHO1;H1-H10), 缺失PHO1基因的拟南芥表现出典型缺磷表型[32], 但通过过表达PHO1或PHO1;H1能够修复, 使拟南芥生长正常[33]。PHO1;H3 具有磷转运的功能[34]; PHO1;H10 与生物和非生物胁迫有关[35-36]。在马铃薯中,StPHT1;7的过表达会降低马铃薯耐旱性[37], PHO1 亚家族成员不仅与磷转运有关, 也涉及马铃薯的抗逆过程[19,38]。本研究中, 无磷条件下, StPHO1.2-Desiree 和Desiree 的生长都受到了明显限制; 缺磷条件下, StPHO1.2-Desiree 能够正常生长, 但 Desiree 生长受限; 富含磷条件下,StPHO1.2-Desiree 和Desiree 均能正常生长, 既表明磷元素对马铃薯生长的重要性, 也表明过表达StPHO1.2能够影响马铃薯对磷元素的吸收和转运,促进马铃薯生长, 增强马铃薯耐热性, 这些结果与前人研究结果一致。
在高温胁迫下, 植物体内会通过一系列理化反应保护自身免受高温侵害, 比如增加细胞膜流动性,增强抗氧化酶活性和光合速率, 产生脯氨酸、可溶性糖等渗透调节物质, 以及产生热休克蛋白等应激蛋白[39]。本研究发现, StPsbR 是光合系统II 蛋白亚基, 与植物光合作用相关; StCAX1 与钙离子的转运有关, 钙离子作为第二信使, 其浓度会在高温胁迫等逆境环境下升高, 对植物的生长发育具有十分重要的作用[40]。因此, StPHO1.2 与StCAX1 和StPsbR互作, 表明StPHO1.2 可能会影响信号转导或光合作用, 从而对马铃薯耐热性、生长发育产生影响, 这和磷元素的生理功能是一致的[2]。除StCAX1 和StPsbR外, 本研究还发现StPHO1.2 与抗氧化反应有关的Glu 蛋白(谷氧还蛋白, PGSC0003DMT400020793)互作(未展示图片), 表明StPHO1.2 还可能通过提高马铃薯的抗氧化能力, 从而增强抵御高温胁迫的能力,但该互作仍需进一步验证。
综上所述, 富含磷条件下, StPHO1.2 可能通过影响马铃薯光合作用、信号转导、抗氧化能力等, 增强马铃薯耐热性, 促进马铃薯生长。
4 结论
本研究构建了一系列重组质粒, 首先利用农杆菌介导的马铃薯转化技术, 在野生型马铃薯(Desiree)中过表达StPHO1.2, 鉴定获得转基因株系(StPHO1.2-Desiree)。其次, 分别在高温(35 ℃)和常温(22℃±1 ℃)环境下, 比较StPHO1.2-Desiree 和Desiree 在无磷(0 mmol L–1Pi)、缺磷(0.1 mmol L–1Pi)和富含磷(1.0 mmol L–1Pi)条件下的生长情况, 结果表明, 在富磷条件下, 过表达StPHO1.2能够增强马铃薯耐热性,对马铃薯生长也具有一定的促进作用。对StPHO1.2的亚细胞定位结果显示, StPHO1.2 在细胞膜上表达,因此, 选择膜系统文库质粒筛选StPHO1.2 的互作蛋白; 对酵母双杂交载体筛选后发现, pBT3-STE 最符合本研究需求。最后, 通过酵母双杂交试验, 证明StPHO1.2 与钙离子转运相关蛋白(StCAX1)和光系统II 蛋白亚基(StPsbR)均有相互作用, 并通过BiFC技术进一步验证了该互作。以上结果为深入理解磷转运蛋白的功能及响应高温胁迫的分子机制机理提供了参考, 对培育出高产、优质、抗逆性强的马铃薯新品种具有促进作用。

