硫酸化制备圆苞车前子低黏多糖及其结构表征和抗氧化活性研究
曹 磊,刘 伟,王俊龙,纳森巴特,巴哈尔古丽·别克吐尔逊,松布尔,冯亚萍,热合巴提·努尔夏提
伊犁师范大学化学化工学院 新疆维吾尔自治区教育厅天然产物化学与应用重点实验室,伊宁 835000
多糖大量存在于动物、植物以及微生物中,由于其较低的毒性、优良的生物活性,在食品和医药行业广泛应用。现代研究表明,多糖具有免疫调节、抗肿瘤、抗炎、抗病毒、抗氧化、抗辐射、降血糖、降血脂、保肝等多种功能[1-4]。近年来,为了提高多糖的生物活性和优化多糖的理化性质,人们开发了多种多糖衍生方法,如硫酸化、乙酰化、羧甲基化和磷酸化等[5-7]。多糖的硫酸化可以显著增强多糖的结构特征,提高多糖的生物活性,甚至使多糖具有新的生物活性[8]。Yang等[8]研究利用氯硫酸-吡啶法对纳豆多糖进行硫酸化,硫酸化后的纳豆多糖的抑菌活性有所增强。Chen等[9]采用氯硫酸-吡啶法制备硫酸化山药多糖衍生物,结果表明硫酸化修饰优化了山药多糖理化性质,表现出更加优异的免疫调节活性。Arokiarajan等[6]通过对海藻多糖的硫酸化修饰,提高了多糖在水中的溶解度,并进一步提高了多糖的提取率。生物结构化合物生物活性的决定性因素,Tao等[10]利用氯磺酸-吡啶法将天然菌类多糖硫酸化衍生物在体内和体外的抗肿瘤活性进行了对比,发现硫酸化衍生物对HepG2细胞的体外抑制率高于原多糖。
圆苞车前子为车前属植物圆苞车前子(PlantagoovataForsk)的干燥成熟种子[11],是中国新疆地区食用和药用的传统药用植物。圆苞车前子具有止泻,利尿,止痛,降热,消肿利咽等功效,主治肾炎水肿,泌尿系统感染,尿频,尿痛,尿血,泻痢等疾病[12]。圆苞车前子多糖具有高黏的特性,虽然赋予了其润肠通便、促进肠道健康等生理功能,但也给其生产,研究和应用带来了不便。这一问题一直受到广泛关注,但进展缓慢。因此,有必要开发新的方法,在保证低成本,保结构,保活性的前提下,有效降低圆苞车前子多糖的黏度,以促进圆苞车前子多糖的进一步开发利用,提高经济效益。到目前为止,还没有研究报道圆苞车前子多糖的结构修饰及其对生物活性和结构特征的报道。
因此,本研究主要以圆苞车前子多糖为研究对象,以硫酸化方法制备低黏性圆苞车前子多糖,再经分离纯化制备均一多糖,并初步研究其结构特征,采用体外抗氧化实验评价其抗氧化活性。据我们所知,这是首次对圆苞车前子多糖的硫酸化降低黏性的研究。
1 材料与方法
1.1 材料与试剂
圆苞车前子购自新疆恩萨尔维吾尔医饮片药业有限公司(批号:201902);乙二胺四乙酸(EDTA)(批号:P2369889,含量≥99%,上海阿拉丁生化科技股份有限公司);透析膜(批号20230615,3 500 kDa,美国BioSharp公司);无水二甲基亚砜(批号:H2211118,含量≥99%,北京索莱宝生物科技有限公司);碳化二亚胺盐酸盐(批号:A2314104,含量≥98%,上海阿拉丁生化科技股份有限公司);间羟基联苯(批号:J2215393,含量≥97%,北京索莱宝生物科技有限公司);Superdex凝胶系列(批号:10341428,含量≥99%,北京英莱克科技发展有限公司);DPPH(批号:D4313,含量≥99%,北京索莱宝生物科技有限公司);ABTS(批号:718T036,含量≥99%,北京索莱宝生物科技有限公司);刚果红(批号:P1645856,含量≥99%,北京索莱宝生物科技有限公司);DMF(批号:P52452225,含量≥98%,北京索莱宝生物科技有限公司);右旋糖酐标准品(5、25、50、80、150和410 kDa)(批号:SM9530,含量≥98%,北京英莱克科技发展有限公司);三氧化硫吡啶配合物(SO3.Pyr)(批号:20220305,含量≥97%,北京索莱宝生物科技有限公司);DEAE-650 M(批号:0043201,含量≥99%,日本TOSHO公司);BCA试剂盒(批号:23227,含量≥99%,赛默飞世尔科技);其他试剂均为国产分析纯。
1.2 实验仪器
分析型高效液相(LC-20A,岛津);气相色谱仪(GC-2014C,岛津);傅里叶变换红外光谱仪(NICOLET6700,美国Thermo Fisher Scientific公司);酶标仪(Spectra Max M5,美国赛默飞世尔科技公司);黏度计(NDJ-5S,上海平轩科学仪器有限公司);能量色散X射线仪(E-1045,日立,日本)。
1.3 实验方法
1.3.1 圆苞车前子的前处理
圆苞车前子原料在60 ℃下通风干燥24 h后,用万能粉碎机粉碎,40目筛网过筛。先用石油醚在60 ℃下脱脂4 h,再用85%乙醇萃取4 h,去除色素、小分子、单糖和低聚糖。最后,将过滤后的残渣收集起来,在50 ℃下干燥,得到预处理后的圆苞车前子。
1.3.2 圆苞车前子粗多糖的制备
采用课题组前期优化方法[13],取50 g预处理后的圆苞车前子,采用碱提法提取圆苞车前子多糖,提取条件:NaOH浓度为0.1 mol/L,料液比1∶40,提取温度70 ℃,每次1 h,提取两次,将两次的提取液合并,减压浓缩至1/2体积,在上清液中缓慢加入冰乙醇,当乙醇浓度达到80%时,出现大量的沉淀,离心保留沉淀组分,沉淀复溶于蒸馏水,纯水中透析36 h,冷冻干燥得到圆苞车前子粗多糖(PlantagoovataForsk polysaccharide,POFP)。
1.3.3 圆苞车前子多糖的硫酸化修饰
POFP的硫酸化修饰采用氯硫酸-吡啶法进行[14]。50 mL圆底烧瓶中加入10 mL无水吡啶,在冰水浴环境下缓慢加入5 mL氯磺酸溶液,并不断搅拌,得到淡黄色酯化试剂,现配现用。取100 mg POFP置于50 mL梨形瓶中,加入10 mL DMF,充分搅拌,得到POFP悬浊液。将酯化试剂在冰水浴条件下缓慢滴加到POFP悬浊液中(30 min中内加完),在80 ℃下反应3h。反应结束后,冷却至室温,加入1 mol/L氢氧化钠溶液中和,最后,用蒸馏水透析(Mw截止=3 500 Da)36 h,冷冻干燥得到硫酸化多糖(sulfatedPlantagoovataForsk polysaccharide,POFP-S)。
1.3.4 多糖黏度测试
利用旋转黏度分别以转速(12、30、60 r/min)对硫酸化前多糖POFP与硫酸化后的多糖POFP-S的黏度进行测定。
1.3.5 POFP-S的分离纯化
采用DEAE-650M纤维素柱(26.6 mm × 126 mm)对POFP-S进行分离。用NaCl(0、0.2、0.4、0.6、0.8和1 mol/L)梯度洗脱,流速为1 mL/min。用自动收集器收集洗脱液,用苯酚-硫酸法检测多糖,收集多糖峰,透析(3 500 Da)。分离后多糖进一步用Superdex 200凝胶柱(16 mm×700 mm)进行纯化,以超纯水为溶剂,0.4 mL/min流速洗脱,收集多糖峰,冷冻干燥得到纯化的圆苞车前子多糖,命名为POFP-S1、POFP-S2。
1.3.6 化学组成分析
1.3.6.1 硫酸基取代度的测定
取代度(degree of substitution,DS)是指多糖中每个单体单元的取代数。采用元素分析方法测定POFP-S1、POFP-S2的硫酸基取代度[15,16]。简单地说,POFP-S1、POFP-S2采用能量色散X射线仪进行元素分析。POFP-S1、POFP-S2的DS根据EDX结果计算,计算公式如下。
(1)
式中,c为硫元素含量(%)。
1.3.6.2 其他化学成分测定
以葡萄糖为标准品,采用苯酚-硫酸法测定中性糖含量[17]。以半乳糖醛酸为标准品,采用四硼酸钠-硫酸法测量糖醛酸含量[18]。以牛血清蛋白为标准品,采用BCA试剂法测定蛋白质含量[19]。
1.3.7 分子量测定
POFP-S1、POFP-S2的分子量(Mw)用分析高效液相色谱法[20]进行测定。准确配制2.0 mg/mL 多糖溶液,以水为流动相,上样量为10 μL,色谱柱型号为TSK-gel G 3 000 PWXL(300 mm× 7.8 mm,7 μm),检测器为RID-10A示差检测器,流速为0.6 mL/min。采用T-dextran(5、25、50、80、150、410 kDa和蓝色葡聚糖)为标准品,以保留时间为X轴,分子量的对数为Y轴,建立标准曲线,将多糖样品带入标准曲线中测定相对分子量。
1.3.8 单糖组成分析
单糖衍生物制备:取5 mg 多糖样品置于10 mL 顶口瓶中,加入5 mL 2 mol/L三氟乙酸(TFA),于115 ℃水解6 h。冷却至室温,加入4 mL甲醇,用旋转蒸发仪除去溶剂(重复3~5次)。随后,加入8 mg盐酸羟胺和0.5 mL的吡啶在90 ℃反应30 min。反应结束后,冷却至室温,再加入0.5 mL乙酸酐90 ℃反应40 min,冷却后,氮吹仪吹干,加入1 mL二氯甲烷,过滤膜(0.45 μm),至气相小瓶中供分析。单糖标准品无需酸解,其他步骤同样品处理。结果与单糖标准品保留时间比对得出单糖组成[21]。
分析条件:采用配备色谱柱(Vondacap df=0.25 μm,X=30 mm)和氢火焰检测器的气相色谱仪,检测器温度为250 ℃,进样量为3 μL,分流比为1∶70,载气流量:氢气,30 mL/min;氮气,30 mL/min;空气,150 mL/min。
1.3.9 紫外可见光谱测定
配制0.5 mg/mL的POFP-S1和POFP-S2的样品10 mL,利用紫外可见分光光度计在200~400 nm之间测定样品的紫外吸收。
1.3.10 红外光谱测定
称取1.0 mg完全干燥的多糖样品,与100 mg完全干燥的KBr粉末在玛瑙研钵中研磨均匀,后压片,用傅里叶变换红外光谱仪进行红外扫描,扫描范围4 000~400 cm-1。
1.3.11 刚果红螺旋结构测定
POFP-S1、POFP-S2的三螺旋构象采用刚果红法进行检测[22],在试管中共加入2 mL水和2 mL 91 μmol/L刚果红溶液,并加入2 mL不同浓度的氢氧化钠溶液(0.1、0.2、0.3、0.4、0.5、0.6、0.7和0.8 mol/L)。同时,按照上述步骤,以2 mL水代替氢氧化钠作为空白对照。在400~700 nm处测定最大吸收波长。以最大吸收波长为纵坐标,以氢氧化钠浓度为横坐标,绘制刚果红实验曲线。
1.3.12 X射线衍射分析(XRD)
采用X射线衍射技术研究了POFP-S1、POFP-S2的分子结晶特性。方法:取适量多糖样品,在室温下用X射线衍射仪扫描一定范围内的衍射峰,扫描条件为:步长:0.01;速度:0.1 s/步。
1.3.13 抗氧化活性研究
1.3.13.1 DPPH自由基清除实验
采用Hu等[23]的实验方法稍作更改,取POFP-S1、POFP-S2(10 mg/mL)分别稀释至10、5、2.5、1.25、0.625和0.312 5 mg/mL,分别等体积加入0.2 mmol/L DPPH乙醇溶液,混匀,室温下避光反应30 min。反应结束后取200 μL于96孔板中利用酶标仪在517 nm处测定其吸光度。以普鲁兰多糖为阳性对照(10、5、2.5、1.25、0.625和0.312 5 mg/mL),以水为空白对照。按照公式(2)计算DPPH自由基清除率。
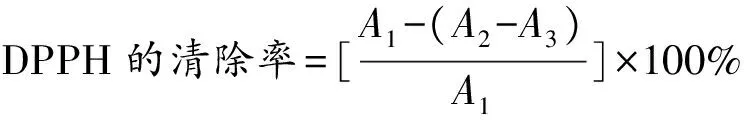
(2)
式中,A1为DPPH与乙醇溶液的吸光度,A2为DPPH与多糖溶液的吸光度,A3为多糖与乙醇溶液的吸光度。
1.3.13.2 ABTS自由基清除实验
取300 μL POFP-S1、POFP-S2(10 mg/mL)分别稀释至10、5、2.5、1.25、0.625和0.312 5 mg/mL,分别加入3倍体积的0.2 mmol/L ABTS溶液,混匀,室温下避光反应10 min。反应结束后取200 μL于96孔板中利用酶标仪在730 nm处测定其吸光度。以普鲁兰多糖为阳性对照(10、5、2.5、1.25、0.625和0.312 5 mg/mL),以水为空白对照。按照公式(3)计算ABTS自由基清除率。
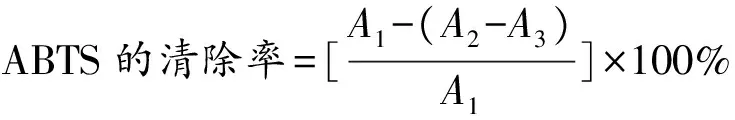
(3)
式中,A1为水与ABTS溶液的吸光度,A2为样品与ABTS溶液的吸光度,A3为水与多糖溶液的吸光度。
1.3.13.3 OH自由基清除实验
取300 μL POFP-S1、POFP-S2(10 mg/mL)分别稀释至10、5、2.5、1.25、0.625和0.312 5 mg/mL,分别加入240 μL的6 mmol/L水杨酸-乙醇溶液和等体积的6 mmol/L的FeSO4240 μL,混匀后加入0.1% H2O2(400 μL),37 ℃水浴孵化30 min。反应结束后取 200 μL反应液于96孔板中,利用酶标仪在510 nm处测定其吸光度。以普鲁兰多糖为阳性对照(10、5、2.5、1.25、0.625和0.312 5 mg/mL),以水为空白对照。按照公式(4)计算OH自由基清除率。
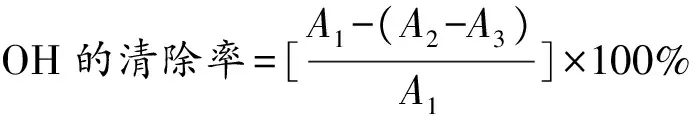
(4)
式中,A1为水与H2O2溶液的吸光度,A2为样品与H2O2溶液的吸光度,A3为水与多糖溶液的吸光度。
1.4 数据处理
2 结果与分析
2.1 硫酸化多糖黏度测试
多糖黏度变化如图1所示。由图1我们可以发现POFP具有极大的黏度,随转速的提高多糖的黏度有所减少,POFP-S黏度有较大的改变,当转速为12 r/min时,POFP-S的黏度相较于POFP降低约80%;当转速提高到30 r/min时,多糖的黏度由355 Pa·s降至50 Pa·s,降低约85%,在转速达到60 r/min时多糖黏度达到最低值20 Pa·s,较POFP降低约90%,实验结果表明通过硫酸化修饰可以有效的降低圆苞车前子多糖的黏度。
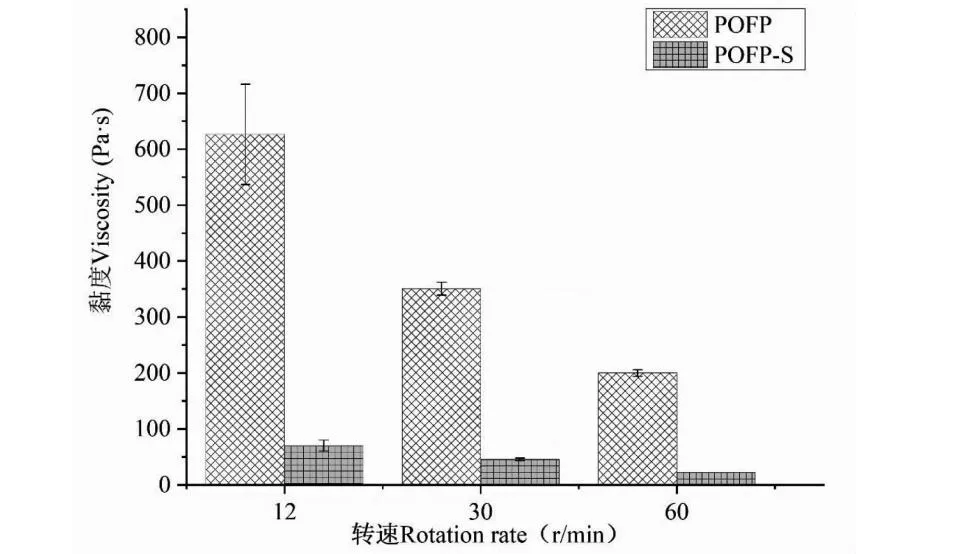
图1 多糖黏度测定结果
2.2 POFP-S 的分离纯化
根据DEAE-650M色谱柱的洗脱曲线(见图2),得到了两个主要峰,其中第一个峰为水洗脱中性圆苞车前子多糖(POFP-S1),最后一个峰为0.8 mol/L氯化钠洗脱的酸性多糖(POFP-S2)。收集了这两个主要峰,利用Superdex 200柱进一步纯化。如图3、图4所示,得到了两个均一的圆苞车前子硫酸化多糖POFP-S1和POFP-S2。
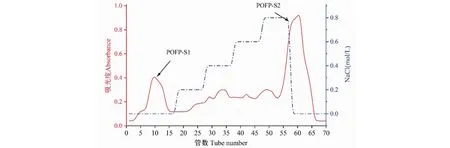
图2 POFP-S的DEAE-650M洗脱曲线
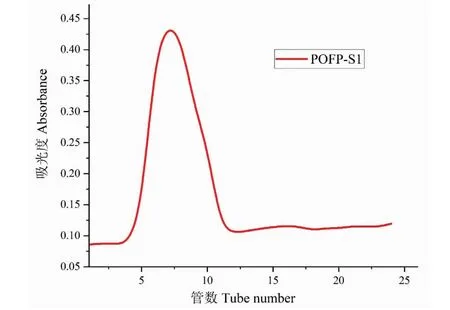
图3 POFP-S1的凝胶纯化曲线
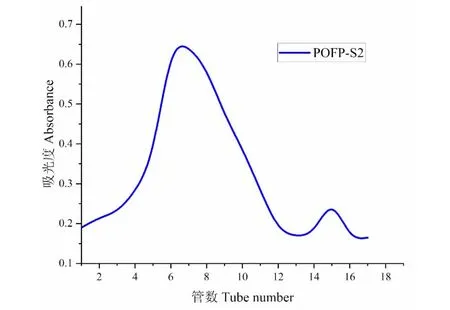
图4 POFP-S2的凝胶纯化曲线
2.3 化学成分测定
POFP-S1、POFP-S2的化学成分及分子量如表1所示,POFP-S1中性糖含量为56.46%,硫酸基含量为17.55%;POFP-S2中性糖含量为66.41%,硫酸基的含量为38.09%,两种多糖在蛋白含量测定实验中均未检测到蛋白;POFP-S1多糖的分子量较大,为3 556.0 kDa,POFP-S2多糖的分子量为833.7 KDa。如图5所示,两种多糖的纯度较高分别为94.20%、98.89%。
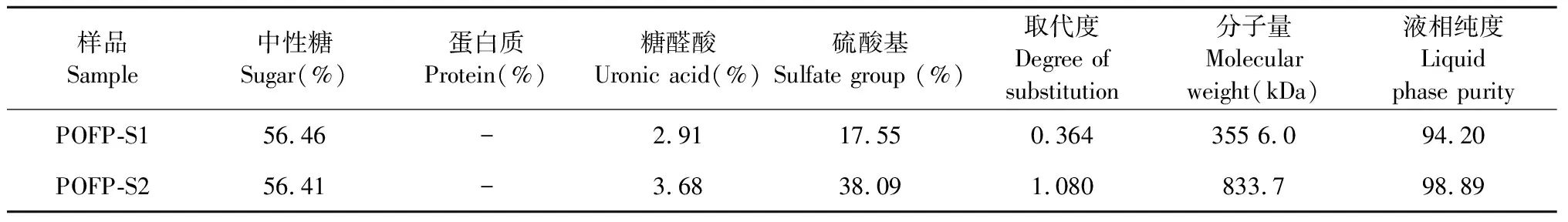
表1 POFP-S1、POFP-S2中性糖、蛋白质、糖醛酸、硫酸基含量、取代度及其分子量
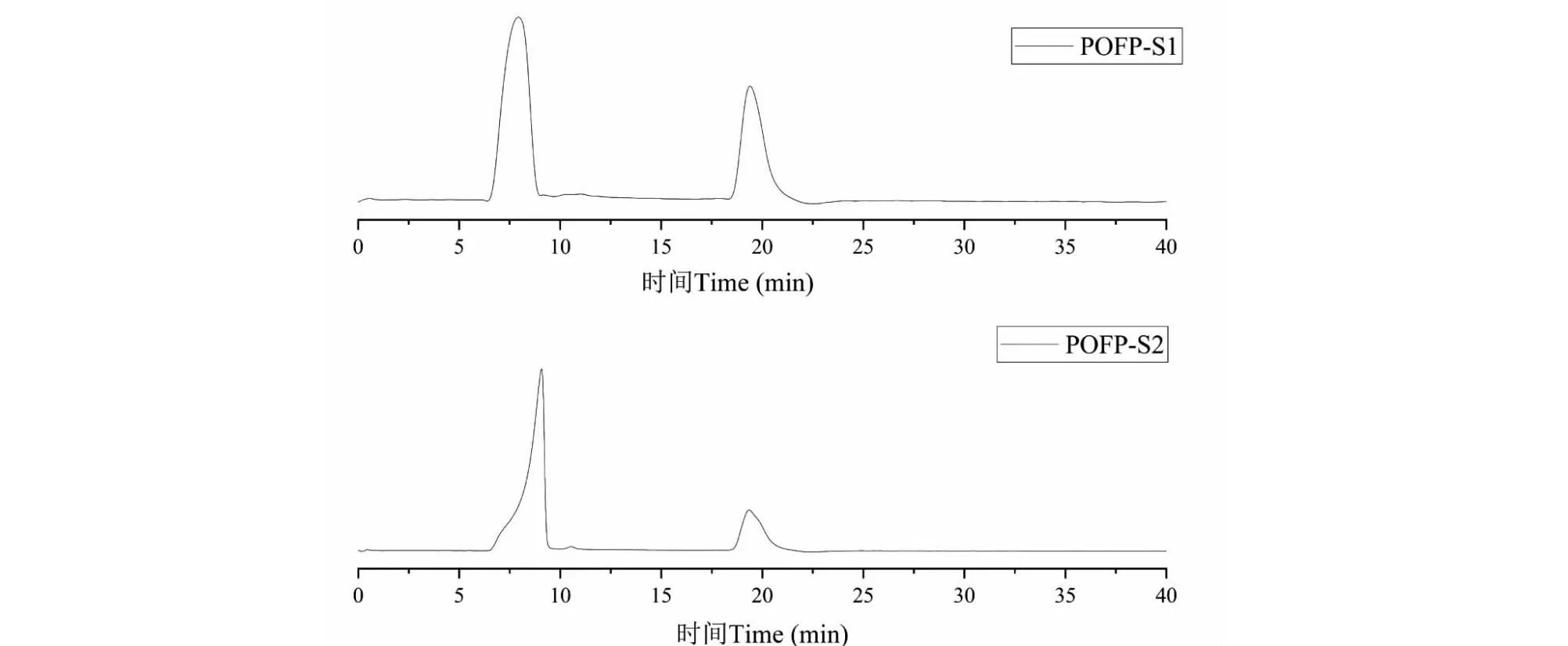
图5 POFP-S1、POFP-S2高效液相色谱图
2.4 单糖组成分析
如表2和图6所示,POFP-S1主要由鼠李糖(rhamnose,Rha)、阿拉伯糖(arabinose,Ara)、木糖(xylose,Xyl)、葡萄糖(glucose,Glu)组成(7.58∶21.67∶67.66∶3.09),POFP-S2主要由Ara和Xyl组成(35.27∶64.73),其中POFP-S1和POFP-S2中Xyl、Ara为主要单糖成分。
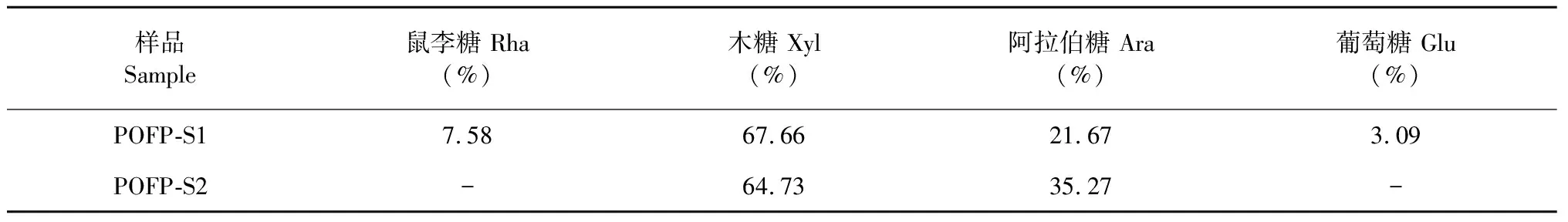
表2 POFP-S1、POFP-S2的单糖组成
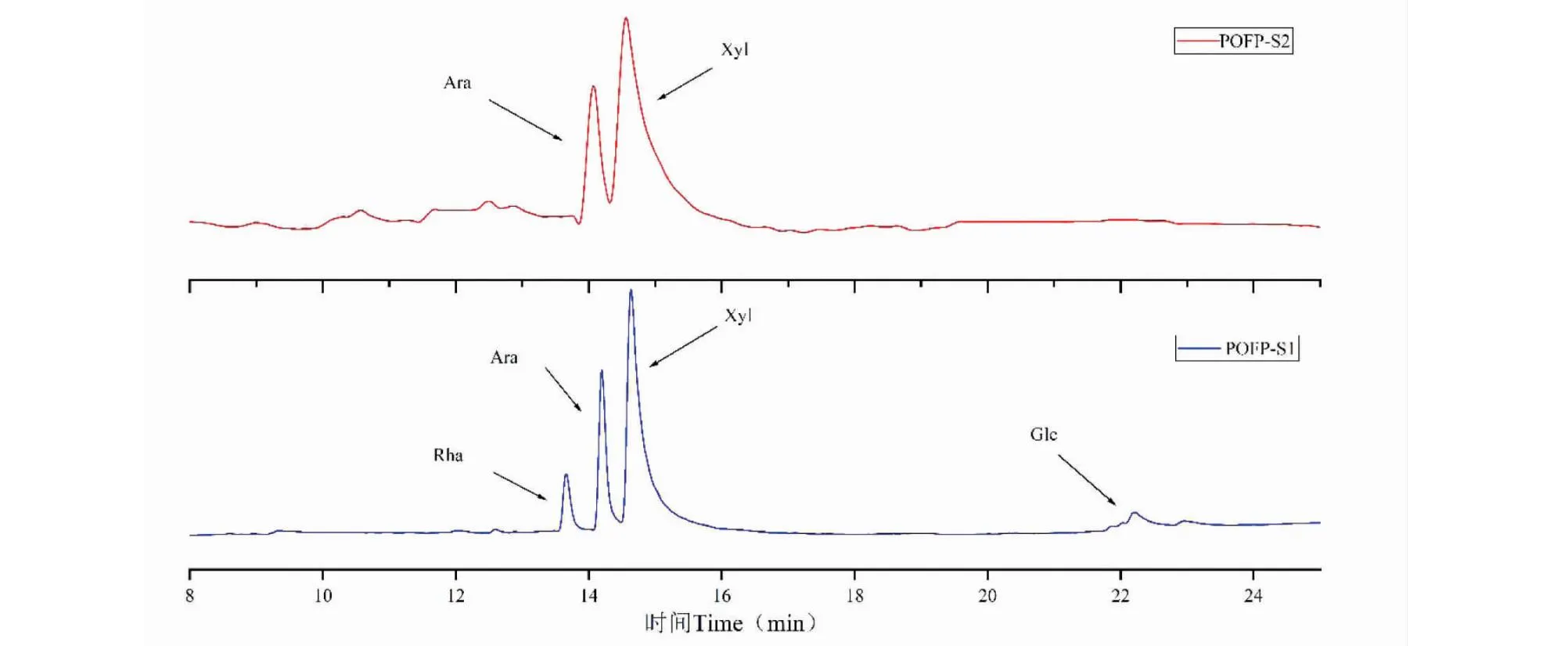
图6 POFP-S1、POFP-S2的单糖组成分析
图7 标准品的单糖分析气相图
2.5 紫外可见光谱解析
POFP-S1、POFP-S2的紫外可见光谱如图8所示,谱图显示,POFP-S1、POFP-S2的吸收平滑,只在260 nm处有较高的吸收峰,这是由于硫酸基的n-π跃迁导致[20]的,进一步说明了POFP硫酸化成功;并且在280 nm处没有吸收,再次说明硫酸化后的多糖没有蛋白成分。
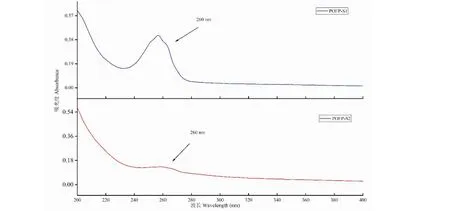
图8 POFP-S1、POFP-S2紫外吸收光谱图
2.6 红外光谱分析
圆苞车前子硫酸化多糖POFP-S1、POFP-S2的红外光谱如图9所示。3 439 cm-1和2 927 cm-1处的强且宽的吸收峰归属为多糖上O-H,是多糖常见的特征吸收峰[24]。1 734 cm-1处有强吸收峰,是C=O 伸缩震动的特征吸收峰[25],表明样品中含有糖醛酸结构。810 cm-1处和在1 249 cm-1处的吸收峰分别是C-O-S、S=O基团的伸缩震动峰,这两处的伸缩震动也是硫酸化多糖的特征吸收峰[7],并且可以观察到POFP-S2与POFP-S1在这两个位置的吸收峰面积有较大差别,可能与硫酸化程度有关,并且与硫酸基取代度的结果一致。
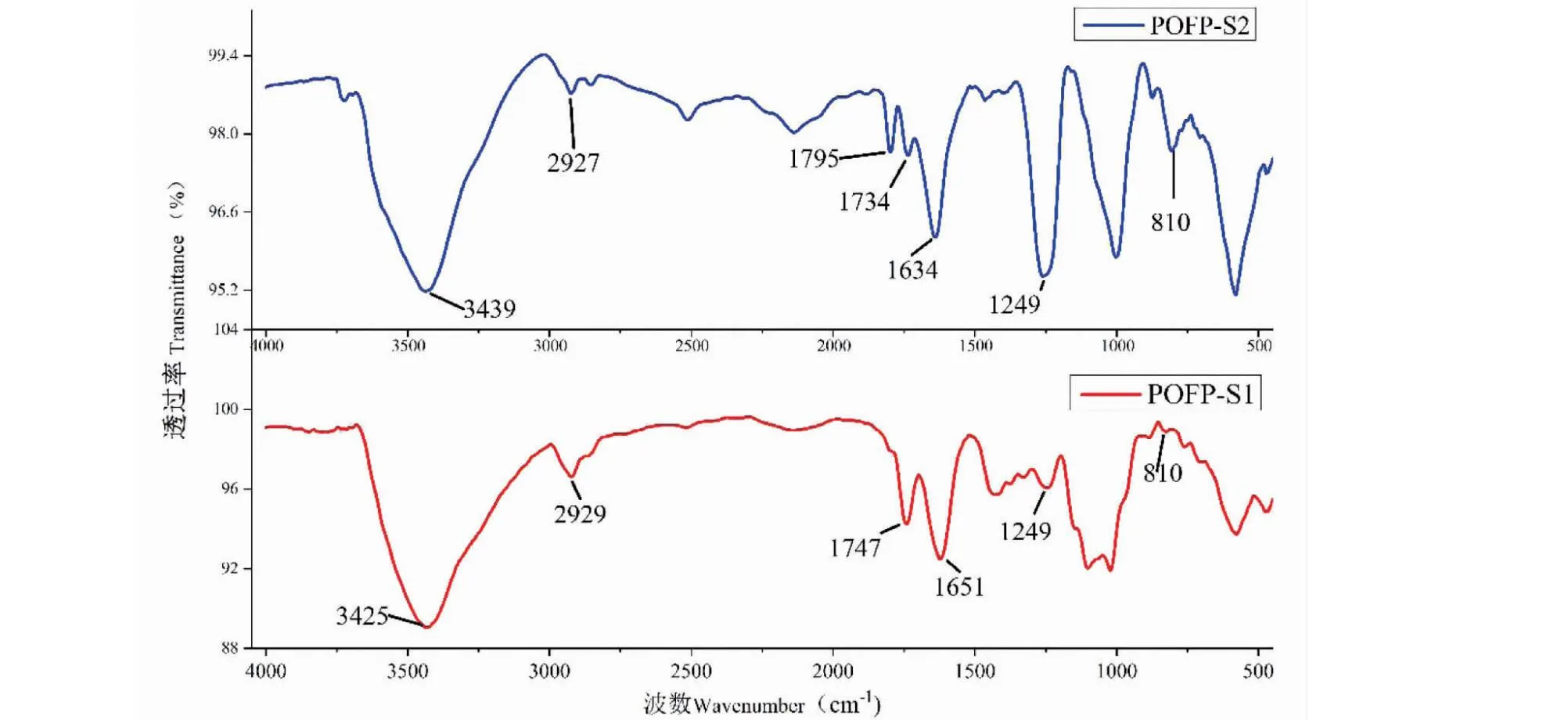
图9 POFP-S1、POFP-S2红外光谱图
2.7 三螺旋结构测定
多糖的活性与它的三螺旋结构具有密不可分的关系[13]。刚果红实验结果如图10所示,我们发现POFP-S2的最大吸收波长随着NaOH浓度的增大而红移,表明多糖与刚果红试剂形成了络合物,而在NaOH浓度达到0.4 mol/L时出现了明显的蓝移,可能是由于NaOH浓度过高破坏了多糖螺旋结构形成了单链结构[26]。然而,POFP-S1和空白对照水一直呈现蓝移,表明POFP-S1不具备三螺旋结构。
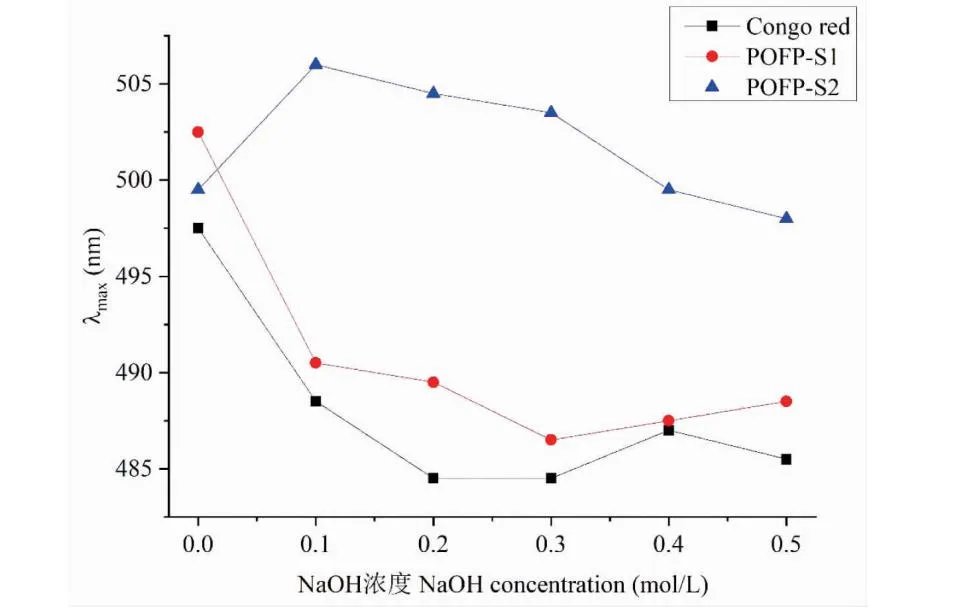
图10 多糖三螺旋结构测定曲线
2.8 X射线衍射分析(XRD)
多糖的X射线衍射如图11所示,可以看出当2θ约为18°、30°、41°时均出现了尖锐且强烈的峰,这是由于多糖的晶体结构所导致的,并且在图中也可以发现存在较为平缓的部分,这也证明多糖具有非晶体结构。因此可以推断出 POFP-S1、POFP-S2多糖是晶体与非晶体结合所形成的具有特殊结构的多糖分子。相较于未硫酸化POFP多糖[13],硫酸化的多糖也显示出了其特殊的晶体结构。
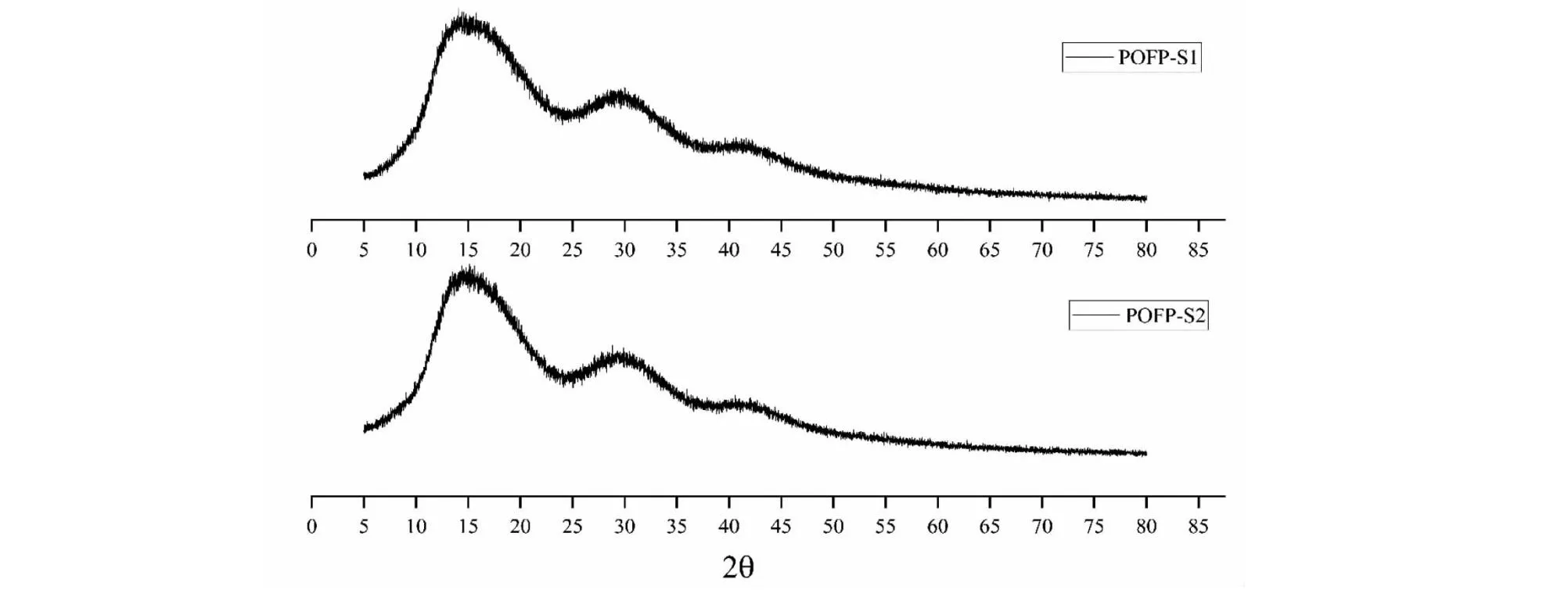
图11 POFP-S1、POFP-S2 XRD曲线
2.9 抗氧化活性分析
2.9.1 DPPH自由基的清除
对DPPH自由基的清除是鉴别物质体外抗氧化能力的一种常用方法[27]。如图12所示,POFP-S1与POFP-S2对DPPH自由基的清除能力与浓度并不存在特殊的线性关系,清除能力随浓度的增加呈先增加后减少再增加的趋势,POFP-S1、POFP-S2在浓度为5 mg/mL时对自由基的清除均达到最大值。并且通过对比阳性对照,发现多糖POFP的清除能力高于Pullulan多糖。
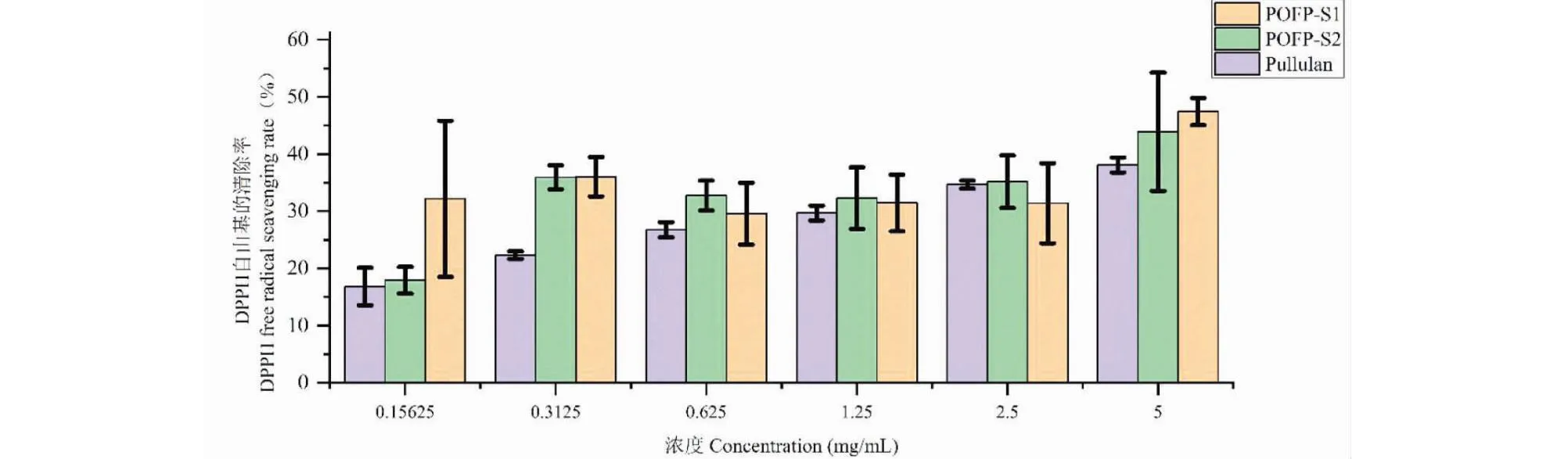
图12 多糖对DPPH自由基的清除能力
2.9.2 ABTS自由基的清除
硫酸化多糖对ABTS自由基的清除结果如图13所示,多糖的清除能力与其浓度呈正相关,随着浓度的增加多糖的自由基清除能力增强,对比阳性对照,POFP对ABTS的清除能力强于普鲁兰多糖,并且可以观察到多糖POFP-S1在ABTS自由基的清除上具有显著优势,当浓度达到5 mg/mL时,POFP-S1的清除能力达到最大值41.8%。
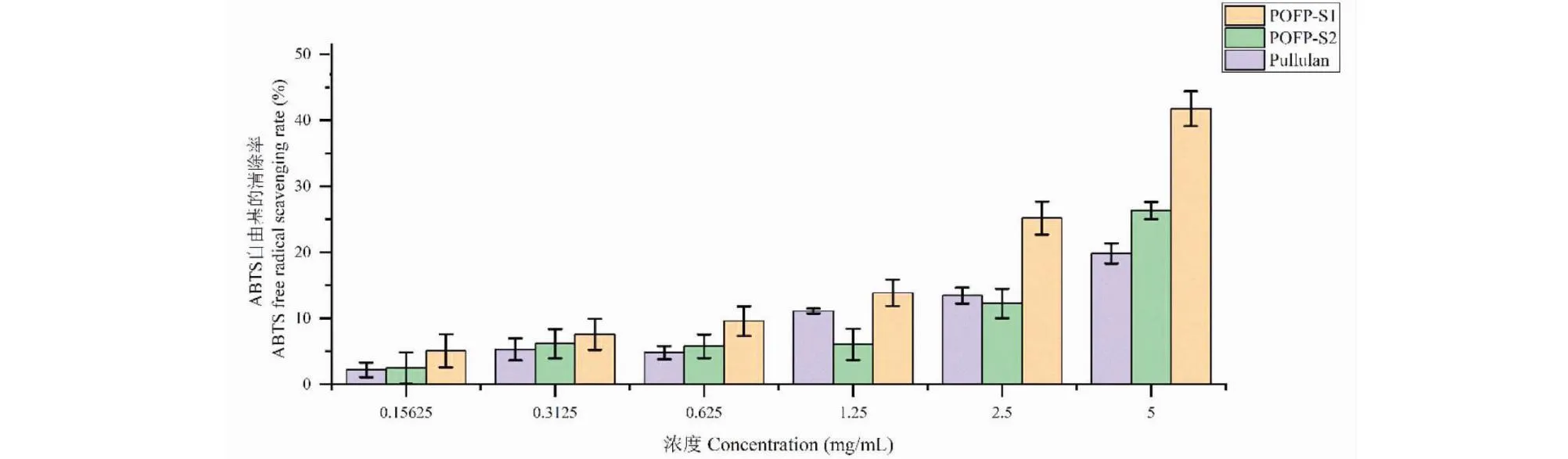
图13 多糖对ABTS自由基的清除能力
2.9.3 OH-自由基的清除
多糖对OH-自由基的清除结果如图14所示,当POFP-S2的浓度达到1.25 mg/mL时达到清除率的最大值。相较于对ABTS自由基的清除,两种多糖的清除能力发生改变,但相较于普鲁兰多糖有了较大提升,并且在低浓度时普鲁兰多糖并没有明显的清除能力。结果也表明POFP-S2对OH-自由基的清除能力强于POFP-S1的清除能力,这可能是由于POFP-S2具备更高的糖醛酸含量及硫酸基含量导致的。
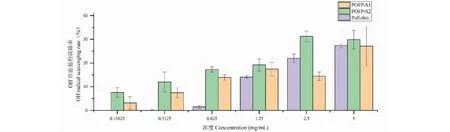
图14 多糖对OH-自由基的清除能力
3 结论
鉴于圆苞车前子多糖高黏特性无法进行纯化及活性检测,本文以硫酸化法对圆苞车前子多糖(POFP)进行硫酸化修饰,修饰后的多糖黏性大幅降低。通过对POFP-S分离纯化,制备了两种均一多糖,其中POFP-S1的多糖、糖醛酸、硫酸基的取代度及其纯度分别为38.96%、2.91%、0.364、94.20%;POFP-S2的多糖、糖醛酸以及硫酸基的取代度分别为52.55%、3.68%、1.080、98.89%,两种多糖均未检测到蛋白质;其中,POFP-S1具有较大的分子量和较丰富的单糖组分。紫外(UV)、红外光谱(FT-IR)发现POFP-S1和POFP-S2均具有典型的硫酸化多糖特征吸收峰,表明硫酸化修饰的成功;X射线衍射(XRD)及刚果红实验发现POFP-S2均具晶体与非晶体共存的,具特殊螺旋结构的多糖。在抗氧化方面,POFP-S1多糖对DPPH,ABTS自由基的清除能力相较于POFP-S2更强,这可能与其具有较大的分子量和其单糖组成(葡萄糖)有关,而对羟基自由基的清除中POFP-S2的清除能力较强,这可能是由于POFP-S2多糖中硫酸基的取代度较大有关。本研究为进一步研究圆苞车前子多糖的结构与活性提供文献依据,以及开发具有潜力的药食同源产品提供理论依据,为多糖的硫酸化研究提供思路。

