咪唑类离子液体长期暴露对鲤肠道形态、氧化应激、免疫和肠道菌群的影响
张艳敏 马丽美 蔡慧敏 梁晓敏 游 富 江爱霞 杨国坤 张新党 申亚伟 常绪路 孟晓林
(1.河南师范大学水产学院, 新乡 453007; 2.河南省水产动物养殖工程技术研究中心, 新乡 453007)
咪唑类离子液体(Alkyl ionic liquids, AILs)种类繁多, 被认为是一种环境友好型溶剂, 广泛应用于环境修复[1]、生物医药[2]等领域。最新研究表明,AILs对藻类[3]、大型溞[4]等水生生物存在一定的生态毒性, 且AILs对水生生物的毒性存在一定的“烷基链效应”, 即毒性随烷基链长度的增加而逐渐增加[5]。Shao等[6]发现用不同碳链长度的咪唑硝酸盐离子液体[Cnmim]NO3胁迫蚯蚓(Eisenia fetida)时,当烷基链长度从2增至8, 其对蚯蚓的急性毒性逐渐增加。然而, 目前, 此类研究大多集中于低等水生生物(如藻类、大型溞、卤虫等), 且多为急性暴露实验[7—9]。不同烷基链AILs对水生生态系统数量最为庞大的脊椎动物——鱼类长期暴露的生态毒性(如是否存在烷基链效应)尚不明确[10—12]。
鱼类肠道因具有广阔的表面积和生理特性, 被认为是消化、营养获取和毒素暴露的首要机械和免疫屏障[13,14]。同时, 肠道微环境中栖息着功能多样的微生物群落, 能够分泌维生素、酶、免疫调节因子及形成非特异性的保护膜[15,17]。稳定的肠道菌群可通过调节机体多种生理功能, 如病原体抗性、营养物质消化、能量代谢和免疫调节, 促进和维持宿主健康[18—20]。然而, 不同烷基链AILs对鱼类肠道的生态毒性尚有待探究。
鲤(Cyprinus carpio.L)为水生生态系统常见鱼类, 常作为毒理学实验的模式动物[21]。因此本研究选择黄河鲤为受试对象, 探究3种不同烷基链AILs([C6mim]Cl、[C8mim]Cl和[C12mim]Cl)长期暴露对鲤肠道物理屏障、氧化应激、免疫和肠道菌群的影响, 以期揭示不同烷基链AILs长期暴露对鱼类肠道的毒性作用, 从而为AILs对鱼类的生态毒性机制研究提供一定的理论依据。
1 材料与方法
1.1 实验材料
黄河鲤幼鱼(3.0±0.5) g购自河南省延津县渔场,鱼体质健康、遗传背景一致。以商业饲料(通威,中国)于河南师范大学水产学院养殖系统暂养2周。
1.2 慢性暴露实验
据文献确定3种AILs([C6mim]Cl、[C8mim]Cl和[C12mim]Cl)对鲤的72h-LC50值[22]。选用3种AILs对鲤72h-LC50值的1/100为长期暴露浓度(分别为4.97、2.15和0.09 mg/L)。将驯化后的360尾鱼平均分为4组, 每组3个重复: 对照组(NC)和[C6mim]Cl、[C8mim]Cl和[C12mim]Cl处理组。采用鲤商品饲料(通威, 中国)饱食投喂实验鱼, 每日3 次(08:00、12:00和18:00), 实验持续30d, 每两日更换50%暴露液, 水质维持在溶解氧5—6 mg/L、氨氮<0.01 mg/L、pH 7.1—7.4、水温(26±1)℃。在实验终止后, 用MS-222麻醉实验鱼, 无菌环境下解剖,进行样品取材。
1.3 中肠组织形态学观察
每桶随机取6尾鱼, 分离中肠组织。磷酸盐缓冲液(0.1 mol/L PBS)冲洗后用4%多聚甲醛溶液固定, 梯度乙醇脱水, 用石蜡包埋切片机将蜡块切成4 μm厚, 苏木精和伊红(HE)染色后, 在光学显微镜下观察、统计各组肠道绒毛高度和肌层厚度[21]。
1.4 肠道酶活性测定
每组随机取12尾鱼, 分离中肠组织样品, 液氮速冻, -80℃保存。肠道组织的超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSHPx)、总抗氧化能力(T-AOC)、乳酸脱氢酶(LDH)的测定采用南京建成生物工程研究所试剂盒进行测定。
1.5 肠道免疫基因相对表达量测定
每组随机取12尾鱼, 分离中肠组织于1.5 mL无菌无酶离心管中, 液氮速冻后-80℃保存。样品提取RNA后使用TaKaRa PrimeScript RT reagent Kit(TaKaRa, 大连)剂盒反转录成cDNA, 18S rRNA基因作为内参。荧光定量PCR反应体系: 5 μL SYBR®Premix ExTaqTM(TaKaRa, 大连), 0.3 μL正向引物(10 μmol/L), 0.3 μL反向引物(10 μmol/L), 1.0 μL cDNA模板, 3.4 μL无菌水。扩增程序为: 95℃, 30s;95℃, 5s; 60℃, 0, 共40个循环, 每样品设3个平行(RocheLightCycler®480, 瑞士)。荧光定量PCR引物由上海生物工程股份有限公司合成, 引物序列见表1,基因的相对表达量采用2-ΔΔCt法计算。
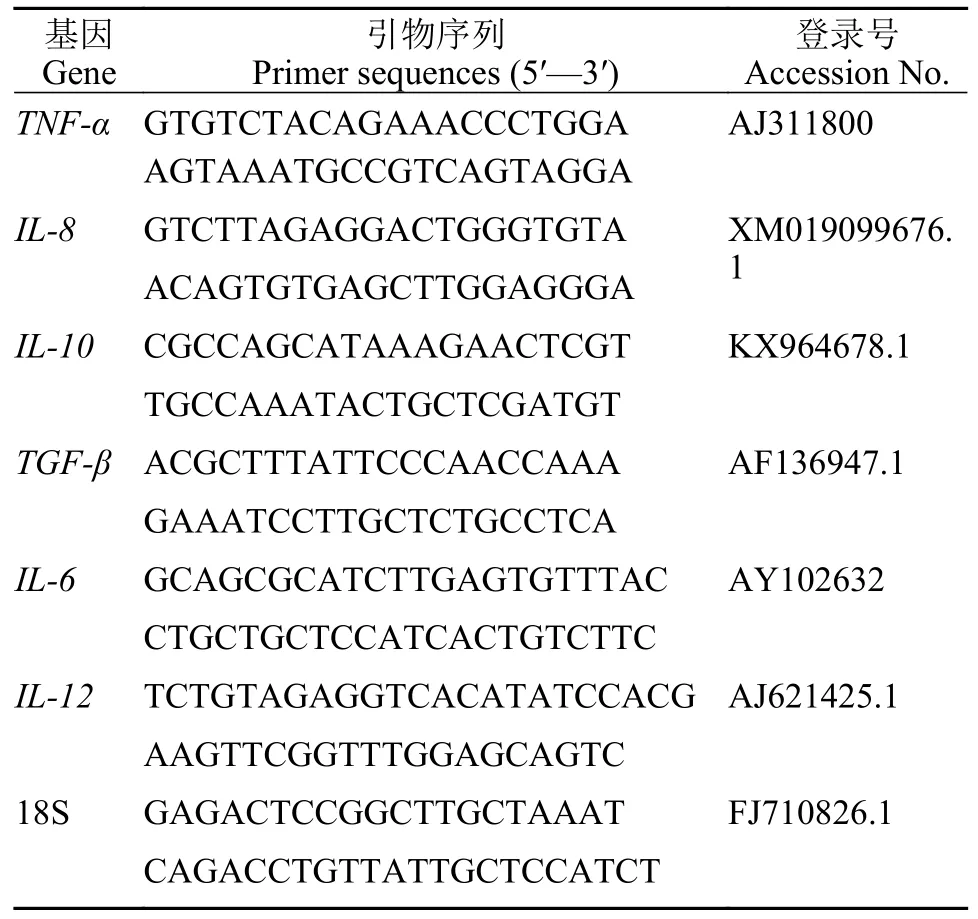
表1 实时荧光定量 PCR 引物序列Tab.1 Primer sequences of Real-time fluorescence quantification qPCR
1.6 肠道菌群测序分析
每组随机选择12尾鱼, 无菌环境下取肠道内容物, 将4尾鱼肠道内容物混合置于1个2 mL无菌离心管中, 液氮速冻, 放置-80℃保存。肠道菌群DNA样品采用QIAamp Fast DNA Stool Mini Kit (QIAamp,德国)试剂盒依据说明书进行提取。通过1%琼脂糖凝胶电泳和Nanodrop 2000全自动超微量分光光度计(Thermo, 美国), 确定DNA样品的质量和浓度, 将检测合格的样品送往广州基迪奥生物科技有限公司(广州, 中国)进行16S rRNA基因高通量测序。
1.7 数据统计及分析
相关数据采用IBM SPSS Statistics 22软件, 以One-way ANOVE及Duncan法进行多重比较分析及显著性检验, 若P>0.05, 表示各组间差异无显著性;若P<0.05, 表示各组间差异具有显著性。
2 结果与分析
2.1 AILs暴露对黄河鲤肠道组织形态的影响
3种不同烷基链咪唑类离子液体暴露处理30d后, 鲤肠道HE染色结果如图1所示。对照组的肠绒毛结构相对正常, 无明显损伤, 肠道组织结构完整,上皮细胞排列紧密, 呈规则栅栏状排列, 固有层紧密。离子液体暴露组出现肠细胞脱落和空泡化现象, 肠道结构不完整(图1A)。随着咪唑类离子液体烷基链长度的增加, 肠道绒毛高度显著降低, 肌层厚度显著变薄(图1B和1C;P<0.05), 肠道组织结构损伤严重。
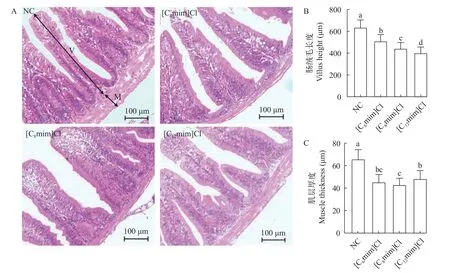
图1 不同AILs暴露对鲤肠道组织形态的影响Fig.1 Effects of different AILs on intestine histology of C.carpio L.
2.2 AILs暴露对黄河鲤肠道氧化应激的影响
与NC组相比, [C12mim]Cl处理组鲤肠道组织GSH-Px、T-AOC和LDH活性或水平显著性升高(P<0.05; 图2B—2D); [C8mim]Cl处理组肠道组织TAOC水平显著性升高(P<0.05; 图2C); [C6mim]Cl处理组鲤肠道组织GSH-Px、CAT和LDH活性降低, 肠道组织T-AOC水平升高, 但均无显著性影响(P>0.05)。
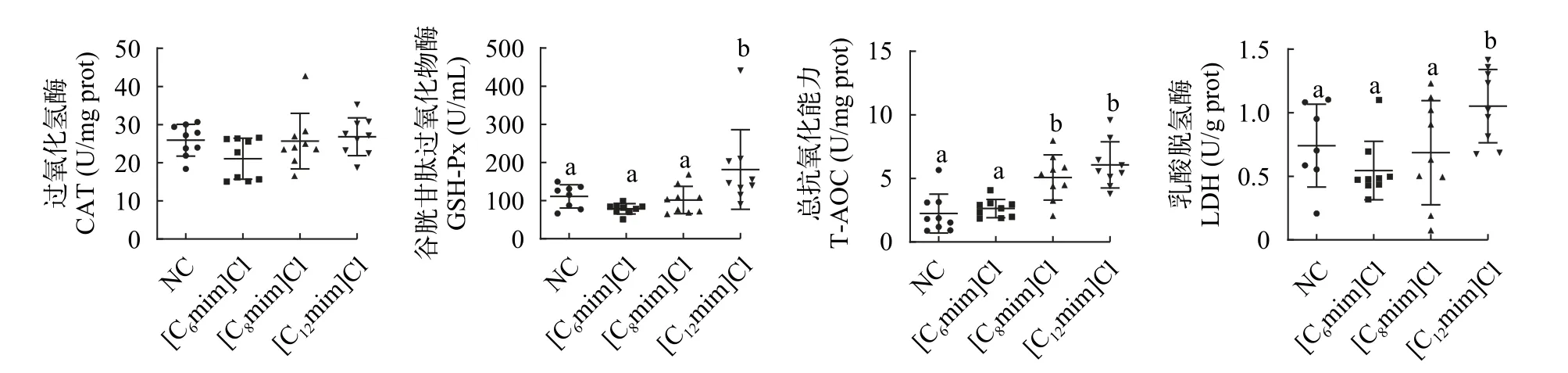
图2 不同AILs对鲤肠道酶活性的影响Fig.2 Effect of different AILs on intestinal enzyme activity of C.carpio L.
2.3 AILs暴露对鲤肠道免疫相关基因表达的影响
如图3所示, 与NC组相比, 促炎基因IL-6在[C12mim]Cl组的mRNA表达水平显著升高(P<0.05),在[C6mim]Cl和[C8mim]Cl组的mRNA表达水平无显著升高(图3A); 促炎基因IL-8在[C6mim]Cl、[C8mim]Cl和[C12mim]Cl组中mRNA表达量均显著上升(P<0.05; 图3B), 抑炎基因TGF-βmRNA表达量显著降低(P<0.05; 图3E)。
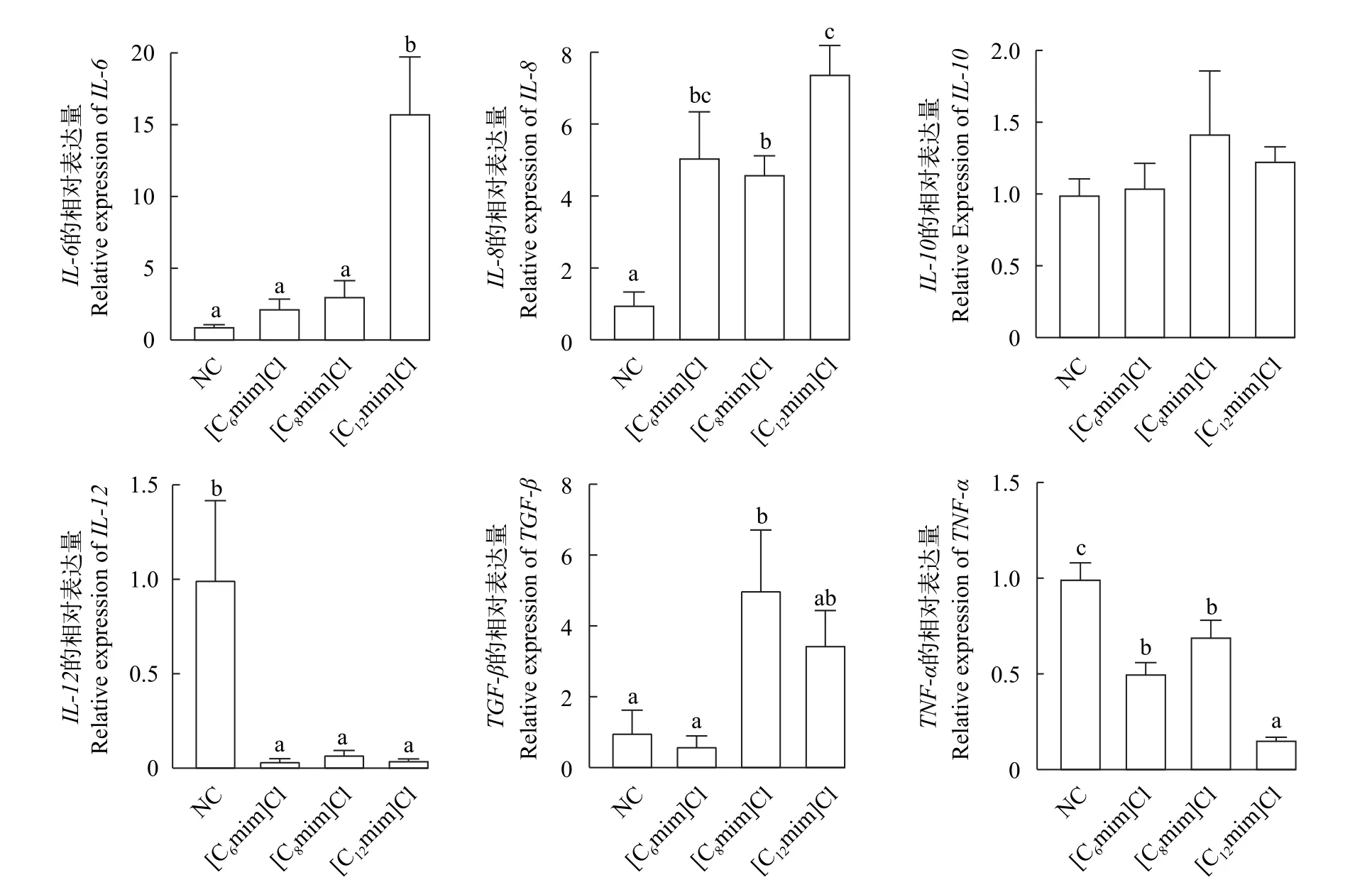
图3 不同AILs对鲤肠道免疫相关基因mRNA相对表达水平的影响Fig.3 Effects of different AILs on mRNA relative expression level of immune related genes in the intestinal of C.carpio L.
2.4 AILs暴露对鲤肠道菌群的影响
由表2可知, 各组样品Coverage覆盖率均大于99.00%, 表明该测序结果能有效反映样本的微生物群落多样性。与NC组相比, [C6mim]Cl和[C12mim]Cl处理组Simpson指数显著降低(P<0.05), Chao1和Ace指数极显著增加(P<0.05)。[C6mim]Cl处理组Chao1和Ace等α多样性指数最高。这表明在不同AILs暴露后, 鲤肠道微生物群落α多样性呈增加趋势。
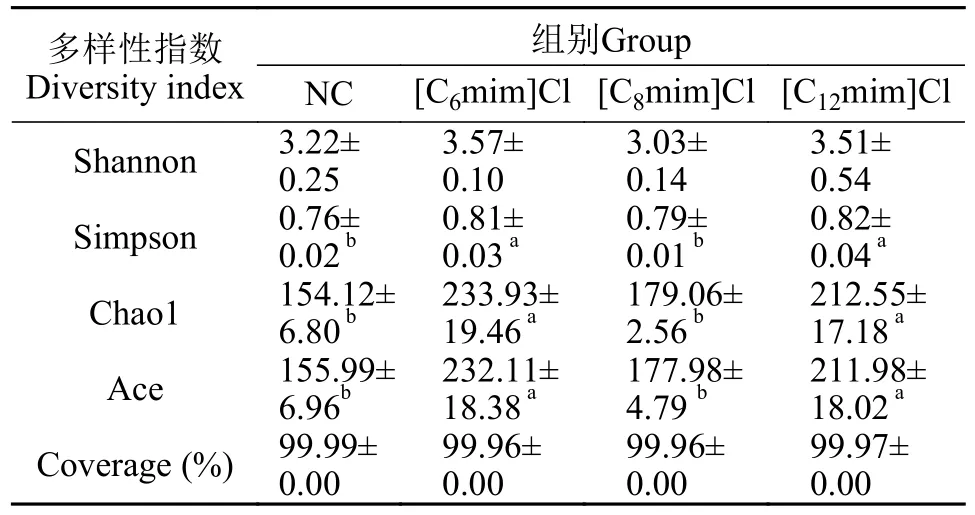
表2 不同AILs暴露30d对黄河鲤肠道菌群多样性及丰富度的影响Tab.2 Effects of 30d exposure to different AILs on intestinal microflora diversity and richness of C.carpio L.
采用主坐标分析方法(Principal coordinate Analysis, PCoA)及非加权组平均法(Unweighted pairgroup method with arithmetic means, UPGMA)评估不同群落样本之间的相似性。从PCoA图中可以看出NC组与离子液体暴露组鲤肠道微生物组成距离相远, [C8mim]Cl和[C12mim]Cl组间聚类明显(图4A)。UPGMA分析结果也显示离子液体暴露组与NC组距离相差较远(图4B)。这说明3种咪唑类离子液体暴露改变了鲤肠道微生物的组成。
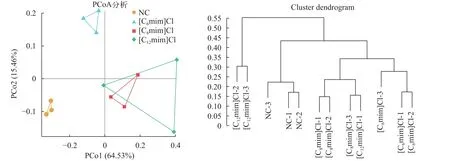
图4 不同组间鲤肠道菌群PCoA分析和UPGMA分析Fig.4 PCoA analysis and UPGMA analysis of each group of C.carpio L.
在门水平上, 各组肠道菌群中变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、梭杆菌门(Fusobacteria)为优势微生物类群(图5A)。其中, 变形菌门(Proteobacteria)的相对丰度最高(其在NC、[C6mim]Cl、[C8mim]Cl和[C12mim]Cl组的相对丰度分别为72.21%、71.65%、82.93%和77.18%), 其次为拟杆菌门(Bacteroidetes)(其在NC、[C6mim]Cl、[C8mim]Cl和[C12mim]Cl组的相对丰度分别为4.23%、17.71%、12.20%和13.99%)和梭杆菌门(Fusobacteria; 其在NC、[C6mim]Cl、[C8mim]Cl和[C12mim]Cl组的相对丰度分别为18.03%、2.44%、2.59%和2.12%)。比较而言, AILs暴露组Proteobacteria相对丰度升高, Fusobacteria相对丰度显著降低(P<0.05;图5B和5C)。Bacteroidetes的相对丰度在[C6mim]Cl处理组中显著增加(P<0.05; 图5D),Firmicutes的相对丰度在[C8mim]Cl和[C12mim]Cl处理组中显著下降(P<0.05; 图5E),Firmicutes和Bacteroidetes相对丰度的比值在AILs暴露组中显著降低(P<0.05; 图5F)。此外, 各AILs暴露组螺旋体门(Spirochaetes)和异常球菌-栖热菌门(Deinococcus-Thermus)的相对丰度降低, [C6mim]Cl处理组放线菌门(Actinobacteria)相对丰度下降, 疣微菌门(Verrucomicrobia)相对丰度增加。
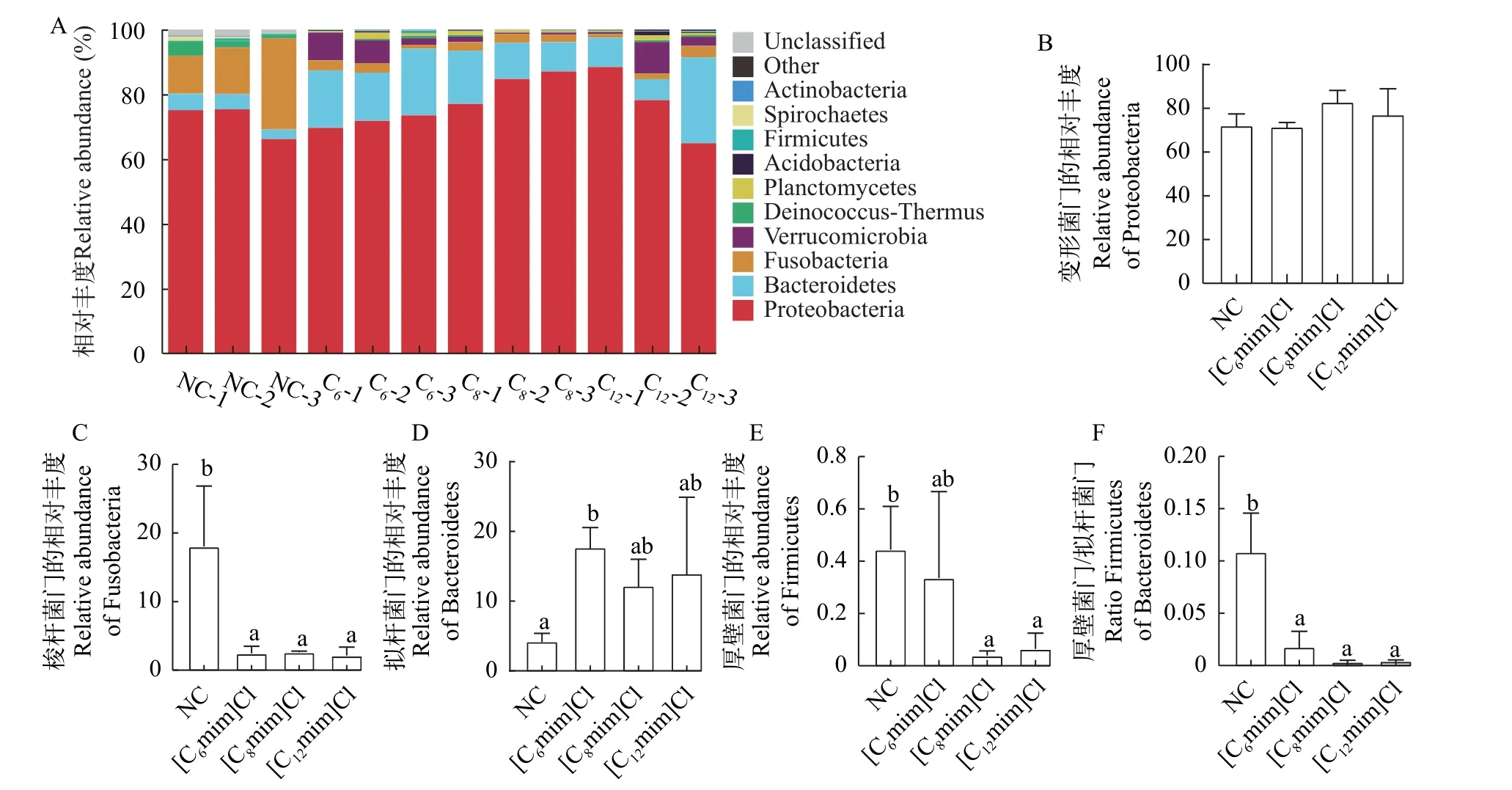
图5 不同AILs暴露30d对黄河鲤肠道菌群门水平(Phylum)相对丰度的影响Fig.5 Effects of 30d exposure to different AILs on relative abundance of intestinal microflora (Phylum) of C.carpio L.
由图6可知, 在属水平上, 各组肠道菌群中气单胞菌属(Aeromonas)相对丰度最高(其在NC、[C6mim]Cl、[C8mim]Cl和[C12mim]Cl组的相对丰度分别为48.00%、44.19%、36.77%和25.17%)、其次是纤维弧菌属(Cellvibrio; 在NC、[C6mim]Cl、[C8mim]Cl和[C12mim]Cl组的相对丰度分别为5.98%、4.04%、27.31%和27.16%)、黄杆菌属(Flavobacterium; 在NC、[C6mim]Cl、[C8mim]Cl、[C12mim]Cl组的相对丰度分别为3.80%、17.39%、12.07%和13.71%)、假单胞菌属(Pseudomonas; 在NC、[C6mim]Cl、[C8mim]Cl、[C12mim]Cl组的相对丰度分别为3.24%、9.08%、11.34%和12.83%)和鲸杆菌属(Cetobacterium; 在NC、[C6mim]Cl、[C8mim]Cl和[C12mim]Cl组的相对丰度分别为18.03%、2.44%、2.59%和2.12%; 图6A)。与NC相比, 各实验组Aeromonas相对丰度下降([C6mim]Cl、[C8mim]Cl和[C12mim]Cl组分别下降3.81%、11.23%和22.83%),Cetobacterium相对丰度显著降低([C6mim]Cl、[C8mim]Cl和[C12mim]Cl组分别下降15.59%、15.44%和15.91%;P<0.05; 图6B和6F)。[C6mim]Cl处理组Flavobacterium和Pseudomonas相对丰度显著升高(P<0.05), [C8mim]Cl和[C12mim]Cl处理组Cellvibrio和Pseudomonas相对丰度显著升高(P<0.05),此外, [C12mim]Cl处理组Pseudomonas的相对丰度也显著升高(P<0.05; 图6C—E)。
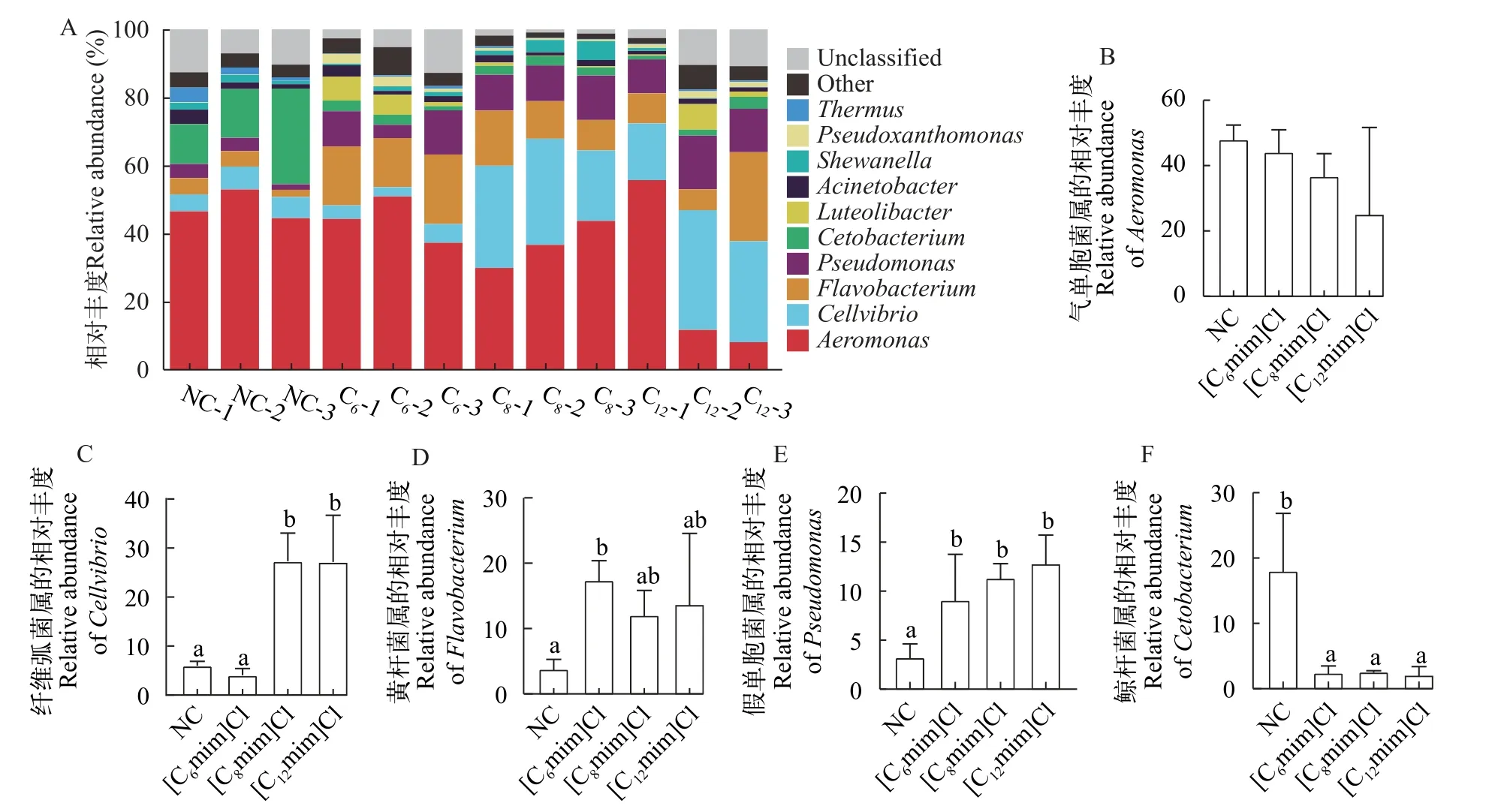
图6 不同AILs暴露30d对黄河鲤肠道菌群属水平(Genus)相对丰度的影响Fig.6 Effects of 30d exposure to different AILs on the relative abundance of intestinal flora of C.carpio L.
基于16S rRNA基因高通量测序结果的PICRUSt2功能预测结果分析表明, 与NC组相比,[C6mim]Cl、[C12mim]Cl组肠道菌群中与辅助因子和维生素代谢、外源生物降解和代、碳水化合物代谢、氨基酸代谢、能量代谢、脂质代谢及其他氨基酸的代谢等相关代谢途径丰度升高; [C8mim]Cl组无显著性变化(图7)。

图7 不同AILs暴露30d对黄河鲤肠道微生物PICRUSt2功能预测分析Fig.7 Effects of 30d exposure to different AILs on the prediction of PICRUSt2 function of intestinal flora of C.carpio L.
3 讨论
3.1 不同烷基链AILs对鲤肠道形态结构的影响
肠道形态的完整性在维持正常的肠道屏障功能以及消化和吸收能力方面发挥着重要作用[23]。肠道结构的形态变化在一定程度上反映了鱼类的肠道甚至机体的健康水平[21]。在本研究中, 不用烷基链AILs([C6mim]Cl、[C8mim]Cl和[C12mim]Cl)暴露30d后对鲤肠上皮结构均有明显损伤, 随着烷基链长度的增加, 肠道绒毛高度显著降低, 肌层厚度显著下降, 肠道组织损伤更为严重(图1), 表明肠道屏障通透性和易感性增加, 从而证实了不同烷基链AILs暴露可能对鲤肠道消化吸收能力和免疫功能产生影响, 且随着烷基链长度的增加, 肠道组织损伤更为严重[24]。
3.2 不同烷基链AILs对鲤肠道氧化应激的影响
在鱼类受到胁迫后, 体内ROS含量会发生变化,当细胞中ROS的产生速率快于氧自由基的清除速率时, 生物体内的抗氧化防御系统便会被激活[25,26]。其中, CAT和GSH-PX是关键的抗氧化酶, 且在机体抵抗氧化应激中具有重要作用。GSH-Px和CAT是机体抗氧化防御系统中的两种抗氧化酶。T-AOC可用来衡量机体抗氧化系统功能情况的综合性指标[27,28]。在污染的胁迫作用下, 抗氧化防御系统的主要特征是相关酶活性成分会发生变化, 因而可间接反映环境中污染的存在[29]。金鱼[30]和蚯蚓[10]暴露于低浓度离子液体后, GSH-Px酶活性升高, CAT活性无显著变化。这可能是在低浓度毒物的诱导,使得GSH-Px活性升高来清除产生的自由基。本实验结果显示, [C12mim]Cl处理组鲤肠道组织的GSHPx活性显著升高。其原因是不同烷基链AILs的长期暴露, 可能导致鲤体内产生了较多的自由基, 为消除这些有害物质, 其抗氧化防御系统被激活,GSH-Px活性升高来清除产生的自由基, 使鲤免受氧化损伤。但CAT作为一种很高效的酶, 可以将H2O2分解成无毒的H2和O2, 当底物H2O2到达较高浓度时仍不会饱和, CAT活性没有立刻改变[31,32]。在本研究中, [C8mim]Cl和[C12mim]Cl处理组鲤肠道组织的T-AOC水平升高, 表明AILs在一定程度可刺激鲤肠道组织的T-AOC水平上升, 提高机体的总抗氧化能力, 可能是机体抗氧化系统对AILs长期暴露的代偿性反应导致的[31]。LDH活性的增加常常是细胞不可逆损伤或坏死的标志, 是用来评价氧化应激的常用指标[33]。章龙珍等[34]研究发现, 随着铅(Pb)暴露剂量增加, 中华鲟幼鱼血液中LDH活力上升, 鱼体受到损伤。这与本研究结果相似, [C12mim]Cl处理组鲤肠道组织的LDH活性显著升高。这可能是因为AILs长期暴露后增强鲤的能量代谢能力, 机体组织器官可能出现损伤或病变。上述结果表明,AILs在一定程度上通过提高鲤肠道组织GSH-Px活性和T-AOC水平应对其对机体造成的氧化胁迫或损伤。
3.3 不同烷基链AILs对鲤肠道免疫基因相关表达量的影响
动物肠道严重损伤通常会导致肠道炎症反应和免疫系统激活[18], IL-6、IL-8、IL-10、IL-12、TNF-α和TGF-β是宿主的免疫细胞因子, 主要由T细胞、淋巴因子、巨噬细胞及其他抗原呈递细胞等分泌,在调节动物炎症反应和免疫功能中发挥重要作用,通常被认为是预测炎症反应的生物标志物[35,36]。在本研究中, 与NC相比, 3种烷基链AILs暴露可以显著升高促炎细胞因子IL-6、IL-8基因mRNA的表达水平, 且随着烷基链长度的增加, 基因的表达水平升高, 这与方美娟[37]将斑马鱼暴露于抗生素中的结果相一致, 促炎基因显著上调, 表明低浓度AILs暴露可能通过诱导鱼体升高免疫基因的表达量来对环境胁迫。王馨等[38]研究表明, 在感染结核杆菌后小鼠血清中IL-12基因表达水平显著降低, 本实验中3组暴露组的IL-12基因表达水平相较于NC组都有显著的降低, 表明AILs长期暴露会抑制促炎细胞因子IL-12基因的正常表达, 导致机体免疫系统紊乱。促炎细胞因子TNF-α负责鱼体内炎症过程的激活和扩展, 抗炎细胞因子TGF-β负向调节鱼类炎症反应激活。Chang等[13]发现([C8mim][PF6])暴露可以通过增加鲤肠道TNF-α水平, 降低TGF-β水平破坏鱼类肠道免疫功能, 引发炎症反应。在本研究中,3组暴露组的促炎因子TNF-α基因表达被不同程度抑制, [C6mim]Cl实验组的TGF-β基因表达水平相较于NC无显著差异, 其余两组TGF-β基因的表达NC相比有显著增加。综上所述, 不同烷基链AILs会在一定程度上引发炎症, 破坏鲤的肠道免疫功能,[C6mim]Cl对肠道免疫功能的伤害较小, 而随着烷基链增加([C8mim]Cl和[C12mim]Cl组), AILs对肠道免疫功能的损伤也随之增加。
3.4 不同烷基链AILs对鲤肠道菌群的影响
环境因素可导致鱼类肠道微生物组成发生巨大变化[39], 但不同烷基链AILs对肠道菌群变化的影响尚不清楚。肠道菌群通过调节多种生理功能影响宿主健康, 包括病原体抗性和免疫调节[40,41]。结果表明, 在不同烷基链AILs长期暴露后, 鲤肠道微生物群多样性和丰富度增加, 且[C6mim]Cl对鲤肠道菌群多样性的影响最明显。此前, 也有研究证实采用纳米银和环境剂量镉对斑马鱼进行暴露处理,能提高肠道微生物群落多样性和丰富度[23,27], 表明低浓度环境污染物毒性干扰可能减少有益菌的数目, 诱导鲤肠道菌群失调, 使外来病原菌能够突破其肠道及共生菌群防线在肠道内定植使菌群多样性上升。
此外, 本研究发现, 不同烷基链AILs长期暴露后, Fusobacteria、Proteobacteria和Bacteroidetes仍为鲤肠道中的优势门[42], AILs暴露组Proteobacteria相对丰度升高, Fusobacteria相对丰度显著降低,Bacteroidetes的相对丰度在[C6mim]Cl处理组中显著增加。有研究发现, Fusobacteria和Firmicutes都是丁酸产生菌, 而丁酸能够增强鲤生长性能、肠道屏障功能及抗炎能力[43]。这表明, 不同烷基链AILs的长期暴露可以通过抑制这些丁酸产生菌的生长来降低鲤的免疫能力。Firmicutes与Bacteroidetes的比值被广泛认为对维持肠道稳态的正常有重要作用, 降低与炎症性肠病有关[39,44]。在本研究中,各处理组Firmicutes与Bacteroidetes的比值极显著降低。这表明不同烷基链AILs暴露可能改变了鲤肠道菌群的稳态和群落组成, 导致肠道产生炎症。有研究表明, Proteobacteria含有病原体, 其丰度增加可能破坏肠道稳态, 增加肠道通透性, 进而引发肠炎性疾病[45], 提示不同烷基链AILs可能通过增加Proteobacteria的相对丰度来破坏鲤肠道稳态, 进而影响其免疫能力。Verrucomicrobia门被认为是污染水体底泥中的优势类群, 能分解有机污染物, 不同烷基链AILs暴露导致Verrucomicrobia相对丰度增加, 表明不同烷基链AILs暴露可能可以增加鲤肠道降解污染物菌群的丰度, 是肠道黏膜层对环境胁迫的一种响应[46]。
Aeromonas广泛分布在水生环境中,Aeromonas参与纤维素的分解, 健康鱼类肠道中Aeromonas的高丰度与宿主的消化功能密切相关[47]。有研究发现,Cetobacterium主要参与氨基酸和糖类的代谢,产生维生素B12, 更重要的是, 其菌体多糖能显著提高斑马鱼的抗病毒能力[48,49]。在本研究中,Aeromonas和Cetobacterium相对丰度的下降表明不同烷基链AILs暴露可能通过抑制Aeromonas和Cetobacterium的生长, 从而降低鲤的消化和抗感染能力, 导致肠道内致病菌增加。Shewanella、Flavobacterium、Pseudomonas和Vibrio已被证明与鱼类的细菌性疾病有关[50,51]。各实验组Shewanella相对丰度升高,此外, [C6mim]Cl处理组Luteolibacter、Flavobacterium和Pseudomonas相对丰度显著升高, [C8mim]Cl处理组Cellvibrio和Pseudomonas相对丰度显著升高, [C12mim]Cl处理组Cellvibrio和Pseudomonas相对丰度显著升高。综上所述, 不同烷基链AILs暴露改变鲤肠道菌群结构, 导致Shewanella、Flavobacterium、Pseudomonas和Cellvibrio等致病菌丰度显著增加,Cetobacterium和Aeromonas等潜在有益菌丰度降低, 且毒性随烷基链增加呈一定上升趋势。
肠道菌群的功能和宿主的生理反应取决于肠道中微生物的组成和功能[52]。本研究基于16S rRNA基因高通量测序结果的PICRUSt2进行代谢功能分析表明, [C6mim]Cl和[C12mim]Cl提升了与辅助因子和维生素代谢、外源生物降解和代、碳水化合物代谢、氨基酸代谢、能量代谢、脂质代谢和其他氨基酸的代谢等相关代谢途径丰度, [C8mim]Cl无明显变化。有研究发现, 外源物质生物降解及代谢功能相对丰度升高, 即对这些有毒有害物质的降解代谢能力升高[53], 氨基酸代谢可以帮助细菌吸收氨基酸, 有利于加速有机物矿化, 促进氨素吸收利用[54], 碳水化合物代谢与碳循环密切相关[55]。因此, [C6mim]Cl和[C12mim]Cl的环境胁迫使鲤肠道菌群对于有毒有害物质的降解代谢能力增强, 可能是不同烷基链AILs作为外来碳源改变了肠道微生态环境, 促使细菌碳水化合物代谢、氨基酸代谢、脂质代谢及其他氨基酸的代谢功能相对丰度升高,进而使肠道菌群中碳氨循环效率得以提升。此外,有研究发现, AILs对水生生物的毒性存在一定的“截断效应”, 即当离子液体长度从2增加到8时, 离子液体对水生生物的毒性逐渐增加, 当碳链长度增加到10时, 离子液体的毒性逐渐减小[6]。与本研究结果相似, 即低毒性的[C6mim]Cl和[C12mim]Cl暴露使鲤肠道微生物碳水化合物等代谢功能富集, 但其具体机制还有待进一步探究。
4 结论
综上所述, 不同烷基链AILs暴露均可造成鲤肠道形态、氧化应激和免疫损伤, 肠道有益菌门(Fusobacteria、Actinobacteria和Firmicutes等)和有益菌属(Cetobacterium和Aeromonas等)的相对丰度逐渐降低, 致病菌门(Proteobacteria和Bacteroidetes等)和致病菌属(Shewanella、Flavobacterium、Pseudomonas、Cellvibrio等)的相对丰度逐渐升高, 肠道菌群结构改变, 其毒性随烷基链增加呈一定上升趋势。本研究结果将为不同烷基链AILs对水生生态系统鱼类肠道的生态毒性机制提供一定的理论依据。

