华南热带水库拟柱孢藻产毒基因型的低优势及影响因子分析
——以珠海市水库为例
吴孟李 范利青 吴艳龙 秦 伟 商添雄 程 楠 雷腊梅
(1.珠海市供水与排水治污中心, 珠海 519000; 2.珠海市水资源中心, 珠海 519000;3.暨南大学生命科学技术学院生态学系, 广州 510632)
拉氏拟柱孢藻(Cylindrospermopsis raciborskii,简称拟柱孢藻CYL)被认为是热带特征性蓝藻, 有学者建议将其与尖头藻合并, 改称拉氏尖头藻(Raphidiopsis raciborskii)[1]。拟柱孢藻所产生的拟柱孢藻毒素(CYN)是一类环胍类生物碱物质, 具有肝毒性,神经毒性、繁殖毒性和细胞毒性, 进入细胞后能抑制谷胱甘肽、细胞色素P450和蛋白质的合成, 是一种潜在的致癌物, 对人类健康造成严重危害[2,3]。澳大利亚最早对饮用水中CYN浓度进行限定, 安全限值为1 μg/L[3], 美国在2016年也发布了CYN卫生警告水平, 6岁以下人群为≤0.7 μg/L, 6岁以上则为≤3.0 μg/L[4], 2022年WHO建议CYN的长期暴露浓度应不超过0.7 μg/L。由此可见, CYN引起的水华毒性在国际上已广受关注。
作为一种入侵蓝藻, 拟柱孢藻已广泛扩张至加拿大、新西兰、欧洲各国等温带地区的水体, 目前仅南极洲未出现拟柱孢藻的报道[5,6]。在我国, 拟柱孢藻发现在广东、福建、云南、湖北、台湾、山东和北京等多个省份有分布[7—11], 并在台湾、福建、广东等地区形成优势和较高生物量[7,11,12],尤其在地处热带-亚热带的广东省, 拟柱孢藻已逐渐取代微囊藻成为多个水库的优势种群, 在广东省江门市镇海水库中常年优势度可达93.5%[9,13]。
然而, 在自然水体中同一蓝藻的产毒和非产毒基因型往往共存, 两者通过显微观测无法区分[14,15],基于毒素合成酶基因的PCR检测可鉴别两种基因型, 而进一步发展的荧光定量PCR(qPCR)则可实现对水体中产毒和非产毒蓝藻的准确定量[16,17]。包括我国在内的世界上许多国家已将qPCR大量应用于湖泊、水库及河流中产毒微囊藻的分布动态及室内模拟研究[15,16,18,19]。相比较而言, 尽管拟柱孢藻已广泛分布于全球, 将qPCR用于产毒拟柱孢藻监测的研究仅有几例[14,20—23], 如我国澳门水库中产毒拟柱孢藻丰度与氨氮浓度显著正相关[22], 澳大利亚North Pine水库中开展的中宇宙试验则发现磷添加显著促进浮游植物群落中产毒拟柱孢藻的生长[14]。初步研究表明环境因子在调节产毒和非产毒两种基因型的演替中起重要作用[20,22—23], 但基于上述有限的研究难以弄清产毒基因型的发生规律。
在我国, 产毒拟柱孢藻和CYN已在浙江、湖北、福建、安徽、广东、澳门等地区的水体被检测到[8,21,22,24,25], Jiang等[8]认为产CYN的拟柱孢藻在我国是呈零星分布的, 非产毒拟柱孢藻的分布更为普遍。而基于Lei等[9]的研究, CYN在广东省东莞市水库中广泛分布, 检到的频次显著高于微囊藻毒素, 浓度最高可达8.25 μg/L, 但该研究没有区分拟柱孢藻的产毒与非产毒种群。Lei等[21]进一步建立了基于CYN毒素合成酶基因cyrJ的qPCR方法, 发现广东省水库约74%的样品中可检到产毒拟柱孢藻, 即产毒基因型在该地区广泛存在, 但其在拟柱孢藻种群中并不占优势, 最高比例不超过35%, 而目前对产毒拟柱孢藻在我国热带地区发生分布的影响因子还缺乏研究。本研究以位于华南热带地区的广东省珠海市20座水库为对象, 对比分析2018和2022年水库中产毒拟柱孢藻丰度、比例和CYN浓度的变化, 结合同步测定的环境因子, 分析和了解产毒拟柱孢藻发生分布规律, 为该地区防范拟柱孢藻水华的毒性风险和水质管理提供科学依据。
1 材料与方法
1.1 采样点的布设与样品采集
珠海市位于广东省南部, 全市都属于热带地区(21°48′—22°27′ N 和 113°03′—114°19′E; 图1)。20座水库主要分布在香洲区(7座)和斗门区(8座),高新区和高栏港区各2座, 大镜山、竹银、乾务和凤凰山等4座水库为中型水库, 其余16座为小型水库(表1)。分别在2018和2022年对20座水库进行采样, 除了大镜山和蛇地坑水库的采样是在2018年的10月进行, 其他水库的采样均在当年雨季结束后的7—8月进行, 并在1周内完成所有水库的采样。在水库的出水口或大坝处设置1个监测点, 2次共采集到40个样品。在水库监测点的表层0.5 m处使用有机玻璃采水器采集2 L水样, 于2h内运至实验室, 其中1 L用于理化指标测定, 另外1 L水样取200 mL用0.45 μm孔径滤膜过滤收集藻细胞用于DNA 提取, 同时取2 mL水样用于测定总拟柱孢藻毒素和微囊藻毒素浓度, 上述处理的样品未测定前直接冻存于-20℃冰箱保存。
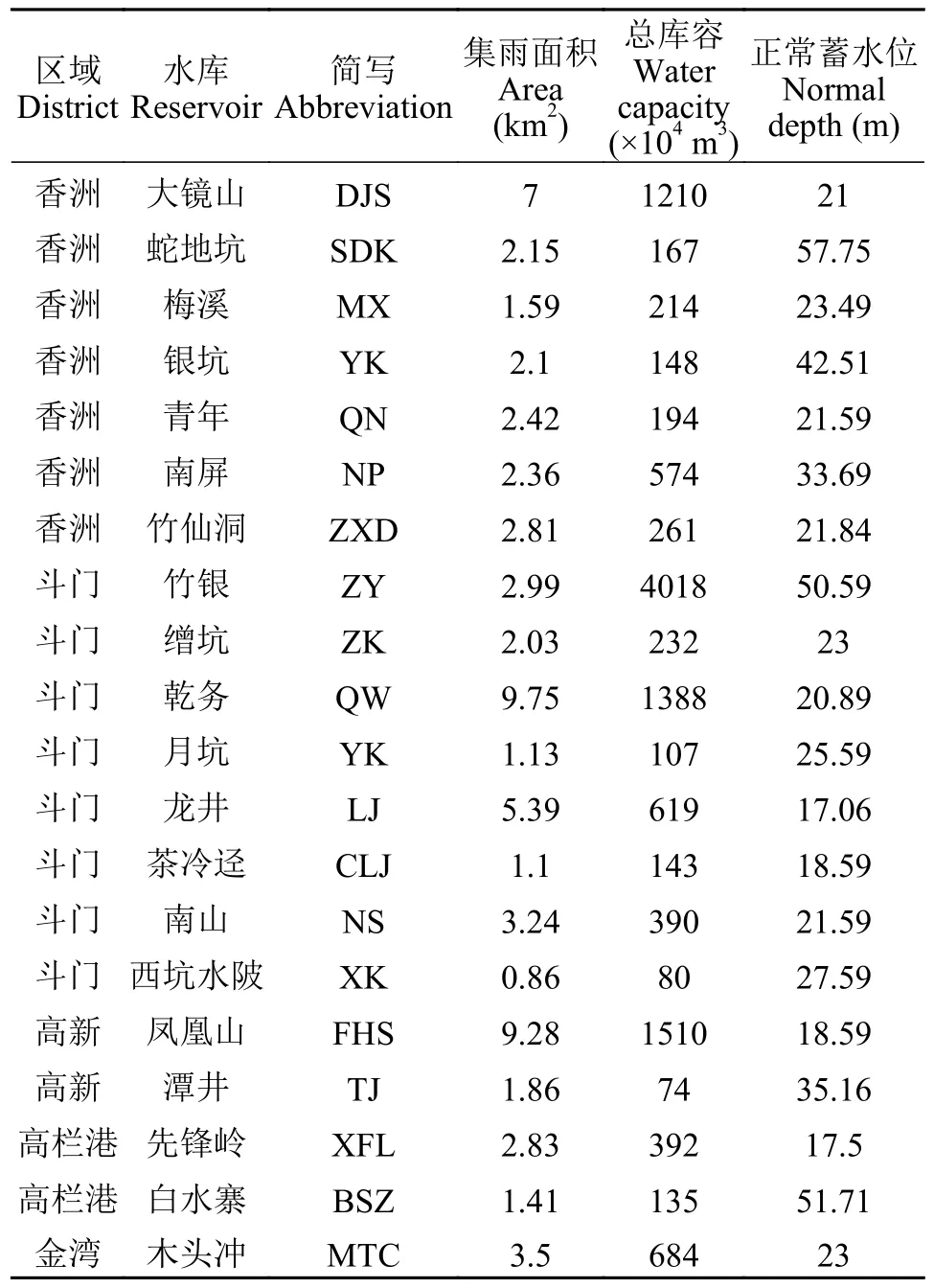
表1 珠海市20座调查水库的主要特征参数Tab.1 Main characteristics of twenty reservoirs in Zhuhai city

图1 珠海市20座调查水库的分布Fig.1 Location of twenty reservoirs in Zhuhai city
1.2 理化指标分析
1.3 荧光定量PCR分析
水库浮游植物样品中的基因组DNA采用试剂盒(北京鼎国昌盛生物技术有限公司)提取, 将收集到藻细胞的滤膜剪碎, 加入800 μL试剂盒中的裂解液, 置于细胞破碎仪(Fastprep 24-5G)辅助裂解细胞,随后按照说明书进行DNA的提取, 在分析前基因组DNA置于-20℃冰箱保存备用。
水样中的总拟柱孢藻丰度和产毒拟柱孢藻丰度的测定采用Lei等[21]建立的荧光定量PCR(qPCR)方法, 该方法针对拟柱孢藻rpoC1基因(RNA聚合酶β'亚基1)和cyrJ基因(CYN合成酶基因簇中的J基因)筛选获得特异性引物对和探针(表2)。以克隆有两个基因的质粒为标准品, 利用质粒 DNA 为模板建立rpoC1和cyrJ基因的不同拷贝数与对应Ct值间的标准曲线, 获得基因组拷贝数的对数与Ct值的线性方程, 根据样品的Ct值算出其初始模板的浓度,计算获得水体中的拟柱孢藻总丰度(rpoC1基因拷贝数)和产毒拟柱孢藻丰度(cyrJ基因拷贝数), 非产毒拟柱孢藻丰度为两者的差值, 拟柱孢藻种群中产毒细胞比例为(cyrJ/rpoC1)×100。
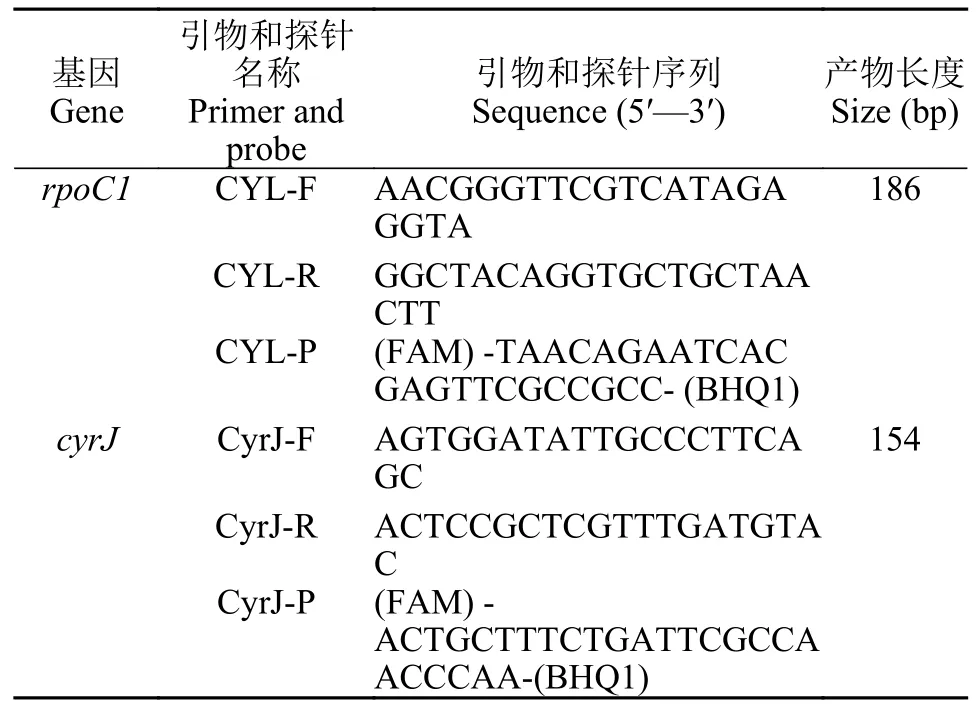
表2 荧光定量PCR主要的引物和探针序列Tab.2 Premiers and probes for Real-time PCR
荧光定量PCR反应体系如下: PCR反应液15.4 μL,引物探针混合液2 μL, Hot-startTaq酶1.2 μL, DNA模板5 μL, 加纯水至50 μL。PCR反应为热启动, 反应条件: 95℃, 2min, 然后94℃ 15s, 55℃ 45s, 50个循环。
1.4 拟柱孢藻毒素和微囊藻毒素分析
水库水样反复冻融后超声处理1min, 离心10min后留上清液用于拟柱孢藻毒素(CYN)和微囊藻毒素(MC)浓度的测定。MC的检测采用美国Beacon公司的微囊藻毒素检测试剂盒, 该试剂盒是为直接竞争ELISA(酶联免疫吸附性分析)模式, 在450 nm波长进行吸光值的测定后绘制标准曲线, 获得线性模拟曲线和方程, 并根据方程计算样品中MC浓度。
CYN的检测亦为直接竞争ELISA方法, CYN单克隆抗体N8为Lei等[27]筛选制备, HRP-CYN采用文献[28]报道的连接方法, ELISA具体步骤如下: 包被二抗的微孔板中依次加入50 μL的HRP-CYN、CYN标准品(0、0.1、1、5和10 ng/mL)或样品、CYN单抗N8, 37℃振动孵育1h, 洗涤液冲洗6次, 加入显色剂100 μL, 室温孵育10—30min, 加入终止液后采用酶标仪测OD450nm的吸光值, 绘制标准曲线并计算样品中CYN浓度。
1.5 数据处理和分析
在R软件采用程序包boxplot对2018和2022年的环境因子、总拟柱孢藻和产毒拟柱孢藻丰度、产毒细胞比例和CYN浓度进行箱须图的绘制, 并采用One-way ANOVA进行显著性比较, 显著水平为P<0.05。对拟柱孢藻丰度、产毒藻比例、CYN浓度与环境因子进行Spearson相关分析并在P<0.05水平上进行统计显著性检验。采用混合效应模型分析环境因子对拟柱胞藻丰度和产毒细胞比例的影响,并将采样年份设为随机变量, 分析前将拟柱孢藻丰度进行log2(N+1)转换。在R语言中调用 “lmertest”包估计线性混合效应模型参数, 使用“step”函数剔除模型中不显著的变量。
2 结果
2.1 水库理化特征
图2显示了2018和2022年两次调查的理化因子均值和变化范围。两次调查时20座水库水温均值都在30℃以上, 10月采样的大镜山和蛇地坑水温稍低, 分别为26℃和23℃。2018年水库的pH为5.26—8.97, 比2022年(7.19—8.5)波动明显, 但两个年份间pH差异不显著(P>0.05); 水库的透明度整体在2018年更深, 但2018和2022年间无显著差异(P>0.05)。2018和2022年水库TP浓度分别在0.01—0.112和0.005—0.05 mg/L, 2018年20座水库的TP和NO3-N浓度均值均高于2022年, 但统计分析表明两个年份间差异不显著(P>0.05)。PO4-P是浓度呈显著增加的唯一理化因子(P<0.01), 2022年20座水库的均值为14.9 μg/L, 比2018年高3.4倍。与2018年相比,水库的TN和NH4-N浓度在2022年显著下降(P<0.05), 两者的均值分别从2018年的1.38和0.097 mg/L降至2022年的0.66和0.034 mg/L。均发现, 2018和2022年水库Chl.a浓度分别为0.685—69.73和0.5—46 μg/L, 最高浓度出现在2018年的南屏水库, 尽管Chl.a浓度在水库间差异明显, 但两个年份间无显著差异(P>0.05)。根据TSI指数, 两次调查时珠海市水库整体为中营养状态, 2018和2022年间的TSI均值无显著差异(P>0.05); 茶冷迳水库为唯一的贫营养水库, 但其TSI从2018年的29.3上升到2022年38.3,2022年TSI>50的水库为6座(大镜山、梅溪、竹银、先锋岭、木头冲和白水寨), 稍高于2018年的4座(大镜山、南屏、竹银和竹仙洞)。
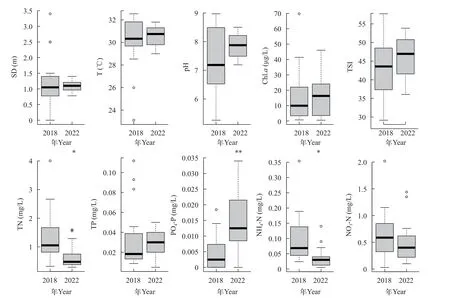
图2 2018年和2022年20座水库理化因子变化范围的比较Fig.2 Comparison of variabilities on environmental variables of twenty reservoirs between 2018 and 2022
2.2 水库中的总拟柱孢藻、产毒拟柱孢藻丰度和比例
在两次调查期间, 基于rpoC1和cyrJ基因的荧光定量PCR方法在20座水库的40个样品中均检到拟柱孢藻, 在其中33个样品中检到产毒拟柱孢藻,2018和2022年未检到产毒基因型的样品分别为3个(大镜山、青年和茶泠迳)和4个(银坑、乾务、西坑水陂和先锋岭), 表明这些水库中只存在非产毒基因型或产毒基因型丰度低至无法检出。2018和2022年20座水库的拟柱孢藻总丰度分别在2.03×104—5.71×108和4.79×105—2.3×109cells/L(图3A), 产毒拟柱孢藻丰度分别在1.33×103—2.18×108和5.26×103—1.14×108cells/L(图3B), 种群内产毒基因型的比例(cyrJ/rpoC1)在0.046%—38.66%, 最大值出现在2018年的龙井水库(图3B), 但20座水库中产毒基因型比例在2018和2022年均没有超过50%, 表明非产毒基因型在拟柱孢藻种群内占据优势。

图3 2018年和2022年20座水库的总拟柱孢藻丰度(rpoC1拷贝数)(A)、产毒拟柱孢藻丰度(cyrJ拷贝数, 柱状图)(B)和比例(cyrJ/rpoC1, 散点图)及其变化范围(C)Fig.3 Total abundances of C.raciborskii (A, rpoC1 gene copies), the abundances of the toxic genotypes (B, cyrJ gene copies) and its ratio within C.raciborskii population (B, cyrJ/rpoC1) in twenty reservoirs and their variabilities in 2018 and 2022 (C)
2022年有17座水库总拟柱孢藻丰度较2018年明显增加, 水库总丰度均值从2018年的3.41×107cells/L上升至2022年的3.15×108cells/L, 增长近10倍, 两个年度间总拟柱孢藻丰度呈显著差异(图3C;P<0.05)。尽管2022年有13座水库的产毒细胞丰度较2018年有一定的升高, 但两个年度间的产毒细胞丰度均值无显著差异(图3C;P>0.05)。从2018年到2022年, 非产毒基因型在拟柱孢藻种群内的优势进一步扩大, 产毒基因型比例进一步显著降低(P<0.05),其均值和最大值分别从2018年的14.86%和38.66%降至2022年的4.17%和17.24%(图3B和3C)。
2.3 拟柱孢藻毒素和微囊藻毒素浓度
2018年水库样品仅测定了CYN浓度, 仅大镜山水库未检到CYN, 其他19座水库中CYN浓度范围在0.19—1.58 μg/L(图4A), 最高浓度出现在乾务水库。2022年同时检测了CYN和MC, 20座水库中有6座水库(梅溪、银坑、乾务、龙井、凤凰山和先锋岭水库)中未检到CYN, 其他14座水库中CYN浓度在0.1—0.767 μg/L(图4A); MC仅在竹银和先锋岭两座水库中检到, 浓度分别为0.192和0.103 ng/mL。2018年有4座水库(银坑、乾务、龙井和南山)的CYN浓度超过WHO建议的0.7 μg/L的安全限值, 而2022年仅月坑水库的CYN浓度超过安全限值(图4A)。与2018年相比, 16座水库的CYN浓度在2022年出现明显下降, 2018年水库的CYN浓度均值(0.56 μg/L)显著高于2022年(0.19 μg/L; 图4B;P<0.05)。

图4 2018和2022年20座水库中的CYN浓度(A)及变化范围的箱须图(B)Fig.4 CYN concentrations in twenty reservoirs (A), and its range of variability in 2018 and 2022 (B)
2.4 产毒拟柱孢藻丰度和比例、拟柱孢藻毒素浓度与环境因子的关系
Spearson相关分析表明(表3), 总拟柱孢藻丰度和产毒基因型丰度与pH (P<0.001), Chl.a(P<0.05)和 TSI (P<0.05)呈显著正相关; 此外, 总拟柱孢藻丰度还与PO4-P (P<0.05)显著正相关, 与NO3-N (P<0.05)显著负相关。种群中产毒拟柱孢藻的比例则与TN和 NH4-N都呈显著正相关(P<0.05)。CYN浓度分别与水温(P<0.01)和NH4-N (P<0.05) 显著正相关; 此外, 线性回归分析表明CYN与与总拟柱孢藻丰度无明显关系, 与产毒细胞比例均呈极显著正相关(图5B;R2=0.459;n=40;P<0.001), 与产毒细胞丰度呈显著相关(图5A;R2=0.133;n=40;P<0.05)。
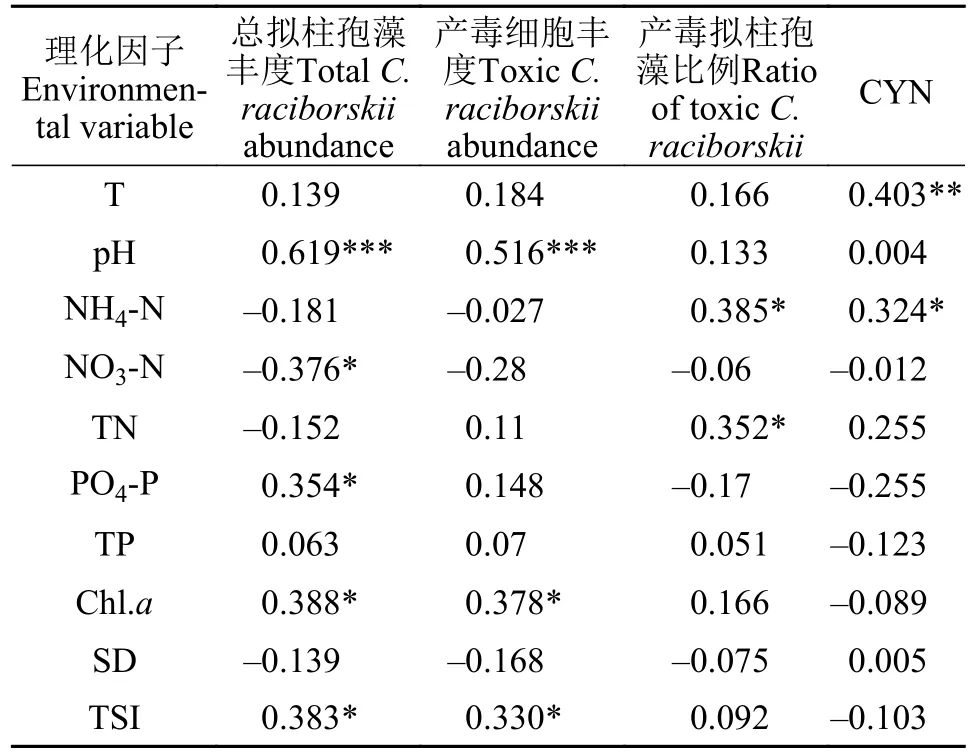
表3 总拟柱孢藻丰度、产毒拟柱孢藻丰度、产毒拟柱孢藻比例、CYN浓度与理化因子的相关系数Tab.3 Spearman correlations coefficients of environmental variables with total and toxic C.raciborskii abundance, ratio of toxic cell and CYN concentration
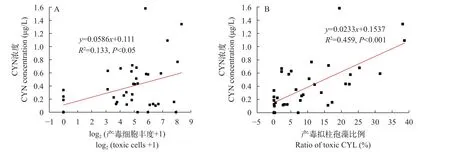
图5 CYN浓度与产毒拟柱孢藻丰度的对数值(A)和产毒细胞比例(B)间的线性回归关系Fig.5 Linear regression between CYN concentrations and the log10 toxic abundance (A) and the ratio of toxic strains within C.raciborskii population (B)
采用混合效应模型分析拟柱孢藻丰度与各环境因子间的关系, 结果发现年际间的随机效应不显著(P>0.05), 用“step”函数筛选后得到线性模型, 结果显示PO4-P和NO3-N是总拟柱孢藻和非产毒拟柱孢藻丰度的显著解释变量(表4), 两者丰度的对数值均随PO4-P浓度的升高而增加, 随NO3-N浓度的降低而减少(图6)。混合效应模型分析表明水温(T)对产毒细胞比例有显著影响(coef.est=2.01; coef.se=0.83; df=37;P=0.02)。

表4 总拟柱孢藻和非产毒细胞丰度与PO4-P和NO3-N的线性混合效应模型Tab.4 The GLMM models between the log abundances of total and non-toxic C.raciborskii and of concentrations PO4-P and NO3-N
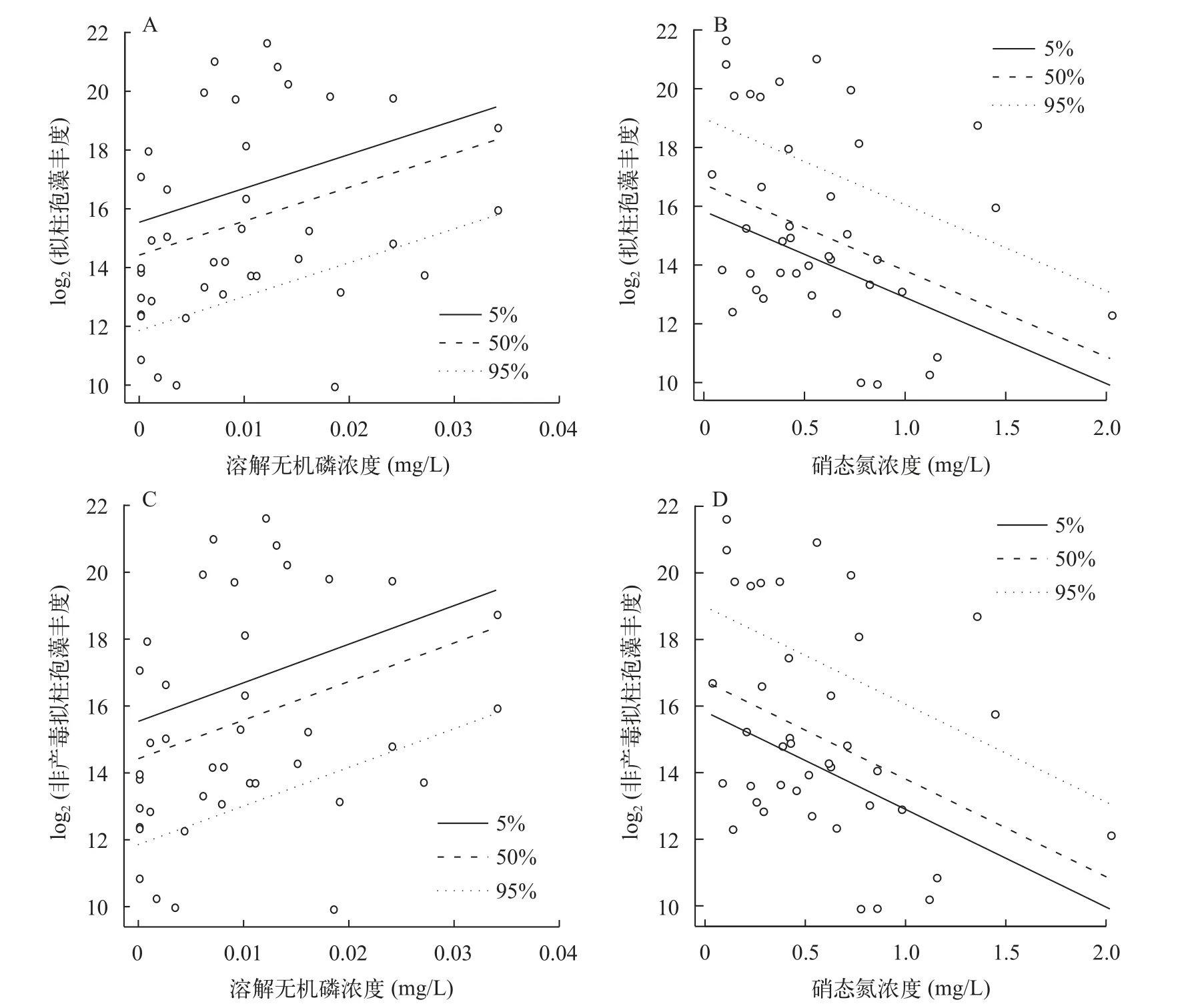
图6 总拟柱孢藻(A和B)和非产毒细胞丰度(C和D)与无机磷(PO4-P)和硝态氮(NO3-N)的线性关系Fig.6 The relationship between the log abundances of total (A and B) and non-toxic (C and D) C.raciborskii and of concentrations PO4-P and NO3-N
3 讨论
与微囊藻易聚集形成表面水华不同, 拟柱孢藻在水柱中的垂直分布较为均匀, 特别是在中小型水库中几乎没有空间差异[22], 因此很多研究均采取表层浮游植物样品进行观测[11—13,20]。本研究采用前期建立的基于rpoC1和cyrJ基因的qPCR方法对珠海市20座水库表层0.5 m的样品进行定量分析[21], 结果发现在2018年和2022年两次调查的40个样品中均检到拟柱孢藻, 其中33个样品检到产毒拟柱孢藻,表明该类水华蓝藻已在广东省水库广泛分布[9,29],产毒拟柱孢藻的发生也极为普遍[21,30]。从两次调查的结果可知, 种群内产毒基因型的比例最高为38.66%, 这与我们前期在广东省的观测结果一致[21,30],即非产毒基因型在拟柱孢藻种群内占据优势。从2018到2022年, 拟柱孢藻总丰度均值增长了近十倍,这意味着我国热带水库中拟柱孢藻的水华强度在明显增加。然而种群内产毒基因型表现出不一样的规律, 其平均丰度和最高丰度在两次调查间均没有显著差异, 这使得产毒基因型的比例进一步降低,非产毒拟柱孢藻在热带水库的优势度进一步扩大。
一般认为水体富营养化程度的加剧导致有害藻类增加[15,31], 氮磷是所有藻类生长必需的营养物质, 在控制浮游植物生长中起主要的限制作用[5,15,31]。线性回归模型显示拟柱孢藻总丰度与PO4-P呈显著正相关, 与NO3-N呈负相关, 表明水库无机磷浓度的升高和氮的下降有利于该蓝藻增殖并形成优势。拟柱孢藻能在全球快速扩张的策略之一是具灵活的磷利用策略, 拥有快速吸收和储存无机磷的能力[5,6,32], 因而可明显受益于2018年到2022年珠海水库PO4-P浓度的显著上升, 拟柱孢藻快速增殖而导致其丰度增加近10倍。作为一种固氮蓝藻, 拟柱孢藻可在水体氮不足的条件下形成异形胞固氮, 从而为其生长提供氮源[33,34]。因此相对于微囊藻等非固氮蓝藻, 珠海水库氮浓度的下降会更有利于固氮拟柱孢藻的优势形成[15,35], 使得拟柱孢藻总丰度与NO3-N 浓度呈显著负相关, 这样的相关性在其他水库的研究中也有观测到[33—36]。基于显微观测的结果, 浮游植物群落中拟柱孢藻在大镜山、凤凰山等水库的相对丰度最高可达99.7%(未发表的数据),是Chl.a浓度的主要贡献者, 调查期间水库较高的水温(>30℃)和其他环境条件都有利于拟柱孢藻生长,导致在Spearson相关性分析中其丰度与pH呈极显著正相关, 也有研究发现拟柱胞藻偏好高pH的生长环境[5,36]。
我们的结果表明拟柱孢藻种群内的产毒和非产毒基因型对PO4-P和NO3-N的响应不同: 由线性回归模型可知非产毒拟柱孢藻丰度与上述两种营养盐分别呈正相关和负相关, 产毒拟柱孢藻则与它们没有明显的关系, 这意味着高磷低氮的条件更有利于非产毒拟柱孢藻获得竞争优势。这与前期的研究不一致, Zhang等[22]发现澳门水库中产毒细胞丰度与氨氮浓度显著正相关, Burford等[5]的中宇宙实验则显示无机磷升高显著促进产毒拟柱孢藻生长。比较基因组分析表明产毒和非产毒蓝藻的本质区别在于毒素合成酶基因簇的有无, 而产毒一直被认为能增加蓝藻自身的竞争优势[17,37], 产毒拟柱孢藻对铁限制、高光、氮限制等胁迫条件的适应要高于非产毒藻株[38—40]。然而, 近期不少学者提出常见的蓝藻毒素如微囊藻毒素和CYN均是富氮毒素, 由于毒素的合成需要碳、氮等物质构建毒素分子[15,41], 氮磷营养的单限制和共限制下都将使产毒藻的竞争优势降低和毒素产量下降[15,30,42,43], 这可能是珠海市水库中产毒拟柱孢藻比例和CYN浓度进一步下降的原因, 最终使得非产毒拟柱孢藻在珠海水库氮浓度下降的情况下占据优势。
作为热带特征性种类, 拟柱孢藻被认为会更加受益于水温的升高[44], 但统计分析没有发现两者间存在显著关系, 这可能是两次采样主要在水温较高的7—8月进行, 温度波动很小所致。本研究发现温度的升高会导致产毒基因型比例增加, 即拟柱孢藻种群内会发生非产毒基因型向产毒基因型的转变,这与很多在微囊藻中观测到的结果相一致, 推测随着全球气候变暖, 与微囊藻水华类似, 拟柱孢藻水华也将趋于具更高的毒性[31,45]。Spearson相关分析还发现温度与CYN浓度呈显著正相关, 与前期我国东莞市的水体和巢湖及埃及、波兰等水体中的观测结果一致[3,9,24], 这表明珠海市水库的CYN风险主要出现在夏季高温时期。
2018年和2022年CYN在珠海市20座水库的检出率分别为95%和70%, 我国巢湖在6—7月夏季水华期的CYN检出率达100%[24], 结合前期东莞市和广东省其他水库的研究[9,21], 可以推断CYN在广东省发生频率极高[8], 该毒素可能也已广泛分布在全国的水体中, 但监测数据极为匮乏。与东莞市水库中最高浓度8.25 ng/mL相比[9], 本次调查的珠海市水库CYN浓度明显很低, 尤其是2022年仅月坑水库超过WHO的安全限值0.7 μg/L, 最高浓度(0.784 μg/L)较东莞市低10倍。2022年珠海市水库中微囊藻毒素的检出率和浓度均显著低于CYN, 与东莞市和广东省其他水库的研究结果一致[9,29], 表明我国热带水库中CYN的发生较微囊藻毒素更为普遍, 需在该地区关注其对水库供水安全的威胁。一般认为蓝藻毒素浓度与其产生者的丰度间会呈正相关[9,24,29],然而本研究发现拟柱孢藻丰度与CYN无相关性, 这可能是因为拟柱孢藻并非是CYN的产生者, 如欧洲水体可检到该毒素, 但其产生者主要为束丝藻[5,46]。然而, 我们在珠海市水库中广泛检到产CYN的拟柱孢藻, CYN浓度与产毒拟柱孢藻丰度和比例呈正相关, 这与前人的观点相一致, 即产毒基因型的丰度和比例更适合用来指征蓝藻水华毒性[14,47]。因此在评估拟柱孢藻水华的潜在健康风险时, 对产毒细胞进行定量分析将更具指导意义。
4 结论
(1)本研究进一步证实了产毒拟柱孢藻和CYN在我国热带水库中广泛分布, 非产毒拟柱孢藻在种群中占据优势; (2)对比2018年的监测, 2022年拟柱孢藻在热带水库呈大幅度增加趋势, 但其产毒基因型丰度基本稳定, 这使得产毒拟柱孢的相对优势进一步下降, 也降低了水体CYN超标概率; (3)无机磷浓度的显著升高及硝氮浓度的下降可能是导致热带水库非产毒拟柱孢藻优势形成的主要原因; 水温升高则使产毒拟柱孢藻比例增加。

