颅缝发育与颅缝早闭的分子机制
叶剑青, 胡雪峰
(福建师范大学生命科学学院, 福建省发育与神经生物学重点实验室, 福州 350117)
颅缝是颅骨顶部扁平骨之间的纤维关节,包括额缝(metopic suture)、冠状缝(coronal suture)、人字缝(lambdoidal suture)和矢状缝(sagittal suture)等。颅缝在分娩或咀嚼时轻微形变来发挥外力缓冲作用,并在个体发育期间充当骨骼生长延伸的区域[1]。颅缝和颅骨具有双重起源,即中胚层来源和颅神经嵴来源,尽管解剖位置和胚胎起源存在差异,但各个颅缝具有相似的基本特征,包括骨前沿、颅缝间充质、上方骨膜和下方硬脑膜。相邻的骨前沿由间充质组织隔开,间充质中含有助于颅骨持续生长的骨祖细胞。随着大脑和头部结构的发育,这些细胞通过膜内成骨在相邻颅骨前沿内增殖分化为成骨细胞,持续产生新骨[2](Fig.1)。颅缝发育的过程涉及多种相互作用的信号通路,包括转化生长因子-β(transforming growth factor beta,TGF-β)、成纤维细胞生长因子(fibroblast growth factor,FGF)、骨形态发生蛋白(bone morphogenetic protein,BMP)和视黄酸(retinoic acid,RA)等[3]。遗传或外界环境的异常则会引起这些通路的失调,干扰正常的细胞增殖和分化,导致颅缝发育的障碍,例如骨之间的过早融合——颅缝早闭[4]。遗传方面的异常会直接影响正常的成骨细胞分化或者引发微环境异常来间接影响。除此之外,机械力等表观遗传因素在颅缝融合中也发挥重要作用[5]。本文就颅缝微环境对颅缝发育的影响,以及机械刺激调控细胞分化的机制作归纳和综述,为将来治疗颅缝早闭的相关药物研发提供新思路。
1 颅缝早闭类型
颅缝早闭的发生可受到遗传因素、致畸物以及外界环境因素的影响,使得颅缝早闭表型种类和机制高度复杂。绝大多数颅缝早闭涉及单颅缝融合,少部分涉及多颅缝的融合。已经确定了50多个与颅缝早闭有关的基因,其中常发生突变的基因包括FGFR(fibroblast growth factor receptor)家族基因、TWIST1(twist family bHLH transcription factor 1)和EFNB1(ephrin B1)等(Table1),在此本文将重点介绍与FGFR2和TWIST1这两个基因突变相关的颅缝早闭。
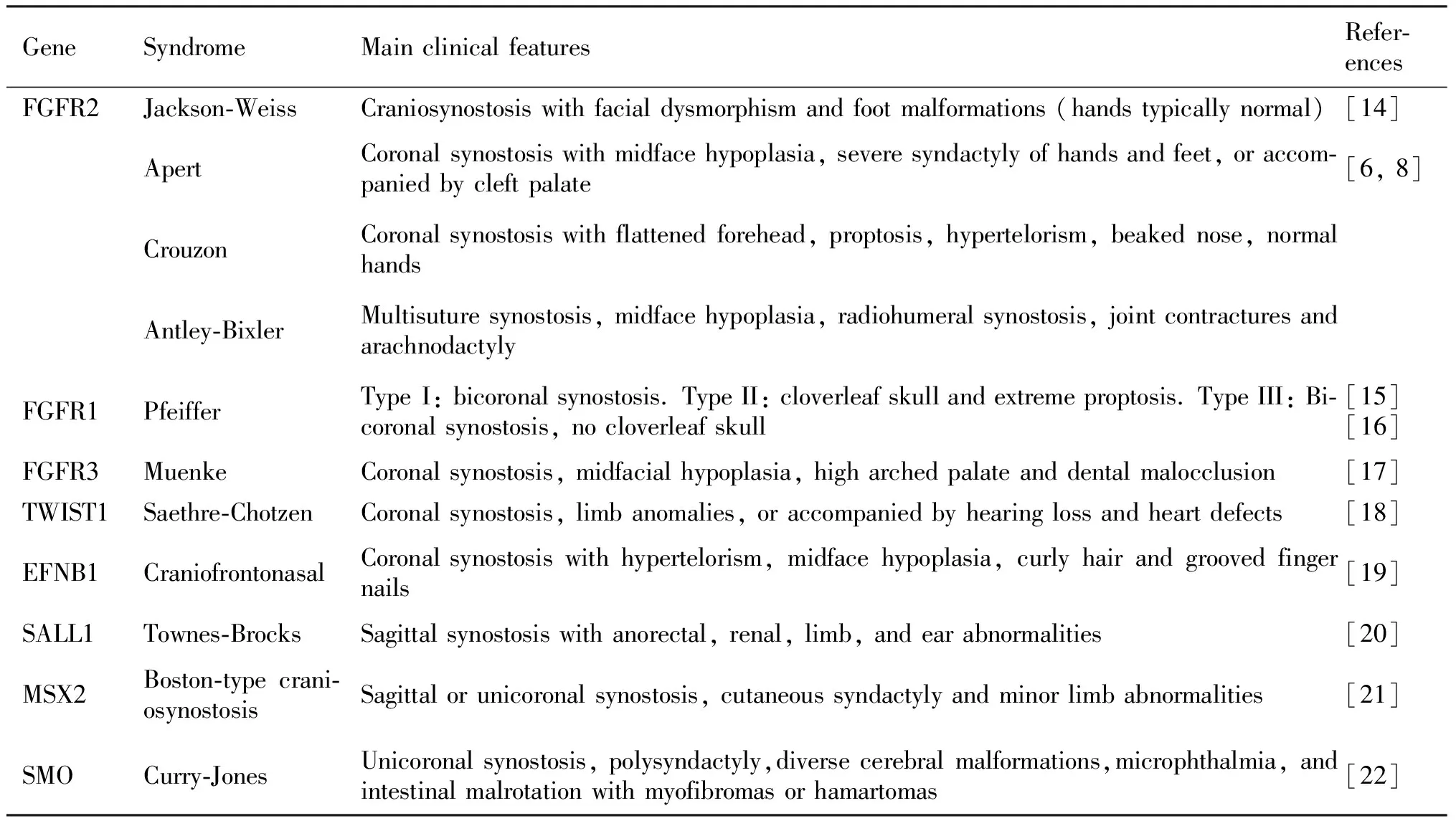
Table1 Craniosynostosis associated genes and main clinical features in human
1.1 FGFR2突变相关的颅缝早闭
与FGFR变异相关的颅缝早闭综合征类型最为广泛,其中又以FGFR2研究最多。FGFR2功能获得性突变导致受体的配体非依赖性激活,引发多种颅缝早闭综合征,例如Crouzon、Apert、Pfeiffer、Antley-Bixler、Jackson-Weiss等[6]。Crouzon和Pfieffer具有相似的分子机制,Crouzon综合征表型相对轻微,主要为双冠状缝的早闭,伴有前额扁平、眼球突出和眼距过宽[7, 8];Pfieffer综合征的颅面特征分为3种类型:Ⅰ型通常伴有中度至重度中面发育不全,Ⅱ型有三叶草头骨畸形和明显的眼球突出,Ⅲ型无三叶草头骨畸形和眼球突出[8, 9]。这2种综合征最常见突变点位于Ig-Ⅲ结构域,并且2种综合征主要由Cys278Phe和Cys342Tyr错义突变引起[6]。Apert综合征通常由FGFR2的Ig-Ⅱ和Ig-Ⅲ结构域之间保守的接头区域的错义突变引起,绝大数突变集中在Ser252Trp或Pro253Arg,主要表现为双冠缝早闭和手脚并指畸形[6]。Shin等[10]的研究表明,Fgfr2Ser252Trp/+突变小鼠的成骨细胞RANKl表达增加,导致破骨细胞多度活化可能是这种手指畸形的原因。
颅缝中FGFR2主要在分化的成骨细胞和骨祖细胞中表达,FGF/FGFR2通过下游通路信号转导介导骨祖细胞增殖、分化和凋亡,Fgfr2功能获得突变导致FGF/FGFR2信号活性增强,激活一个或多个下游信号通路,ERK1/2是在FGFR2信号转导中介导丝裂原活化蛋白激酶(MAPK)的关键蛋白质[11]。最近的研究[12]证明,Fgfr2的突变会过度激活ERK1/2-MAPK的信号转导,引起骨祖细胞过早成骨分化,导致颅缝早闭。正常FGFR2的补充可以缓解改善颅缝早闭发生[13]。
1.2 Saethre-Chotzen综合征
不同于FGFR2的杂合激活突变,TWIST1的突变导致自身蛋白质功能的丧失,特异性导致Saethre-Chotzen综合征,主要表现为单侧或双侧冠状缝的融合以及上睑下垂、宽鼻梁和宽眼距[23]。转录因子基因TWIST1或TCF12(transcription factor 12)中的单倍体不足是大多数Saethre-Chotzen综合征的原因[6, 24]。近来研究表明,TWIST1基因附近非编码区域的变异也会导致颅缝早闭[25, 26]。在斑马鱼中,TWIST1同源基因Twist1b丢失以及Tcf12的丢失会引发颅缝早闭,小鼠中只有Twist1的单倍体功能不足能导致颅缝早闭,Twist1+/-小鼠被认为是研究Saethre-Chotzen综合征的成熟模型[27, 28]。Twist1+/-突变小鼠表现为颅缝中成骨细胞过早分化导致骨生成增加,不同来源的成骨细胞的成骨贡献是不同的,正常情况下神经嵴来源成骨细胞比中胚层来源成骨细胞具有更强的成骨能力和增殖特性[29]。这种特性在Twist1+/-小鼠中发生了转变,Quarto等人[30]对Twist1+/-突变小鼠体外成骨细胞的研究发现,突变体的顶骨成骨能力增强,而额骨的成骨能力受损。另外对中胚层或者神经嵴来源的Twist1基因特异性失活会导致骨的相对增长,Wnt1-Cre;Twist1flox/+小鼠中额骨相对于顶骨过度生长,而在Mesp1-Cre;Twist1flox/+小鼠中,则导致中胚层衍生的顶骨相对于额骨的过度生长[28]。
TWIST1通过与其他碱性螺旋-环-螺旋(basic helix-loop-helix,bHLH)转录因子同源或异源二聚化,并与启动子上CANNTG(E-box)保守基序结合,调控靶基因转录活动[31, 32]。在成骨细胞分化过程中,TWIST1主要作为转录抑制因子广泛抑制骨骼发育相关的基因表达和信号通路[33-35]。近来研究也确定了最新的调控靶基因,Quarto等人[30]的研究发现,Twist1+/-小鼠的FGF23表达下调,并在Fgf23基因启动子中发现E-box结合基序的存在,表明Fgf23直接受TWIST1调控。Camp等[36]研究表明,TWIST1直接与C-ROS-1(ROS proto-oncogene 1, receptor tyrosine kinase)基因近端启动子上2个E-box结合位点结合;他们的另一项研究[37]表明,抑制Saethre-Chotzen患者的颅骨细胞中C-ROS-1的表达和活性,能改善体外TWIST1单倍体人颅骨细胞的成骨异常。
2 颅缝微环境异常影响颅缝发育
2.1 成体颅缝间充质干细胞保证颅缝开放
颅缝间充质干细胞是一种异质性干细胞群,属于间充质干细胞或骨骼干细胞,具有自我更新和多向分化的能力,对颅骨的稳态和修复至关重要。已经表明,在颅缝早闭小鼠的颅缝中植入Gli1+间充质干细胞群能改善颅缝早闭[38]。成体颅缝干细胞已在小鼠中被各种报告基因标记,例如Gli1+、Axin2+、Prrx1+细胞以及CD51+;CD200+细胞,各种被标记的干细胞之间存在密切联系,但它们在颅缝中定位并不完全重叠,体现了这些干细胞的异质性。Axin2+细胞与Gli1+细胞空间分布动态重叠:颅骨的Gli1+细胞广泛存在于出生时的整个骨膜、硬脑膜和颅缝间充质中,在随后的个体发育成熟中逐步收敛限制在颅缝中[39];相比于Gli1+细胞,Axin2+细胞分化速度较慢,对骨骼贡献也相对较低,Axin2+细胞在早期被限制在颅缝间充质中线处,并随着个体发育逐步扩展至骨膜和硬脑膜中[40, 41],两者呈现出此消彼长的趋势。Twist1+/-小鼠中颅缝Gli1+细胞数量明显下降,无法维持颅缝开放性[39];Twist1+/-小鼠模型中Axin2+细胞是否减少仍未知,但已知Axin2基因突变会导致颅缝早闭,并且闭合颅缝中细胞轴蛋白抑制蛋白2(axis inhibition protein 2,AXIN2)表达明显低于颅缝开放处细胞[42, 43]。Axin2+细胞中Bmpr1a敲除会引起干细胞的过度成骨分化导致颅缝早闭,但Gli1+细胞中Bmpr1a的敲除却不会导致颅缝早闭,这与Gli1+细胞不与骨形态发生蛋白受体1A(bone morphogenetic protein receptor type 1A,BMPR1A)共定位有一定联系[44, 45]。Prrx1+细胞会随着年龄的增长而减少,这被认为是由于Prrx1+细胞中含有大量骨祖细胞和转运放大细胞。另外,Prrx1+细胞也表达AXIN2,并在Wnt激动剂的刺激下增加,因此,Prrx1+细胞可能是Axin2+干细胞的一个子集[46]。CD51+;CD200+细胞同样被发现在Twist1+/-小鼠中显著减少,Twist1+/-小鼠中Axin2基因的失活则可以恢复CD51+;CD200+细胞的数量,并改善颅缝早闭[47]。
2.2 胚胎期骨祖细胞规范早期颅缝发育
胚胎时期颅缝间充质起源于表达GLI1的细胞,这些细胞在胚胎日E7.5 d迁移离开近轴头中胚层,并在E12.5 d开始向顶部扩展至外侧真皮间充质层和内侧脑膜层之间[48, 49]。各种出生后的干细胞标志物,例如GLI1和配对相关同源框 1(paired related homeobox 1,PRRX1)广泛标记胚胎时期的颅缝,并不适用胚胎期的颅缝间充质干细胞的识别。最近,对E15.5和E17.5的小鼠冠状缝转录物组研究[50]将Six2+细胞鉴定为胚胎冠状缝中的骨祖细胞,谱系追踪显示,它们贡献了出生后的颅缝间充质,Six2+细胞沿着额骨和顶骨的前沿表面从颅缝中心延伸开来呈现出不对称的分布,并且发现由Six2+细胞分化的两种分别定位在骨尖和远处骨膜的前成骨细胞,可能分别有助于骨长度和厚度的增加;在另一项研究中[24]也观察到,Grem1+骨祖细胞在冠状缝中的不对称分布——大部分细胞分布在额骨外表面和顶骨内表面,而这种不对称性被认为可以保证顶骨始终重叠在额骨上方;Holmes等[51]在E16.5和E18.5的额缝中发现了Npnt+骨祖细胞,Npnt+骨祖细胞未呈现出与冠状缝中的骨祖细胞类似的不对称分布,但在额缝中由前到后逐渐表达减少。胚胎时期的骨祖细胞在颅缝发育中发挥储备以及维持颅缝开放性的作用,突变小鼠的颅缝骨祖细胞明显减少且存在过度的成骨分化。在Twist1+/-;Tcf12+/-小鼠中Six2+细胞和Grem1+细胞都显著减少,并且不对称结构消失,导致额骨与顶骨的接触融合[24];另一个对E16.5和E18.5小鼠冠状缝的研究[52]显示,将Hhip+细胞确定为冠状缝独有的骨祖细胞,它们同样贡献了出生后的颅缝干细胞,Hhip-/-小鼠中颅缝间充质干细胞减少并且顶骨与额骨处于同一水平,表明在胚胎发育后期阶段,可能需要Hedgehog相互作用蛋白(hedgehog interacting protein,HHIP)的抑制来防止过早成骨分化。Twist1和Hhip的突变改变了颅缝干细胞和增殖性成骨细胞及其直接祖细胞之间的平衡,成骨细胞数量的早期增加将以长期祖细胞的损失为代价,从而导致之后的骨骼无法持续生长及出生后颅缝干细胞的减少。鉴于颅缝早闭的胚胎病因学数据越来越多,识别胚胎时期颅缝中细胞种类多样性有助于理解胚胎时期祖细胞功能障碍导致颅缝早闭的深层机制。
2.3 硬脑膜与颅缝相互影响保证正常发育
脑膜的发育与颅骨相同都是双重起源(神经嵴或中胚层来源)。脑膜由3个不同的层组成:外层的硬脑膜、中间的蛛网膜和内部的软脑膜。硬脑膜是附着在颅骨内表面的厚而致密的胶原膜。在发育末期,硬脑膜的外层在颅骨的内表面形成骨膜,使得颅骨和脑膜连续。早期的研究[53]通过切除硬脑膜证实了其在颅骨修复和重新骨化的重要性;最近的研究[38]发现,硬脑膜来源的间充质干细胞在外源植入的Gli1+干细胞的诱导下有助于颅缝的愈合再生,这进一步表明,颅缝与硬脑膜之间的密切交流对于颅缝发育和愈合至关重要。硬脑膜来源的多种信号通路配体对颅骨发育具有指导作用。Kou等人[54]研究的表明,将大鼠人字缝旋转使之位于非颅缝处的硬脑膜上方,导致硬脑膜Twist1表达下调并且颅缝提早闭合。Ang等[55]构建了Fgfr2基因突变的硬脑膜细胞并与成骨细胞共培养,明显提高成骨细胞增殖水平;Dong等[56]的研究则进一步表明,硬脑膜细胞可能通过Hippo/Yap-PI3K-AKT信号通路来影响成骨细胞的增殖和分化。Ferguson等人[57]的研究发现,利用RA处理颅缝可以上调抗成骨基因的表达以抑制成骨分化;值得注意的是脑膜中RA在E12.5 d表达,而颅缝间充质在E14.5 d表达RA 降解酶——细胞色素P450家族成员26B1蛋白(cytochrome P450 family 26 subfamily B member 1,CYP26B1)[53];并且有研究[58]表明,CYP26B1表达上升导致RA过度分解会导致小鼠颅缝早闭。以上证据表明,硬脑膜对于颅骨早期发育的指导一部分体现在防止过度的成骨分化。除此之外,有研究[59]显示,在矢状缝颅缝早闭患者中发现了SIX1基因的多种突变,对SIX1的定位显示它在硬脑膜中表达;对脑膜的单细胞转录物组分析也显示硬脑膜中Six1的高表达[60]。这些都提示,Six基因可能在维持硬脑膜与颅缝之间正常的信号通路交流中发挥作用。颅缝早闭的患者通常会表现出其他症状,例如智力障碍、社交问题以及注意力缺陷,并表现出压抑孤僻的性格。由于颅骨过早融合会阻碍大脑正常生长,众多颅缝早闭的患者表现出不同程度的颅内压(intracranial pressure,ICP)升高,即使在手术治疗后也可能存在颅内后期压慢性升高的风险,导致认知和智力的受损。有证据表明,他们升高的颅内压与静脉畸形存在密切联系[61]。Twist1基因是Saethre-Chotzen综合征的关键致病基因,Twist1基因的突变同样会导致硬脑膜中静脉畸形,Tischfield等[62]研究表明,利用Pdgfrb-Cre或Sm22a-Cre条件性敲除颅骨和硬脑膜的Twist1基因足以导致静脉畸形,来自于颅骨的前成骨细胞和硬脑膜Twist1基因调控的旁分泌BMP信号有助于静脉血管发育,表明颅缝也积极的影响着硬脑膜的正常发育。Ang等[63]研究表明,Sm22a-Cre条件性敲除小鼠由于血管内皮生长因子C(vascular endothelial growth factor C,VEGFC)表达下调以及硬脑膜发育不全和细胞外基质缺失也会导致硬脑膜中脑膜淋巴管出现异常,值得注意的是淋巴系统的异常会影响神经系统中无用代谢物的清除,所以颅缝早闭患者认知能受损与淋巴系统异常也存在一定联系。
2.4 颅缝细胞响应细胞外基质信号保证颅缝正常发育
细胞外基质环境的变化会影响细胞功能,例如黏附、迁移、增殖和分化,因此对这些细胞外基质功能的研究将有助于对颅缝发育和颅缝早闭的进一步了解。Bala等[64]研究发现,成骨细胞和终末分化细胞阶段,闭合颅缝的细胞外基质蛋白表达也与开放颅缝的存在差异,其中核心蛋白聚糖、光蛋白聚糖和白脂素差异最为显著。骨膜蛋白也是一种细胞外基质蛋白,在闭合的颅缝中表达降低[65];Bai等[66]研究发现,重组骨膜蛋白治疗可以抑制冠状缝细胞增殖和迁移,改善了Twist1+/-敲除小鼠的冠状缝早闭表型。牙本质基质蛋白1(dentin matrix protein 1,DMP1)的蛋白多糖形式(DMP1-PG)在颅缝的骨前沿高度表达,DMP1-PG可通过调节骨间充质干细胞的成骨分化来防止颅缝过早融合,DMP1糖基化位点突变小鼠则表现出颅缝早闭[67]。骨骼中细胞外基质可以通过与细胞表面的外基质受体结合来影响细胞活动,破坏整合素(integrin)等外基质响应受体与细胞外基质间正常的相互作用会导致众多人类骨骼疾病,包括骨骼发育不良、软骨发育不良、骨关节炎和骨质疏松症。已经有体外实验证明光蛋白聚糖在颅骨前成骨细胞中依赖结合整合素α2β1下游的ERK信号刺激细胞的分化[68];Jiang等[69]研究发现,颅缝中结蹄组织生长因子依赖整合素α5介导来促进前成骨细胞往成骨前沿的聚集与成骨分化;Gilbert等[70]在颅缝早闭兔模型中确定了一个与整合素α3相关的非编码突变,对颅缝早闭患者的数据分析也显示整合素α3基因ITGA3表达在冠状缝早闭患者的显著降低,但需要进一步的研究确定其在颅缝发育的功能;黏着斑激酶(focal adhesion kinase,FAK)可接收来自整合素的信号以激活下游骨形成相关信号,有研究发现FAK在颅缝早闭的大鼠中表达上升[54]。以上研究皆表明,整合素介导的信号传导在颅缝发育中的重要性。盘基蛋白结构域受体2 (discoidin domain receptor2,DDR2) 是另一种胶原蛋白受体,人类和小鼠DDR2与细胞外基质中胶原蛋白相互作用从而调控细胞增殖和分化。Binrayes等[71]研究发现,DDR2功能丧失小鼠颅骨中骨祖细胞和成骨细胞增殖分化减少,引发严重的颅面和骨骼缺陷,过表达DDR2则会刺激细胞的增殖分化;另一项研究[72]则发现,颅骨中DDR2表达区域与Gli1+细胞重叠,Gli1+细胞依靠DDR2的正常功能开始成骨谱系分化。
3 机械刺激调控颅缝发育
颅缝上的压力主要来自不断增长的大脑。分娩、挤压和创伤性冲击等外部刺激以及咀嚼等正常生理过程也会在颅骨上施加压力,临床实践已经证实了适当的机械力有利于骨愈合和再生[73]。机械拉伸促进颅缝中Gli1+干细胞成骨分化,进而促进成骨[40]。机械刺激激活多种成骨分化信号通路(Fig.2)。有研究[74]表明,机械拉伸会激活胞内ROCK-TAZ通路来促进Runx2转录,影响颅缝间充质干细胞的成骨分化;Li等[75]研究发现,激活非经典Wnt信号通路可增强RhoA-ROCK信号通路介导的机械转导;机械拉伸也会刺激VGLL3的表达上调,VGLL3与TEAD结合作用于Runx2促进转录[76]。机械刺激还会影响其他细胞的活动,成纤维细胞在机械拉伸作用下被激活,可促进颅缝中血管生成[77];机械刺激使得大量巨噬细胞聚集在缝合血管周围,随后促进颅缝间充质干细胞的成骨分化[78]。

Fig.2 Regulation of cranial suture cells by mechanical forces (A) Internal expansion from brain growth and external mechanical force is transmitted to cells in the cranial suture mesenchyma, which affects skull development.(B) Hh binds to Patch1 receptor and activates Hh signal to promote transcription of related genes. Integrins and DDR2 sense mechanical signals from the extracellular matrix and activate downstream signals to promote transcription. PC1 and PC2 are located in the primary cilia and act synergistically, sensing external mechanical stimuli and activating downstream signals to promote transcription. Piezo1 senses the external mechanical stimulus, which causes the inflow of Ca2+, activating a downstream signaling pathway that promotes transcription
3.1 细胞外基质介导的机械调控
近来的单细胞数据表明,颅缝间充质是一种机械反应性结缔组织,并在冠状缝上方识别出一种富含与韧带形成、细胞收缩和机械感觉相关基因表达的韧带层,该层与成骨细胞之间有着强烈的配体-受体相互作用[50, 51]。细胞外基质在结缔组织中最为丰富,并能够响应外界的机械刺激来改变自身的硬度。然而,目前许多有关细胞外基质机械传导的研究广泛集中在躯干骨上而非颅骨上。Barreto等[79]研究表明,细胞外基质硬度的增加可以提高细胞成骨谱系分化和骨形成,来自闭合处的颅缝细胞比开放处的颅缝细胞具有更高的硬度敏感性,表明细胞外基质的硬度与颅缝早闭有着密切联系。颅骨中的机械刺激传导与整合素也有着密切关联。Jin等[80]的体外研究表明,流体剪切力可以提高颅骨中成骨细胞表面整合素的表达量。细胞在响应机械刺激后也会反过来改造细胞外基质的机械和结构特性,机械刺激允许细胞通过表达生长因子和细胞外基质分泌物改变其微环境。Jiang等[69]研究发现,颅缝中结蹄组织生长因子在机械力作用下高表达;Takeshita等[81]研究同样发现,机械环境下颅缝中结蹄组织生长因子和血管内皮生长因子的高表达;Li等[77]研究发现,颅缝中成纤维细胞在机械应变下表达了许多细胞外基质相关基因。
3.2 初级纤毛介导的机械调控
初级纤毛(primary cilia)是一种存在于大多数细胞表面类似天线的细胞器,参与细胞间信号传导、感受环境机械刺激。前成骨细胞和骨细胞顶端表面突出的初级纤毛能够通过特定的受体和机械敏感通道感知骨诱导刺激并转导它们以激活细胞内成骨级联反应[82, 83]。纤毛内的结构变异会导致颅面畸形,比如Bardet-Biedl综合征(Bardet-Biedl syndrome,BBS)主要由编码BBS蛋白质复合体BBSome的基因突变引发。从非综合征颅缝早闭患者中分离出的间充质细胞表现出BBS9的表达失调,导致纤毛无法正确感知和响应来自周围环境的机械刺激[84];Fuz蛋白参与鞭毛内运输过程,Fuz的突变会干扰Hh通路的正常传导,引发颅缝早闭等表型[85];对颅缝早闭中鉴定的基因的研究也将91个基因中的18个映射到纤毛功能中[86]。因此,纤毛功能障碍似乎与颅缝病变密切相关,特别是颅缝早闭。多囊蛋白(polycystin,PC)是一种定位于初级纤毛的跨膜蛋白家族,由PC1和PC2组成,可感知机械信号并转化为胞质内生化信号,激活多种信号转导途径[87]。PC1和PC2在小鼠成骨细胞和骨细胞表达,PC1缺陷小鼠在外力刺激下骨生成受限[88, 89]。有研究[90-92]表明,机械负荷通过增强PC1-JAK2-STAT3、PC1-CaN-NFAT以及PC1-AKT-β-Catenin信号轴,促进成骨细胞分化和骨形成。最近,对人颅缝早闭细胞的体外研究[93]中发现,被抑制的PC1还可激活PI3K-AKT-mTOR2通路来抑制颅缝细胞增殖和迁移;另外一项研究[94]则发现,对PC1激活则增强了ERK信号来提高RUNX2基因表达促进成骨分化。
3.3 Piezo1机械敏感蛋白介导的机械调控
Piezo1是一个精密的机械敏感阳离子通道,能被各种形式的机械刺激激活,有助于细胞对周围组织的触摸、压力或拉伸做出反应[95]。激活状态下的Piezo1介导Ca2+流入胞质以启动下游Ca2+信号传导,Ca2+内流可导致CaMKII磷酸化并激活CREB,促进成骨细胞分化。Sun等[96]研究发现,Piezo1有助于成骨细胞对显微镜探针戳的机械刺激做出反应,特异性敲除成骨细胞中Piezo1的小鼠(OC-Cre;Piezo1f/f)表现出颅骨闭合不完全,发育迟缓。此外,敲除小鼠的成骨细胞中CaMKII和CREB的磷酸化明显降低,参与成骨细胞分化的关键转录因子RUNX2和ATF4在敲除小鼠成骨细胞中被下调。目前,在小鼠四肢的研究[97]中发现,Piezo1/2依赖于NFAT-YAP1-ß-catenin信号通路传递介导骨形成所必需的机械信号,由于Piezo1敲除小鼠具有颅骨缺陷,推测在小鼠颅骨中可能存在相同的机制来介导骨形成,并且通过抑制Piezo1机械感知可能有助于改善颅缝早闭。
4 问题与展望
颅缝早闭发生可被多种内外因素诱导,因此颅缝早闭分为多种类型。绝大多数颅缝早闭患者的共性表现为颅缝处骨生成增加,过度的成骨细胞分化导致颅缝间充质干细胞储备的下降被认为是主要原因。一方面,内在遗传因素直接影响干细胞规范和分化,另一方面,来自硬脑膜和细胞外基质的信号失衡也可间接影响细胞活动,进一步加重颅缝微环境的紊乱。规范颅缝发育的重要因素不止如此,最近的研究[98]表明,颅骨中的神经系统也积极影响着颅缝发育。因此,探究其他组织对颅缝的潜在影响有助于将来更全面的认识颅缝微环境中的相互联系。
颅缝已被证明是一个典型的模型来研究细胞外力如何与细胞骨架或内在力相作用。机械信号由细胞外基质传递,并由细胞膜上特殊蛋白质或结构感知,转化为胞内化学信号,引发细胞反应。基于干细胞的治疗已被证明有助于颅缝的通畅,阻断成骨倾向的药物治疗效果显著以及经缝牵引成骨技术也被用于颅缝早闭的矫正,尽管研究和技术进步改善了颅缝早闭的临床治疗,但这种疾病的治疗仍具有挑战性。鉴于颅缝早闭的病因复杂,需要进行更多的研究来阐明这一重要关系。

