磺胺间二甲氧嘧啶纳米抗体免疫磁珠的制备及其鉴定
程小容, 赵 琳, 王 迪, 王雅婷, 杨雅匀, 古少鹏, 何金鑫*
(1)山西农业大学动物医学学院预防兽医系公共卫生学实验室,山西 太谷 030801;2)南江县农业农村局,四川 南江 635600)
磺胺间二甲氧嘧啶(sulfadimethoxine,SDM)是一种抗菌谱广的磺胺类药物,因其在水产和畜牧业中的过度使用,对食品安全和人类健康构成潜在威胁[1],因此,对其残留量进行检测是十分有必要的。目前,我国磺胺类药物的检测方法仍是高效液相色谱法,虽然其检测灵敏度高,但是样品前处理复杂,利用抗体和磁小体制备免疫磁珠,快速富集样品中的SDM,对提高SDM的检测效率具有重要意义。
近年来研究发现,趋磁细菌(magnetotactic bacterium,MTB)体内能够合成一种称为磁小体(bacterial magnetic particles,BMPs)的磁性纳米颗粒,其粒径分布范围窄、磁靶向性低和晶型稳定且成分单一[2,3],程等人[4]研究发现,BMPs的性能比常规磁颗粒优良,可作为免疫磁珠的优良载体。BMPs表面被一层生物膜包被[5],为其表面功能基团偶联提供了大量修饰位点。基于BMPs这一特性,许多研究利用酶、抗体、核酸和多肽等对其进行修饰[6]。例如,He等人[7]将纳米抗体(nanobody,Nb)定向固定在BMPs上制备免疫磁珠,用于检测环境中的TBBPA。与传统抗体相比,Nb具有溶解性好、亲和力高、稳定性强和易表达等优点[8,9],Wu等人[10]将噬菌体库淘选出的抗流感弧菌脂多糖Nb用于合成免疫磁珠,结果发现,免疫磁珠对流感弧菌的富集高达90.7%±3.2%。连接肽(linker)是连接2个或多个蛋白质之间的氨基酸序列,最常用的柔性连接肽是由甘氨酸(Gly)和丝氨酸(Ser)构成的一类易弯折的氨基酸序列,常见为(G4S)n重复序列[11,12]。连接肽最重要的指标是氨基酸链的长度,过长或过短的连接肽均会影响融合物的稳定性与活性[13]。基于Nb和BMPs研制的免疫磁珠,具有良好的应用前景,然而两者间的连接肽对免疫磁珠性能的影响尚不清晰。为了探究连接肽长度对免疫磁珠性能的影响,本研究利用基因工程技术,在anti-SDM Nb的C端融合不同长度的连接肽,将其与BMPs进行偶联,检测免疫磁珠的性能差异,为今后选择具有合适长度的连接肽提供理论依据,为SDM的残留检测提供物质支撑。
1 材料与方法
1.1 材料
1.1.1 菌株、质粒 大肠杆菌BL21(DE3)和质粒pET28a;质粒pH-17和趋磁细菌(MTB)发酵产物,分别惠赠于中国农业大学动物医学院王战辉老师和生物学院田杰生老师。
1.1.2 试剂 eECL Western Blot Kit高灵敏度化学发光检测试剂盒购自康为世纪生物科技有限公司;3-(2-吡啶二巯基)丙酸N-羟基琥珀酰亚胺酯(N-succinimidyl-3-(2-pyridyldithiol)propionate,SPDP)购自默克化工技术(上海)有限公司;限制性内切酶EcoR I、XhoI、T4 DNA 连接酶(TaKaRa,北京);蛋白质标记物(marker)购自武汉爱博泰克生物科技有限公司;D2000 plus DNA Ladder购自中科瑞泰生物科技有限公司;小鼠抗6His单克隆抗体(mIgG-HRP)购自武汉三鹰生物技术有限公司;卡那霉素(Kana)、蛋白质上样缓冲液购自生工生物工程(上海)股份有限公司;PCR Mix、异丙基-β-D-硫代半乳糖苷(IPTG)、BCA蛋白质定量试剂盒购自上海阿拉丁生化科技股份有限公司。其余常用试剂均为国产分析纯。
1.2 方法
1.2.1 构建与鉴定pET28a-Nb-(G4S)1-Cys、pET28a-Nb-(G4S)4-Cys 2种表达载体 依据anti-SDM Nb的基因序列,通过Primer 5.0软件分别设计PCR引物(F-SDM-(G4S)1-EcoR I:5′-CGAATTCCAGGTGCAGCTCGTGGAG-3′,R-SDM-(G4S)1-XhoI:5′-CCTCGAGTCAGCACGATCCGCCACCGCCAAGC TTCGAGGAGACGGTGACCTGG-3′;F-SDM-(G4S)4-EcoR I:5′-CGAATTCCAGGTGCAGCTCGTGGAG-3′,R-SDM-(G4S)4-XhoI:5′-CCTCGAGTCAGCACGAT CCGCCACCGCCCGATCCGCCACCGCCCGA TCCGCCACCGCCCGATCCGCCACCGCCAAGCTTCG AGGAG ACGGTGACCTG-3′)。以pH-17质粒为模板,利用上述引物进行PCR扩增,获取Nb-(G4S)1-Cys、Nb-(G4S)4-Cys 2种基因片段,将基因片段进行胶回收。使用高纯度质粒小提试剂盒提取BL21(DE3)-pET28a菌液中的pET28a质粒,将目的基因和质粒使用EcoRⅠ和XhoⅠ进行双酶切,在37 ℃水浴锅中放置3 h,待酶切完全,将酶切产物置于75 ℃水浴锅中放置10 min灭活并进行胶回收,将胶回收后的pET28a质粒分别与Nb-(G4S)1-Cys、Nb-(G4S)4-Cys 2种基因片段连接,构建pET28a-Nb-(G4S)1-Cys、pET28a-Nb-(G4S)4-Cys 2种表达载体。将构建的表达载体转入BL21(DE3)感受态中,置于含卡那霉素抗生素的固体培养基上划线培养,将长出的单克隆菌扩大培养,提取质粒,使用EcoRⅠ和XhoⅠ酶对提取的重组质粒进行双酶切验证,将验证成功的质粒进行测序,若结果与预期相符,则表明载体构建成功。
1.2.2 制备anti-SDM Nb-(G4S)1-Cys、Nb-(G4S)4-Cys重组蛋白质 将测序正确的2种重组菌划线培养,挑取单菌落过夜培养,吸取1 mL的菌液置于100 mL LB液体培养基中,培养3 h,待菌液OD600为0.4~0.6时,加入0.8 mL 100 mmol/mL的IPTG于BL21(DE3)-pET28a-Nb-(G4S)1-Cys菌液中,加入0.5 mL 100 mmol/mL的IPTG于BL21(DE3)-pET28a-Nb-(G4S)4-Cys菌液中,诱导培养11 h,离心弃上清,加入PBS重悬,离心弃上清,重复此操作1次,将洗涤后的沉淀溶于10 mL PBS中,在低温下超声破碎40 min,9 000 r/min离心20 min,将离心后的沉淀依次用包涵体洗涤液I、II、III、包涵体溶解液进行处理,再置于尿素浓度依次为6 ,4 ,2 ,0 mol/L的PBS溶液中进行复性。将得到的2种纯化蛋白质进行SDS-PAGE鉴定。
1.2.3 提取BMPs 将MTB置于含PBS的小烧杯中,充分混匀,低温条件下进行细胞破碎,超声3 s,间隔5 s,运行30 min,将破碎后的MTB置于磁铁上吸附过夜,使BMPs沉降,待BMPs全部沉降于烧杯底部,弃去上清,每天反复3次,直至上清中蛋白质浓度小于0.1 ng/mL,将提取的BMPs置于4 ℃保存。
1.2.4 构建和优化anti-SDM Nb免疫磁珠 称取2份1 mg的BMPs,置于含PBS的2 mL EP管中,静置于磁力架上,待固液分离后弃去液体,加入1 mL pH为8.0的PBS,80 W超声10 min,静置分层后,弃去上清,重复上述步骤,反复3次。将溶解在20 μL DMF中的SPDP加入到EP管中,超声混匀后,置于220 r/min摇床上孵育2 h,静置分层,弃去上清,加入1 mL pH为7的PBST,80 W超声10 min,静置弃去上清,反复3次,将1 mg anti-SDM Nb-(G4S)1-Cys和Nb-(G4S)4-Cys分别加入到BMP-SPDP中,超声并置于摇床上孵育2 h,置于磁力架上静置分层,弃去上清,加入1 mL pH为8.0的PBST,80 W超声10 min,静置后弃去上清,反复3次,加入1 mL PBS,4 ℃保存备用。利用公式计算偶联效率:偶联效率=(C1-C2)×V/M(C1表示Nb与BMPs反应之前的浓度;C2表示Nb与BMPs反应后的浓度;V表示与BMPs反应时的溶液体积;M表示参与偶联反应的BMPs重量)。
将构建的2种免疫磁珠各取10 μL,加入5 μL上样缓冲液处理后,离心取上清,进行SDS-PAGE凝胶电泳,使用转膜仪将凝胶上的样品转移至PVDF膜上,使用小鼠抗6His单克隆抗体(mIgG-HRP)对膜上的目的蛋白质进行验证,初步判定免疫磁珠是否构建成功。将WB验证成功的免疫磁珠用ddH2O清洗,用透射电镜和Zeta电位分析仪分析BMPs偶联前后水合粒径、Zeta电位和分散性差异。
为了提高Nb和BMPs的偶联效率,设置了不同的孵育时间(30、60、90、120、150 min),通过计算偶联效率选取最佳孵育时间,在最佳孵育时间下将BMPs与1 mL不同浓度的SDM Nb(0.1、0.5、1.0、1.5 mg/mL)进行孵育,根据偶联效率,选取最佳孵育浓度。
1.2.5 统计学分析 使用透射电镜分析BMPs、BMP-(G4S)1-Nb和BMP-(G4S)4-Nb粒径,每种磁颗粒置于三种不同视野下,使用GraphPad Prism 8.0对统计数据进行多组间两两比较,采用one-way ANOVA进行分析,其中P<0.05有统计学意义。*P<0.05表明差异显著,**P<0.01和***P<0.001代表差异极显著。
2 结果
2.1 pET28a-Nb-(G4S)1-Cys、pET28a-Nb-(G4S)4-Cys表达载体的构建与鉴定
以pH-17质粒为模板,进行PCR扩增,结果正如Fig.1A所示,anti-SDM Nb-(G4S)1-Cys基因在405 bp处呈现,而anti-SDM Nb-(G4S)4-Cys在450 bp处有单一明亮条带,使用高纯度质粒小提试剂盒提取过夜培养的BL21(DE3)-pET28a中的pET28a质粒。将验证成功的基因和pET28a质粒进行双酶切,质粒呈现出单一条带(Fig.1B),证明质粒酶切成单一的链状结构,基因经酶切后条带依然明亮,证明酶切后的基因浓度依然很高,有利于后续载体的构建。将基因和质粒过夜连接,构建出pET28a-Nb-(G4S)1-Cys、pET28a-Nb-(G4S)4-Cys 2种表达载体,对两者进行双酶切验证,结果正如图Fig.1C所示,pET28a-Nb-(G4S)1-Cys表达载体呈现出5 300 bp和405 bp 2条带,pET28a-Nb-(G4S)4-Cys表达载体呈现出5 300 bp和450 bp 2条带,二者均未见明显杂带,证明选取的表达载体初步构建成功。
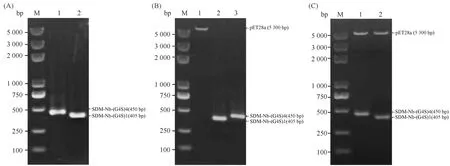
Fig.1 Identification of pET28a-SDM-Nb-(G4S)1-Cys and pET28a-SDM-Nb-(G4S)4-Cys plasmids The pH-17 plasmid containing Nb gene against SDM was used as the template for PCR amplification. The pET28a and anti-SDM gene were double-digested with EcoR I and Xho I. Then, the gene and plasmid were recovered and linked with T4 DNA ligase. (A) Amplification of anti-SDM Nb-(G4S)1-Cys and Nb-(G4S)4-Cys by PCR. Line M: DNA Marker; Line 1: anti-SDM Nb-(G4S)4-Cys fragment; Line 2: anti-SDM Nb-(G4S)1-Cys fragment; (B) Digestion of anti-SDM Nb and pET28a by EcoR I and Xho I. Line M: DNA Marker; Line 1: pET28a; Line 2: anti-SDM Nb-(G4S)1-Cys fragment; Line 3: anti-SDM Nb-(G4S)4-Cys fragment; (C) Digestion of pET28a-SDM-Nb-(G4S)1-Cys and pET28a-SDM-Nb-(G4S)4-Cys by EcoR I and Xho I. Line M: DNA Marker; Line 1: Digestion of pET28a-SDM-Nb-(G4S)4-Cys by EcoR I and Xho I; Line 2: Digestion of pET28a-SDM-Nb-(G4S)1-Cys by EcoR I and Xho I
2.2 Anti-SDM Nb-(G4S)1-Cys、SDM Nb-(G4S)4-Cys重组蛋白质的制备
重组菌BL21(DE3)-pET28a-Nb-(G4S)1-Cys在0.8 mmol/mL IPTG浓度下进行诱导表达,重组菌BL21(DE3)-pET28a-Nb-(G4S)4-Cys在0.5 mmol/mL IPTG浓度下进行诱导表达,结果发现,二者都以包涵体的形式进行表达,对超声破碎的沉淀进行包涵体蛋白质的纯化和复性,取10 μL纯化后的蛋白质,使用上样缓冲液处理,进行SDS-PAGE验证,结果如Fig.2 所示,anti-SDM Nb-(G4S)1-Cys在12.5 kD处有明显条带,anti-SDM Nb-(G4S)4-Cys在14.1 kD处有明显条带。纯化出的样品SDS-PAGE图上都无明显杂带,证明样品中杂蛋白质较少,可以满足后续实验需要。
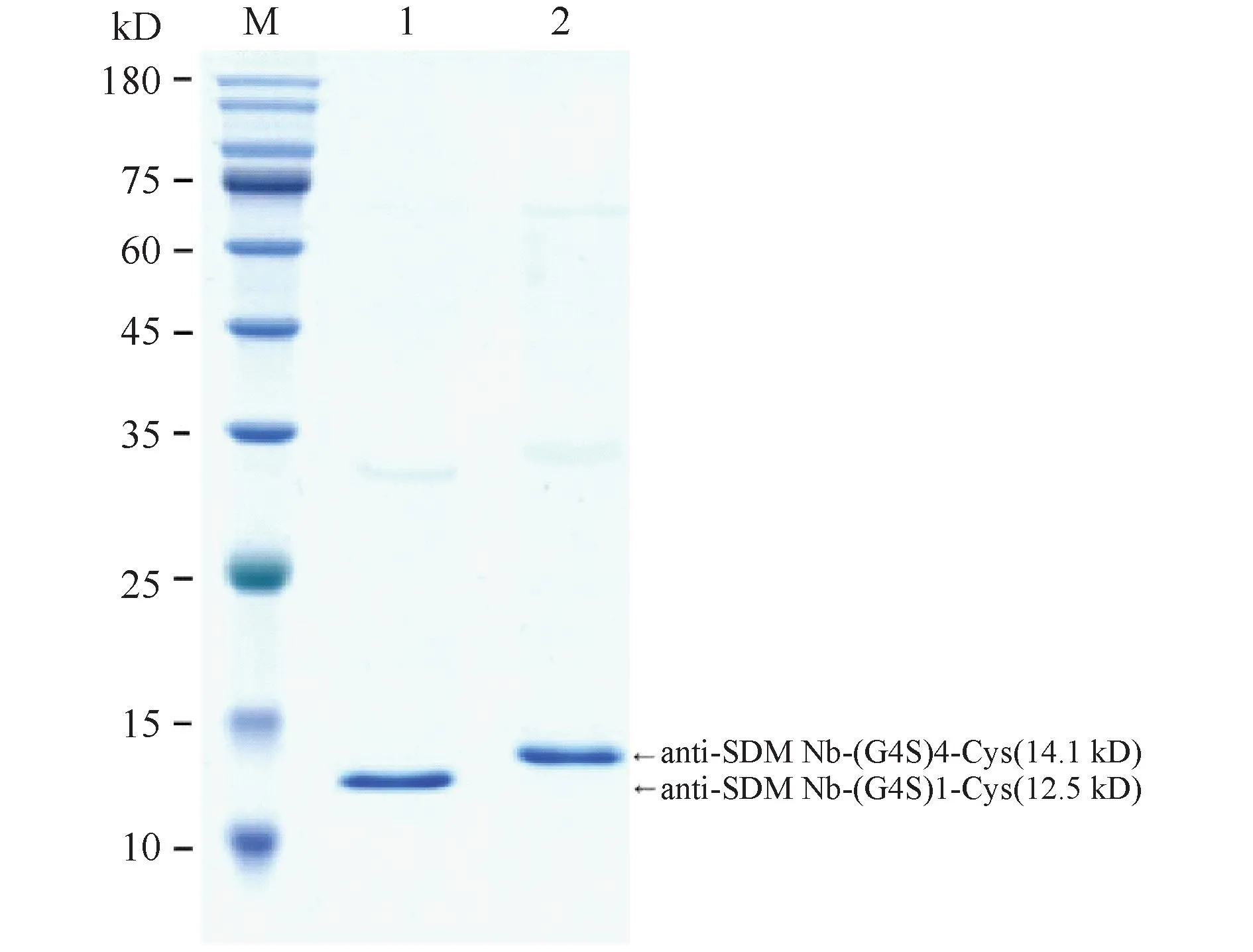
Fig.2 SDS-PAGE identifies anti-SDM Nb purification results Expression of Nb-(G4S)1-Cys and Nb-(G4S)4-Cys was performed using a final concentration of IPTG at 0.8 and 0.5 mmol/mL, respectively. Line M: protein marker; Line 1: anti-SDM Nb-(G4S)1-Cys; Line 2: anti-SDM Nb-(G4S)4-Cys
2.3 Anti-SDM Nb免疫磁珠的构建
用BMPs作为空白对照,将构建的2种免疫磁珠经高温处理,进行Western 印迹验证,结果如Fig.3所示,泳道2无任何反应,证明BMPs不影响研究结果的判断,而泳道1在12.5 kD呈现出单一条带,泳道3在14.1 kD处有明显反应,二者皆与预期结果相符,结果表明,2种蛋白质皆偶联到BMPs上,初步判定2种免疫磁珠构建成功。

Fig.3 Identification of immunomagnetic beads by Western blotting The samples were separated by SDS-PAGE and transferred to PVDF membrane. The target proteins were then confirmed by respective antibodies. BMPs were used as a blank control. Line M: Protein Marker; Line 1: BMP-(G4S)1-Nb; Line 2: BMPs; Line 3: BMP-(G4S)4-Nb
对SDM Nb-(G4S)1-Cys的孵育时间和孵育浓度进行优化,结果如图Fig.4所示,当孵育30、60、90 min时,随着孵育时间的增加,偶联效率增加,当孵育时间达到120 min时,偶联效率达到最高值,若孵育时间继续增加,偶联效率反而降低,所以SDM Nb-(G4S)1-Cys的最佳孵育时间为120 min。当将1 mg的BMPs与不同浓度的Nb-(G4S)1-Cys孵育120 min时,从Fig.4B显示,当SDM Nb-(G4S)1-Cys的浓度为1 mg/mL时,二者偶联效率最高,1 mg BMPs可偶联726±17 μg SDM Nb-(G4S)1-Cys。当BMPs和SDM Nb-(G4S)4-Cys孵育不同时间时,从Fig.4C中显示,当孵育120 min时,偶联效率最高,在最佳孵育时间下,不同浓度的Nb-(G4S)4-Cys与1 mg BMPs孵育,结果发现,1 mg Nb-(G4S)4-Cys与1 mg BMPs进行孵育时,偶联效率最高,1 mg BMPs可与692±15 μg SDM Nb-(G4S)4-Cys偶联。

Fig.4 The linking ratios of BMPs and Nb-(G4S)1-Cys/Nb-(G4S)4-Cys (A) The linking ratios of SDM Nb-(G4S)1-Cys and BMPs at different times, with 1 mg SDM Nb-(G4S)1-Cys and 1 mg BMPs being incubated; (B) The linking ratios of Nb-(G4S)1-Cys and BMPs after 2 h incubation; (C) The linking ratios of Nb-(G4S)4-Cys and BMPs at different times, with 1 mg SDM Nb-(G4S)4-Cys and 1 mg BMPs being incubated; (D) The linking of different ratios of SDM Nb-(G4S)4-Cys and BMPs after 2 h incubation
2.4 anti-SDM Nb免疫磁珠的表征
取微量BMPs进行透射电镜分析,先将Nb-(G4S)1-Cys/Nb-(G4S)4-Cys与BMPs进行偶联,再取微量样品进行透射电镜观察,结果显示,BMP-(G4S)1-Nb和BMP-(G4S)4-Nb颗粒与颗粒之间的空隙较大,几乎皆是单分散颗粒,与BMPs空白对照组在形态上无明显区别(Fig.5A,B,C),BMP-(G4S)1-Nb和BMP-(G4S)4-Nb的粒径分布均匀,在20 ~ 60 nm之间,粒径大小为30 ~ 40 nm的居多,将BMP-(G4S)1-Nb和BMP-(G4S)4-Nb粒径与空白对照组BMPs粒径进行统计学分析,皆无显著性差异(Fig.D),说明BMPs与SDM Nb偶联后,对BMPs的形态并未造成影响。
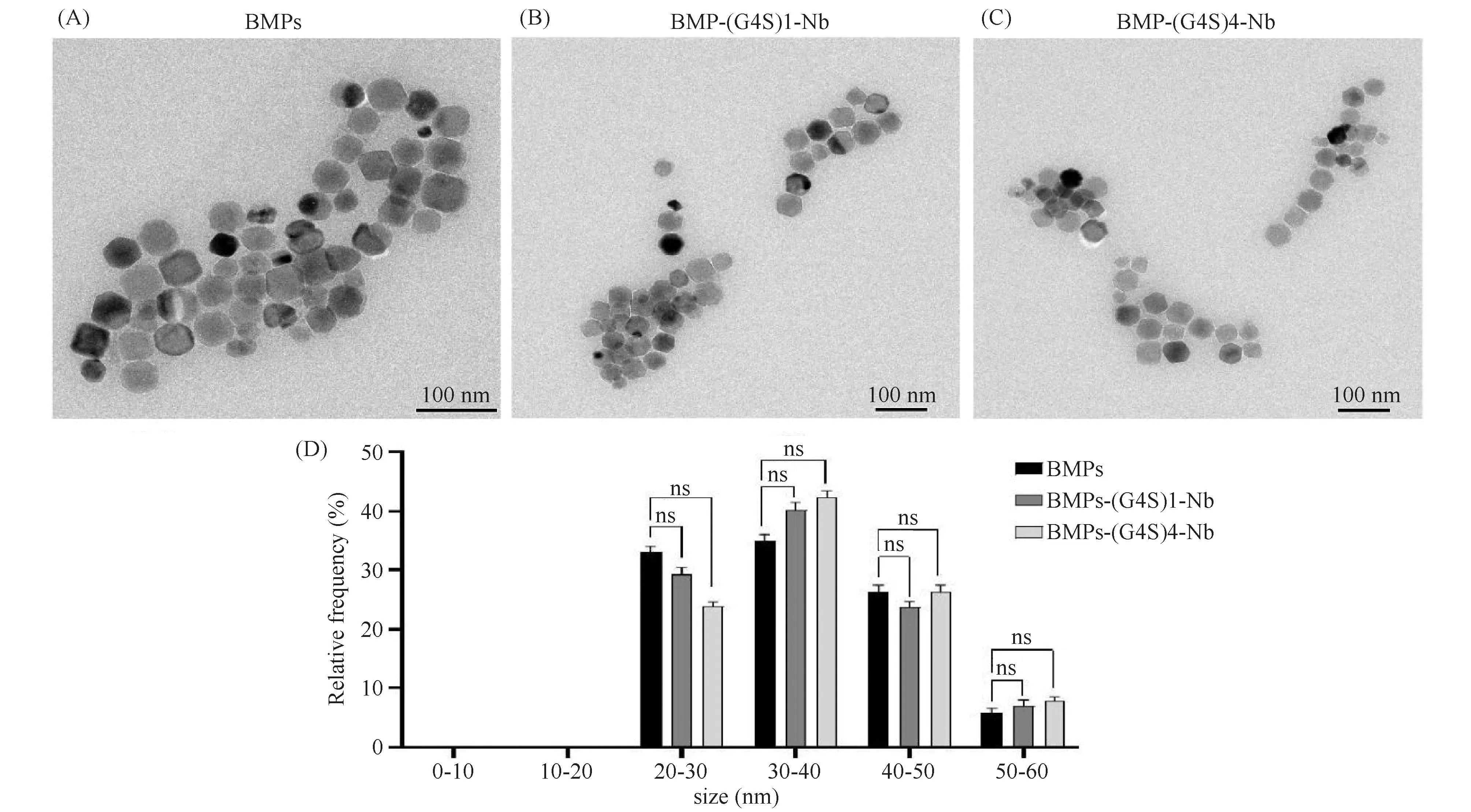
Fig.5 Electron microscopy of magnetic particles After the immunomagnetic beads were cleaned with ddH2O, they were dried under infrared light and observed by transmission electron microscopy. (A) BMPs; (B) BMP-(G4S)1-Nb; (C) BMP-(G4S)4-Nb; (D) The size distribution of BMPs、BMP-(G4S)1-Nb and BMP-(G4S)4-Nb
以BMPs作为空白对照,用Zeta电位分析仪对BMPs、BMP-(G4S)1-Nb和BMP-(G4S)4-Nb的水合粒径、Zeta电位及分散性进行分析,结果如Table 1所示,—30 mV或+30 mV一般作为水相稳定的分界线,Zeta电位高于+30 mV或低于-30 mV,则表明所形成的分散体系较稳定,BMP-(G4S)1-Nb和BMP-(G4S)4-Nb的Zeta电位皆低于-30 mV,说明二者的水相胶体皆比较稳定,BMP-(G4S)1-Nb的Zeta电位绝对值更高,水合粒径更小,多分散性指数低,综上表明,BMP-(G4S)1-Nb在水相体系中胶体稳定性更强。
3 讨论
磺胺类药物因具有价格低廉、抗菌谱广等优点,而广泛应用于预防和治疗养殖业中的疾病,但其会通过食物链进入人体[14],许多国家对食品中磺胺类药物的残留做出了相关规定。有的国家甚至对不同磺胺药的残留量进行限定,这就对检测磺胺类药物的免疫分析法提出更高的要求。寻根究底是需要制备兼具高特异性和高亲和力的识别材料。由于磺胺类药物具有高度相似的结构[15],只制备针对某一种磺胺类药物的高特异性多克隆抗体和单克隆抗体非常困难,所以本文选择利用基因工程技术,制备具有巨大应用潜力的Nb,与传统抗体相比,纳米抗体不仅尺寸较小、特异性高和理化性质稳定,而且利用微生物生产表达时无需翻译后修饰,可实现大规模生产,显著降低生产成本[9]。
Nb与新型材料的结合会提高检测的灵敏度,20世纪70年代,美国工作者发现并报道了MTB[16],BMPs是一种由其在胞内合成的生物膜包被的纳米磁性材料[17],因为其具有独特的特征,例如顺磁性、纳米级尺寸(40~120 nm)和高分散性,且被稳定的细胞质膜覆盖,被认为具有良好的生物相容性[18],因此,BMPs能够轻松地与蛋白质和基因结合,具有各种技术应用的潜力,使用其作为载体不仅高富载,而且复合物易于从溶液中分离。本文选用BMPs作为载体,Nb作为免疫配基制备免疫磁珠,通过Western印迹初步验证发现,BMPs上偶联有纳米抗体,随后,本文对孵育时间和孵育浓度进行优化,结果发现,最佳孵育时间是120 min,最佳孵育浓度为1 mg BMPs分别与1 mg/mL Nb-(G4S)1-Cys、1 mg/mL Nb-(G4S)4-Cys进行孵育,在最优条件下,1 mg BMPs可与726±17 μg Nb-(G4S)1-Cys偶联,1 mg BMPs可与692±15 μg SDM Nb-(G4S)4-Cys偶联,偶联效率的不同是因二者之间的连接肽长度不同,连接肽是基因融合技术成功实现的重要技术手段,借助一段合适的核苷酸序列将目的基因连接起来,其在生物体内表达成为一条单一的肽段[19]。主要分为刚性连接肽和柔性连接肽,柔性连接肽即成柔软线性的一类易弯折的氨基酸序列,常见为(G4S)n重复序列,因其柔软性好和亲水性强,所以本文选择在Nb的末端引入柔性连接肽,使Nb更好的展示在BMPs上。
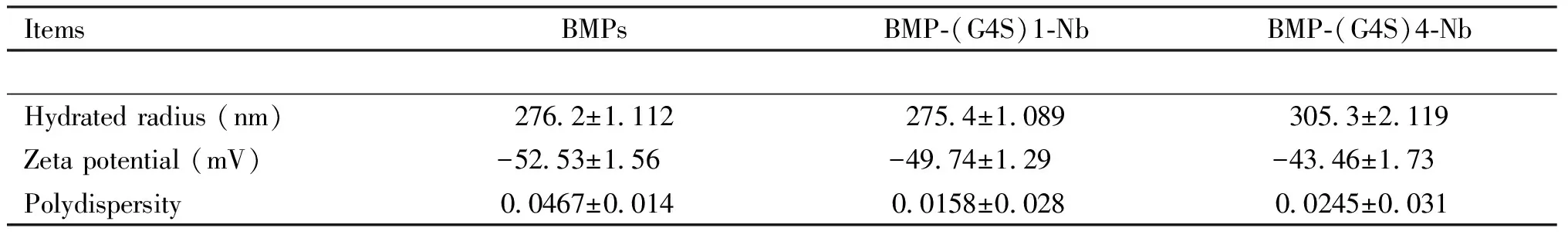
Table 1 Hydration radius, potential and dispersion of immunomagnetic beads
长度是选择连接肽时主要考虑的因素,本文在anti-SDM Nb的C端引入(G4S)1、(G4S)4 2种长度的柔性连接肽,对2种抗体构建的免疫磁珠偶联效率进行比较,结果发现,(G4S)1具有更高的偶联效率,免疫磁珠表征发现,BMP-(G4S)1-Nb的Zeta电位绝对值更高,水合粒径更小,多分散性指数低(BMP-(G4S)1-Nb的水合粒径为275.4±1.089,Zeta电位为-49.74±1.29 mV,分散性为0.0158±0.028;BMP-(G4S)4-Nb的水合粒径为305.3±2.119,Zeta电位为-43.46±1.73 mV,分散性为0.0245±0.031),BMP-(G4S)1-Nb在水相体系中胶体稳定性更强。综上所述,BMP-(G4S)1-Nb免疫磁珠的性能优于BMP-(G4S)4-Nb,本研究制备的2种免疫磁珠皆可用于快速检测养殖环境和动物产品中的SDM,为今后选择具有合适长度连接肽提供理论依据。

