造血前列腺素D合酶功能及其在过敏性疾病中的作用
樊易简, 刘羽辰, 初 明
(北京大学医学部基础医学院免疫学系, 北京 100191)
过敏性疾病是特应性个体暴露于过敏原后导致的一种慢性非感染性炎症性疾病,可以累及全身多个系统和器官,严重影响患者的工作和生活。常见的过敏性疾病主要包括特应性皮炎、食物过敏、过敏性哮喘、过敏性鼻炎、嗜酸性食管炎等。特应性皮炎患病率在全球范围内差异很大,年龄小于18岁人群中患病率约为0.2%~36.0%[1],成人患病率约为1.2%~9.7%[2]。过敏性哮喘患者人数在全球超过3.582 亿[3]。其中,我国20岁以上人群过敏性哮喘患病率达到4.2%,患者总数达4 570万[4]。近年来,过敏性疾病的患病率急剧升高,被世界卫生组织列为21世纪重点防治的三大疾病之一。因此,迫切需要寻找过敏性疾病发病的关键靶点,从而研发治疗过敏性疾病的药物,以控制过敏性疾病的发病。
2000年,Urade等[5]分离纯化出造血前列腺素D合酶(hematopoietic prostaglandin D synthase, HPGDS),并采用X射线衍射方法解析了HPGDS的晶体结构。进一步研究发现,HPGDS是一种谷胱甘肽转移酶,广泛地表达于外周组织中,能够催化前列腺素D2(prostaglandin D2, PGD2)的生成[6]。PGD2能够活化Th2细胞、浆细胞和肥大细胞等,促进免疫细胞的趋化和更多PGD2的分泌,导致过敏反应的发生和加剧。已有研究表明,靶向HPGDS的药物HQL-79在治疗过敏性气道炎症中取得一定的进展[7],提示靶向HPGDS的药物能够治疗过敏性疾病。因此,本文综述了HPGDS在特应性皮炎、食物过敏、过敏性哮喘、过敏性鼻炎和嗜酸性食管炎中的研究进展,为研发治疗过敏性疾病的药物提供新的思路。
1 造血前列腺素D合酶的结构与功能
HPGDS,造血前列腺素D合酶,替代名称包括谷胱甘肽 S-转移酶、谷胱甘肽依赖性PGD合酶等,是前列腺素 D2 合酶(prostaglandin D synthase, PGDS)的一种。PGDS分为脂质运载蛋白型前列腺素D合酶(lipocalin-type prostaglandin D synthase, LPGDS)和造血前列腺素合酶两种类型。LPGDS 是一种N-糖基化蛋白质,由多种分泌蛋白质组成,其参与反应需要游离的巯基化合物,但不依赖于谷胱甘肽。Se4+、 N-乙基马来酰亚胺(NEM)和碘乙酰胺等能够抑制LPGDS活性,低浓度盐酸胍或尿素能够激活LPGDS活性[8]。HPGDS是谷胱甘肽(GSH)依赖性的造血PDG合酶。其整体结构与其他谷胱甘肽巯基转移酶(GST)的结构相似,但在 GSH 结合位点附近的宽裂缝内具有独特的催化位点[9]。Ca2+、Mg2+等二价金属离子通常结合在同二聚体的亚基之间,随浓度增高会将HPGDS活性提高到基础水平的150%。
HPGDS由hpgds基因转录而成,该基因也称为GSTS、PGDS或PTGDS2,位于4号染色体长臂上。HPGDS属于谷胱甘肽巯基转移酶 (GST)超家族,由199个氨基酸构成。HPGDS在细胞质内发挥催化作用需要依赖于谷胱甘肽的活性,其主要功能是催化前列腺素H2(prostaglandin H2, PGH2)转化为PGD2,并促进谷胱甘肽与各种芳基卤化物和有机异硫氰酸酯的结合[6]。HPGDS的表达有组织特异性。HPGDS在多种组织中都有表达:在脂肪组织和胎盘中高度表达[10],在心[11]、肺、淋巴结、阑尾和骨髓等中以较低水平表达。此外,HPGDS也存在于人类蜕膜着床部位的滋养层细胞、子宫上皮和子宫内膜腺体,以及杜氏肌营养不良症或多发性肌炎患者坏死肌纤维[5]。HPGDS广泛分布于外周组织,在多数巨核细胞系中表达,主要定位于抗原呈递细胞、肥大细胞和Th2淋巴细胞等免疫细胞。肥大细胞是过敏反应发生时的关键细胞。在过敏反应发生时,肥大细胞中HPGDS富集,PGD2含量上升[12];树突状细胞和Th2细胞也高表达HPGDS,部分Th2细胞表达HPGDS下游细胞因子前列腺素D2受体(chemoattractant receptor-homologous molecule, CRTH2)[13]。在急性肺部炎症中,单核细胞衍生的巨噬细胞高表达HPGDS 并释放大量PGD2,但外周血单核细胞分泌PGD2明显多于巨噬细胞,二者均为PGD2的重要来源[14]。
2 造血前列腺素D合酶的生理作用
HPGDS的主要功能是催化PGH2转化为PGD2[6],PGD2能够诱导过敏反应的发生。在机体内外环境条件刺激下,细胞膜上磷脂脱落,在磷脂酶2(phospholipase 2,PLA2)作用下生成花生四烯酸,经环氧化酶(cyclooxygenase, COX)途径生成PGH2,在HPDGS作用下生成PGD2入血发挥作用。磷脂COX有2种同工酶COX1和COX2。COX1为组成型异构体,广泛存在,在正常组织中均有表达,参与机体正常生理过程和结构保护;COX2为诱导型异构体,通常在某些组织例如大脑、肾等器官中低水平表达,炎症刺激或氧化应激时因诱导而导致表达升高。当COX2占主导地位时,大量花生四烯酸参与反应导致其浓度降低。反之,当COX1占主导地位,花生四烯酸浓度较高[15]。PGH2在不同酶催化下可以生成多种产物,包括前列环素(prostacyclin 2, PGI2)、血栓素B2(thromboxane B2, TXA2)、前列腺素E2(prostaglandin E2, PGE2)和PGD2等。PGD2由肥大细胞大量产生,一般被认为是肥大细胞标志性分子,但在树突状细胞和嗜酸性粒细胞中也有分泌[8]。PGD2通过ATP结合盒亚家族C成员4(ATP binding cassette subfamily C member 4, ABCC4)转运出细胞进入血液中,与受体DP2/CRTH2结合。DP2主要介导嗜酸性粒细胞、嗜碱性粒细胞和Th2细胞的趋化反应[16],同时也可以促进Th2细胞分泌IL-4、IL-5、IL-13和PGD2,进一步增高嗜酸性细胞活性,促进浆细胞分泌IgE作用于肥大细胞引发过敏反应。肥大细胞自身也能够分泌PGD2和白三烯等炎症因子加强过敏反应。此外,先天淋巴细胞(ILC2)也存在CRTH2受体,经IL-2、IL-25等刺激ILC2中COX2和HPGDS上调[17],且内源性PGD2的生成对ILC2 的激活是必不可少的。PGD2还能够与血栓素A2受体(thromboxane A2 receptor, TP)结合促进支气管平滑肌收缩;与抑制性受体DP1(D-prostanoid receptor 1, DP1)结合激活腺苷酸环化酶,促进支气管血管舒张,但两者都不是主要作用(Fig.1)。
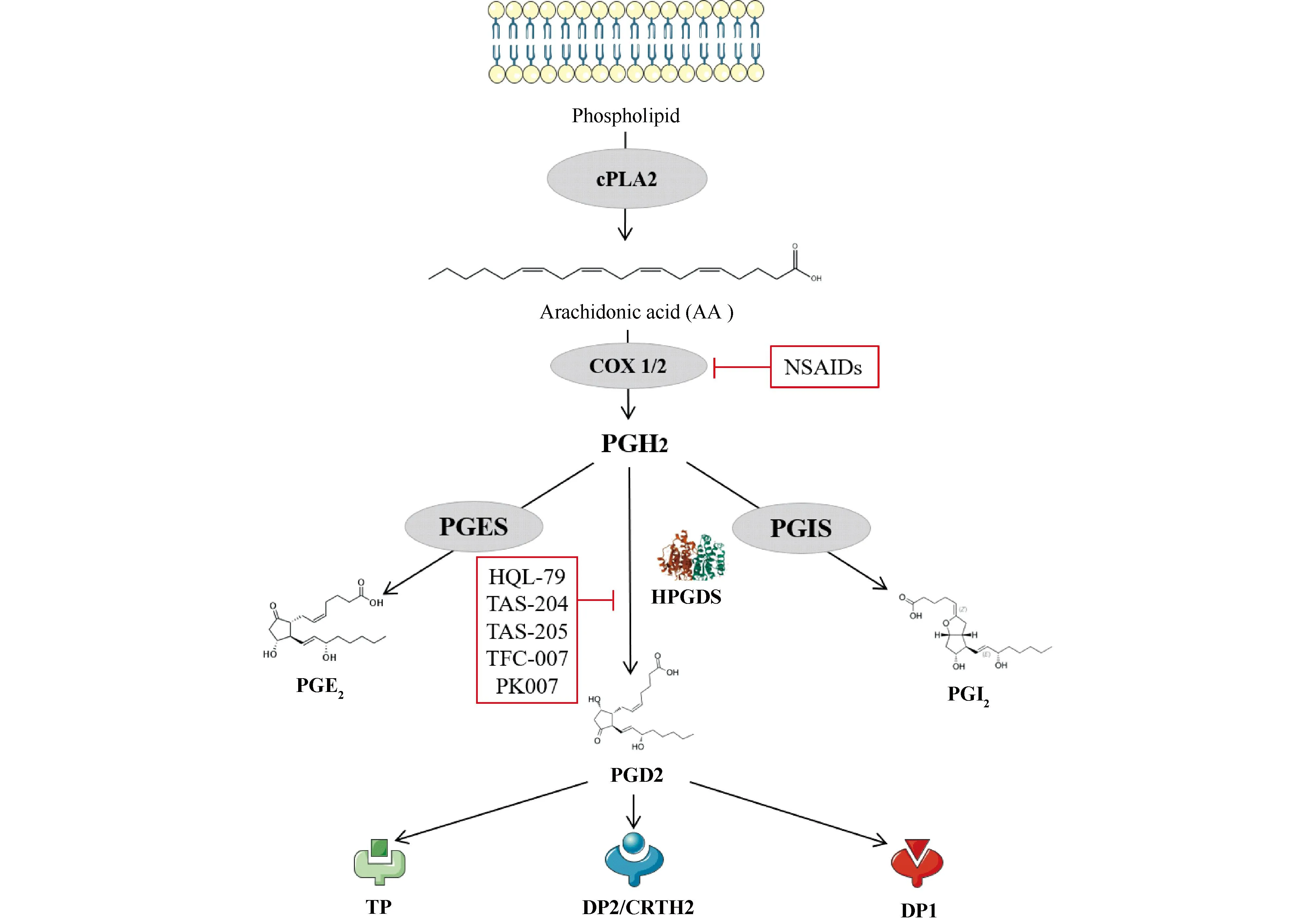
Fig.1 Biological Functions of HPGDS Phospholipids are catalyzed by phospholipase 2 to generate arachidonic acid, and then PGH2 is generated under the action of COX1/2. PGH2 is catalyzed by HPGDS to generate PGD2, which can bind to TP receptors, DP2/CRTH2 receptors, and DP1 receptors
3 造血前列腺素D合酶在过敏性疾病中的作用
HPGDS在过敏性疾病中发挥重要作用,其催化产生的PGD2能够促进过敏反应的发生发展,并通过正反馈加重过敏性疾病。在多种不同的过敏性疾病中均可以检测到体内组织HPGDS和PGD2含量升高,部分尿液中的PGD2代谢产物含量也升高。通过研究HPGDS在过敏性疾病中的作用,可以更好地了解其在疾病发生发展中的变化过程和重要作用,对研发靶向HPGDS药物治疗过敏性疾病有重要意义。
3.1 HPGDS在特应性皮炎中的作用
特应性皮炎 (atopic dermatitis, AD) 是一种常见的慢性炎症性皮肤病,AD 的临床特征包括红斑、水肿、苔藓样变、表皮剥落、渗出和结痂,多发于婴幼儿和青少年。皮肤屏障缺陷和免疫反应改变通常被认为是疾病发展的关键组成部分[18]。HPGDS在AD发病时高表达。Sugimoto等人[19]使用在常规条件下会发生AD样皮炎的NC/Nga (NC) 小鼠进行研究,在抓挠行为下,根据免疫印迹和免疫组化分析显示,NC小鼠早期(7周)HPGDS蛋白表达较高,第13周表达量明显低于第7周。小鼠皮肤PGD2水平在早期也显著升高,后期(10~13周)由于皮肤产生PGD2能力下降,PGD2水平未见增加或略有下降,可能与HPGDS表达量降低有关。AD具有Th2免疫反应表型特征[20]。Th2 细胞能够产生 IL-4、IL-5 和 IL-13,在体液免疫等方面有重要作用,且是许多过敏性炎症疾病发病机制的核心。嗜酸性粒细胞在过敏性炎症部位浸润也与Th2细胞有关,通常会导致皮肤损伤,影响皮肤组织[21]。研究发现,人Th2细胞中HPGDS催化产生的PGD2通过自分泌方式刺激Th2细胞上的CRTH2受体,并以旁分泌方式刺激其他细胞上的CRTH2受体,其产生的PGD2仅为肥大细胞产生量的1/10,但存在生物学意义[14],能够加速过敏和炎症反应发生和进展。细胞膜上的CRTH2受体与PGD2 结合有效诱导细胞因子的产生和ILC2的迁移。因此,HPGDS可以作为抗过敏药物的靶点[8],靶向HPGDS药物可能会有效缓解特应性皮炎症状。
3.2 HPGDS在食物过敏中的作用
食物过敏是一种由特定免疫反应引起的不良健康影响,这种反应在接触特定食物时可重复发生。食物过敏产生的免疫反应包括急性过敏反应、慢性炎症性疾病,可能诱发炎症性肠病、嗜酸性食管炎等过敏性疾病[22]。食物过敏时,HPGDS在体内升高直接导致尿液中PGD2代谢产物增多。Maeda等人[23]对小鼠进行反复口服卵清蛋白致敏,出现过敏症状的小鼠尿液中PGD2代谢产物和肠肥大细胞数量成正相关。食物过敏小鼠体内增生的肥大细胞主要包括两个亚群:结缔组织型肥大细胞和粘膜型肥大细胞。两种类型的肥大细胞在食物过敏时均数量增加,且相较于其他免疫细胞,更加强烈地表达HPGDS和分泌更多的PGD2,进而导致尿液中PGD2代谢产物增加。当在小鼠体内HPGDS缺乏时,显著降低了尿液中PGD2代谢物的水平。此外,在食物过敏模型小鼠中,PGD2的产生以及尿液中其代谢产物的排泄均是由HPGDS 的激活引起的。
3.3 HPGDS在过敏性鼻炎中的作用
过敏性鼻炎是常见的慢性过敏性疾病,具有过敏原引起的2型炎症的临床和病理特征。在鼻部受到抗原刺激后,过敏性鼻炎患者立刻出现过敏反应,部分患者还存在后期鼻炎反应[24]。在鼻炎鼻息肉中,HPGDS 和 DP2高度表达[25]。Kajiwara 等人[24]通过对过敏性鼻炎豚鼠模型的鼻灌洗液分析表明,无论早期或晚期PGD2水平均有所增加,而通过对HPGDS的抑制,晚期鼻塞几乎完全消失,表明HPGDS在过敏性鼻炎尤其是晚期中发挥重要作用。Suzuki等[25]实验也证明,HPGDS和DP2在鼻息肉中的活化的嗜酸性粒细胞中高表达,在正常的嗜酸性细胞中不表达。目前,PGD2及其限速酶HPGDS已被公认为是过敏性呼吸道炎症的驱动因素[14]。过敏性鼻炎患者的鼻黏膜中HPGDS显著表达,LPGDS表达较低,且过敏患者HPGDS表达明显高于无黏膜肥大患者。其中,肥大细胞、嗜酸性粒细胞、淋巴细胞和上皮细胞等均有HPGDS表达。在慢性鼻窦炎伴鼻息肉中,Th2细胞高表达HPGDS,并且富含参与脂质代谢的基因,进一步促进PGD2的产生[13]。PGD2通过HPGDS作用从细胞中释放并与DP2结合,参与嗜酸性粒细胞向鼻粘膜的汇集[26]。因此,HPGDS可以作为治疗过敏性鼻炎的重要靶点。已有研究证实,HPGDS抑制剂能够通过抑制HPGDS改善过敏性鼻炎临床症状,主要包括TAS-204和TFC-007。TAS-204通过对HPGDS的抑制作用,进而减少PGD2的产生,但它对COX1、COX2或 LPGDS 无抑制活性。使用TAS-204治疗过敏性鼻炎模型豚鼠,能够降低鼻腔灌洗液中的嗜酸性粒细胞浸润和鼻对组胺的高反应性,缓解过敏性鼻炎[24]。HPGDS 的选择性抑制剂TFC-007,用于日本雪松花粉诱导的过敏性鼻炎豚鼠模型也可以显著缓解后期鼻塞症状[27]。
3.4 HPGDS在过敏性哮喘中的作用
哮喘是一种常见的下气道慢性炎症性疾病,主要特征包括不同程度的气流阻塞、支气管高反应性和气道炎症。当哮喘引发过敏性炎症时,中性粒细胞和嗜酸性粒细胞浸润气道,肺也是病理性嗜酸性粒细胞浸润的常见部位[28]。哮喘患者支气管肺泡灌洗液中能够检测到多种介导炎症的细胞因子和趋化因子,这些因子由气道中免疫细胞分泌,又对自身产生影响,因此,自分泌和旁分泌等可能参与哮喘的发生[29]。哮喘发作时,支气管平滑肌痉挛,PGD2在被急性过敏原激发的患者和严重哮喘患者中被发现,且哮喘发作的严重程度和PGD2浓度密切相关。当哮喘加重、哮喘控制不佳时,PGD2、HPGDS 和 CRTH2 水平上调。当小鼠未感染肺炎病毒时,基础HPGDS量较低且主要存在于支气管气道上皮细胞,而感染且暴露于蟑螂过敏原后的小鼠,HPGDS和PGD2则上调显著[30]。Chiba等人[31]进一步的研究发现,被抗原攻击的哮喘小鼠支气管平滑肌组织中花生四烯酸代谢倾向于PGD2的产生,PGD2含量上调;同时,组织中HPGDS的mRNA和蛋白质均显著上调,这可能是哮喘小鼠PGD2上调的原因。同时,使用PGD2预处理可以提高平滑肌组织细胞对乙酰胆碱的反应,增强平滑肌收缩性,加重哮喘发生。严重哮喘患者上皮细胞中HPGDS增加,细胞内DP1受体mRNA水平基本不变,CRTH2受体mRNA增多,PGD2产生更强的作用。与无哮喘发作病史的患者相比,哮喘患者病情恶化与支气管肺泡灌洗液中PGD2水平、HPGDS+细胞数量和CRTH2+细胞数量相关[32]。在细胞水平上,过敏性哮喘时肥大细胞是PGD2产生的主要来源,因此,肥大细胞中HPGDS通常高表达。过敏性哮喘中增生的肥大细胞常黏附在黏膜或黏膜下层,大量增生的肥大细胞也对疾病发生有一定作用。IgE长期激活肥大细胞不会对PGD2的产生造成影响,但干细胞因子(SCF)激活则导致PGD2显著增加[33]。虽然过敏性哮喘时肥大细胞高表达HPGDS和PGD2会导致过敏反应的加重,但Nakamura 等人研究表明,HPGDS缺乏会加剧肥大细胞浸润,导致几乎所有组织中肥大细胞增生,同时浸润至发炎部位。
3.5 HPGDS在嗜酸性食管炎中的作用
嗜酸性粒细胞性食管炎是一种慢性免疫介导的疾病,其特征是在无继发性嗜酸性粒细胞增多症的情况下出现食管功能障碍和食管黏膜嗜酸性粒细胞浸润的症状,暴露于过敏原会引发以嗜酸性粒细胞为主的2型炎症[34]。暴露于过敏原时,患者外周血中嗜酸性粒细胞升高,HPGDS mRNA高表达,且通过蛋白质杂交证实,HPGDS蛋白表达也处于较高水平。Feng等人[35]研究表明,在阿司匹林刺激下呼吸系统疾病受试者外周血嗜酸性粒细胞释放PGD2的量高于对照组和哮喘受试者。干扰素-γ(interferon-γ, IFN-γ)对嗜酸性粒细胞终末成熟有加速作用,IFN-γ刺激嗜酸性粒细胞后,HPGDS mRNA增加,HPGDS蛋白增加,PGD2自发释放升高。在富含 IFN-γ的环境中,嗜酸性粒细胞对阿司匹林刺激反应强烈,PGD2合成更多。嗜酸性粒细胞膜上存在CRTH2受体,PGD2作用于该受体激活嗜酸性粒细胞,导致颗粒蛋白释放和嗜酸性粒细胞的汇集[36],促进炎症细胞的募集和肥大细胞、T细胞和成纤维细胞的激活。同时,肥大细胞数量不断增加并浸润食管所有层,分泌许多促炎因子,对上皮细胞屏障有一定破坏作用[37]。肥大细胞、嗜酸性粒细胞均可表达HPGDS并分泌PGD2,通过旁分泌或自分泌导致过敏和炎症的加重。除嗜酸性粒细胞和肥大细胞以外,有研究发现,当过敏反应发生时,黏膜组织中存在一种HPGDS+Th2细胞,被称为Th2A细胞,分泌大量IL-5和IL-13,并产生PGD2作用于相应受体诱导激活嗜酸性粒细胞和Th2细胞,加重嗜酸性食管炎症状[38],且这种细胞在食物过敏、过敏性鼻炎、嗜酸性食管炎、特应性皮炎等多种过敏性疾病中均能够被检测到[39]。
4 造血前列腺素D合酶的靶向药物
HPGDS在多种过敏性疾病中发挥重要作用,是过敏和炎症过程中发挥关键作用的介质,因此,HPGDS可以作为治疗相关疾病的重要靶点,研发的HPGDS抑制剂药物可能会缓解过敏炎症症状。在FDA已批准的药物中,赤藓红钠、苏拉明、硫酸血根碱和单宁酸能用作HPGDS的有效抑制剂[40]。黄酮类化合物杨梅素(Myr)也可以有效抑制动物模型中肥大细胞的脱颗粒和HPGDS mRNA水平[41]。HQL-79已从药理和生物化学上被证明是一种针对 HPGDS的选择性口服抑制剂。人类HPGDS过表达转基因 (TG)小鼠过敏性气道炎症模型研究表明,HQL-79 选择性地抑制HPGDS产生PGD2,而对其他前列腺素的产生影响较小[7]。另一种新型HPGDS抑制剂TAS-205相较于TAS-204和TFC-007副作用减轻。TAS-205 呈浓度依赖性地抑制 HPGDS 的酶活性,但即使在高浓度时TAS-205也不会抑制LPGDS的酶活性,对其他包括环氧合酶COX1、COX2和 LTC4合酶在内的174种酶也未见活性影响[42]。Yokoo 等人研究开发通过泛素-蛋白酶体系统降解HPGDS的嵌合小分子PROTAC(H-PGDS)-1。该新型化合物由2个配体TFC-007(与 HPGDS 结合)和 pomalidomide组成,具有强大的HPGDS降解活性[43],且对PGD2有较长时间的抑制作用,因此,可以发挥良好的治疗效果[44]。蜡样蛋白(cereblon, CRBN)配体对蛋白水解靶向嵌合体(proteolysis-targeting chimeras, PROTAC)的修饰,可以提高抑制剂的化学和代谢稳定性,有望改善PROTACs药代动力学[45]。靶向HPGDS抑制剂除治疗过敏性疾病动物模型外,新型HPGDS抑制剂PK007也能够治疗杜氏肌营养不良症(DMD)MDX小鼠模型,有效减少其肌肉炎症和纤维化。PK007相较于HQL-79表现出更好的治疗效果,可以使MDX小鼠恢复到与对照相似的水平[46]。除此以外,2-苯基咪唑[1,2-a]吡啶-6-甲酰胺等多种HPGDS 抑制剂正在研究中[47]。
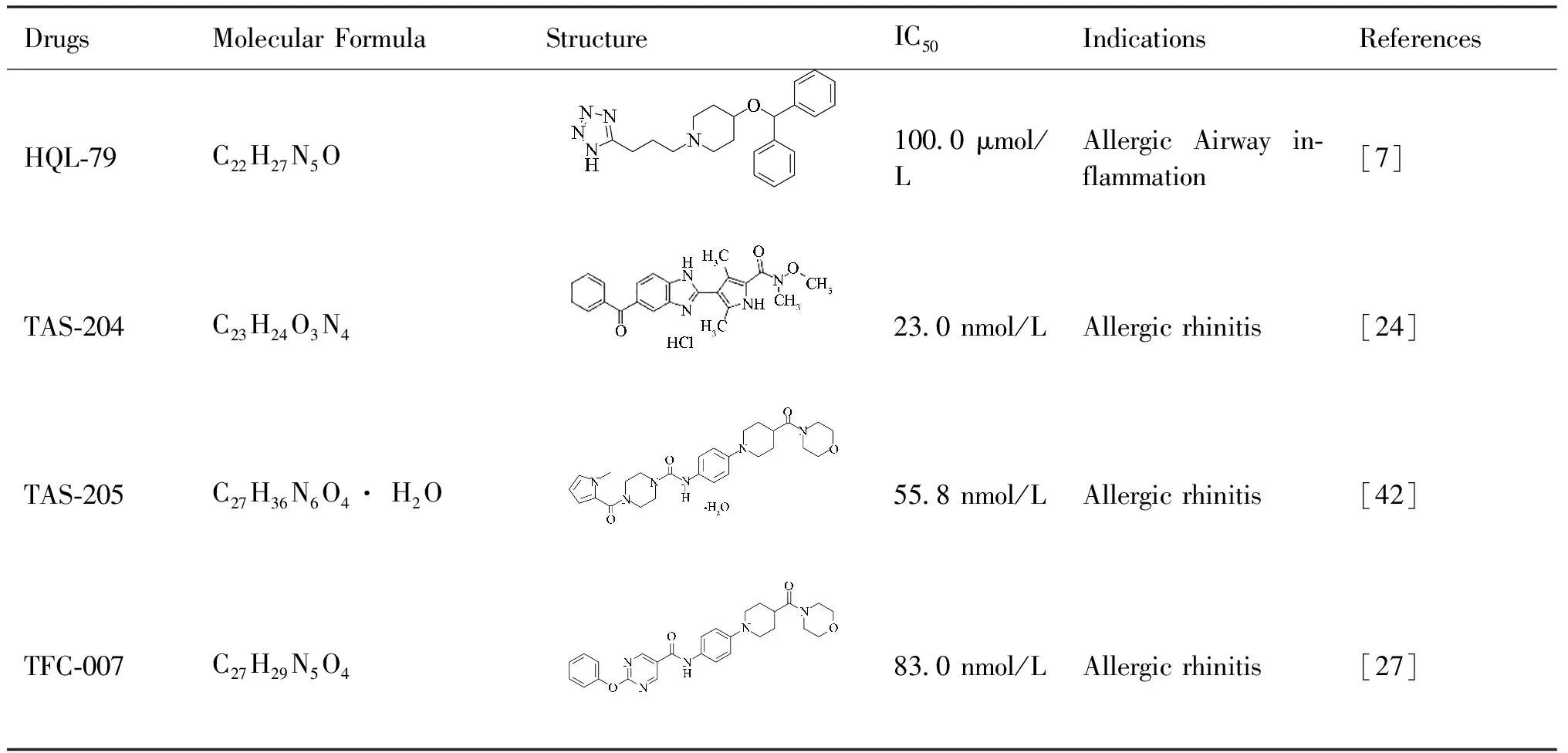
Table 1 Drugs targeting HPGDS
5 问题与展望
过敏性疾病影响患者的正常生活,对患者家人生活也造成不良影响。在多种过敏性疾病中,HPGDS发挥作用的途径基本相同,能够催化PGH2生成PGD2,PGD2是炎症发生的关键因子,能够激活免疫细胞分泌细胞因子,促进炎症细胞趋化作用,加重炎症反应。因此,HPGDS的作用广泛,抑制HPGDS能够治疗多种过敏性疾病。抑制PGD2发挥作用的途径主要包括抑制PGD2和DP2受体的结合与抑制PGD2生成2种途径。COX、HPGDS在PGD2的上游,在PGD2的生成过程中发挥关键作用。COX1主要维持正常生理功能的稳定,COX2是触发PGD2生成和后续炎症反应的关键环节。非甾体类抗炎药通过抑制COX2来抑制PGD2的产生缓解炎症,但是抑制COX2可能会对PGH2、PGE2等多种COX2下游细胞因子产生影响,破坏COX1、COX2共同调节作用的平衡,造成不良反应。而HPGDS作为直接催化PGD2生成的酶类物质,在过敏性疾病的发生和发展中发挥重要作用,通过抑制HPGDS能够更加精确的抑制PGD2相关的炎症恶化,降低对相关细胞通路其他细胞因子的影响,减少副作用。同时,HPGDS靶向抑制剂不会对LPGDS下游的PGD2产生干扰,对内皮细胞功能的稳定维持有重要意义。但是,当HPGDS被抑制时,由于PGD2生成减少,过量的PGH2仍可能会作为其他前列腺素的前体,从而导致COX途径失衡,但这也可能对预后产生积极作用。因此,通过进一步的研究和靶向HPGDS抑制剂的开发,有望为临床治疗过敏性疾病提供新的思路。
HPGDS抑制剂能够抑制各种类型细胞中的PGD2的生成,可能对过敏性疾病的治疗产生有利作用。但是,HPGDS在不同过敏性疾病中发挥重要作用的细胞有所不同,因此,药物对不同细胞的抑制作用可能会对治疗效果产生影响。同时,有研究表明,PGD2在炎症早期可能存在抗炎作用,而在炎症晚期促炎功能占主要地位,可能对于HPGDS抑制剂的使用时间和使用效果有一定的指导意义。目前,针对HPGDS的化学结构,已有多种小分子抑制剂合成的相关研究,靶向HPGDS药物的治疗效果仍在研究中。多数相关研究在动物过敏模型中进行,且局限于过敏性鼻炎和过敏性气道炎症。尽管在开发有效的HPGDS抑制剂方面已经付出很多努力,但仍未见相关药物进入市场,这表明可能需要进一步研究HPGDS在过敏性疾病发病过程中的具体机制,进行动物模型实验和临床试验,以确定受益最大的疾病以及最佳的治疗时间,从而提高治疗效果。

