钠-葡萄糖协同转运蛋白2及其抑制剂与相关疾病
丁百香
(天津大学生命科学学院 结构生物学实验室, 天津 300072)
葡萄糖(glucose)是地球上生命活动的主要能量来源,它不仅可以作为合成生物大分子的重要前体参与调节细胞周期进程及细胞凋亡,还可以作为信号分子介导细胞中的基因表达和生物生长发育,研究发现,葡萄糖可以作为塑造免疫反应的一个重要信号[1]。血浆葡萄糖水平是临床糖尿病诊断和管理的重要指标,人类基因组中有3个葡萄糖转运体家族,都属于溶质载体(solute carrier,SLC)超家族:SLC2、SLC5和SLC50。SLC2家族的葡萄糖协助转运蛋白(glucose transporters)是负责机体葡萄糖进出细胞的关键门控蛋白质,对能量供给和调节葡萄糖稳态至关重要[2];SLC5家族的钠-葡萄糖协同转运蛋白(sodium-glucose cotransporters)调节小肠和肾对葡萄糖的重吸收[3],对维持机体血糖水平不可或缺;SLC50属于SWEET家族,是近年来才发现的一类新型糖转运蛋白质家族,主要参与植物中糖的外排,在人类基因组中只有一个成员[4]。不同的转运体在葡萄糖代谢网络中发挥的作用大有可观,了解各转运体正常生理功能及异常表达所引起的缺陷障碍具有重要价值和意义。本文介绍的是SLC5家族中的—钠-葡萄糖协同转运蛋白2(sodium-glucose cotransporters 2,SGLT2),它主要负责肾对葡萄糖的重吸收[5],而SGLT2的异常表达将导致葡萄糖重吸收障碍,使得葡萄糖从尿液排出,从而降低机体的葡萄糖负担,这对于糖尿病患者来说是一种福音。因此,钠-葡萄糖协同转运蛋白2抑制剂(sodium-glucose cotransporter 2 inhibitor,SGLT2i)抑制SGLT2的重吸收功能,被认为是一类新型抗糖尿病药物。本文综述了SLC超家族及SGLT2在结构功能方面的研究进展,同时对其抑制剂的阻断机制和相关疾病的应用进行总结,为糖尿病及其并发症的基础研究和临床药物开发提供新的线索和思路。

Table 1 Classification, function, and association with related diseases of human glucose transporters
1 溶质载体超家族蛋白的结构特征和功能
SLC超家族目前包括65个家族,共458种转运蛋白质[6,7],数量仅次于G蛋白偶联受体超家族(G-protein-coupled receptors)。SLC超家族成员广泛分布在人体的各种组织和器官中,且定位于细胞膜和多种亚细胞器膜上,利用细胞内外电化学电位差或离子梯度提供的能量转运生物膜内外的各种底物[8]。SLC亚家族之间序列同源性为20%~25%,通常含有1至多个跨膜螺旋,但大多数蛋白质倾向于包含7至14个跨膜螺旋[9]。结构显示,SLC超家族中有13个不同的折叠[10],但人类SLC超家族中最常见的4种折叠模式分别为:MFS样折叠、LeuT样折叠、NhaA样折叠和GltPh折叠[11-14],虽然SLC超家族成员之间结构差异较大,但仍具有两大共同结构特征:跨膜螺旋的伪对称和不连续的跨膜螺旋[15]。
结构多样性和分布广泛性使得SLC超家族蛋白成员的功能具有多样性,除在生物体内承载对营养物质的摄取及必需离子的吸收外,SLC超家族蛋白还参与细胞中的信号转导,对细胞的生长增殖及代谢发挥至关重要的作用。SLC转运蛋白调节多种必需分子,例如糖、氨基酸、无机离子、神经递质、激素、维生素和药物的摄入和外排[3,16-18]。因此,SLC蛋白表达异常或功能缺陷与多种疾病的发生和代谢紊乱密切相关。人类遗传数据表明,超过50%的SLC家族成员与人类疾病相关,例如SLC7A1高表达与上皮性卵巢癌细胞的增殖迁移有关[19],SLC13A5突变导致癫痫和发育迟缓[20],SLC23A2多态性可能与妊娠期高血压风险有关[21],SLC37A4缺乏则会造成先天性糖基化障碍[22]等。SLC家族成员的功能障碍与许多人类疾病相关联,了解SLC家族转运体与异常细胞之间的关系,将为潜在的新治疗策略打开大门。
2 钠-葡萄糖协同转运蛋白2概述
人类SLC5溶质载体家族包括12个成员,在从上皮细胞到中枢神经系统的组织中广泛表达[23]。其中,有10个成员是紧密耦合的质膜Na+/底物共转运蛋白质,负责葡萄糖、肌醇、维生素、单羧酸盐和阴离子等溶质分子的运输:一个是Na+/Cl-/胆碱转运蛋白;另一种是葡萄糖激活离子通道,促使Na+涌入细胞,但不运输糖[23]。SGLT1和SGLT2是SLC5溶质载体家族中负责在肾和小肠中进行葡萄糖重吸收的关键转运蛋白质,它们利用钠离子穿过质膜的电化学梯度为葡萄糖的摄取提供动力。SGLT1和SGLT2分别以1∶2和1∶1的比例结合葡萄糖和Na+,形成Na+-载体-葡萄糖复合物,顺Na+浓度梯度进入细胞,随后SGLT1/2构象还原到初始状态,继续结合葡萄糖、Na+运送进胞内,而Na+则不断由细胞质膜上的Na+/K+-ATP泵泵出,以维持细胞内外的Na+浓度差,为葡萄糖逆浓度梯度进入细胞提供动力。
SGLT1主要分布于小肠刷状缘和肾近曲小管第三节段中,由SLC5A1基因编码,该基因的突变会导致肠道葡萄糖/半乳糖吸收不良,这是一种罕见的常染色体隐性遗传病,临床上表现为严重的腹泻及营养不良,在婴儿期甚至危及生命[24]。SGLT2由SLC5A2基因编码,SLC5A2基因主要在肾中表达,存在于近端小管第一和第二节段的上皮细胞管腔膜中,负责重吸收肾小球滤液中的大部分(通常≥90%)葡萄糖,大脑、肝、甲状腺、心血管中SGLT2也有表达,但其mRNA水平较肾要低[25]。在人类的前列腺癌、胰腺癌中也有SGLT2表达的情况[26],在分化程度较高的肺腺癌样本中,SGLT2表达更高[27]。1993年,研究人员首次用啮齿动物和人类体细胞杂交的方法确定了SLC5A2基因的位置,SLC5A2位于16号染色体p11.2带靠近中心点的位置[28],全长约7.7kb,含有14个外显子,编码的产物有672个氨基酸,相对分子质量约为73 kD,与SLC5A1有60%的序列相同[29]。SGLT2的基因突变会导致家族性肾性尿糖的发生,又称为原发性肾性糖尿症(primary renal glucosuria)[30],患者除表现为尿糖高外其与正常人无异,该病为SGLT2作为全新靶点用于糖尿病的治疗奠定了基础。因此,SGLT2的功能障碍被视为治疗糖尿病的新型途径。
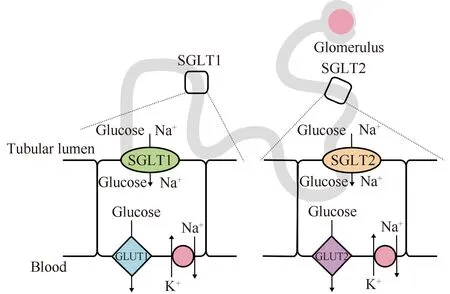
Fig.1 Distribution and function of SGLT1 and SGLT2 in the human kidney SGLT1 is mainly distributed in the third segment of the renal proximal convoluted tubules, and SGLT2 is mainly distributed in the luminal membrane of epithelial cells in the first and second segments of the proximal tubules
人源SGLT2(human sodium-glucose cotransporter 2,hSGLT2)为14次跨膜蛋白质,TM1-TM5和TM6-TM10是2个结构相似但拓扑结构相反的重复序列,它们构成了整个转运体的核心[31],类似于原核生物神经递质钠共转运体LeuT的核心结构[32]。TM0、TM11-13在hSGLT2核心结构的周围,附属亚基MAP17通过疏水相互作用与TM13结合,MAP17是SGLT2的附属膜相关蛋白质,在细胞中单次跨膜,它是SGLT2必不可少的辅助亚基,可以增强SGLT2的活性百倍以上[33,34]。此外,在hSGLT2细胞内侧,胞内环(intracellular loop,IL)6的氨基酸残基与IL1和IL5之间有广泛的相互作用,该环在真核生物SGLT1和SGLT2之间具有较高的序列保守性,表明其具有重要功能。hSGLT2结构的解析将为其抑制机制的阐明提供结构基础,并进一步有助于开发针对这些转运体的抑制药物。
3 钠-葡萄糖协同转运蛋白2抑制剂及其抑制机制
据研究统计,全世界有1/10的成年人患有糖尿病,总数约5.37亿人。我国是全球糖尿病患病率增长最快的国家之一,2022年中国糖尿病报告患者人数达140.9百万人。糖尿病患者长期存在的高血糖,导致各种组织的慢性损害和功能性障碍,严重影响人们的生产生活。肾对维持体内葡萄糖稳态具有关键作用,它主要通过3种方式调节糖代谢:一是通过葡糖异生过程将非糖物质转变成葡萄糖或糖原,使其进入血液循环;二是肾摄取血液循环中的葡萄糖作为代谢底物满足自身能量需求;三是肾近曲小管SGLT1和SGLT2对超滤液中的葡萄糖重吸收。肾对葡萄糖重吸收能力降低以及葡萄糖进入尿液的阈值较高,使得糖尿病患者血糖水平居高不下。最近,SGLT2被选为2型糖尿病的治疗靶点,其依据是抑制SGLT2会导致肾葡萄糖排泄阈值显著降低,从而促进尿液排出过量的葡萄糖,降低血糖水平,SGLT2i的降糖作用呈现血糖水平依赖性,单用SGLT2i不会发生低血糖,确保了该类药物降糖的安全性,同时对于SGLT2i作用的解除推测有2种机制,一是SGLT2i发挥作用后被解离下来,二是不断有新生的SGLT2转运到细胞膜上,因此,SGLT2i不会一直发挥作用。
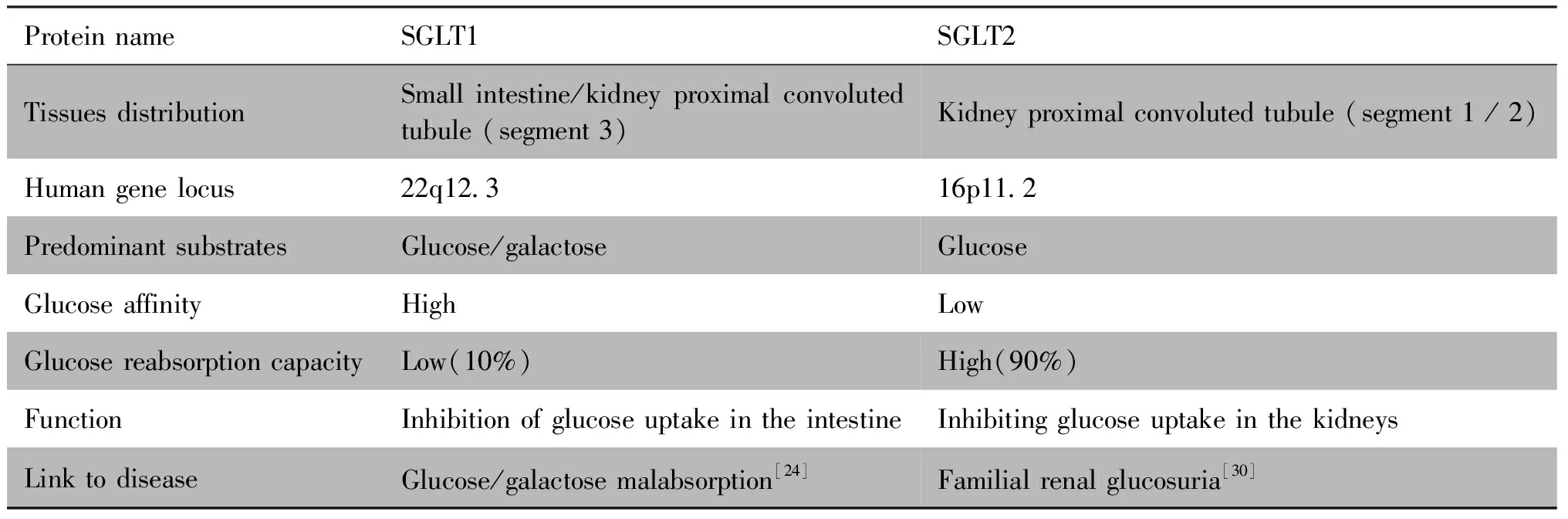
Table 2 Differences between SGLT1 and SGLT2
人们首先从苹果树根中发现了非选择性抑制剂—根皮苷,根皮苷对SGLT的亲和力远显著高于葡萄糖,可以阻止SGLT对葡萄糖的重吸收,但它对SGLT1和SGLT2的选择性差,同时容易在体内被肠道乳糖酶水解,妨碍细胞的正常转运,治疗潜力有限[35]。此后,基于根皮苷特性开发了一系列小分子化合物,目前,全球已上市多种SGLT2i,我国已上市的SGLT2i有达格列净、恩格列净、卡格列净和艾托格列净。
SGLT2i成为国内外研究糖尿病治疗靶点的热门选择,其抑制机制将为新的药物开发提供更多可能方向。hSGLT2结构的解析揭示了SGLT2i的抑制机制,抑制剂恩格列净通过其羟基与蛋白质的羟基之间形成氢键结合在SGLT2的中间位置,抑制剂的葡萄糖基占据了葡萄糖的底物结合位点,同时抑制剂的糖苷配基从葡萄糖结合位点向外延伸,直到SGLT2蛋白外侧,将SGLT2锁定在向外开放的构象中,葡萄糖重吸收不能进行,从而抑制了运输循环周期[31]。这种机制与抗抑郁药物结合的真核生物多巴胺转运体,以及人血清素转运体中提出的机制类似[36,37]。此外,研究还发现,将和恩格列净结合的SGLT2氨基酸突变为SGLT1对应的氨基酸会使其抑制效果减弱,这在一定程度上解释了恩格列净对SGLT2相较于SGLT1的高选择性[31]。这些研究发现为理解SLC5A家族葡萄糖转运蛋白的机制提供了一个框架,也为未来合理设计和优化靶向这些转运蛋白质的新抑制剂奠定了基础。
SGLT2i通过抑制SGLT2减少肾对葡萄糖和钠的重吸收,发挥降糖作用,但不同的抑制剂因分子结构的不同而使得药物代谢和不良反应存在差异,在适应症方面也有所不同,例如恩格列净主要用来抑制SGLT2,卡格列净不仅能抑制SGLT2,还能抑制SGLT1,这也使得卡格列净的减重效果要优于恩格列净,因此,各抑制剂因结构的差异在机制方面存在不同,但归根结底都是发挥降糖作用,其余抑制剂的具体作用位点仍需进一步结构的解析来阐明。
4 钠-葡萄糖协同转运蛋白2抑制剂对疾病的有益影响
SGLT2i作为新型降糖药物其抑制作用不是胰岛素依赖性的,也不受胰岛素抵抗的影响,因此,胰岛素抵抗的患者也可受益[38],同时对其他组织器官无显著影响,为控制糖尿病患者的血糖水平提供了一种合理的治疗手段。此外,SGLT2i能改善血压水平,减轻体重[39-41],也表现出良好的肾保护和心血管保护作用[38,42],通过各种机制共同参与发挥作用。最近研究发现,SGLT2也在胰腺和前列腺肿瘤以及胶质母细胞瘤中表达,这为SGLT2特异性靶向癌症治疗提供了新的策略[26,43]。
4.1 SGLT2i与慢性肾病
慢性肾病(chronic kidney disease,CKD)是长期持续丧失肾功能或存在清蛋白尿或其他肾损害特征的疾病。糖尿病是CKD的重要诱因之一,糖尿病肾病(diabetic kidney disease,DKD)是最主要的糖尿病微血管并发症之一,已成为发达国家终末期肾病的主要原因[44]。多项临床研究表明,SGLT2i可以延缓肾疾病的进展[45,46],例如EMPA-KIDNEY试验表明,在有疾病进展风险的广泛CKD患者中,恩格列净治疗导致肾疾病进展或心血管原因死亡的风险低于安慰剂[47];DAPA-CKD试验中,达格列净显著降低了CKD患者的复合肾结局,可以作为患者CKD进展的新药理学选择[48];另一项DAPA-CKD试验表明,达格列净降低了肾和心血管结局的相对风险[49]。SGLT2i的使用延缓了肾疾病的进程,以下机制可能与肾保护有关。
(1)恢复管球反馈,减少高滤过和蛋白尿:SGLT2i可增强糖尿和利钠作用,致密斑细胞感受到肾小管内钠浓度的变化,激活管球反馈,并促进入球小动脉收缩和出球小动脉舒张,球内血流量减少,肾小球内压和滤过率下降[50-53],这在一定程度上可以降低尿蛋白水平,减轻对肾微血管的损害[54]。Cassis 等人[55]研究表明,在蛋白质超负荷小鼠模型中,达格列净减少了蛋白质尿并改善足细胞功能障碍和丢失,延缓了肾病进程。
(2)改善缺氧状态,促进促红细胞生成素的生成:糖尿病患者SGLT2重吸收能力增强,导致腔内葡萄糖浓度升高,高浓度葡萄糖对氧气的需求增加,易出现缺氧状态,肾小管间质缺氧是终末期肾病的最终常见途径。SGLT2i可通过诱导肾组织中缺氧诱导因子的表达,提高促红细胞生成素的产生,增加血细胞比容,从而改善氧供和肾损伤[56-58]。在糖尿病患者中,血细胞比容升高可能是可逆性肾小管间质损伤恢复的替代标志物[59],另有发现,SGLT2i恩格列净通过AMP活化蛋白激酶的激活,减少肾小管线粒体破碎,从而增强线粒体功能和自噬[60]。
(3)降低尿酸水平:SGLT2i使得尿糖排泄增加,与参与尿酸转运的葡萄糖转运蛋白9(glucose transporter 9,GLUT9)竞争,尿酸与GLUT9结合被抑制,重吸收减少,导致尿酸排泄增加,降低血尿酸水平[61,62]。除GLUT9外,SGLT2i还能直接抑制另一尿酸重吸收蛋白—尿酸盐阴离子转运体1,从而显著增加肾对尿酸的清除率[63]。
(4)抗炎和抗纤维化作用:长期高糖状态导致肾的炎症因子和纤维化因子分泌增加,加剧炎症和纤维化进展。有研究显示,SGLT2i能减少炎症标志物例如白细胞介素6(interleukin-6,IL-6)、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)以及其他与炎症和组织纤维化相关因子的表达,延缓肾间质纤维化进展[64,65]。在心血管中,动脉粥样硬化生成和血管内皮功能障碍与TNF-α和IL-6以及IL-1循环水平升高有关[66],此外,心力衰竭也与这些促炎因子水平升高有关[67],总之,SGLT2i对促炎因子的抑制作用对肾和心血管来说都是有益的。
(5)改善血脂和细胞代谢:血脂异常是糖尿病的常见合并症,患者长期存在高血脂造成血管脂质过载,沉积在血管壁内,累及到多个脏器的功能障碍。研究显示,SGLT2i对血脂的影响是双重的,既可以使低密度脂蛋白胆固醇和高密度脂蛋白胆固醇轻度升高,同时也可以轻度降低甘油三酯[68-70]。SGLT2i导致血糖水平降低,进而影响细胞代谢的转变。这种变化的结果是脂肪酸氧化和酮体生成增加,降低了细胞脂毒性并改善了氧化应激,同时酮体似乎是肾和心肌细胞更好的能量底物。
SGLT2i对DKD的有利作用是显而易见的,除此之外,SGLT2i还能靶向DKD相关的分子途径,通过线粒体功能和内皮功能改善、减轻氧化应激[71,72]等参与肾的保护作用。
4.2 SGLT2i与心力衰竭
心力衰竭(heart failure)是心室功能障碍引起的一组综合征,其特征集中表现为肺淤血、腔静脉淤血。研究表明,与无糖尿病的患者相比,糖尿病患者更易患心力衰竭,由心血管疾病引起的死亡可能占糖尿病人群死亡的一半[73]。SGLT2i通过多种途径的综合作用改善心血管相关的治疗效果,使心力衰竭患者受益,愈来成为重要的治疗靶点。根据心血管结局试验的结果,与安慰剂相比,SGLT2i降低了心血管相关的死亡率和住院风险,减少了不良心血管事件的发生[74-76]。已经提出了几种理论来解释这些观察结果。一般来说,这些归因于以下5种可能。
(1)血流动力学效应:SGLT2i通过促进尿糖排泄发挥渗透性利尿和利钠作用,改善水钠潴留以及降低血压,从而降低心血管的前负荷和后负荷[77,78]。SGLT2i引起持续性糖尿和短暂性利尿,但不会造成肾功能恶化[79,80],这对于糖尿病合并心力衰竭患者来说是有利的。此外,与传统利尿剂相比,SGLT2i诱导的利尿有望产生更高的无电解质水清除率[81,82],对于血管和间质间隙积液减少有重要作用。
(2)提高心肌能量代谢:衰竭的心血管中葡萄糖氧化受损,酮体和支链氨基酸成为心肌细胞替代的能量来源,SGLT2i促进心肌细胞β-羟丁酸等酮体的生成,改善线粒体功能,增加心血管能量供给,进一步优化心血管的能量代谢[83,84]。生酮代谢增加也可能是SGLT2i诱导的血细胞增加的原因,这反过来又增加了肾髓质等缺氧敏感地方的氧气输送[80]。同样,红细胞量增加可能有助于改善冠状动脉疾病糖尿病患者的心肌组织供氧和减少左心室质量[85,86]。
(3)抑制钠氢交换:钠离子浓度升高会导致糖尿病患者心律失常和氧化应激[87]。研究表明,SGLT2i能够抑制心肌中的钠氢交换体(sodium hydrogen exchanger isoform 1,NHE1)活性,降低心肌细胞质中的钠和钙水平,同时增加线粒体钙水平,减少心衰的发生[88-90]。通过遗传小鼠模型,Jiang等人[91]证明,恩格列净的心血管保护作用是通过NHE1介导的过度自噬通量的下调,显著降低了心肌梗死和心血管的纤维化,从而改善了心血管功能。恩格列净还能通过抑制NHE1活性,恢复蛋白质激酶和内皮NO合酶信号通路来改善基因突变引起的内皮功能障碍[92]。
(4)抑制交感神经系统:长期慢性交感神经活性增加多见于糖尿病和心力衰竭及肾疾病中,交感神经兴奋可导致心率加快血压升高,心血管并发症风险增加[93]。研究显示,使用SGLT2i治疗后血压显著降低而不会诱发心率的代偿性变化,提示SGLT2i可能具有交感神经抑制作用,并降低心血管发病几率[94-96]。Herat等人[97]利用神经源性高血压小鼠模型证实,SGLT2i达格列净会降低交感神经系统的活性,EMBODY试验结果也显示,SGLT2i恩格列净能有效改善心血管的交感神经系统[98]。
(5)改善心外膜脂肪沉积:心外膜脂肪异位沉积影响心力衰竭的发病率,而心肌脂肪因子与该沉积过程存在密切联系。研究显示,脂肪因子,例如瘦蛋白和脂联素,它们与肥胖相关的心血管疾病和心血管的保护有关[99,100],而SGLT2i能降低血清瘦蛋白并增加脂联素浓度,显著保护心血管功能[101]。结构和瘦蛋白代谢的改变决定了心外膜脂肪的积累,这在心肌纤维化和炎症引起的心力衰竭发展中发挥至关重要的作用,从而有助于心室重塑[102]。事实上,另一项研究报道了达格列净能减少异位心外膜脂肪、TNF-α和纤溶酶原激活物抑制剂-1[103],这一结果表明,SGLT2i可能在心血管炎症的许多机制中发挥作用[104,105]。
SGLT2i最初是以降糖药物出现在大众视野,但是随着研究的不断深入其作用机制已不止发挥降糖效果,除以上机制外,SGLT2i还可以通过抑制心肌纤维化、改善内皮功能障碍[106,107]等一系列进程对心血管疾病产生保护作用,有利的反向左心室重塑可能是SGLT2i降低心力衰竭的又一机制[75]。本文认为,SGLT2i对患者肾及心血管的保护作用存在多种机制或是多种机制协同作用的结果,新的发现会为以后的药物开发提供不同见解,机制的总结将为进一步优化当前心力衰竭药物提供新的视角,并为心力衰竭的治疗提供更多选择。
4.3 SGLT2i与癌症
癌症严重威胁人类健康,糖尿病与许多癌症的风险增加有关,一些原癌基因在高血糖症中被激活和过表达,导致病理基因表达失衡,加速癌症的发展。探究高血糖对癌细胞的作用机制,寻找有效的治疗靶点对肿瘤防治至关重要。研究表明,SGLT2在多种类型的肿瘤细胞中表达,并可能参与癌细胞对葡萄糖的代谢利用,抑制SGLT2可以抑制肿瘤细胞的生长,SGLT2有望成为早期癌症的诊断和治疗靶点。Scafoglio等人[27]发现,SGLT2在肺部肿瘤发生早期表达,并且在癌前病变和分化良好的肺腺癌中特异性发现,使用SGLT2i选择性靶向SGLT2,显著降低了肿瘤生长速度,延长小鼠生长期,并通过SGLT2i与特殊示踪剂的配对,在发展的早期阶段拦截肺癌进展。此外,Luo等人[108]提出,SGLT2i的使用与改善罹患糖尿病的非小细胞肺癌患者的总生存率有关,深入研究后发现,SGLT2i具有抗增殖、抗肿瘤发生和抗迁移作用,能诱导癌细胞凋亡。此外,用SGLT2i处理癌细胞系导致其中选定基因的下调[109]。
值得注意的是,SGLT2i在不同肿瘤的发生发展中可能通过多种途径抑制癌细胞进展。Kaji等[110]研究发现,SGLT2i卡格列净通过抑制葡萄糖摄取来减缓肝癌细胞生长和血管生成活性,此外,他们发现SGLT2i还诱导G2/M期停滞和凋亡,另一项研究也证实,SGLT2i伊格列净对乳腺癌细胞系MCF-7的抗增殖作用[111],伊格列净不仅抑制葡萄糖的流入,也抑制细胞钠内流,诱导MCF-7细胞中的细胞膜超极化和线粒体膜不稳定,且其抗增殖作用具有剂量依赖性。此外,也有研究证明,卡格列净通过破坏谷氨酰胺利用来干扰细胞呼吸和ATP生成,从而抑制乳腺癌的发展[112]。最新研究发现,SGLT2i通过下调YAP1(Yes-associated protein 1)表达抑制Hippo通路,可能成为胰腺癌的一种新型治疗方法[113]。经证实,卡格列净也通过mTOR信号通路对胰腺癌细胞发挥抗增殖和细胞凋亡诱导作用[114]。
此外,SGLT2i对宫颈癌、结直肠癌[115,116]等的抗癌作用也已有了初步发现,由此可见,SGLT2i广泛参与抑制不同类型肿瘤的发生发展,有潜力成为一种新型抗癌辅助疗法的关键因子。
5 问题与展望
SGLT2i对慢性肾病、心力衰竭及癌症的积极影响已有了初步了解,然而对于SGLT2是否为主要靶点仍需药物靶标实验的进一步验证。不同SGLT2i与SGLT2的结合位点需冷冻电镜结构的解析,或分子对接技术等来阐述其具体的抑制机制。此外,SGLT2i应用于成人2型糖尿病,当饮食和运动不能使血糖得到满意控制或二甲双胍不能耐受时,可单独使用,也可与其他口服降糖药物及胰岛素联合使用。目前,SGLT2i的降糖效果显著,但也要了解其带来的不良反应,包括生殖泌尿道感染和酮症酸中毒的风险[117-119],要注意患者有效循环血容量以及外周循环等情况,提醒患者适度多喝水,保持尿道清洁。因此,提高SGLT2i安全性和临床可行性仍有待于进一步研究,许多正在进行的临床前研究和可能的新临床试验为未来在临床中优化使用SGLT2i带来了希望。最近,研究发现,SGLT2i在细胞抗衰和延寿方面具有作用[120],可能是由于SGLT2i对肾的葡萄糖和钠处理之外的多效性作用造成的,包括改善线粒体功能,恢复自噬和促进生酮依赖性抑制mTOR信号通路过度激活。以上研究结果均表明,SGLT2i的功能不是单独发挥作用,而是通过多种机制或是多种机制共同作用对人体产生影响。SGLT2是肾、肠道重吸收葡萄糖和钠的关键载体,多种因素共同参与并调控SGLT2活性,继而影响代谢性疾病的发展。SGLT2i通过干预肾和肠道的重吸收功能,发挥心肾保护作用,抑制癌症发生发展,使患者获益良多,为治疗代谢性疾病提供新靶点。总而言之,对SGLT2i参与的各种疾病的进程仍需更多的研究证实,随着未来研究的不断深入,SGLT2i在各种疾病中的作用机制将会日渐明晰,为疾病的治疗带去新的希望。

