环状RNA
——肿瘤干细胞中的新角色
陈懿禹, 叶 婷
(西南医科大学附属医院医学检验部, 四川 泸州 646000)
1 肿瘤干细胞定义及生物学特性
肿瘤干细胞(cancer stem cells,CSC)是一类具有高度自我更新的不定向分化潜能等特征的细胞亚群[1],它主要来源于成体干细胞[2]、肿瘤细胞[3]、分化细胞[4]及细胞融合[5]。肿瘤干细胞假说提出肿瘤干细胞是肿瘤发生、耐药和转移等不良生物学行为的根源[6]。肿瘤干细胞的生物学特性包括:(1)自我更新能力。肿瘤干细胞利用干细胞独特的细胞分裂方式,维持肿瘤干细胞未分化状态[7]。此外,肿瘤干细胞处于静止状态及缺氧环境也会诱导其自我更新[8]。肿瘤干细胞高度自我更新潜能是导致肿瘤发生的直接诱因。(2)多向分化潜能。肿瘤干细胞利用不对称分裂方式并在多种信号通路及转录因子调控下,产生不同分化程度及表型的子代细胞,以构成肿瘤主体、确定肿瘤组织学类型和维持肿瘤异质性[9, 10]。而肿瘤干细胞的分化过程并非单向和不可逆的,已分化的肿瘤细胞也能去分化或转分化形成肿瘤干细胞,两者之间相互转换可驱使肿瘤恶性进展[11-13]。(3)致瘤性。利用免疫缺陷型实验动物通过原位接种肿瘤干细胞构建肿瘤干细胞异种移植模型,通常以原位接种1 000个细胞/只动物作为经典操作[14]。同时,观察一定时间内成瘤情况,包括:成瘤动物数量、肿瘤体积及重量,证实肿瘤干细胞具有更强的肿瘤形成能力[15, 16]。(4)治疗抗性。当前,肿瘤治疗方式多样,包括手术、化学药物治疗、放射治疗、靶向治疗和免疫治疗等,但治疗抵抗所引起的复发是导致肿瘤死亡的主要原因[17]。目前,多种机制调控肿瘤干细胞治疗抗性,例如:多重耐药基因表达、DNA修复能力增强、抑制细胞凋亡、活性氧(reactive oxygen species,ROS)清除剂及细胞代谢改变等方式参与肿瘤干细胞介导的治疗抵抗[18]。(5)高转移潜能。作为肿瘤干细胞的关键特征之一,肿瘤干细胞通过分化为转移性起始细胞(metastasis-initiating cells,MICs)、与肿瘤干细胞微环境相互作用等[19]多种途径获得高转移潜能,进一步赋予肿瘤启动和维持的能力[20, 21]。
2 环状RNA结构及生物学功能
CircRNAs(circular RNAs)是由3′和5′末端通过外显子或内含子环化连接,形成共价闭合环状非编码RNA[22]。因其不含3′和5′端特殊结构,不易被核酸外切酶降解,其结构更稳定[23]。CircRNAs按其来源分为:外显子circRNAs(exon-derived circRNAs,EcRNAs)[24]、内含子circRNAs(intron-derived circRNAs,CiRNAs)[25]和外显子-内含子circRNAs(circRNAs containing both exons and introns,EIciRNAs)[26],绝大多数circRNAs属于EcRNAs。
研究表明,circRNAs存在于不同物种间且具有一定进化保守性,大多真核生物中circRNAs具有组织、发育阶段及亚细胞定位特异性,证实circRNAs属于功能分子[27],通过发挥多种生物学功能参与不同生理及病理过程[23]。(1)CircRNAs充当微小RNA(microRNA,miRNA)海绵作为其经典功能之一。根据竞争性内源RNA(competitive endogenous RNA,ceRNA)假说提出,ceRNA通过miRNA应答原件(microRNA response elements,MREs),可竞争性结合miRNA影响其剪接和转录,进而影响mRNA稳定性及翻译,间接调控miRNA靶基因表达,这种竞争性结合miRNA被称为miRNA海绵作用[28]。虽然miRNA海绵作为circRNAs功能最为常见,但并非所有circRNAs具备miRNA海绵功能模型,因此,仍需进一步探究其他功能[29]。(2)CircRNAs与蛋白质相互作用,以circRNAs与RNA结合蛋白(RNA-binding proteins,RBPs)相互作用较为多见。RBPs作为一类广泛与RNA相互作用的蛋白质,主要参与RNA转录后调控和组织发育等过程[29]。因此,circRNAs与RBPs相结合会进一步影响蛋白质活性及功能,调节circRNAs合成及降解,调控基因转录和抑制细胞周期等过程。此外,circRNAs与蛋白质相互作用还包括:利用circRNAs中保守的蛋白质结合序列与蛋白质相互结合调节亲本基因转录,促进多种蛋白质的相互作用,以及改变蛋白质的亚细胞定位,形成蛋白质支架、多元复合物等方式参与机体发育、疾病等各阶段[30]。(3)CircRNAs具有翻译蛋白质的潜能[31]。近年来,circRNAs利用内部核糖体进入位点(internal ribosome entry site,IRES)和开放阅读框(open reading frame,ORF)进行蛋白质翻译的方式得到证实。同时,N6-甲基腺苷(N6-methyladenosine,m6A)甲基化驱动及滚轮扩增方式也能有效启动circRNAs蛋白质翻译。但目前circRNAs参与蛋白质翻译的调控机制及延伸终止的过程仍不清楚[32]。
CircRNAs具有作为潜在肿瘤生物标志物、治疗靶点等临床价值[33],研究人员借助工具和方法分析circRNAs序列、亚细胞定位、生物学功能、对肿瘤的影响及治疗潜力,推动circRNAs检测临床应用[34]。因此,本文总结了当前circRNAs在肿瘤领域相关检测技术应用、优势及局限性(见Table 1)。
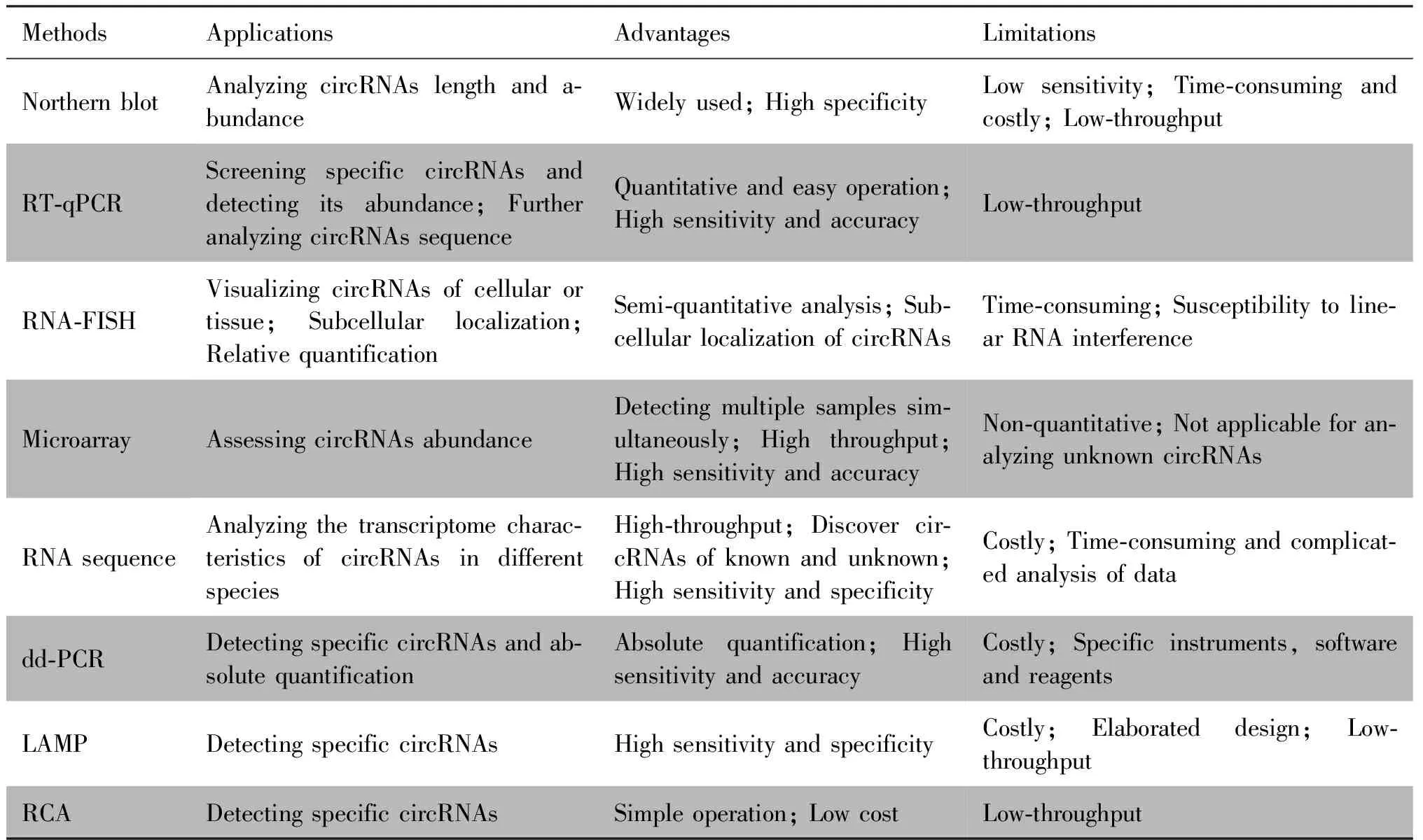
Table 1 Applications, advantages and limitations of circRNA detection technologies
RNA印迹杂交(Northern blot)作为RNA分析技术之一,虽可检测circRNAs大小及表达丰度,但灵敏度低、且耗时费力,并不适用于高通量筛选。实时荧光定量逆转录PCR(quantitative real-time PCR,RT-qPCR)也能检测circRNAs表达丰度及筛选特异性基因,且在一定程度兼顾灵敏度、特异性、速度和成本,使其更适用于临床常规操作[35]。虽然该技术已实现检测及筛选circRNAs,但核糖核酸外切酶R(ribonuclease R,RNase R)可能对含3′末端二级结构的线性RNA消化不足[36]。同时,在逆转录过程中,由于链置换和滚环复制效应,单个circRNA分子可以产生多个重复的cDNA模板,均可导致circRNAs表达分析错误[37]。因此,一定程度限制RT-qPCR用于高通量分析。荧光原位杂交(fluorescence in situ hybridization,FISH)技术,可用于circRNAs半定量分析及亚细胞定位。但该检测技术中其FISH 探针设计仅限于反剪接点,以避免识别线性 RNA。因此,若使用多个FISH探针,可能存在线性RNA干扰[38]。同时,微阵列技术(microarray)通过分析杂交信号强度筛选特异性circRNAs。但仅针对已知探针,不能分析未知变异[39]。随着高通量circRNAs测序技术(Circ-seq)的建立,该方法能高效识别并分析circRNAs表达丰度、保守性及功能等,但目前成本较高,不利于常规开展[40]。此外,为进一步提高circRNAs检测灵敏度及速度,还可利用环介导等温扩增法(loop-mediated isothermal amplification,LAMP)、滚环扩增技术(rolling circle amplification,RCA)及微滴式数字PCR(droplet digital PCR,dd-PCR)等新型技术用于检测circRNAs。由于成本较高、引物设计和特殊仪器等问题,导致目前应用较少[41]。
3 环状RNA在肿瘤干细胞中的研究
CircRNAs属于功能性RNA,已成为恶性肿瘤的关键调节因子,并在肿瘤干细胞中作为重要介质,发挥不同的生物学功能,调节CSCs自我更新、增殖、分化和转移等不同表型。
3.1 环状RNA参与肿瘤干细胞的自我更新
CircRNAs在不同肿瘤类型中发挥促癌或抑癌双重作用,调控其下游转录因子活性、激活相关信号通路,参与肿瘤干细胞自我更新(见Fig.1)。
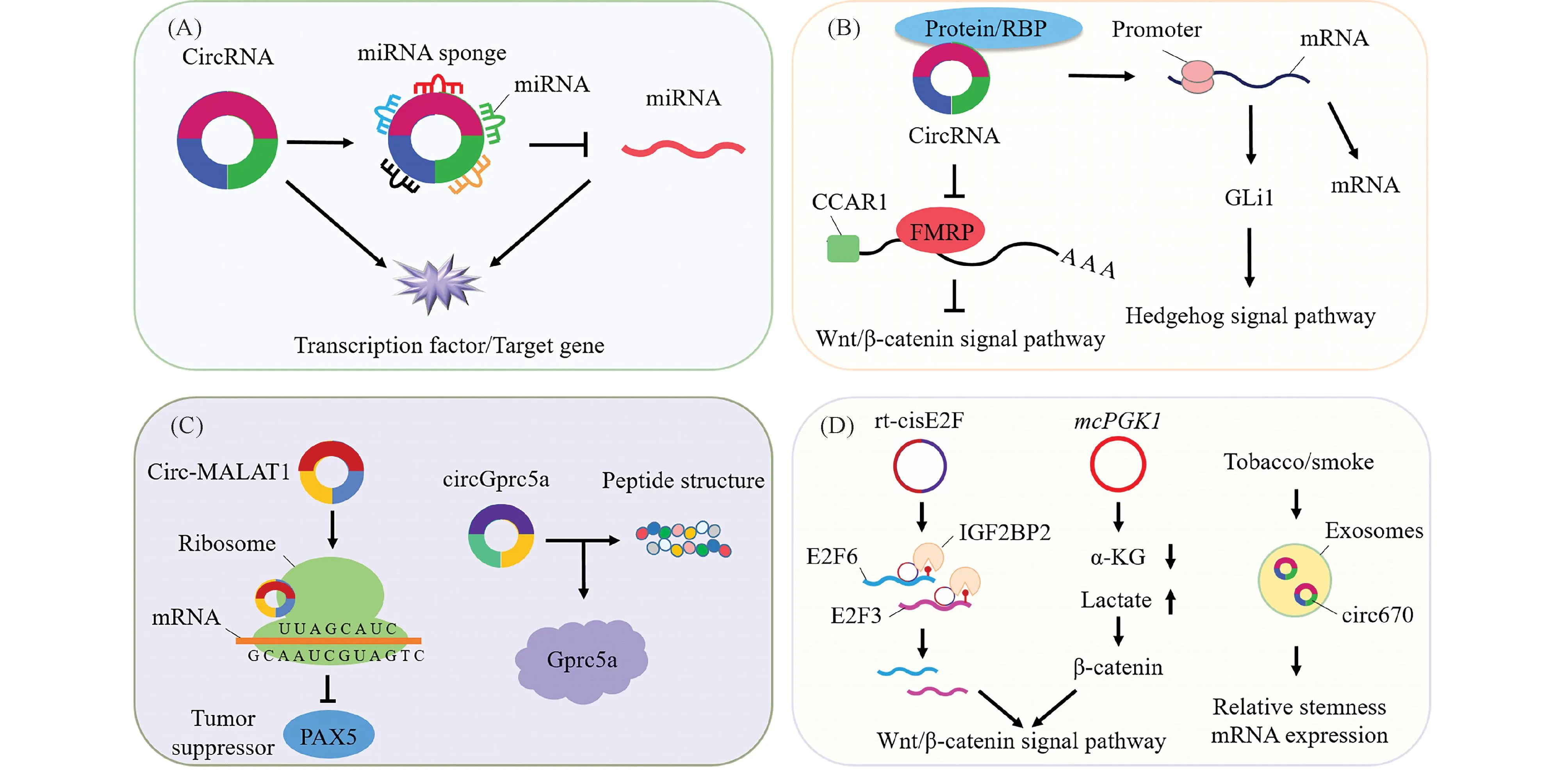
Fig.1 circRNAs regulate self-renewal of cancer stem cells (A) CircRNAs act directly or as miRNA sponges to regulate self-renewal of cancer stem cells; (B) Interaction between circRNAs and proteins regulates self-renewal of cancer stem cells; (C) CircRNAs regulate self-renewal of cancer stem cells through protein translation. (D) Regulation of self-renewal of cancer stem cells by novel and different sources of circRNAs. CircRNA: circular RNA; RBP: RNA-binding proteins; mRNA: messenger RNA; miRNA: microRNA; GLI1: GLI family zinc finger 1; CCAR1: cell-division cycle and apoptosis regulator protein 1; FMRP: fragile X mental retardation protein. Circ-MALAT1: circular RNA- MALAT1; PAX5: paired box 5; circGprc5a: circular RNA Gprc5a. Gprc5a: G protein coupled receptor family C group 5-member A. rt-cisE2F: read-through circRNA stabilizing E2F6/E2F3 mRNAs; IGF2BP2: insulin-like growth factor 2 mRNA-binding proteins 2. E2F6: E2F family of transcription factor 6; E2F3: E2F family of transcription factor 3. mcPGK1: mitochondrial circRNA for translocating phosphoglycerate kinase 1; α-KG: α-ketoglutarate; circ-670: hsa-circRNA-000670
3.1.1 环状RNA促进肿瘤干细胞自我更新 CircRNAs异常表达能有效促进CSCs自我更新,进而利于CSCs所介导的肿瘤耐药、转移和复发等过程。在肿瘤干细胞中,circRNAs作为直接调节因子转录激活下游转录因子介导肿瘤干细胞自我更新。在结直肠癌中cis-HOX与HOXC10 mRNA结合抑制其衰变,从而促进结直肠癌肿瘤干细胞自我更新[42]。Jia等人[43]证实,circFAT1介导信号转导器和转录激活因子3(signal transducer and activator of transcript,STAT3)激活并上调干性相关转录因子性别决定区Y-box2(sex-determining region Y-box2,SOX2)、克鲁珀尔样因子4(krüppel-like factor 4,KLF4)表达,诱导头颈部鳞状细胞癌CSCs成球能力。
CircRNAs还通过与miRNA、mRNA、蛋白质相互作用等方式,在表观遗传、转录及转录后水平调节多种基因,参与肿瘤干细胞自我更新。Hsa_circ_0003222海绵化吸附miR-527促进非小细胞肺癌(non-small cell lung cancer,NSCLC)肿瘤干细胞干性[44]。结合生物信息学方法可筛选特异性circRNAs,circRNA_103809在膀胱CSCs中的表达显著高于膀胱癌非肿瘤干细胞,并海绵化吸附miR-511促进膀胱CSCs自我更新[45]。Chen等人[46]利用生物信息学预测miR-145-5p作为circPTN下游靶标及干性的负调控因子,证实circPTN海绵化miR-145-5p促进胶质瘤干细胞(glioma stem cells,GSCs)自我更新。另外,circRNAs、miRNAs、mRNAs所构成的ceRNA调控网络参与调控肿瘤干细胞自我更新。利用全基因组测序筛选结直肠癌CSCs中636个特异性circRNAs,结合生物信息学分析筛选2个主要circRNAs:hsa_circ_0066631和hsa_circ_0082096,且证实其通过ceRNA网络调控肿瘤干细胞干性[47]。同时,多种肿瘤类型中也存在该调控轴,例如:乳腺癌CSCs中存在circNOLC1/miR-365a-3p/STAT3[48]及circ_002178/miR-1258/KDM7A,促进乳腺癌CSCs自我更新[49]。肝母细胞瘤[50]及骨肉瘤[51]中分别存在circRNA CDR1as/miR-7-5p/KLF4、circPIP5K1A/miR-515-5p/YAP1促进肿瘤干细胞自我更新。肿瘤中p53作为抑癌基因参与肿瘤各阶段,在EBV相关胃癌(EBV associated gastric carcinoma,EBVaGC)中发现ebv-circLMP 2A/miR-3908/TRIM59/p53轴,通过抑制p53诱导其肿瘤干细胞自我更新[52]。缺氧环境会导致基因组失衡,抑制细胞凋亡,维持细胞处于未分化状态[53]。在缺氧状态下,circHIF1A充当miR-580-5p海绵靶向CD44,促进乳腺癌CSCs自我更新[54]。
CircRNAs与蛋白质相互作用激活下游靶基因或信号通路并驱动肿瘤干细胞自我更新。Chen 等人[55]证实,circRNA激活肌肉腱膜纤维肉瘤癌基因同系物F(musculoaponeurotic fibrosarcoma oncogene homolog F,MAFF),即circRNA activating MAFF(cia-MAF)在肝癌CSCs中显著上调,可与TIP60复合物相互作用形成分子支架,募集至MAFF启动子,促进MAFF表达,驱动肝癌肿瘤干细胞自我更新。核重塑因子复合物(nucleosome remodeling factor,NURF)作为启动染色质重塑的必要部分,在结肠癌中,circCTIC1会将NURF募集至c-Myc启动子,驱动c-Myc转录促进肿瘤干细胞自我更新[56]。此前,已证实多种信号通路参与调控各种生命过程,而信号通路的异常激活是诱发干细胞恶变及肿瘤发生的潜在机制之一[57]。Hedgehog信号通路与正常组织修复及上皮间质转化(epithelial-mesenchymal transition,EMT)有关,有利于维持干细胞自我更新,该信号通路异常激活与恶性肿瘤启动、转移和耐药密切相关[58]。肝癌中发现circIPO11与拓扑异构酶I(topoisomerase I,TOP1)相互作用,并将其募集至胶质瘤相关癌基因同系物1(glioma-associated oncogene homologue 1,GLI1)启动子以触发其转录,激活Hedgehog信号通路驱动肝癌肿瘤干细胞自我更新[59]。
CircRNAs具备蛋白质翻译潜能,参与特定蛋白质翻译调控肿瘤干细胞自我更新。Chen等人[60]提出circRNAs制动机制,即形成circRNA-ribosome(核糖体)-mRNA复合物参与mRNA翻译。Circ-MALAT1通过circRNAs制动机制延缓肿瘤抑制因子配对盒转录因子5(paired Box,PAX5)翻译,促进肝癌CSCs自我更新。另外,有证据表明,circRNAs具有肽编码潜力,hsa_circ_02838(circGprc5a)在膀胱癌CSCs中高表达,且通过其肽结构结合Gprc5a,形成circGprc5-peptide(肽)-Gprc5a轴驱动膀胱癌CSCs自我更新[61]。
CircRNAs因特殊的结构赋予其独特的功能,而不同结构及来源的circRNAs也在肿瘤干细胞中发挥着重要作用。当前,Chen等人[62]在肝癌中鉴定出一种通读circRNAs(read-through circRNAs,rt-circRNAs)[63],rt-cisE2F(read-through circRNA stabilizing E2F6/E2F3 mRNAs)是由10号染色体上的CYP2C18及CYP2C19的外显子环化形成。随后证实,在肝癌肿瘤起始细胞(tumor initiating cells,TICs)中,rt-cisE2F通过转换E2F6/E2F3与m6A阅读器胰岛素样生长因子2信使RNA结合蛋白2(insulin-like growth factor 2 mRNA-binding proteins 2,IGF2BP2)、YT521-B 同源域家族成员2(YT521-B homology domain-containing family protein 2,YTHDF2)的相互作用调控肝癌TICs自我更新。其中,IGF2BP2作为m6A结合蛋白质,被证实其具有促进mRNA稳定性的作用[64],而YTHDF2作为m6A修饰阅读蛋白质,则加快mRNA降解[65]。在肝癌TICs中,rt-cisE2F通过促进E2F6/E2F3与IGF2BP2相互作用并抑制其与YTHDF2的结合,提高E2F6/E2F3 mRNA稳定性,进一步上调Wnt/β-catenin信号通路的下游基因轴抑制蛋白2(axis inhibition protein 2,AXIN2)、细胞周期蛋白D1(CyclinD1,CCND1)、c-Myc,证实在肝癌TICs中,rt-cisE2F/IGF2BP2-E2F6/E2F3/Wnt/β-catenin轴促进其自我更新。近来,一种新型由线粒体DNA编码的circRNAs——mcPGK1(mitochondrial circRNA for translocating phosphoglycerate kinase 1),证实在肝癌TICs中表达增强,并通过抑制线粒体氧化磷酸化(oxidative phosphorylation,OXPHOS)和促进糖酵解来调节代谢重编程,进一步改变了α-酮戊二酸(α-ketoglutarate,α-KG)和乳酸的细胞内水平。由于乳酸能促进β-联蛋白(β-catenin)稳定性,α-KG则抑制β-联蛋白启动子的活化、及其转录,即在肝癌TICs中mcPGK1通过调节代谢重编程促进Wnt/β-catenin活化和肝内TICs自我更新[66]。外泌体(exosome)由细胞内多泡体与细胞膜融合后释放到细胞外基质中的膜性囊泡,存在于几乎所有类型的细胞中。其结构是一种直径为30~100 nm的脂质包裹体,内部含有蛋白质、mRNA和miRNA等物质[67]。近年来,外泌体来源的非编码RNA被证实参与肿瘤的发生及恶性进展,具有评估肿瘤进展和预后的潜在价值[68, 69]。Liang 等人[70]在胃癌CSCs中发现烟草/烟雾会促进其外泌体分泌,其中外泌体来源的hsa-circRNA-000670(circ670)在胃癌CSCs中表达升高,并增强胃癌CSCs的成球能力及干性基因表达发挥促进其自我更新的功能。
3.1.2 环状RNA抑制肿瘤干细胞自我更新 CircRNAs可参与阻断重要信号通路和/或抑制干性相关转录因子活性,破坏肿瘤干细胞干性维持。肝癌作为全球常见恶性肿瘤之一,其中肝细胞癌作为原发性肝癌最常见的病理类型,每年导致约830 000人死亡[71]。Zhu 等人[72]利用RNA免疫共沉淀测序及生物信息学分析circZKSCAN1表达水平与多种肝细胞癌特征相关。生存分析结果显示,circZKSCAN1 表达水平与总生存期和无复发生存期呈正相关。进一步证实,circZKSCAN1充当RNA结合蛋白(RNA binding protein,RBP)海绵,与脆性X染色体智力迟钝蛋白(fragile X mental retardation protein,FMRP)靶基因细胞周期和凋亡调节因子1(cell cycle and apoptosis regulator 1,CCAR1)竞争,促使Wnt/β-catenin信号通路失活,抑制肝细胞癌肿瘤干细胞成球能力。此外,circZKSCAN1在体内诱导肿瘤静止,表明其在精准靶向治疗方面的潜力。在乳腺癌CSCs中,circRNAs作为干细胞抑制剂并充当miRNA海绵。Yan等人[73]通过生物信息学分析证实,circRNA VRK1可以抑制乳腺CSCs自我更新能力,是治疗肿瘤的良好靶点。
以上研究结果表明,circRNAs异常表达与肿瘤干细胞自我更新密切相关。但目前circRNAs发挥抑癌作用的相关研究较少,后续研究还需致力于寻找抑癌性circRNAs,进一步探讨其在肿瘤基因治疗中的潜在价值。
3.2 环状RNA调控肿瘤干细胞的增殖与分化
肿瘤干细胞增殖、分化是维持肿瘤异质性的关键因素,目前已证明,多种信号通路及转录因子参与调控CSCs增殖和分化[74]。原癌基因c-Myc作为转录因子,参与细胞的生长、增殖和凋亡[75]。在膀胱癌[76]及肾母细胞瘤[77]中,分别存在hsa_circ_0068307/miR-147及circPHACTR4/ miR-34b-5p轴调控c-Myc表达,参与肿瘤干细胞增殖。同源框(homeobox,HOX)基因构成的转录因子家族,在细胞增殖和肿瘤发生中具有重要的调节作用[78]。CircCHAF1A海绵化吸附miR-211-5上调转录因子HOXC8表达,促进GSCs增殖[79]。CircATP5B充当miR-185-5p海绵上调同源框转录因子B5(homeobox B5,HOXB5)表达。并进一步转录调节白细胞介素-6(interleukin- 6,IL6)表达,激活JAK2/STAT3信号传导促进GSCs增殖[80]。此外,根据circRNAs与mRNAs相互作用功能模型,circ-CCDC66通过HGF/c-Met信号通路有效促进肾癌干细胞增殖能力[81]。
迄今为止,肿瘤干细胞分化的潜在机制受到广泛研究,包括转录因子、信号通路和表观遗传修饰等调控方式。CircRNAs作为新型非编码RNA,对于肿瘤干细胞分化具有调节作用。Zeste2增强子(enhancer of Zeste2 polycomb repressive complex 2 subunit,EZH2)作为一种原癌基因,有利于维持干细胞多能性[82]。Circ-TRPS1在前列腺癌中发挥致癌作用,并形成circ-TRPS1/miR-124-3p/EZH2轴促进肿瘤干细胞分化[83]。罗雯等人[84]在肺癌CSCs中发现,circMYO1C通过促进SOX2、OCT4、Nanog表达,抑制肺癌CSCs分化。已证实端粒酶能有效促进细胞分裂,诱导细胞恶性转化。Jiang等人[85]证实,circMEG3抑制核糖核糖蛋白H/ACA端粒合成酶组成物(component of telomere synthetase H/ACA ribonucleoprotein,Cbf5)转录活性,从而抑制端粒酶复合物活性,达到抑制肝癌CSCs分化的目的。
上述内容表明,circRNAs通过改变增殖/分化相关转录因子、端粒酶活性等调控肿瘤干细胞增殖和分化,促进肿瘤恶性转化(见Fig.2)。但其中是否存在其他因素,例如细胞周期调控和细胞代谢等值得进一步探讨。

Fig.2 circRNAs regulating the proliferation and differentiation of cancer stem cells CircRNA: circular RNA; CSCs: cancer stem cells; c-Myc: oncogene MYC; HOXC8: homeobox gene C8; HGF/c-Met: hepatocyte growth factor/cellular-mesenchymal epithelial transition factor; HOXB5: homeobox gene B5. EZH2: enhancer of Zeste2 polycomb repressive complex 2 subunit; circ-TRPS1: circular RNA-TRPS1; circRNA MYO1C: circular RNA MYO1C; Nanog: homeobox-containing transcription factor; SOX2: sex-determining region Y-box2; OCT4: octamer-binding transcription factor 4; CircMEG3: circular RNA MEG3; Cbf5: the component of telomere synthetase H/ACA ribonucleoprotein
3.3 环状RNA参与调控肿瘤干细胞侵袭与转移
肿瘤干细胞相较于肿瘤细胞而言,表现出更强的侵袭、转移潜能。即肿瘤干细胞所介导的转移性肿瘤,表现出更强的致瘤性及治疗抗性[86]。研究证实,circRNA ARF1(cARF1)能有效促进人脑微血管内皮细胞(human brain microvascular endothelial cells,hBMECs)侵袭及血管生成,在肿瘤干细胞中作为miR-342-3p海绵抑制其表达,从而上调胰岛素基因增强蛋白2(insulin gene enhancer protein,ISL-2)促进胶质瘤血管生成[87]。此外,Lin等人[88]利用人类端粒酶逆转录酶(human telomerase reverse transcriptase,hTERT)特异性启动子VP16-GAL4-土拨鼠肝炎病毒转录后调节元件(woodchuck hepatitis virus posttranscriptional regulatory element,WPRE)集成的系统,放大复合物过表达circRGPD6(TV-circRGPD6),证实TV-circRGPD6/miR-26b/YAF2轴可抑制乳腺癌肿瘤干细胞介导的转移,为难治性癌症提供新的治疗选择。
以上研究结果表明,circRNAs通过利用其特殊结构及miRNA海绵等方式参与肿瘤干细胞的侵袭、转移,可将circRNAs作为评估肿瘤转移和预后不良的潜在标志物。同时,针对circRNAs的独特结构联合其他新型治疗技术,增强肿瘤治疗效果,为临床应用提供理论依据。
4 问题与展望
近年来,新型分子检测技术及生物信息学的高速发展,推动circRNAs在肿瘤干细胞研究领域深入并取得一定成果。已证实失调的circRNAs与肿瘤干细胞生物学特性密切相关,但仍有问题亟待解决。目前,circRNAs在肿瘤干细胞中的研究主要集中于细胞内水平,但对于肿瘤干细胞分裂方式、耐药性、休眠性肿瘤干细胞等生物学特性的研究仍有待完善。此外,肿瘤干细胞脂类代谢、免疫逃逸等方式作为调控肿瘤干细胞生物学特性、介导肿瘤耐药的重要机制[89, 90],探究circRNAs在上述过程中的功能,有利于寻求新型治疗靶点及积极有效的肿瘤治疗策略。CircRNAs作为研究新热点,仍需不断完善基础性研究内容,例如:构建高质量circRNAs数据库和开发高精度快速检测方法等。在临床检验诊断方面,由于其闭合环状结构,具有更高的稳定性,认为其具有成为肿瘤干细胞或肿瘤诊断生物标志物的可能。当前,circRNAs的大量研究仍停留于基础研究阶段,同时存在circRNAs特异性、检测方法自身局限性及检测标准化等问题,限制其临床应用。后续研究应致力于改良circRNAs检测方法和提高检测灵敏度。同时,通过筛选新型及特异性circRNAs,与传统生物标志物联合检测以提升诊断效能,并通过多中心、大样本的临床研究验证其临床价值。

