TNF-α和VEGF协同作用小鼠胚胎干细胞衍生的血管内皮祖细胞促伤口愈合
杨 影, 陈东升, 赵艾艾, 何才蓉, 陈凤娇, 何运雪, 郑 梅, 陆 莹, 丁 洁*
(1)贵州大学生命科学学院/农业生物工程研究院, 山地植物资源保护与保护种质创新教育部重点实验室, 贵阳 550025;2)贵州省人民医院科研处, 贵阳 550025;3)贵州中医药大学基础医学院解刨学教研室, 贵阳 550025)
皮肤是机体感知外界刺激的重要器官,当皮肤的结构完整性受损时,身体防御机制的功能就会被破坏,引起严重的发病率和死亡率[1,2]。伤口愈合是一个复杂有序的生理过程,需要多种细胞和活性因子共同参与皮肤组织的修复和重建[3,4]。合理地调控炎症和血管生成反应是改善伤口愈合不良引起瘢痕疙瘩和增生性疤痕产生的有效手段。内皮祖细胞(endothelial progenitor cell, EPC)作为血管生成的主导细胞,通过动员、归巢、增殖和分化来介导血管损伤后的内皮化过程,并利用旁分泌细胞因子募集单核细胞/巨噬细胞到创伤处,从而加速伤口愈合[5-7]。然而,临床研究中由于自体EPC的数量有限,且迁移和归巢等生理活性差导致新生血管形成效果不理想[8]。因此,扩展EPC的获取来源尤为重要,胚胎干细胞衍生的血管内皮祖细胞将成为伤口修复和组织再生的重要种子细胞源[9-11]。增强EPC生物学功能是改善EPC对急性/慢性伤口愈合治疗的重要策略。
据报道,肿瘤坏死因子-α (tumor necrosis factor- α, TNF-α)通过促进炎症反应,刺激血管内皮生长因子 (vascular endothelial growth factor, VEGF)介导毛细血管再生、帮助肉芽组织的构建,改善伤口愈合过程[12-14]。低剂量促炎因子TNF-α预处理的EPC可显著增加EPC的迁移归巢活性和管腔形成能力[15,16]。VEGF是一种血管内皮细胞特异性的肝素结合生长因子,不仅能在体外诱导胚胎干细胞分化为内皮祖细胞和内皮细胞,还是创面血管化的主要调控因子,具有促内皮细胞迁移和新生血管形成的作用[17-19]。可见,TNF-α和VEGF在血管生成、血管通透性以及创面组织再生中发挥着重要作用。目前,TNF-α和VEGF协同处理对EPC功能的影响尚不清晰,双因子与EPC协同治疗创面修复的生物学效应尚未见报道。
本文以mESC(mouse embryonic stem cells)分化获得的EPC为研究材料,通过双因子协同培养细胞,验证VEGF和TNF-α联合作用可增强mESC衍生EPC的黏附、迁移和管腔形成能力。在此基础上,进一步建立小鼠创伤模型,探究VEGF和TNF-α协同EPC促小鼠创伤愈合的可能性。本研究旨在利用细胞与生长因子协同疗法为在皮肤创伤的临床治疗中提供新的思路。
1 材料与方法
1.1 材料
小鼠胚胎干细胞(品系:RW.4)购于中国科学院干细胞库;无特定病原体级ICR雄性小鼠购于长沙市天勤技术有限公司。
主要试剂:DMEM基础培养基(Gbico);胎牛血清(Gbico);MEM非必需氨基酸(Gbico);L-谷氨酰胺(Gbico);青-链霉素(Gbico);胰酶(Gbico);β-巯基乙醇(Sigma);bFGF(R&D Systems);VEGF(R&D Systems);TNF-α(Peprotech);Matrigel基质胶(BD Biosciences);4%多聚甲醛(Biosharp);CD34抗体(Servicebio);CD133抗体(Servicebio);VEGF抗体(Servicebio);TNF-α抗体(Servicebio);CD31抗体(BD Pharmingen);ANG1抗体(Affinity);ANG2抗体(Affinity);GAPDH抗体(Affinity)。
1.2 内皮祖细胞的体外分化及分组
加入0.05%含EDTA的胰酶消化mESC,待mESC与饲养层MEF细胞相分离脱落,用2~3倍胰酶体积的mESC培养液终止消化后收集细胞,800 r/min,离心3 min,并将细胞重悬液接入6 cm皿中,贴壁40 min后弃上清,沿壁加入4 mL EPC培养液,并添加10 ng/mL VEGF和5 ng/mL bFGF诱导3 d,用于后续实验。实验分为3组:V组:10 ng/mL VEGF处理mESC衍生的EPC为对照组;T组:10 ng/mL TNF-α处理mESC衍生的EPC;VT组:10 ng/mL VEGF和10 ng/mL TNF-α协同处理mESC衍生的EPC。放置37 ℃、5% CO2培养箱中培养24 h,收集各组细胞进行实验。
1.3 RT-PCR
分别提取mESC和诱导3 d后EPC的总RNA并逆转录为cDNA,采用SYBR Green PCR试剂盒进行RT-PCR检测,引物列于Table1。

Table 1 Primer sequences
1.4 Western 印迹检测
在分别装有mESC和mESC-EPC的EP管中加入RIPA裂解液,提取细胞总蛋白质,BCA法检测蛋白质浓度,根据不同蛋白质分子量选择合适的SDS-PAGE上样凝胶,上样、电泳、经转膜、封闭、用一抗(CD34、CD133和GAPDH)4 ℃孵育转膜过夜、经洗涤、室温二抗孵育1 h,随后加入ECL化学发光液显影并拍照。
1.5 黏附和细胞划痕实验
黏附实验:将实验组细胞以1×105个/孔细胞量接种于预铺0.1%明胶的24孔板中,37 ℃孵育4 h,弃去培养液,用PBS洗去悬浮细胞。倒置相差显微镜照相(20×),计数贴壁细胞数目。
细胞划痕实验:将mESC衍生的EPC接种于预铺有0.1%明胶的6孔板中,待细胞生长至80%~90%汇合率后用10 μL的移液枪头划痕。PBS清洗漂浮细胞,将细胞(继续)培养在含有10 ng/mL VEGF、10 ng/mL TNF-α和10 ng/mL VEGF+10 ng/mL TNF-α的EPC培养液中,在倒置显微镜下统计0 h、12 h、24 h细胞迁移率。
1.6 细胞管腔形成分析
将融化的Matrigel胶预铺在预冷的24孔板中,放入37 ℃培养箱中30 min使胶凝固。10 ng/mL VEGF、10 ng/mL TNF-α、10 ng/mL TNF-α+ VEGF处理内皮化2 d细胞经24 h后消化收集,以5×105个/孔细胞量均匀接种到铺有基质胶的24孔板中,置于37 ℃培养箱中,培养24 h后拍照。每组设置5个重复,采用Image J图像分析软件计算管腔节点和分支长度。
1.7 体内小鼠伤口全层皮肤创伤检测
1.7.1 动物分组及小鼠创伤模型建立 动物分组:将购买的35只8周龄(33~37 g)ICR雄性小鼠分成5组;PBS组:阴性对照组;EPC组:mESC-EPC注射到小鼠皮肤创周处;VE组:10 ng/mL VEGF协同mESC-EPC注射到小鼠皮肤创周处;TE组:10 ng/mL TNF-α协同mESC-EPC注射到小鼠皮肤创周处;VTE组:10 ng/mL VEGF和10 ng/mL TNF-α协同mESC-EPC注射到小鼠皮肤创周处。
小鼠创伤模型建立:用腹腔注射200~300 μL 4%水合氯醛麻醉小鼠,剃去背部毛发,用眼科剪切除全层皮肤,以形成1.5 cm直径的创面。碘伏消毒但不包扎,在圆形创周处3个位点各注射100 μL添加不同因子处理的细胞悬液(1×106个),PBS组和EPC组小鼠创周处注射300 μL的PBS或EPC细胞悬液。
1.7.2 伤口愈合率分析 每天观察小鼠创面的愈合情况并拍照记录,统计各组小鼠d0、d3、d7和d13的背部创口面积,通过Image J软件分析计算伤口愈合率(创口愈合率=d0的伤口面积-dn的伤口面积)/d0的伤口面积×100%)。
1.7.3 小鼠皮肤伤口愈合组织学分析 HE染色:待小鼠皮肤伤口愈合,取皮肤创面组织固定于10%多聚甲醛溶液中,HE染色后置于显微镜下观察组织的病理变化。
免疫组化:取13 d的创面组织切片、脱蜡、复水后浸泡于0.01 mol/L 柠檬酸钠抗原修复液中热修复。用含5% BSA的PBST封闭30 min,加入一抗(TNF-α、CD31、VEGF)4 ℃孵育过夜,二抗室温避光孵育1 h,经DAB显色剂显色,用中性树脂封片,显微镜下拍照并记录内皮细胞标志蛋白质VEGF、CD31和炎症因子TNF-α的表达情况,在同一图像中随机截取5个视野,使用Image Pro Plus软件进行平均光密度(Mean optical density; MOD)分析。
1.7.4 伤口炎症细胞生成和新生血管的差异分析 不同处理组的组织病理切片中随机选取5个视野,观察并计算视野中新生血管和炎症细胞的数量。同时,观察TE组7 d和13 d炎症细胞生成情况。
1.7.5 Western印迹检测相关蛋白质表达水平 将创面皮肤组织用液氮研磨,加入RIPA裂解液,提取总蛋白质并测浓度。检测皮肤样本中ANG1、ANG2和TNF-α蛋白质表达水平,使用Image J软件进行蛋白质灰度值分析。
1.8 统计学分析

2 结果
2.1 小鼠胚胎干细胞体外分化3 d的细胞鉴定为内皮祖细胞
mESC克隆团呈圆形或椭圆形,边界清晰(Fig.1A)。经胰酶消化的mESC接种于6 cm皿中,采用含10 ng/mL VEGF和5 ng/mL bFGF培养液进行诱导培养,内皮化3 d的细胞呈现典型的梭形、多边形或圆形的内皮祖细胞样形态,以铺路石状铺展于皿底(Fig.1B)。
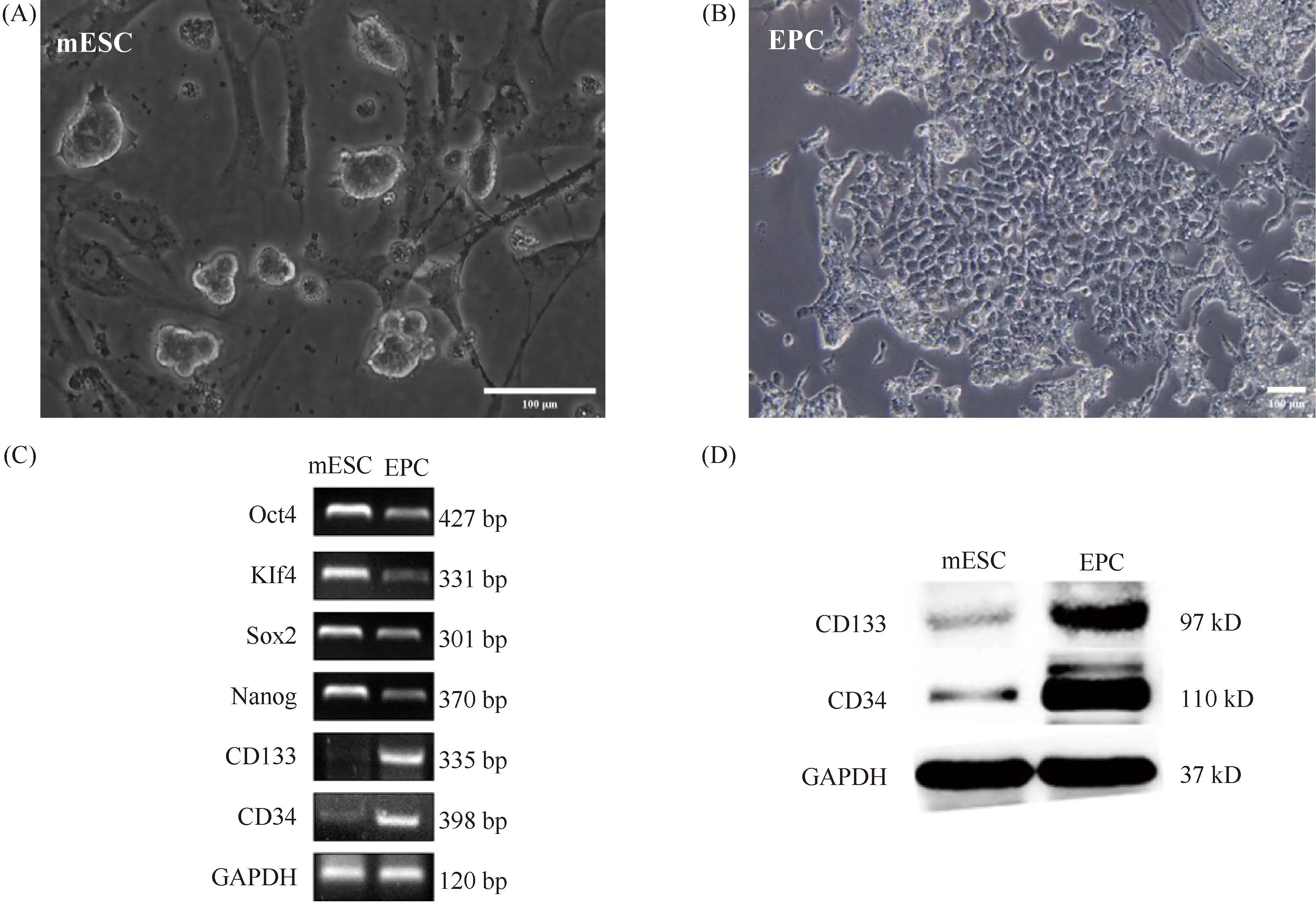
Fig.1 The endothlialization of mESC over a 3-day period was verified as EPC (A) Observation on the cell morphology of mESC, scale bar: 100 μm; (B) Analysis of cells on day 3 of EPC differentiation, scale bar: 100 μm ; (C) RT-PCR assessment of the expression of marker genes for mESC (Oct4, KIF4, Sox2 and Nanog) and EPC (CD133 and CD34) ; (D) The expression of CD133, CD34 in each group examined by Western blotting
通过细胞形态学观察、RT-PCR和Western 印迹分析验证内皮化3 d细胞为内皮祖细胞。内皮化3 d细胞低表达mESC的干性基因Oct4、Klf4、Sox2和Nanog,高表达EPC的标志基因CD133和CD34(Fig.1C)。内皮化3 d细胞中CD133和CD34在蛋白质水平的表达显著高于mESC (Fig.1D)。结果表明,mESC经过10 ng/mL VEGF和5 ng/mL bFGF诱导培养3 d后稳定分化为EPC,可用于后续实验。
2.2 VEGF和TNF-α协同作用促进内皮祖细胞的黏附能力和迁移能力
通过黏附实验检测VEGF和TNF-α单独或协同对EPC体外黏附能力的影响。与V组(60.78 ± 1.499个)和T组(72.53 ± 4.096个)相比,VT协同处理组(101.56 ± 5.814个)的EPC黏附能力明显增强,具有统计学意义(P<0.01, Fig.2A和2C)。

Fig.2 Comparison of adhesion and migration ability in different treatment groups (A) Adhesion ability of EPC in different treatment groups after 4 hours, scale bar: 100 μm; (B) Cell migration at 0 hours, 12 hours and 24 hours from the scrape margin, scale bar: 100 μm; (C, D) Quantitative analysis of migration rates and adhesion in V (the VEGF group), T (the TNF-α group) and VT (the VEGF and TNF-α combination group). Mean ± SD (n = 3).*P <0.05,**P <0.01,***P <0.001
通过划痕实验检测不同处理组EPC的迁移能力,划痕12 h,联合处理组(46.71 ± 14.73%)的EPC迁移能力显著高于V组(20.22 ± 1.83%)和T组(17.04 ± 3.67%);划痕24 h时,VT组(63.62 ± 7.70%)仍具有较好的迁移能力,细胞迁移差异相比于12 h更为明显,具有统计学意义(P<0.01, Fig.2B和2D)。上述结果表明,VEGF和TNF-α协同比单因子处理较好地促进mESC-EPC的黏附和迁移功能。
2.3 TNF-α促进VEGF诱导的内皮祖细胞管腔形成能力
验证了VEGF和TNF-α协同作用促进EPC的黏附能力和迁移能力的基础之上,进一步检测VEGF和TNF-α协同处理对EPC管腔形成能力的影响。结果正如Fig.3所示,各组都具有管腔形成能力,各组分支节点数和总分支长度的趋势为VT (152.75 ± 8.44; 9.51×103± 0.39) >T (144.25 ± 18.90; 9.10×103± 1.17) >V (108 ± 7.50; 5.12×103± 0.29)。其中T组和VT组的管腔总分支长度和分支节点数明显高于V组,差异具有统计学意义(P< 0.05, Fig.3B),结果表明,TNF-α可增强VEGF介导的EPC管腔形成能力。

Fig.3 Comparison of lumen formation capablilty in different treatment groups (A) A tube formation assay was performed on EPCs seeded on Matrigel with different treatments for 24 hours, and subsenquently observed under a light microscope, scale bar : 100 μm. Note: The regions marked by the red arrows represent sites of luminal formation; (B) Statistical analysis of the total lumen branch length and number of branch nodes within V (the VEGF group), T (the TNF-α group) and VT (the VEGF and TNF-α combination group). Mean ± SD (n = 4).*P <0.05,**P <0.01,***P <0.001
2.4 VEGF和TNF-α协同小鼠胚胎干细胞衍生的内皮祖细胞促小鼠皮肤伤口愈合
2.4.1 血管生成因子VEGF和促炎因子TNF-α的协同作用促伤口愈合 小鼠皮肤创伤建模后,连续观察13 d,拍照记录结果正如Fig.4A所示。伤口愈合率趋势为:VTE >TE >VE >EPC >PBC。其中VTE组的创面愈合率:4 d (36.54±1.41%)、8 d (62.78 ± 1.20%)、10 d (88.69 ± 0.58%)和13 d (96.82 ± 0.11%)伤口愈合率均显著高于其他实验组,第10 d极为显著,均具有统计学意义(P<0.05, Fig.4B)。由此可见,VEGF和TNF-α协同EPC处理能加速小鼠皮肤伤口愈合。

Fig.4 Detection of mouse skin wounds in different treatment groups (A) Photographic documentation of wound progression on the dorsal surface of mice at different time intervals; (B) Percentage of wound healing at different posttraumatic time points, with the order of efficacy being: VTE >TE >VE >EPC >PBS. Mean ± SD (n = 5).*P <0.05,**P <0.01,***P <0.001
2.4.2 VEGF和TNF-α协同促伤口组织再生 创伤治疗13 d时,取不同组小鼠创周处组织切片进行HE染色,观察病理学差异。结果如Fig.5A和5B所示,VTE组(271.22 ± 21.19 μm)和TE组(220.24 ± 14.52 μm)的皮肤再生真皮层相较PBS组(132.72 ± 8.55 μm)、EPC组(156.42 ± 6.13 μm)和VE组(156.61 ± 5.75 μm)明显增厚。VTE组与TE组也具有极显著差异性(P<0.001)。相比于VE组和TE组,VTE组小鼠创面覆盖有连续且完整的表皮层,新生毛囊增多,炎症细胞浸润减少,毛细血管丰富且管腔粗大。结果表明:VEGF和TNF-α协同EPC能有效促进小鼠皮肤损伤后的愈合和组织再生。

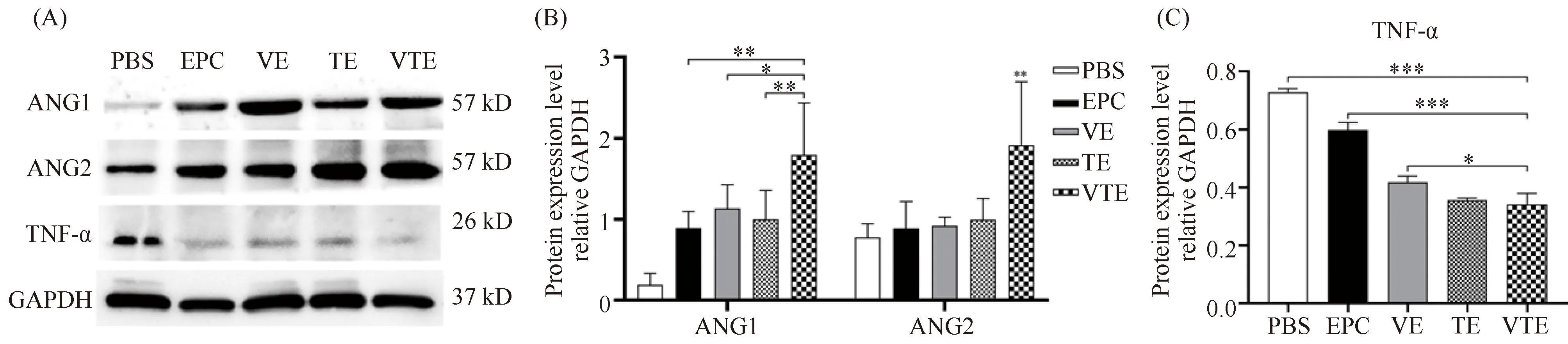
Fig.5 Pathological alterations in mouse skin wounds among different treatment groups (A) Representative images of HE staining of wound skin tissue sections 13 days after surgery, scale bar : 100 μm. Note: black double arrow = dermal thickness; Dark blue arrow = skin appendage; Red arrow = new blood vessels; Green arrow = inflammatory cells. (B, C) The thickness of new dermis and the number of new blood vessels in different treatment groups: VTE >TE >VE >EPC >PBS; (D) The number of new inflammatory cells in different treatment groups: VTE 2.4.3 VEGF和TNF-α协同促新生血管生成率和早期炎症反应 进一步评估PBS组、EPC组、VE组、TE组和VTE组的新生血管量和炎症反应,VTE组(72.8 ± 13.17)的新生血管数显著高于PBS组(3.2 ± 1.94)、EPC组(15 ± 4.20)、VE组(15.6 ± 2.24)和TE组(21.6 ± 10.97),具有统计意义(P< 0.001, Fig.5C)。各组创周处炎症细胞数目差异趋势为VTE (29.4 ± 7.39) 2.4.4 CD31和VEGF在VTE组表达量增加 在HE染色的基础上,进一步通过免疫组化染色分析TNF-α、CD31和VEGF蛋白质在伤口愈合过程中炎症反应和血管生成的差异。结果如Fig.6A所示,建模13 d时,TNF-α蛋白的表达定位于毛囊中。相比于VE组和TE组,PBS组和EPC组呈强阳性,VTE组呈弱阳性;不同处理组的平均光密度趋势为VTE Fig.6 Immunohistochemistry analysis of TNF-α, CD31 and VEGF in the skin wound area of mice (A) Immunohistochemistry stanining of TNF-α (50×), CD31(50×) and VEGF (100×) conducted after 13 days of wound healing in each group, scale bar : 20 μm.; (B) Variations in the mean optical density of TNF-α among different treatment groups: VTE 2.4.5 VTE组的ANG1、ANG2和TNF-α蛋白表达增高更多 血管生成素ANG1和ANG2是血管重塑和成熟的重要调节因子,过度的炎症反应将影响血管形成以及伤口愈合重塑阶段,通过Western 印迹检测各组治疗13 d后创周处ANG1、ANG2和促炎因子TNF-α的表达情况。与PBS组、EPC组、VE组和TE组相比,VTE组的新生皮肤组织高表达ANG1 (1.80 ± 0.58)和ANG2 (1.92 ± 0.71),具有统计学意义。同时,各创周治疗组TNF-α蛋白表达趋势为VTE(0.34 ± 0.03) Fig.7 Differences of TNF-α, ANG1 and ANG2 protein levels in each group (A) Protein levels of TNF-α, ANG1 and ANG2 in each group were determined using Western blotting, with GAPDH serving as a control. (B, C) Changes in protein expression contents were analyzed by gray values (using Image J) of each band and compared to the control group. Mean±SD (n =3).*P <0.05,**P <0.01,***P <0.001 有效的皮肤伤口愈合需要协调凝血级联、免疫细胞流入、上皮和血管形成以及组织重塑,还需多种生长因子和细胞外信号创造的有利微环境[4,20,21]。其中炎症反应和血管生成在伤口修复过程中相互串扰。创伤后的微血管网络形成有助于将炎症细胞募集到伤口处清除碎片,提供维持肉芽组织再生的氧气和营养,而炎症细胞分泌的急性因子(TNF-α)和血管生成因子(VEGF)进一步刺激内皮祖细胞和内皮细胞迁移到损伤部位,参与血管生成和组织修复[22-24]。然而,机体内源性内皮祖细胞来源和数量少,导致血管生成不足,延迟伤口愈合。体外分化的EPC移植可弥补内源性内皮祖细胞不足,在一定程度上促进血管生成以加速小鼠皮肤创伤愈合[5,9]。干细胞的研究和发展为基于细胞移植和组织再生提供了充足的细胞来源,本论文将mESC在10 ng/mL VEGF和5ng/mL bFGF的作用下分化为高表达CD34和CD133的 “铺路石样”内皮祖细胞样细胞,并具有一定的迁移和管腔形成能力。然而,植入的外源性EPC在新生血管中的黏附率和渗入率低,血管的成熟和数目直接影响创伤部位的愈合效率。 VEGF作为皮肤伤口愈合过程中主要的促血管生成因子,通过刺激内皮祖细胞和内皮细胞的活力、迁移和分化以促进新生血管形成和维持血管内皮的连续性和完整性[9,18,25]。VEGF参与伤口愈合的增殖和重塑阶段,由骨髓样细胞(单核细胞和巨噬细胞)、内皮祖细胞、角质细胞和成纤维细胞等多种细胞分泌[26]。研究表明,通过局部使用重组VEGF或病毒载体提高小鼠伤口中VEGF水平,能加速早期的血管生成,增强结缔组织,提高愈合伤口的质量[17,27,28]。因此,VEGF被认为是促伤口愈合的潜在疗法。然而,当VEGF介导的新生血管形成不适当或不完全时,将引起伤口水肿,从而延迟伤口愈合[29,30]。本研究中发现,VEGF单独诱导内皮祖细胞样细胞形成的管腔少且不成熟,说明仅用单一生长因子VEGF不足以形成具有循环功能的成熟血管结构,达不到预期治疗皮肤创伤的临床效果。Bruna Eibel等人[31]研究表明,VEGF质粒基因治疗患者后,EPC的动员和TNF-α之间有很强的正相关性。揭示EPC血管生成与急性炎症水平相关,促炎因子TNF-α通过激活VCAM1/VLA4和NF-kB介导的CADM1,以增强EPC和内皮细胞间的黏附、血管样结构的迁移和整合[15,16]。同时,间接诱导细胞分泌VEGF,促进内皮祖细胞分化为功能性内皮细胞[32,33]。TNF-α进一步调节成纤维细胞,血管内皮细胞和角质形成细胞的活性,以及细胞外基质蛋白质和基质金属蛋白酶的合成,它们与损伤组织的愈合密切相关[34]。本文验证了mESC-EPC在VEGF和TNF-α双因子的协同作用下较好地提高EPC的黏附、迁移和管腔形成能力,弥补单因子作用的局限性。同时,在创面愈合过程中观察到VEGF和TNF-α的协同作用。VEGF有助于愈合早期的血管通透性,募集适当数目的单核/巨噬细胞、EPC和内皮细胞迁移到创伤处,加速伤口愈合进程[35,36]。TNF-α引起的炎症反应驱动旁分泌信号在祖细胞归巢和血管形成中发挥重要作用,实现血管生成与炎症协同调控伤口愈合[37,38]。本研究发现,VEGF和TNF-α双因子协同能提高EPC的渗入率、迁移和分化,显著加速小鼠伤口闭合,增加胶原沉积和毛囊,改善血管生成不足的问题。通过免疫组化和Western 印迹检测验证在伤口愈合过程中,血管生成素(ANG1和ANG2)蛋白质表达上调,介导VEGF+CD31+内皮细胞重塑的血管网络成熟,从而促进伤口愈合。同时,TNF-α在愈合前期加速免疫细胞在伤口处的浸润,创造有利于启动和促进新生血管形成的炎症微环境[39]。然而,考虑到TNF-α的促炎特性,可能影响血管形成和使组织纤维化,延迟伤口愈合进程[40]。在伤口修复的后期,双因子协同EPC治疗组的TNF-α蛋白的表达下调,说明TNF-α在整个研究中严格调控炎症反应进程,适当剂量的TNF-α对伤口愈合的益处是不可忽视的。本文采用的细胞和双因子协同疗法兼顾了伤口愈合过程中复杂微环境需要涉及的免疫反应、血管生成和细胞归巢的“多因素”协调,为皮肤缺损和组织再生的临床应用提供科学的理论基础与新策略。 综上所述,VEGF和TNF-α能有效改善EPC的生物学功能,通过双因子协同EPC可促进创伤周围组织的血管重塑,改善炎症环境,加速伤口愈合。因此,协同调节炎症和血管生成可提高伤口愈合率,细胞和因子协同疗法是促进伤口愈合的有效途径。本研究仅初步探究了双因子对内皮祖细胞的功能以及协同EPC治疗伤口愈合后期的生物学效应,仍需进一步探索VEGF和TNF-α协同促进EPC功能的分子机制,全面分析双因子协同EPC对伤口愈合的各个阶段的生理影响,以及炎症-血管生成协同促伤口愈合的分子串扰机制,以便为开发临床级细胞与因子疗法治疗急性/慢性伤口患者提供有力证据。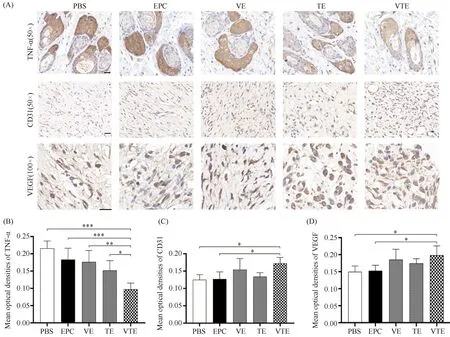
3 讨论

